元宝枫KCS 基因家族的鉴定及时空表达分析
2022-07-20马建文顾锡亭陈转香张博勇李玲俐
马建文,顾锡亭,王 珊,陈转香,张博勇,李玲俐
(西北农林科技大学 林学院,陕西 咸阳 712100)
元宝枫Acer truncatum(2n=2x=26)属槭树科Aceraceae 槭属Acer植物,是我国特有且综合效益较高的木本油料树种,主要分布于我国东北和华北等地区的27 个省、区、市,分布区域广、海拔差异大[1]。由于其翅果外形与我国古代的金元宝极其相似,故常被称为“元宝槭”或“元宝枫”。发展元宝枫可获得良好的生态效益与社会效益。元宝枫秋叶具有独特的园林观赏价值,而且由于元宝枫具有VA 菌根,是抗旱、耐寒、耐贫瘠、改善生态环境的理想造林树种[2]。元宝枫是良好的木本油料树种,其种仁含油率45%~48%,其种子油食用后无不良反应。元宝枫叶中含多种活性物质和营养保健成分[3];种皮中含60%的凝缩类单宁,是皮革工业和纺织印染工业的优质原料[4]。另外,元宝枫种仁含27%的蛋白质,是理想的蛋白质资源[5],且其油酸、亚油酸、维生素E 含量丰富。最重要的是元宝枫种仁中含有5%~6%的神经酸[6],神经酸是大脑神经系统发育所需重要物质,而我国常规食用植物油中不含神经酸[7],因此近年来元宝枫种子油得到了相关学者和企业的青睐。
神经酸(NA,C24:1,ω-9,顺15-二十四碳烯酸)是一种超长链单不饱和脂肪酸(C22 ~C26)[8],最早从鲨鱼大脑内分离出来,故又称鲨鱼酸,能促进受损脑神经纤维的修复和再生[9],是大脑发育必需的营养物质,在大脑发育和维持以及神经细胞的生物合成和改善中起着至关重要的作用。但人体自身较难合成神经酸,只能靠体外摄取。婴儿通过吸收母乳中的神经酸协助神经系统发育[10-11]。神经酸水平的降低与发生精神类疾病的高风险密切相关[12-13],补充神经酸是有效治疗几种神经系统疾病的方法,如脱髓鞘疾病[13-15]。由于鲨鱼等动物体内神经酸的获取成本高、资源少,并且化学合成神经酸产率低、副产物多,难以大量生产[16],所以,植物神经酸是神经酸的重要来源。据报道,富含神经酸的植物主要有蒜头果Malania oleifera、银 扇 草Lunaria annua、海 檀 木Ximenia caffra、元宝枫、琉璃苣Borago officinalis、大麻Cannabis sativa、旱金莲Tropaeolum majus、美丽旱金莲T.speciosum、 文 冠 果Xanthoceras sorbifolium等,考虑到植物的适生性以及种子的含油率和含神经酸率等因素,在实际应用中,银扇草和元宝枫被认为是生态位种,其他植物有待进一步研究和开发[17-18]。现阶段,主要任务是选育出高含油率、高神经酸含量的品种。基因修饰是大规模生产神经酸以及选育高神经酸含量品种的一个良好途径[18]。通过研究元宝枫种子油中神经酸生物合成的相关基因或基因互作,找到影响神经酸生物合成的遗传因素是提高神经酸生物合成效率的有效策略。
超长链脂肪酸(VLCFAs)的生物合成包括在植物质体中从头合成脂肪酸(FA)和在细胞质内质网膜利用4 种酶(KCS、KCR、HCD 和ECR)以油酸(C18:1)开始的脂肪酸碳链延伸(FAE)2 个阶段[19]。VLCFAs 包括多种植物脂类,如种子油、表皮蜡、鞘膜脂、角质以及花粉外表脂类。KCS(β-羟脂酰-CoA 合酶)作为脂肪酸碳链延长反应中第1 个参与反应的限速酶,决定FAs 的延伸以及VLCFAs 的数量和类型。在模式植物拟南芥中,AtKCS1 和AtKCS17 催化C20:0、C20:1、C22:0、C24:0 和C26:0 等5 种VLCFAs 的 伸 长,而AtKCS18 催 化 合 成C20:0、C20:1、C22:0、C22:1、C24:0 、C24:1 和C26:0,其种子特异性表达催化籽油中C20:0 和C22:1 的合成;AtKCS2和AtKCS20 催 化 合 成C22:0、C24:0 和C26:0;AtKCS5 和AtKCS6 参 与 合 成C24 ~C28[20-21]。在文冠果中,KCS基因在种胚发育早期调控神经酸的合成[22]。在蒜头果中,MoKCS1在果实膨大期表达量最高,而此阶段也是神经酸累积期,表明MoKCS1与蒜头果神经酸合成密切相关[23]。在甘蓝型油菜中,武玉花[24]发现仅BnKCS1基因在酵母异源表达后能产生微量的超长链脂肪酸,且多数KCS基因存在功能重叠;Xue 等[25]发现6 个KCS基因可能是病原菌应答基因。在元宝枫的相关研究中,Ma 等[26]在种子发育期发现了3个与神经酸积累密切相关的KCS基因,同时发现MYB 和bZIP 转录因子也参与神经酸调控,具体机制仍在研究中。KCS 高度的底物特异性决定了VLCFAs 的最终链长,其表达量和活性也决定了合成产物的量[18]。从蒜头果中分离出的MoKCS11基因对C20:1 具有底物偏好,但对芥酸无底物偏好,因此出现基因已表达但并无神经酸积累的结果[27]。另外,在植物中,KCS的表达决定了VLCFAs 是否在特定细胞中合成,而其他3 种酶(KCR、ECR、HCD)在植物中无处不在,无速率限制[28]。由此可见,KCS基因的表达以及严格的底物特异性和组织特异性与神经酸的生物合成有着直接且密切的联系。
本研究中,利用元宝枫转录组数据,使用生物信息学分析软件,鉴定了元宝枫VLCFAs 生物合成的KCS 蛋白,研究了KCS基因在元宝枫根、茎、叶、花4 个器官中以及授粉后4 个发育阶段种子中的表达量,旨在为后续的KCS基因调节神经酸生物合成研究提供参考。
1 材料与方法
1.1 植物材料采集和处理
元宝枫样株种植于陕西省咸阳市杨凌区西北农林科技大学北校区(108°04′E,34°17′N,海拔520 m),树龄约60 a,树高约13.5 m,胸径约25 cm,为长势优良、结实量大的优良单株。2019—2020年的7—11 月,采集其根、茎、叶、花和发育中的种子(授粉后100、130、160、190 d),每种样取3 个生物学重复,在液氮中速冻后置于-80 ℃冰箱中保存备用。
1.2 试验方法
1.2.1 总RNA 提取和转录组测序
采用改良的CTAB 法提取元宝枫根、茎、叶、花及发育各时期种子的总RNA[29]。依据mRNAseq 样品制备试剂盒(Illumina 公司,美国)构建mRNA-seq 文库。用Illumina HiSeqTM 2000 测序法测定mRNA-seq 基因组文库的序列。
1.2.2AceKCS基因家族鉴定
在pfrm 数据库(http://pfam.xfam.org/)分别输入PF08392(FAE1/Type Ⅲ polyketide synthaselike protein)、PF08541(3-Oxoacyl-[acyl-carrier protein (ACP)] synthase Ⅲ C terminal)和PF00109(acetyl-CoA C-acetyltransferase)Pfam 号 下 载 隐马可夫模型。用于元宝枫KCS基因家族鉴定的蛋白质、核苷酸序列文件及基因注释文件来自陕西佰艾基因信息科技有限公司。使用Hmmsearch 程序包搜索元宝枫蛋白序列中含以上蛋白保守结构域的蛋白,将得到的基因利用Tbtools、Clustalw、Hmmerbuild、Hmmersearch 等软件(设置E值为10-5),筛选出元宝枫KCS基因家族成员。
1.2.3AceKCS基因染色体定位及串联重复基因的Ka/Ks
使用Tbtools V1.0971软件的Gene location visualize from GFF 程序以及元宝枫基因组注释文件,得到元宝枫KCS基因在染色体上的分布图谱。检测KCS基因在不同染色体上的出现频率。在本研究中,KCS基因簇的分配参考用于蒺藜苜蓿Medicago truncatulaNBS 基因家族分析的标准[30]。如果2 个相邻的KCS基因在染色体上相隔不超过250 kb,那么这2 个基因被认为是该簇的基因成员。基于这个标准,每个基因组中串联排列的KCS基因被识别。然后对串联重复基因,使用Tbtools 软件分别计算每条染色体上串联重复基因的Ka/Ks。
1.2.4AceKCS基因系统发育树构建及顺式作用元件预测
使用鉴定AceKCS基因家族的方法来鉴定蒜头果、文冠果KCS基因家族成员,蒜头果、文冠果基因组序列从GigaDB(http://gigadb.org/dataset/view/id/100549/File_page/2)数据库获取。甘蓝型油菜KCS基因家族直接使用Xue 等[25]鉴定的58 个成员。拟南芥KCS基因组数据从TAIR 数据库(https://www.arabidopsis.org/)获 取。使 用Editplus 软 件将元宝枫等5 个物种的蛋白质序列合并成1 个Fasta 文件,利用本地muscle 3.8.31 程序对5 个物种KCS 蛋白质序列进行多序列比对,将比对后的文件导入MEGA 7.0[31]进行系统发育树构建。首先使用Muscle 工具进行序列比对,采用最大似然法Maximum Likelihood 构建系统发育树,设置Bootstrap 为1 000,选择mtREV 模型,然后利用ITOL(https://itol.embl.de/tree)在线网站进行系统发育树的美化。
利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测所有AceKCS基因上游2 000 bp 碱基范围内的顺式作用元件。
1.2.5AceKCS基因结构预测及保守基序Motif 分析
使用TBtoolsv1.0983 软件中的Gene structure View 程序,提交元宝枫基因组的发育树文件以及NCBI-CDD 保守域结果文件,生成基因结构及保守域图谱。使用MultipleEm-for-Motif-Elicitation(MEME)在线程序(https://meme-suite.org/meme/tools/meme)上传元宝枫KCS 蛋白质序列文件,得到Motif 图谱。
1.2.6AceKCS基因编码蛋白质三维结构及亚细胞定位预测
使用在线网站(https://swissmodel.expasy.org)预测AceKCS基因编码蛋白质的三维结构,使用Plant-PLoc server 在线网站预测亚细胞定位。
1.2.7AceKCS基因家族成员RNA-seq 分析
采用RT-qPCR 技术检测AceKCS在元宝枫各组织器官中的表达,根据目标基因的开放阅读框列出RT-qPCR 反应的特异性引物。使用SYBR Green试剂盒,在StepOnePlus 实时PCR 系统(ABI)中进行实时qPCR 反应。采用actin house keeping 基因作为内部对照,并对样品重复测定3 次,通过计算每个基因的RNA 相对表达量及归一化量[32],得到元宝枫不同组织和不同发育阶段种仁RNA-seq数据的FPKM 值,将所有样本表达量数据以10 为底数取对数,然后使用R 包的pheatmap 生成相应的表达水平热图。
1.3 数据分析
使用Excel 软件分析转录组数据。使用R 语言和Origin 2021 软件作图。
2 结果与分析
2.1 AceKCS 基因家族成员的鉴定及染色体定位
通过采用生物信息技术共鉴定到35 个AceKCS基因家族成员。根据每个成员在染色体上的位置,依次命名为AceKC1~AceKC35。使用EXPASY 在线数据库对35 个AceKCS 蛋白进行理化性质分析,结果见表1。

表1 AceKCS基因编码蛋白质的理化性质Table 1 The AceKCS gene encodes the physicochemical properties of proteins

续表1Continuation of Table1
由表1 可知,AceKCS 蛋白氨基酸数量在600以内,其中最长的KCS 蛋白质为AceKCS30,其氨基酸数量为571,最短的为AceKCS21,其氨基酸数量为156。预测的相对分子质量为17.62 ~61.85 kDa,其中AceKCS21 的相对分子质量最低,AceKCS9 的相对分子质量最高。等电点为5.91 ~9.60,其中AceKCS26 的等电点最低,AceKCS2 的等电点最高。大多数AceKCS蛋白的不稳定指数小于40,较稳定,有13 个AceKCS 蛋白的不稳定指数等于或大于40,较不稳 定, 包 括AceKCS4、AceKCS7、AceKCS8、AceKCS9、AceKCS10、AceKCS12、AceKCS21、AceKCS23、AceKCS25、AceKCS28、AceKCS30、AceKCS31、AceKCS33。另外,AceKCS 蛋白大多具亲水性,少数具疏水性。
AceKCS基因染色体定位结果如图1 所示。由图1 可见,35 个AceKCS基因分布于Chr1、Chr2、Chr3、Chr4、Chr5、Chr6、Chr7、Chr8、Chr9、Chr10、Chr12、Chr13 等12 条染色体上。Chr7 染色体上AceKCS基因分布最多,有14 个,占基因家族成员数量的40%,共有5 个串联重复基因,包括AceKCS1~AceKCS3、AceKCS5~AceKCS6、AceKCS10~AceKCS18、AceKCS19~AceKCS20、AceKCS21~AceKCS23。

图1 AceKCS基因的染色体定位Fig. 1 Chromosome mapping of AceKCS gene
对串联重复基因进行进化分析,其中有10 对串联重复基因的Ka/Ks大于0.250 且小于1.000,见表2。由表2 可知,AceKCS22和AceKCS23串联基因的Ka/Ks为0.943,接近1.000。
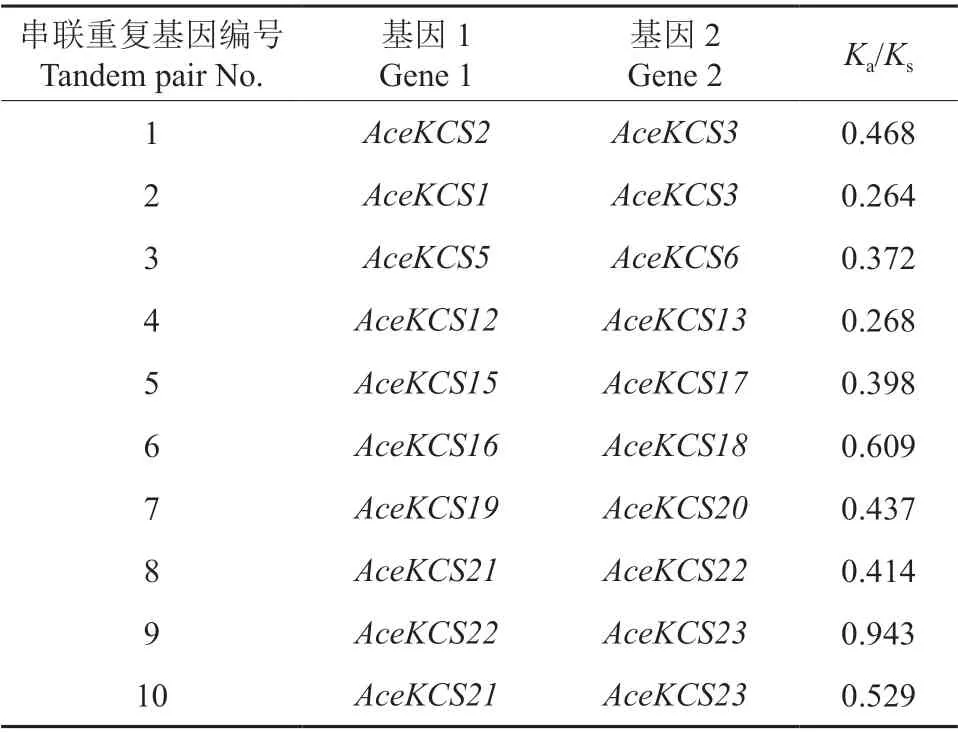
表2 AceKCS基因的串联重复基因及其Ka/KsTable 2 The tandem repeats of the AceKCS gene and Ka/Ks
2.2 AceKCS 基因家族成员的系统发育地位
用于构建物种系统发育树的5 个物种的KCS基因共有152 个,其中元宝枫有35 个,拟南芥有21 个,蒜头果有21 个,文冠果有17 个,甘蓝型油菜有58 个。根据Joubès 等[20]对拟南芥KCS基因家族研究结果,古老的复制最终产生了8 个不同的亚组。通过系统发育分析,将152 个KCS基因分成α、β、γ、η、θ、ζ、δ、ε共8 个亚组,如图2 所示。由图2 可见,AceKCS基因家族成员在β亚组中无分布,其主要集中在ε亚组(AceKCS10、AceKCS11、AceKCS13~AceKCS18、AceKCS29、AceKCS32)、η亚组(AceKCS2、AceKCS4、AceKCS6、AceKCS9、AceKCS20、AceKCS22、AceKCS23、AceKCS26、AceKCS27、AceKCS30、AceKCS34)、θ亚组(AceKCS1、AceKCS3、AceKCS5、AceKCS12、AceKCS19、AceKCS21、AceKCS33、AceKCS35),且蒜头果、文冠果、甘蓝型油菜的KCS基因家族成员在亚组中的分布规律与元宝枫基本一致。
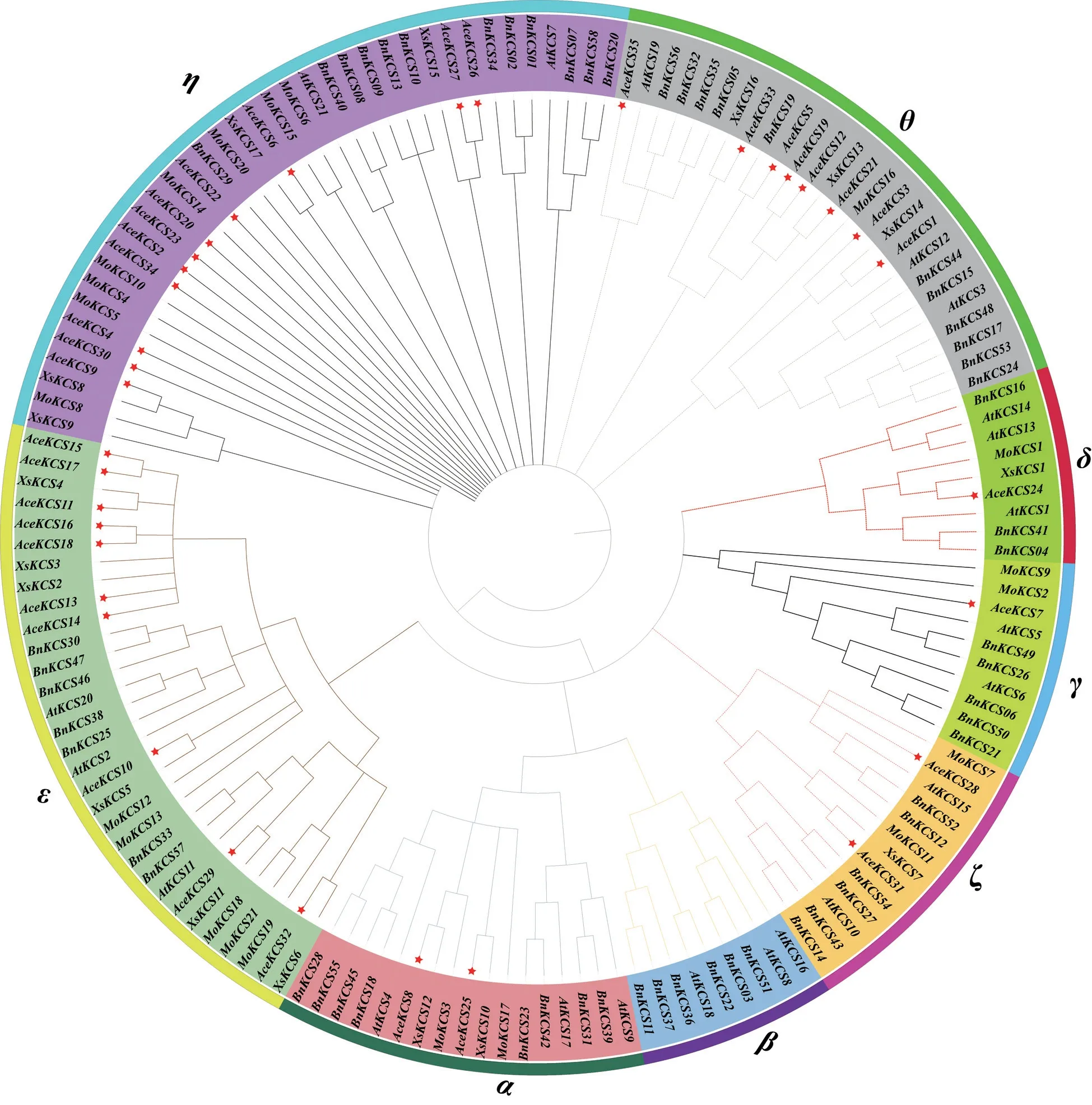
图2 5个物种KCS家族基因成员的系统发育树Fig. 2 Phylogenetic tree of gene members of the KCS family in five species
2.3 AceKCS 基因启动子区顺式作用元件预测
可以通过预测启动子区顺式作用元件来预测基因的潜在功能及转录调控。AceKCS基因中的顺式作用元件可分为以下4 类:光响应元件、植物生长发育相关元件、激素响应元件及胁迫响应元件。AceKCS基因中与植物生长发育、激素响应及胁迫响应相关的顺式元件如图3 所示。由图3 可见:与植物生长发育相关的顺式作用元件共有11 个,包括CCAAT-box、GCN4_motif、HDZip 1、as-1、CAT-box、AAGAA-motif、O2-site、CCGTCC-box、AT-rich element 等,与胚乳特异基因表达、植物细胞增殖分化、玉米醇溶蛋白代谢调节等有关;与激素响应相关的顺式作用元件较多,包括MBSI、CGTCA-motif、TGACG-motif、TGAelement、GARE-motif、AuxRR-core、ABRE、ABRE3a、ABRE4、P-box、TGA-element、ERE 等,与类黄酮、茉莉酸甲酯、水杨酸、乙烯、生长素、赤霉素、脱落酸等的合成有关;与胁迫响应相关的顺式作用元件有11 个,包括WUN-motif、ARE、LTR、W box、MBS、GC-motif、MYB、STRE、MYC、WRE3 等,其中MYB 和MYC 数量最多,其与干旱诱导、低温响应、厌氧诱导及防御反应等非生物胁迫有关。
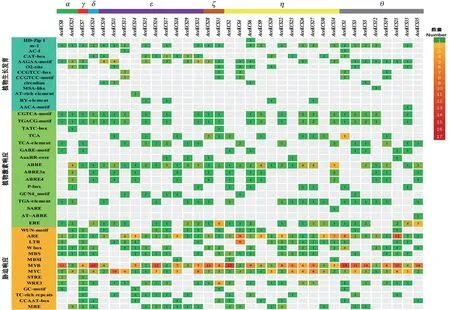
图3 AceKCS基因家族成员启动子区(2000bp)顺式作用元件预测结果Fig. 3 Cis-acting element prediction of AceKCS gene family in promoter region (2 000 bp)
2.4 AceKCS 基因内含子-外显子、保守域及序列Motif 分析
AceKCS基因主要由CDS(编码区)和UTR(非翻译区)组成,有14 个基因仅有CDS 而无UTR。AceKCS基因家族的基因结构如图4 所示。利用NCBI 的Batch-CDD 批量搜索AceKCS基因的保守域,根据每个保守域的功能描述,可将所有保守域归纳为6 类,分别为3-酮脂酰辅酶a 合成酶(3-ketoacyl-CoA synthase)、MDR、FAE1_CUT1_RppA、Ribosomal_L18_L5e、ACP_syn_ Ⅲ_C、乙酰辅酶C- 乙酰转移酶(acetyl-CoA C-acetyltransferase)。 其 中,FAE1_CUT1_RppA、ACP_syn_ Ⅲ_C、3-ketoacyl-CoA synthase和acetyl-CoA C-acetyltransferase 是KCS基因家族典型的保守域,具有较高的保守性,MDR 属于中链脱氢酶家族,Ribosomal_L18_L5e 是一种核糖体蛋白。此外,将所有基因保守域及Motif 进行比较,发现AceKCS1与AceKCS3,AceKCS15与AceKCS17,AceKCS16与AceKCS18,AceKCS10、AceKCS29与AceKCS32的保守域、Motif 出现的位置及长度具有高度相似性(图5)。
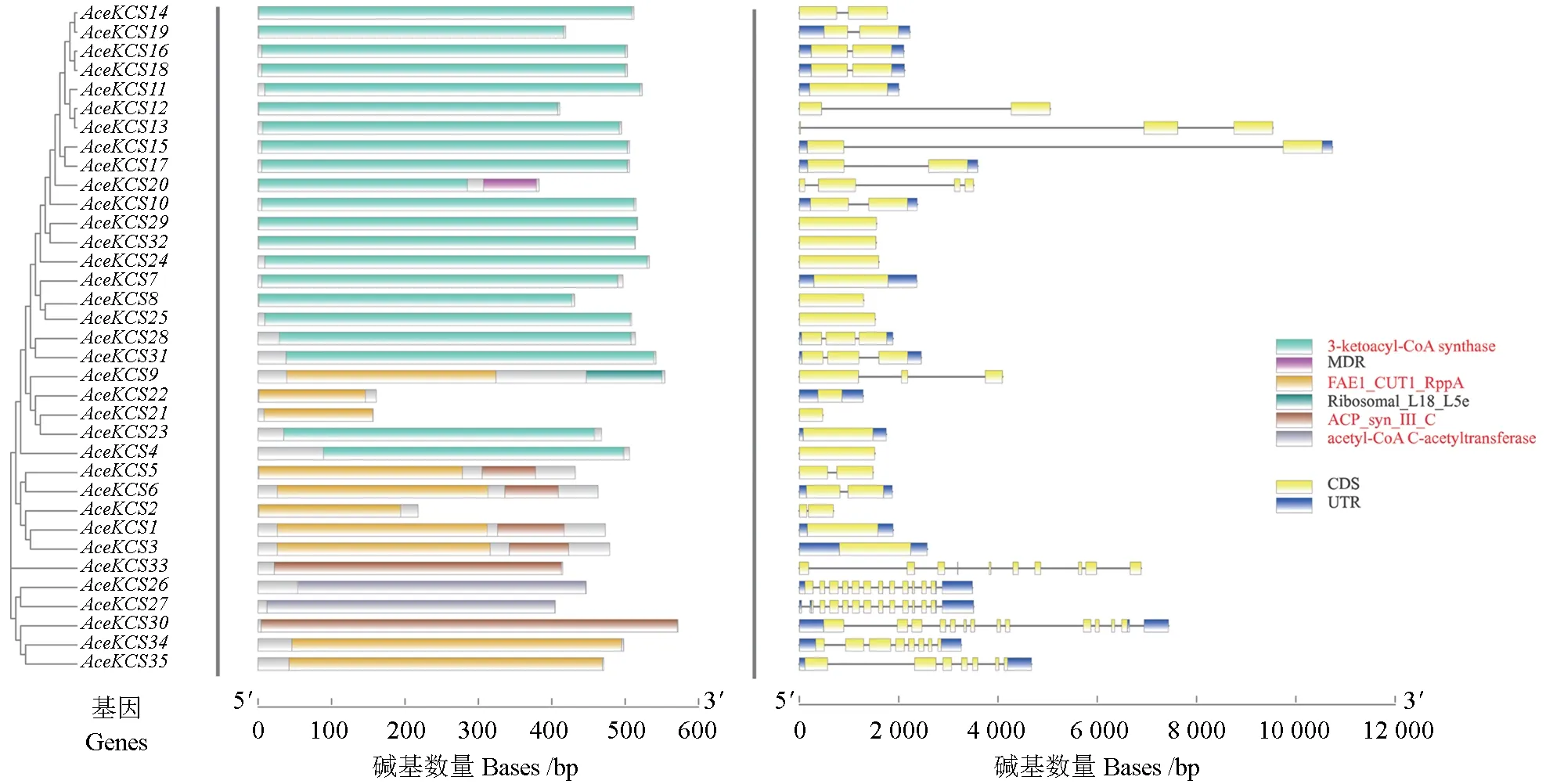
图4 AceKCS基因家族保守结构域(左)和基因结构(右)Fig. 4 Conservative structure domain (left) and structure (right) of AceKCS gene family

图5 AceKCS编码蛋白质Motif分析结果Fig. 5 Motif analysis of the AceKCS protein
2.5 AceKCS 基因亚细胞定位预测
AceKCS基因家族表达主要集中在质膜、叶绿体(图6),其次在细胞质、细胞核中表达,另外在内质网、高尔基体、线粒体、液泡膜以及胞外有少量表达,在细胞骨架表达的仅有AceKCS5;在过氧化物酶体中表达的仅有AceKCS1和AceKCS12;α、γ、δ、e、ζ亚组AceKCS基因在质膜高表达,AceKCS33、AceKCS34和AceKCS35在叶绿体高表达。
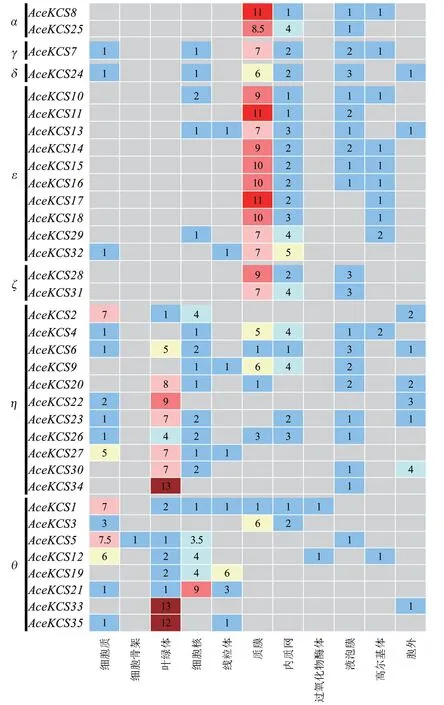
图6 AceKCS基因亚细胞定位预测结果Fig. 6 Subcellular localization prediction of KCS gene family in A. truncatum
2.6 AceKCS 基因的时空表达
为了解AceKCS基因在元宝枫神经酸生物合成过程中的生物学功能,研究了AceKCS基因在根、茎、叶、花和4 个不同发育阶段(授粉后100、130、160、190 d)种子中的时空表达模式。
剔除掉表达量为0 的基因,其余基因的表达模式如图7 所示。由图7 可见,有2 个基因(AceKCS15、AceKCS17)在根、茎、叶、花中表达量均为0,但在种子中特异性高表达。

图7 AceKCS基因在不同组织器官中的表达Fig. 7 KCS gene expression in roots, steams, leaves flowers and four stages of seeds development in Chinese maple
AceKCS15、AceKCS17在授粉后100、130、160、190 d 4 个时期的种子中表达量的变化趋势一致,均为授粉后100 d 时表达量最高,之后逐渐降低,如图8 所示。
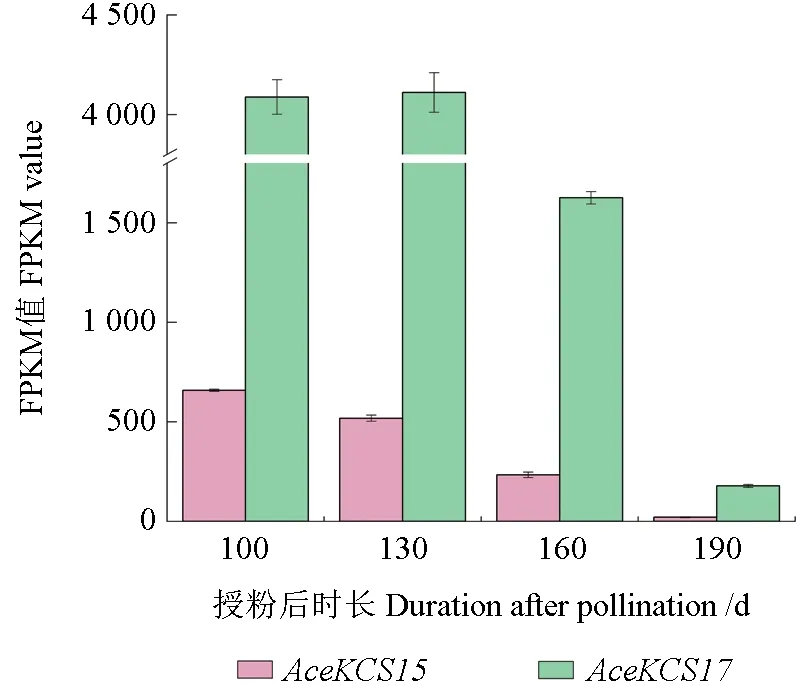
图8 AceKCS15和AceKCS17在不同发育阶段种子中的表达量Fig. 8 Expression levels of AceKCS15, AceKCS17 in seeds at different development stages
AceKCS15和AceKCS17均位于ε亚组,且具有相同的基因结构、保守结构域以及Motif,蛋白质3D 结构预测结果显示两者蛋白结构非常相似,如图9 所示。
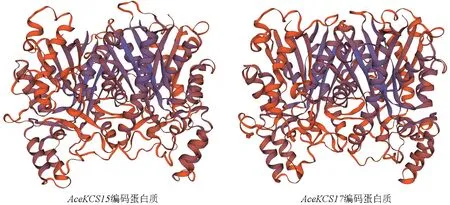
图9 AceKCS15和AceKCS17编码蛋白质的三维结构预测结果Fig. 9 Three-dimensional structure prediction of AceKCS15 and AceKCS17 proteins
此 外, 结 果 显 示AceKCS25、AceKCS26、AceKCS27、AceKCS30、AceKCS31、AceKCS35在所有组织中均有表达且表达量较高。还有一些基因在所有组织中均有表达,但在茎、叶、花中表达量较高,如AceKCS1、AceKCS3、AceKCS6、AceKCS7、AceKCS24。
3 结论与讨论
从元宝枫全基因组中鉴定出35 个AceKCSs,为便于功能分析,将其分为7 个亚组,各亚组均含有特异的保守结构域,可能具有不同的超长链脂肪酸延伸特性。AceKCS15和AceKCS17在种子中特异性高表达且表达模式一致,推测其可能是神经酸生物合成的关键基因,在神经酸生物合成中发挥着重要作用。
中国是世界上油料生产大国,也是第一消费大国。一直以来,我国食用植物油资源短缺,60%依赖进口[33],食用油已成为对外依存度较高的大宗农产品,仅次于粮食。由于木本油料物种的高种实含油率、较强的适应性及木本植物油含有丰富的营养成分,发展优质木本油料树种是解决我国粮油安全的有效措施[34],大力发展木本食用油产业,具有重要的现实意义[35-36]。近年来,随着帕金森病等神经退行性疾病严重影响人们的健康和生活,加之有限的神经酸植物资源,以及含神经酸植物油的毒性和病理性试验的局限性,元宝枫种仁油神经酸分子合成机制研究成为了热点[37-42]。
脂肪酸合酶(FAE)是超长链单不饱和脂肪酸生物合成的关键酶,在植物中有2 种类型,即FAE(fatty acid elongase) 和ELO(fatty acid elongation),ELO 型酶多存在于动物细胞中,在植物中较为少见[43]。本研究中也未发现ELO 型KCS。大量研究结果已证明FAE/KCS 是一种限速酶,调节特定KCS 蛋白的表达会影响超长链脂肪酸的合成。Guo 等[21]和Huai 等[43]也已证实神经酸的生物合成是由KCS 决定的,而不是KCR、HCD 和ECR。在高含量神经酸植物资源中大量KCS基因的功能及其影响神经酸产生的机制需要进一步验证。
目前,有关许多植物中FAE/KCS 基因家族的鉴定和分析已有报道,如拟南芥[20,44]、甘蓝型油菜[25]、蒜头果[27]、文冠果[45]、元宝枫[26]等。本研究组前期对36 个基因型的元宝枫种质种仁进行了脂肪酸成分分析,鉴定到高神经酸含量和低神经酸含量的种质,对鉴定种质的表型、脂肪酸含量和神经酸含量进行了分析,并对其进行了基因组分析和转录组测序,初步揭示了AceKCS基因的表达量与种仁神经酸含量正相关[39,46]。在此基础上,本研究中进一步对元宝枫KCS基因家族成员进行了鉴定与功能分析。由于蒜头果、文冠果也是我国特有的含神经酸的植物[45],且关于其KCS基因家族已有研究报道,有关拟南芥、油菜中KCS基因家族的研究比较成熟,因此,本研究中参考蒜头果、文冠果、拟南芥和甘蓝型油菜4 个物种的KCS基因相关研究结果来分析元宝枫KCS基因功能。元宝枫KCS基因家族成员被分为7 个亚组,分别为α、γ、δ、ε、ζ、η和θ,在β亚组中 无AceKCS、XsKCS、MoKCS,仅 有BnKCS和AtKCS。根据以往文献报道,BnKCS22与AtKCS18(FAE1)是直系亲属,在拟南芥中AtKCS18主要负责种子油中芥酸的合成[25],因此推测β亚组的KCS基因仅负责长链脂肪酸合成,而超长链脂肪酸如神经酸的合成需要含有ε、η和θ亚组KCS蛋白结构域的基因才能进行,ε、η和θ亚组中每个KCS 蛋白在拓扑结构、跨膜结构域方面与其他亚组KCS 蛋白有显著区别[20]。此外,在蒜头果中,通过同源克隆方法从发育种子中分离出的KCS同源物MoKCS11,在拟南芥种子中特异性表达,导致约5%的神经酸积累[27],因此推测神经酸生物合成关键KCS基因在ε、η和θ等3 个亚组中。AceKCS15和AceKCS17在发育的种仁中特异性高表达,表明其可能是神经酸合成的重要基因。Ma 等[26]通过对6 个发育阶段(授粉后70、85、100、115、145 和180 d)种子中的脂肪酸进行分析发现,在授粉85 d 后芥酸(C22:1)和神经酸(C24:1)开始积累,在授粉115 d 后神经酸含量基本不变。通过基因表达分析,发现多数KCS基因在种子发育早期表达量高,之后逐渐降低,而KCS_Atru.Chr.4.2308、KCS_Atru.Chr.4.2307、KCS_Atru.Chr.4.2311基因的表达量在授粉后70 d时无表达或低表达,在授粉85 d 后表达量逐渐升高。将这3 个基因与AceKCS15和AceKCS17基因进行同源性分析,发现KCS_Atru.Chr.4.2307基因与AceKCS15的比对得分为100%,KCS_Atru.Chr.4.2308和KCS_Atru.Chr.4.2311与AceKCS17同源性较高,进一步表明AceKCS15和AceKCS17是神经酸生物合成的关键基因。
KCS基因通过复制已经形成一个庞大的基因家族,在经历了漫长的进化后积累了许多突变,导致基因功能的分化和更新,产生了特异性[21]。本研究结果表明,元宝枫KCS基因家族成员分布于12 条染色体上,共有5 个串联重复事件,其中Chr7 上有3 个串联重复事件,表明重复序列是元宝枫基因组的重要组成部分,也是其基因组进化的基础。对串联重复基因进行进化分析,找到21 个串联基因对,其中有10 个串联基因对的Ka/Ks大于0.25 而小于1.00,其余均小于0.25,说明KCS基因在进化过程中受到了强烈的纯化选择[47-48]。Guo 等[21]通过鉴定26 种植物的475 个KCS基因家族成员并分析KCS基因进化史也证明了这一观点。另外,AceKCS22和AceKCS23这2 个基因的Ka/Ks为0.943,已接近1.000,表明KCS基因在片段重复的过程中不断进化。
特异性启动子是KCS基因在油料植物中过表达后提高神经酸含量的关键途径[43]。在启动子和内含子区域存在的顺式元件模式决定了基因表达的水平[49]。本研究中通过KCS基因启动子分析,发现在基因启动子区有许多光响应元件、植物生长发育相关元件、植物激素响应元件和植物胁迫响应元件。植物激素响应元件中数量较多的有与茉莉酸甲酯MeJA 合成有关的CGTCA-motif、TGACG-motif,与水杨酸SA 合成有关的TCA、TCA-element,与赤霉素GA 合成有关的P box,与脱落酸ABA 合成有关的ABRE、ABRE3a、ABRE4。据报道,植物激素作为信号分子调节植物应对非生物胁迫[50]。生物膜是植物应对非生物胁迫的主要屏障,而脂肪酸是构成生物膜的必要成分,且膜中不饱和脂肪酸的比例与植物耐低温等非生物胁迫的能力密切相关。例如:在植物受到非生物胁迫时,脂肪酸脱氢酶FAD 催化亚麻酸形成,并使其转变为茉莉酸,从而提高植物抗冷性[51];另外,水杨酸可以诱导FAD 基因的表达以维持细胞膜脂肪酸不饱和度,提高细胞膜在低温下的稳定性[52]。胁迫响应元件较多的有MYB、MYC、APE、LTR。表明与植物激素及抗旱相关途径可能通过直接或间接结合这些顺式作用元件来调节AceKCS转录物。MYB 转录因子参与表皮生长物的积累[53],且其与bZIP 转录因子在超长链单不饱和脂肪酸的生物合成中发挥着重要作用[26]。MYC 是bHLH 转录因子家族的一个亚家族,在植物生长发育调控、种子生产、蛋白质积累以及次生代谢物积累等方面发挥着重要作用[54]。本研究结果表明,元宝枫KCS基因的表达及超长链脂肪酸的积累是在植物受到非生物胁迫时由许多胁迫响应元件及激素响应元件共同调控,神经酸是该通路中的一种产物,挖掘关键KCS基因是研究神经酸的累积规律及变化机制的基础。本研究中未对元宝枫关键KCS基因功能进行验证,后续将通过关联性分析及异源表达等验证神经酸累积关键KCS基因功能。
