超声和MRI影像学及影像组学在乳腺癌中的研究进展
2022-07-19周成礼
周成礼,黄 嵘
1汕头大学医学院,广东 汕头 515041;2南方医科大学附属深圳市妇幼保健院超声科,广东 深圳 518028;3北京大学深圳医院放射科,广东 深圳518036
乳腺癌是全球女性中最常见的恶性肿瘤之一,发病率和致死率居癌症首位[1],中国每年新发乳腺癌约26.9万例,是导致45岁以下女性死亡的最常见原因[2]。乳腺X线检查、超声和MRI等影像学检查在乳腺癌筛查、诊断、分期以及疗效监测等方面发挥了非常重要的作用。随着影像学技术的进步和人工智能的广泛应用,影像学检查已经超越了传统意义的形态学成像,发展为集形态和功能成像为一体的技术,衍生出影像组学[3],对乳腺癌精准医疗,早期诊断、和正确分型分期、对患者的预后预测和个性化治疗具有重要意义。本文就乳腺癌的超声、MRI影像学及影像组学研究进展进行综述。
1 乳腺癌分子分型
乳腺癌起源于末端导管-小叶单元,是一种异质性很强的肿瘤,近半个世纪以来,基于分子分型乳腺癌的治疗发生了划时代的变化,不同分子分型的肿瘤有不同生物学特征、临床表现、病理特征,对治疗的反应和结果也不同。
根据2022年CSCO乳腺癌诊疗指南[4],随着驱动基因重要性的不断增强,首先明确判断HER-2状态成为分子分型的重要原则,按HER-2、ER、PR和Ki-67的表达将乳腺癌分子分型分为5型(表1)。针对不同分子分型,乳腺癌治疗从最初的局部手术切除,发展到现在以手术治疗为主,辅以放疗、化疗、内分泌、靶向和免疫治疗等全身综合治疗,为患者精准治疗提供重要依据。
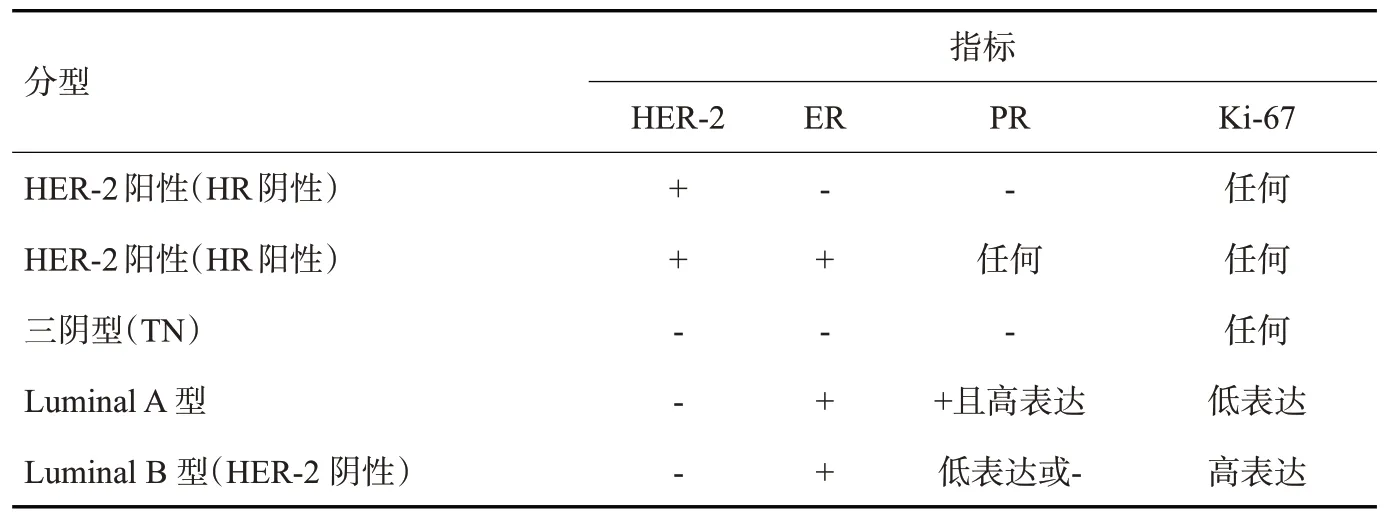
表1 乳腺癌分子分型Tab.1 Molecular typing of breast cancer
2 超声和MRI影像学及影像组学与乳腺癌
2.1 超声
2.1.1 常规乳腺超声 常规乳腺超声在乳腺癌诊断、引导的乳腺活检和定位、腋窝评估和随访起着重要作用,由于其假阳性率较高,导致很多不必要的活检。
2.1.2 超声弹性成像 超声弹性成像技术通过观察肿瘤组织硬度指数判定肿瘤良、恶性,一般作为常规超声的补充工具,可减少对乳腺良性病变活检的需求和帮助确定活检的位置。弹性成像是以外力激励病变组织使其产生形变和位移,探头接收信号后进行数字图像处理,形成灰阶或彩色编码成像,分为应变弹性成像和剪切波弹性成像[5]。与传统的B超比较,乳腺超声弹性成像的准确性尚存在争议,并且剪切波弹性成像在检测浸润性导管癌或浸润性小叶癌方面并不比灰度超声更敏感[6];肿块的大小会影响成像结果,有研究显示较小的病变具有更好的敏感度和特异性[7]。
2.1.3 超声造影 超声造影是将超声造影剂由外周血管注入,影剂微气泡(<8 μm)仅限于血管空间,在声场中产生散射以提高图像对比度,从而使病灶区低速血流得以显示清晰。既往研究发现超声造影区分恶性和良性乳腺病变的敏感度和特异性分别为100%和87.5%,并且对比增强超声图像与MRI提供的图像相关性很好[8]。
2.1.4 自动乳腺全容积扫描成像 自动乳腺全容积扫描成像为三维容积超声技术,对乳腺连续自动扫描并多角度三维成像,以克服手持超声对操作者的依赖,提高检查的可重复性,允许进行多平面重建,冠状视图可以显着缩短阅读时间[9]。自动乳腺全容积扫描成像系统的主要限制是从视野中排除腋窝区域以及缺乏评估血管分布和组织弹性的工具[10]。研究表明自动乳腺全容积扫描成像和超声的敏感度、病灶检出率、诊断准确性和图像质量相似,但自动乳腺全容积扫描成像的检查时间长,其临床应用价值仍有争议[11]。
2.1.5 超声光散射断层成像 超声光散射断层成像是以超声定位、以光谱分析病灶内血红蛋白浓度和血氧饱和度,从而判断病灶内生物代谢信息的成像技术。乳腺癌血管丰富,总血红蛋白浓度增高,基于人工智能的超声光散射成像对乳腺癌T1期的诊断优于常规超声,可作为早期乳腺癌检查的有效方法[12]。
2.2 MRI
乳腺MRI检查在临床用于乳腺癌的术前分期、高危患者的筛查、新辅助化疗期间的评估,也可用于引导介入操作,例如定位和活检。美国放射学会对乳腺MRI报告在乳腺成像报告和数据系统(BI-RADS)中标准化。MRI公认可以对乳腺癌进行早期诊断,能够识别同侧乳房中20%的其他恶性病变和对侧乳房中4%~5%的其他恶性病变。但在是否常规用于术前分期仍存在较大分歧。
2.2.1 磁共振动态增强扫描(DCE-MRI)DCE-MRI采用T1高分辨各向同性容积激发序列,用高压注射器注入对比剂进行增强扫描。其原理是肿瘤诱导的新血管生成导致渗漏血管的生成,静脉注射钆对比剂时更快地从血管向间质外渗,从而导致快速的局部增强。DCEMRI通过使用可缩短局部T1弛豫时间的静脉内钆对比剂来评估血管的通透性,从而在T1加权图像中产生更高的信号。通过测定血管内外对比剂的时间-信号强度曲线,容量转移常数、速率常数和容积比例参数等参数指标可识别出不同的乳腺病增强动力学改变。相关研究显示浸润性乳腺癌的定量MRI形态学与免疫组化生物标志物和亚型有一定相关性[13-14],容量转移常数、速率常数、容积比例参数区分良、恶性病变准确率分别为94.50%、79.82%和87.16%,敏感度高达99%,特异性高达97%[15]。
2.2.2 磁共振波谱(MRS)MRS通过应用点分辨光谱序列或体素受激回波采集模式序列来获得波谱成像,可测定特定组织区域内化学成分的功能分析诊断技术。
组织代谢物tCho水平可用来区分恶性和良性病变[16]。一项Meta分析报道单独使用的MRS具有较高的综合诊断敏感度和特异性(73%vs88%),虽然研究之间的敏感度存在很大的异质性(42%~100%),但特异性几乎没有变化,也仅限于诊断早期乳腺癌、小的乳腺肿瘤和非肿块增强病变[17]。脂质代谢物有助于区分良、恶性病变。在离体人类乳腺组织中,与恶性病变标本相比,良性病变标本中的水脂肪比显著降低。体内研究显示MRS 可提高MRI确定脂肪坏死的特异性,避免不必要的活检。与良性病变或正常乳腺实质相比,浸润性导管癌的水脂肪比更高。水脂比也被证明可用于监测乳腺癌对新辅助化疗的反应[18-19]。此外,乳腺MRS还有助于对肿瘤侵袭性和生物学行为分析。在具有高增殖活性的分化良好的肿瘤类型的人体研究中,tCho积分值增加了[20];具有非常低增殖活性的肿瘤,尤其是小叶癌,在MRS光谱中显示出稀少的胆碱部分。MRS 尚未广泛应用于mpMRI 协议,为通过多中心临床试验来证明其可重复性和准确性,2D和3D多体素MRS成像方法仍需优化。
2.2.3 扩散加权成像(DWI)DWI可以测量组织中扩散的水分子的流动性,间接反映出该组织的病理生理特性,受细胞密度、膜完整性和微观结构限制等的影响,是临床公认的高敏感性乳腺癌检查方式[21]。有研究表明,DWI也可能有助于预测病理分级[22],ADC值在ER阳性与ER 阴性乳腺癌中显著降低[23];相反地,HER-2阳性则比HER-2 阴性乳腺癌表现出更高的ADC 值,而在ER/PR阳性乳腺癌中观察到较低的ADC值是反常态的,因为ER/PR表达通常见于生长较慢、级别较低的癌症,因此这是一个值得进一步研究的领域。
2.2.4 体素内不相干运动扩散加权成像(IVIM)IVIM是在DWI基础上建立双指数模型以分离微循环灌注和水分子扩散,通过ADC值、单纯扩散系数(D值)、假性扩散系数(D*值)、灌注分数(F值)对乳腺病变进行良恶性鉴别。在低b值时,信号强度反映组织中的水扩散以及毛细血管网络中的微循环,在高b值下,信号强度反映了组织扩散性,以此评估肿瘤组织的微循环灌注和水分子扩散情况[24]。灌注驱动的IVIM-MRI已经显示出其在良、恶性肿瘤鉴别诊断以及检测预后生物标志物和治疗监测方面的潜力,部分研究显示较低的ADC通常与更具侵袭性的浸润性乳腺癌表型相关[25-26],与Luminal A肿瘤相比,Luminal B中的D和ADC值显著降低,ER表达与ADC、D和f显著相关,而D*与单克隆抗体(Ki-67)表达显著相关。IVIM亦可作为动态对比增强MRI的辅助手段,可提高乳腺良恶性病变鉴别诊断的准确性[27]。
2.2.5 磁共振扩散峰度成像 磁共振扩散峰度成像是在DWI和扩散张量成像基础上发展而来,是一种非高斯扩散加权分析方法,通过计算扩散率(D,具有非高斯偏差校正的扩散系数)和峰度(K,组织扩散与高斯模式的偏差)探测活体组织细胞内呈非正太分布水分子扩散运动的MRI新技术[28]。有学者发现浸润性乳腺癌中90%的D值往往低于良性病变,而导管原位癌D值低于乳腺良性病变(P=0.040);D值在浸润性乳腺癌中的第50个百分位数和第75个百分位数往往低于导管原位癌,D值在第50个百分位数、第75个百分位数区分乳腺良性病变和浸润性癌的特异性高达95.7%[28]。
2.3 影像组学
影像组学是利用专用的开源或内部开发的软件从影像学图像的特定感兴趣区域中提取病灶的形态、强度、质地、纹理、梯度、小波特征等,再经机器学习算法(随机森林、支持向量机、深度神经网络等)分割和提取良恶性病灶所代表图像部分的特定几何或物理特性。当一组新的未标记特征标签的图片出现时,经过训练的机器学习方法能够概括并提供未知标签的概率预测(如良性或恶性等)[29]。
有学者基于超声的影像组学对315名乳腺肿瘤患者进行乳腺恶性病变鉴别的研究结果表明,结合影像组学评分和BI-RADS 类别的列线图比单一影像组学评分或BI-RADS 类别提高了对良性和恶性病变的辨别能力[30]。
DCE-MRI是目前精确度较高的成像技术,因此大多数影像组学研究都是基于这种技术。有学者将DCEMRI和DWI与ADC值相结合使区分恶性和良性乳腺结节的总体准确度提高到0.90[31]。但很多研究反映出影像组学是一种很有前景新技术,一项基于MRI的影像组学研究发现恶性病变的熵值比良性病变的更高,反映了肿瘤的异质性及其血管状态[32]。基于MRI影像组学研究对乳腺癌分子亚型进行评估具有很好的结果。有学者基于DCE-MRI的影像组学特征和临床信息的组合模型,预测Luminal A、Luminal B、HER-2过表达和三阴性(TN)。AUC值分别为0.87、0.79、0.89和0.92[33]。有学者使用从定量ADC 图和DCE 中提取的纹理特征来检测三阴性乳腺癌(TNBC),其AUC为0.71(TNBC与Luminal A)、0.76(TNBC 与HER-2 阳性)和0.68(TNBC与非TNBC)[34]。
虽然目前影像组学研究文献数量很多,但临床应用或基于临床的评估却很少[35]。一项38个提取特征的DCE-MRI图像回顾性分析得出包括和不包括病灶大小特征的曲线下面积(AUC)分别为0.846和0.848,这些值低于乳腺放射科专家的值(AUC=0.959),表明影像组学在区分恶性和良性病变方面的价值还需进一步论证[36]。可能原因是影像组学对标准化可重复的特征提取系统的可用性和数据共享资源有限,或是大多数影像组学研究是回顾性且样本量较小缺乏可重复性评估所致。
3 乳腺癌新辅助化疗疗效评价
3.1 超声
乳腺癌在新辅助化疗(NAC)后,药物作用于肿瘤细胞会导致其变性坏死,在这个过程中瘤床或小动脉内可见到血管内膜炎、管腔狭窄等,随着治疗周期的延长,病灶纤维化程度明显降低,硬度降低。有研究表明,非Luminal型乳腺癌患者在新辅助化疗之前,超声造影显示病灶体积及灌注缺损范围大于普通超声,化疗之后则小于普通超声,新辅助化疗能有效降低病灶纤维化程度,可避免超声造影对疗效的低估[37]。经过2周期治疗后的病灶最大直径与应变率之比有助于评估乳腺癌新辅助化疗的疗效[38]。另有研究表明,乳腺癌血红蛋白含量高于良性病变,结合超声特征表现其诊断敏感度为96.6%~100%[39]。当乳腺癌癌细胞侵犯淋巴结血管或沿着淋巴结转移与总血红蛋白浓度存在一定联系,而超声光散射断层成像对总血红蛋白浓度变化敏感,可用于评估新辅助化疗的疗效[40]。
3.2 MRI
3.2.1 DCE-MRI DCE-MRI是评估乳腺癌新辅助化疗后残留病灶大小和体积的常用方法,但因病灶纤维化形成疤痕、坏死及免疫反应引起的炎症等使得DCE-MRI易高估病变的程度,而极小残留病灶因部分容积效应和化疗药物的抗血管作用致DCE-MRI易低估肿瘤的大小。尽管DCE-MRI 有残留病灶大小和体积参数的异质性结果,但反映肿瘤通透性和细胞密度的定量灌注参数(如容量转移常数、速率常数和容积比例参数)的组合可以早期预测新辅助化疗期间的pCR[41]。一项回顾性研究结果显示,乳房内残留癌症负担指数是对乳房实质和淋巴结中残留肿瘤的绝对评估,与DCE-MRI特征的变化相关性最好[42]。一项包括44项研究的Meta分析发现,MRI 在检测新辅助治疗后残留乳腺癌的中位敏感度为92%,中位特异性为90%[43]。
3.2.2 MRS MRS可以反映肿瘤治疗后早期代谢变化,肿瘤形态学变化往往落后于乳腺癌代谢物的变化(如tCho峰)。有研究显示,在新辅助化疗后具有非向心性收缩模式的乳腺癌,tCho积分降低可能可用作预测标志物[44]。随访期间,尽管肿瘤大小的变化显著,但化疗后tCho积分的变化在两组间存在显著差异,tCho积分变化的敏感度为93.75%,阳性预测值为78.9%。有学者通过高分辨率魔角旋转MRS研究了他莫昔芬、顺铂和多柔比星治疗组和未治疗组的转移性乳腺癌MDA-MB-231细胞的代谢特征,结果显示磷酸胆碱信号在未治疗组比治疗组细胞中更强,治疗组磷酸胆碱信号显著降低[45]。由此可见,MRS 在肿瘤治疗反应评估中的应用有重要价值。
3.2.3 DWI和IVIM 乳腺癌化疗后ADC变化越大,说明患者对化疗越敏感。Pereira等[46]对62名接受新辅化疗的患者在MRI 在化疗开始前、第1次化疗后和化疗结束后分别测量ADC值,显示化疗开始前和第1次化疗后的ADC值的百分比增加在pCR组中更高,当化疗开始前和第1次化疗后之间ADC的最小增加设置为25%时,敏感度为83%,特异性为84%,早期预测pCR预测新辅化疗的准确性为84%。新辅化疗第1个周期后ADC的增加与化疗后的pCR密切相关,因此可用作治疗反应的早期预测指标。有研究认为,与单指数(即DWI)的ADC相比,双指数(即IVIM)的D*和ƒ参数在预测pCR方面没有显著优势,新辅化疗期间双指数D*和ƒ参数的变化在缓解和非缓解者之间没有显著差异[47]。
3.3 影像组学
来自影像组学的诸如强度、质地、纹理、梯度、小波特征等定量数据的评估,对真正的个性化医疗有重要的临床意义。一项由定量超声监测的59名乳腺癌患者NAC后的影像组学研究结果显示[48],基于支持向量机径向函数的分类在第1周和第4周具有最高的响应预测准确率,AUC分别为81%、0.87,超声的定量反应监测有可能在早期治疗阶段促进反应引导的适应性化疗,以改善接受NAC的患者的反应,远远超过传统成像方式或最终组织病理学评估检测到的形态学变化。
影像组学在乳腺癌NAC后的病理完全缓解(pCR)评价中的表现不错。一项对纳入了152名乳腺癌患者的研究基于T2WI、DWI、DCE-MRI及其组合构建4个影像组学特征,比较了对NAC敏感和不敏感反应的患者以及pCR和非pCR患者之间的定量参数。研究结果表明,在基于T2WI、DWI、DCE-MRI以及这三者组合的影像组学特征中,组合特征在预测NAC 敏感度和实现pCR的可能性方面表现最佳(AUC为0.90)[49]。有学者认为,Luminal B和HER-2 富集的乳腺癌显示出不同的影像组学特征,使其能够与其他亚型区分开来。基于影像组学的Luminal B和HER-2富集乳腺癌的高准确度分别为100%和94.7%[50]。这一特定发现可能会产生直接的临床意义,即可能会防止女性在患有异质性肿瘤时被错误地排除在激素治疗之外。
4 乳腺癌复发风险预测
超声检查是乳腺癌术后定期复查首选方式。定量超声通过定量分析从组织反向散射的射频频谱数据来反映组织微结构特征,如检测肿瘤微结构变化和肿瘤细胞死亡信息来判断新辅助化疗的效果、识别远处淋巴结中的乳腺癌微转移[51-52]。超声造影可为淋巴结的局部复发风险发出预警[53]。有学者对246例乳腺癌经新辅助化疗且术前行DCE-MRI扫描的患者进行研究,发现在整个队列中,3年的无复发生存率和总生存率分别为82.9%和89.4%。放射学完全缓解或pCR患者复发或死亡风险显著降低,pCR但没有放射学完全缓解的患者复发风险增高(P=0.025)[54]。一项包括了1487个腋窝淋巴结的META分析结果显示,与非转移性淋巴结相比,转移性淋巴结的总体ADC值较低,DWI的敏感度和特异性分别为83%和82%[55]。
影像组学的发展具有较好的临床应用前景。一项由21个源自原发性乳腺癌超声图像的纹理特征构成的预测腋窝淋巴结转移的影像组学研究显示[56],在训练组和验证组中分别获得了0.778 和0.725 的曲线下面积值,表明乳腺癌复发风险预测能力适中。
5 展望
超声和MRI影像学新技术、影像组学的应用开拓了乳腺癌的精准医疗,尤其是人工智能在影像学中的广泛应用,并衍生出影像基因组学和栖息地成像等新兴领域,有效利用了海量影像数据,对乳腺癌的诊断、分子亚型、化疗疗效评估、预测预后和复发等领域有了重大进展,与基因组学、免疫组化指标、病理数据等联合,有望优化临床决策,改善患者预后,进一步推动乳腺癌精准医疗的发展。
