阶梯式景观河流夏季溶解性有机质构成与分布
2022-07-11陈旭东高良敏庞振东陈晓晴王慧张金昕童荣荣
陈旭东, 高良敏*, 庞振东, 陈晓晴, 王慧, 张金昕, 童荣荣
(1.安徽理工大学地球与环境学院, 淮南 232001; 2.淮南市环境保护监测站, 淮南 232001)
城市景观河流是城市生态系统的重要一环,其水质状况变化对其生态功能与景观价值有重要影响。溶解性有机质(dissolved organic matter,DOM)是由成千上万种芳香族和脂肪族化合物组成复杂异质体(包括羧基、苯酚、醌基、醛、酯、酮、羟基和氨基等),是水体中最活跃的组分之一[1-2]。DOM具有高反应性和强迁移性[3- 4],广泛存在于土壤和水生环境中,为水环境中的微生物提供了必需的营养和能量,是生物地球化学循环中重要的一环[5- 6]。DOM的含量与构成在时空分布上有很大差异[7],对水体生态环境状况具有很好的指示作用[8-9]。目前已有多种技术来表征DOM的环境行为,而光谱法由于其独特的优势,如简便、速度快、成本低和灵敏度高等,是研究DOM最有效的工具之一[10-12]。基于光谱学的水质监测、评价和管理是一种很有前景的策略[13-15]。
同步荧光光谱(synchronous fluorescence spectrum,SFS)常用来分析和表征样品间DOM含量与构成变化情况[16]。冗余分析(redundancy analysis,RDA)可以用于分析DOM构成对水环境变化的响应[14]。DOM的异质性使其光谱重叠度高,组分间难以识别和分离,二维相关光谱(two-dimensional correlation spectroscopy,2D-COS)通过外部施加扰动(如时间、浓度、温度、磁场、pH和空间等)所产生的一系列光谱,经过Herbert-NODA变换扩展到二维空间,提高了光谱分辨率并识别出不同组分发生变化的先后顺序[17-18]。同步荧光光谱结合二维相关分析(SFS-2D-COS)对研究水体中DOM的构成与变化有着极其广泛的应用[19]。同步荧光光谱结合主成分分析(principal component analysis,PCA)是一种快速有效的光谱分析方法,可以针对DOM光谱变化特点进行分类与解析并消除光谱噪声[20]。
基于此,以夏季阶梯式景观河流不同高程水体作为研究对象,采用SFS荧光强度区域积分校正因子法解析水体DOM的含量与构成变化。通过SFS-RDA、SFS-2D-COS和SFS-PCA等方法探究DOM含量与构成变化和水环境参数间的相互关系,对城市景观河流水质监测、水污染防治和生态修复具有指导意义。
1 材料与方法
1.1 样品采集与处理
1.1.1 研究区概况
如图1所示,研究区内阶梯式景观河流位于安徽省淮南市田家庵区(117°00′30″E~117°01′30″E,32°33′05″N~32°33′35″N)。河流水体主要由周边雨水汇集而成,地势西高东低,呈现阶梯状,东西落差近22 m。百川河不同海拔区间设置多级堤坝维持水面高度,类似于多个湖泊串联相通,降水时表现出河流的特征,水体依靠重力自流由研究区东部流出。河流周围植被覆盖茂盛,绿化面积较高,流域内存在大量建筑与道路,无裸露土地。作为景观河流,部分区域水面覆盖着挺水和浮水植物。流经道路时,河流通过暗渠相连。

S1~S8为采样点
1.1.2 样品采集
样品采集时间为2021年7月,采样前一星期有短暂降水过程。使用有机玻璃采水器,每个点位采集3份水样,基础水质指标采用便携式仪器现场测定,水样于4 ℃下避光保存,3 d内完成所有指标测定。采样时估计采样区域水面覆盖率Cover,单位:%。
1.2 样品测定
1.2.1 水质参数测定
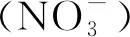
1.2.2 SFS测定
SFS测定过程中样品全程避光,待样品恢复至室温后开始测定。采用RF-5301PC(Shimadzu,日本)测定水样SFS,仪器参数为:150 W无臭氧氙气光源;激发与发射狭缝宽度均为5 nm;在激发波长Ex:220~490 nm范围扫描,波长间隔1 nm扫描速度为250 nm/min,恒定波长偏移为60 nm(选择60 nm 的值作为偏移量,以提供比其他偏移量更高的荧光强度和更好的分辨率);每个样品扫描三次取平均光谱以消除测量误差,同时测定超纯水的SFS作为空白校正。
1.3 数据分析方法
1.3.1 综合营养状态指数
采用综合营养状态指数(trophic level index,TLI)来衡量研究区水体的营养状态,TLI以TN、TP、CODMn、SD和叶绿素a(Chla)作为5种因子,通过皮尔逊相关性加权计算TLI指数[9]。根据营养状态的分级标准,当TLI<30时,水体处于贫营养状态;当30≤TLI≤50,水体处于中营养状态;当TLI>50时,水体处于富营养状态[22-23]。
1.3.2 数据统计与绘图
统计学分析使用R(4.0.5)软件进行(不同统计学水平上的显著性差异以P<0.05、P<0.01、P<0.001表示)。单因素方差分析(analysis of variance,ANOVA)及LSD事后检验使用R(4.0.5)中“agricolae”(1.3-5)包完成;使用“vegan”(2.5-7)包进行去趋势分析(detrended correspondence analysis,DCA)和RDA分析;以河流水面海拔高程变化为扰动变量,利用“corr2D”(1.0.2)包进行SFS-2D-COS分析[24];“factoextra”(1.0.7)包和“FactoMineR”(2.4)包进行SFS-PCA分析。使用“ggplot2”(3.3.5)包、Origin2021b(学习版)、Adobe Illustrator2021和ArcMap10.2绘图。数据以均值(mean)±标准偏差(SD)表示。
2 结果与讨论
2.1 水体基本参数与水质指标
如表1所示,各采样点位水面海拔高度依次降低,海拔高度变化范围为56.11~41.21 m。夏季采样水体温度维持在较高水平[(29.19±0.36)℃]。水体中EC[(325.26±13.59)μS/cm]和TDS[(210.2±8.99)mg/L]均表现出随海拔降低过程逐步升高的趋势。除S6外,其他点位TUR均处于较低水平,S6水深仅有0.3 m,水体易受底层沉积物影响,S6拥有最高的TUR(13.6 NTU)和最低的SD(0.22 m)。S5和S8处Cover最高(>80%),水面覆盖着大量的植物使水体受到的阳光辐射减少,水体藻类的活动受到影响,光合作用产生的DO减少,同时,水面覆盖也影响了水体大气复氧过程。

表1 采样点基本参数
如图2所示,河流水体各水质指标在S1~S8(每个点位采集3份水样,即样品数n=3)的分布均存在显著性差异(P<0.05,ANOVA,n=3),S1处的TN[(0.62±0.02)mg/L]和TP[(0.35±0.03)mg/L]显著高于其他点位(P<0.001,LSD)。根据《地表水环境质量标准》(GB 3838—2002),除S1外,其他点位水质符合地表水环境质量Ⅲ类标准,TP为S1首要污染指标,符合地表水环境质量Ⅴ类标准。如图2(b)所示,S1为河流源头,周边存在大量的草地、林地及未开发荒地(研究区北部为未开发荒地),降水形成的面源输入过程将周围土壤中的磷带入水体,其TP与TDP含量显著高于其他点位(P<0.001,LSD)。S2~S8周边以道路和建筑区域为主,面源输入水平较弱,TP与TDP在流程内受到降水稀释、面源输入、和生物活动等复杂环境因素的影响下呈现出波动性分布。如图2(d)所示,TLI分布表明S1(52.45±0.46)和S6(50.41±2.26)处水体于轻度富营养化的状态,而其他点位处于中营养状态。S5与S8水体中Chla浓度分别为(3.72±0.22) μg/L和(4.78±0.30)μg/L,低于其他点位,S5和S8处的藻类活动受到抑制。
以*、**、***(P<0.05、P<0.01、P<0.001,ANOVA)表示显著性差异水平;柱高表示均值(mean),误差棒表示标准偏差(SD)
2.2 SFS分析
如图3所示,根据水样DOM构成,将SFS划分为4个区域,分别为类酪氨酸区(TYRLF,220~250 nm)、类色氨酸区(TRPLF,250~300 nm)、微生物源类腐殖质区(MHLF,300~340 nm)和陆源类腐殖质区(HLF,340~490 nm)。其中,TYRLF接近DOM三维荧光光谱“B峰”区域,TRPLF则接近“T峰”区域,两者与水体生物活动所产生的DOM类蛋白物质密切相关,同时也有报道称其与人类生活尾水排放有密切关系[20]。MHLF接近于DOM海洋类腐殖质“M峰”区域,与水体中的微生物代谢活动关系紧密[25-26]。HLF穿过了“C峰”与“D”峰区域,归类为类富里酸和类胡敏酸区域,与陆地输入水体的DOM陆源类腐殖质有关,可以衡量水体DOM陆源输入强度[27-28]。

图3 采样点同步荧光光谱
SFS不同区域荧光强度积分面积,可以解释相应区域所代表的DOM组分含量及相对丰度信息。为了消除积分区域范围大小差异对结果产生的影响,提高SFS荧光强度区域积分半定量分析的准确性,参考Chen等[29]提出的三维荧光区域积分(fluorescence regional integration,FRI)区域校正倍增因子MFi。引入SFS积分校正因子SFi,每个区域的SFi等于积分区域总波长范围除以每个区域的波长范围。如表2所示,荧光区域积分面积Si乘以相应的SFi,得到校正后的荧光强度区域积分面积Sin。

表2 SFS积分校正因子
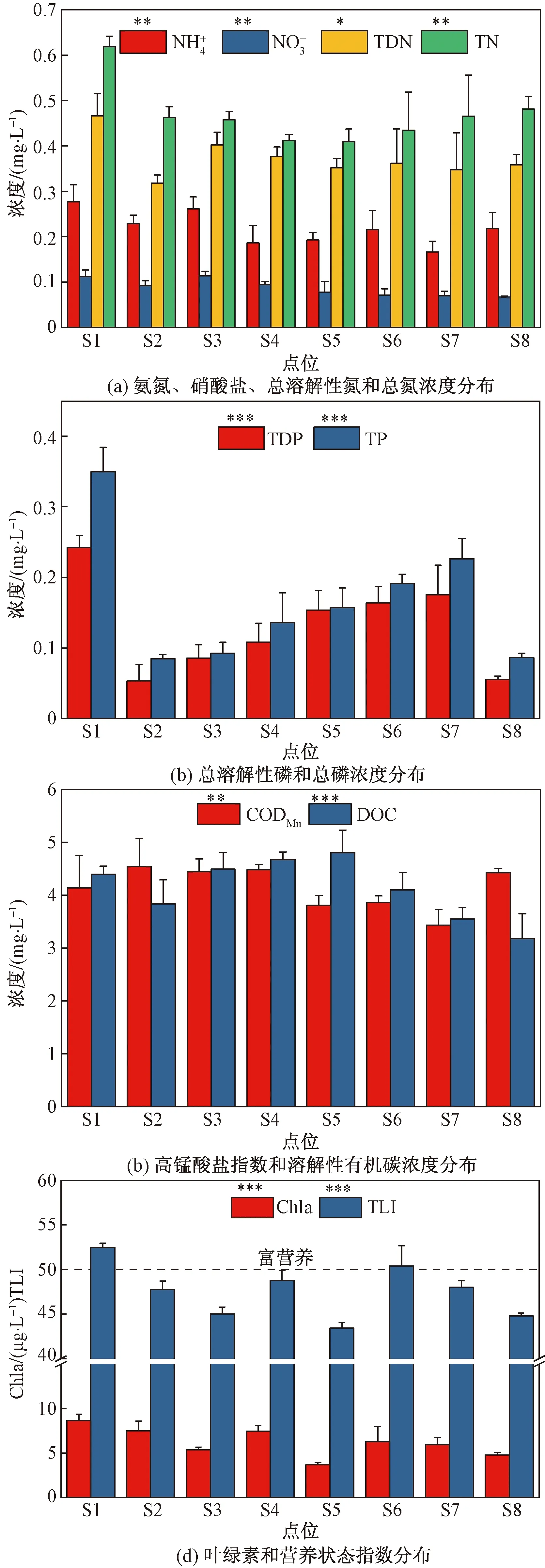
各点位水体SFS校正荧光强度区域积分结果如图4(a)所示,S1(24 970.92 a.u.)、S2(23 723.02 a.u.)、S5(23 823.66 a.u.)和S8(25 339.82 a.u.)总荧光
图4 SFS各组分荧光强度与丰度占比
强度积分高于S3(21 435.96 a.u.)、S4(22 041.05 a.u.)、S6(21 430.62 a.u.)和S7(21 226.04 a.u.)。S1周围存在大面积绿化用地及未开发荒地,降水时的陆地面源输入强度高于其它区域,水体中荧光DOM含量较高。S5和S8点位水面覆盖度高于80%,DOM光化学氧化受到抑制,光化学氧化是DOM降解的主要途径之一[9]。各区域水体DOM荧光组分丰度如图4(b)所示,研究区水体DOM主要由TYRLF(8%~15%)、TRPLF(29%~39%)和MHLF(34%~44%)构成,其占比总和达到80%以上,而代表陆地源输入的HLF占比较低(11%~18%)。HLF类物质主要来源于降水过程中陆地土壤面源输入水体,而研究区内主要土地利用类型为建筑、道路和绿化用地等。水体中来源于陆地输入的HLF类DOM物质含量远低于水体生物活动所产生的DOM。TYRLF组分呈现出逐渐降低的趋势,TYRLF所代表的低相对分子质量、弱疏水性和不饱和度的DOM组分,更易被水体中微生物利用,在河流整个流程中逐渐降低。李崇蔚等[30]利用SFS研究了内蒙古乌梁素海水体中DOM组分,MHLF为其研究区内DOM的主要组分。MHLF主要由水体中微生物活动产生,研究区内水体系统中生长着大量水生植物,水底存在着大量的植物残体,微生物分解活动剧烈,MHLF为DOM主要组分。TRPLF多由水体藻类活动产生,S8处河道狭窄,且植被茂密,水中生长了大片挺水植物,藻类活动受到抑制,TRPLF含量29%低于其他点位。S5处虽然水体覆盖度达到85%,但此处水面宽阔,且其上游点位与下游点位水面覆盖都处于低水平,研究区水体处于不断更替中,外部环境影响对其有显著影响。
2.3 SFS-RDA分析
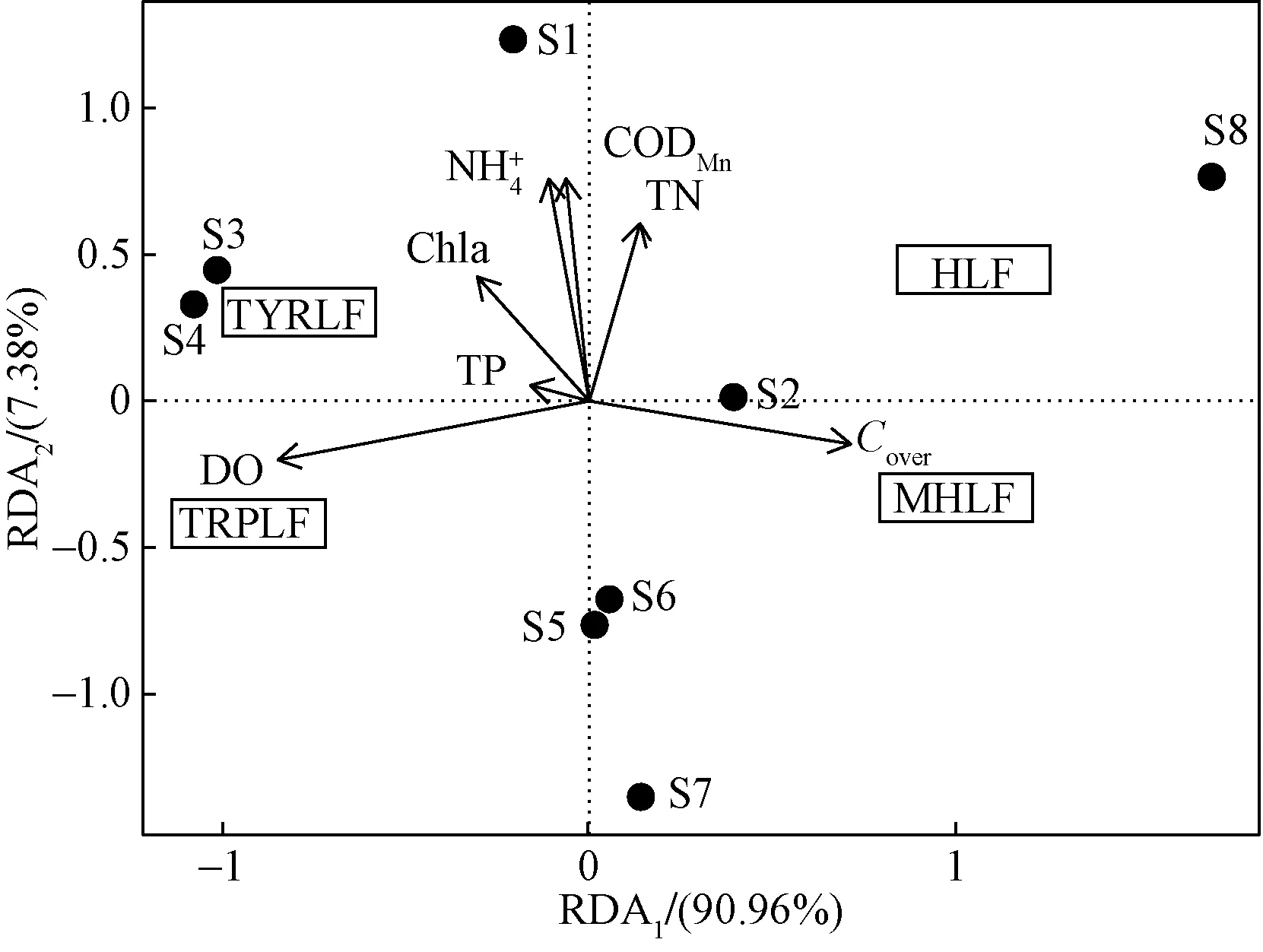
图5 RDA分析
2.4 SFS-2D-COS分析
阶梯式景观河流水体SFS-2D-COS分析结果如图6所示,在图6(a)中存在4个自动峰位,分别位于230/230、280/280、320/320、360/360 nm处,分别对应着TYRLF、TRPLF、MHLF和HLF 4个区域的SFS峰位。根据自动峰的峰强可以判断出4个DOM组分在河流水体中的变化情况,其变化强弱为:HLF(27.20)>MHLF(22.78)>TYRLF(8.87)>TRPLF(5.94)。DOM中的HLF和MHLF组分在河流流程中的变化幅度大于TYRLF和TRPLF组分,DOM中的类腐殖质组分相对于类蛋白质组分具有更大的变化幅度,更易受到周边环境的影响。图6(a)中交叉峰符号可以体现出峰位间的变化方向,4个峰位的交叉峰分别位于230/280(+)、230/320(-)、230/360(-)、280/320(-)、280/360(-)和320/360 nm(+)。根据SFS-2D-COS同步图交叉峰的符号,TYRLF和TRPLF组分变化方向与MHLF和HLF组分变化方向相反。
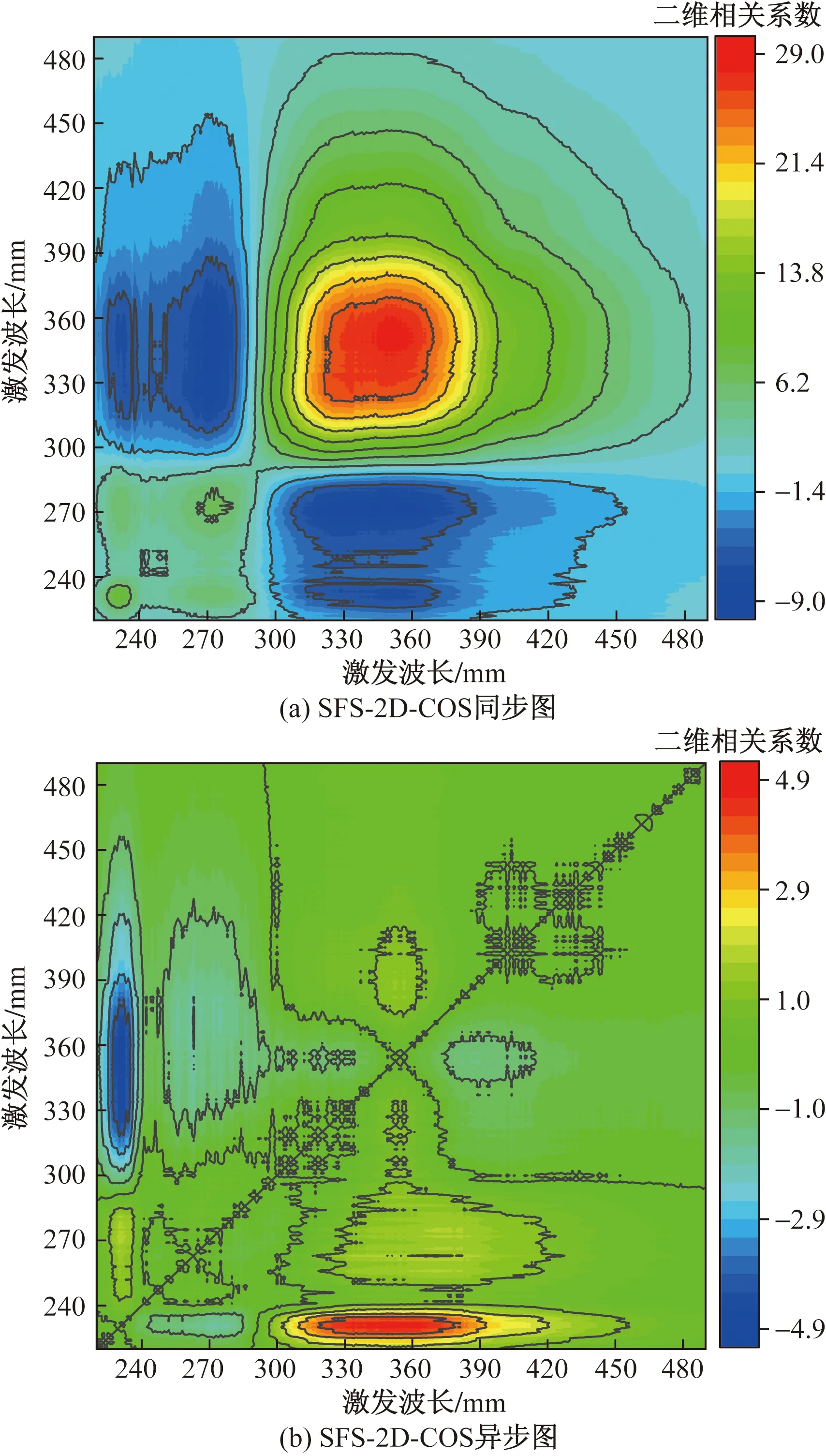
图6 SFS-2D-COS分析
SFS-2D-COS同步图[图6(a)]与异步图[图6(b)]对应峰位符号结合NODA规则[当同步图6中(X1、X2)和异步图中(X1,X2)符号正负相同时,X1波长处的光谱强度变化先于X2波长处发生,否则相反;同步图中(X1,X2)≠0而异步图中(X1,X2)=0时,X1和X2的光谱强度变化完全同步,当同步图(X1,X2)=0,二者变化顺序无法断定]可以判断水体流动过程中DOM荧光组分变化先后顺序[31-32]。同步图与异步图对应峰位的SFS-2D-COS符号如表3所示,根据NODA规则,河流水体中DOM各组分的变化先后顺序为:230 nm(TYRLF)>280 nm(TRPLF)>360 nm(HLF)>320 nm(MHLF)。在河流水体中类蛋白组分先于类腐殖质发生变化,类蛋白组分更易参与水体中的生物活动,从而发生变化,而微生物活动所产生的类腐殖质(MHLF)则拥有最高的稳定性。Ishii等[33]研究表明,接近“M峰”位置的微生物源类腐殖质(MHLF)比靠近“C峰”位置的陆源类腐殖质(HLF)更耐光化学氧化分解。
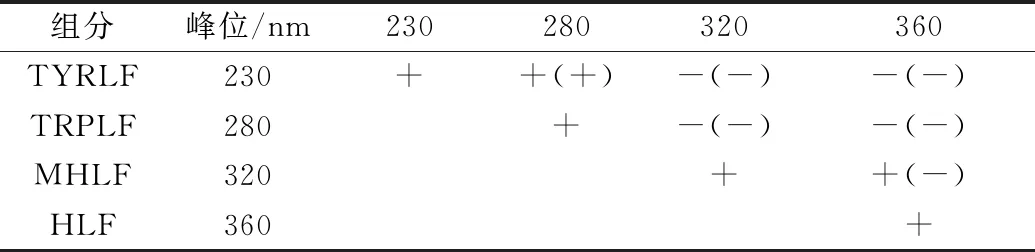
表3 NODA规则
2.5 SFS-PCA
对水样SFS进行PCA分析,KMO值为0.81,Bartlett检验P<0.001,水体DOM的SFS数据适合进行PCA分析[20, 34]。PCA的两个主成分共解释了SFS数据集99.8%方差变化,其中,PC1解释了96.9%方差变化,PC2解释了2.9%方差变化。根据图7(a)中的PC1和PC2波长得分分布情况,PC1正载荷方向代表了DOM的TRPLF和MHLF组分,负载荷方向代表了TYRLF和HLF组分。PC2正载荷方向为DOM类蛋白组分(TYRLF和TRPLF),负载荷方向为DOM类腐殖质组分(MHLF和HLF)。
图7(b)中展示了不同点位的分布情况,所有采样点位均位于PC1的正载荷方向,表明水体中的DOM以TRPLF和MHLF组分为主要成分。S3和S4位于PC2的正载荷方向,表明其DOM组分以类蛋白为主,而S8位于PC2的负载荷方向,其DOM以类腐殖质组分为主。SFS-PCA所得到的组分分布与SFS区域积分结果类似,可以作为水体DOM组分构成快速分类的依据。

图7 SFS-PCA分析
3 结论
(1)根据DOM的荧光特性将SFS划分为TYRLF、TRPLF、MHLF和HLF 4个区域。采用SFS荧光强度积分校正因子对区域积分面积进行校正,提高了SFS半定量分析准确性。
(2)夏季阶梯式景观河流水体中DOM以类蛋白组分(TYRLF和TRPLF)和微生物源类腐殖质(MHLF)为主(>80%),陆源类腐殖质(HLF)占比较低(<20%)。SFS-2D-COS揭示了随着水体的运移,DOM中的类蛋白组分(TYRLF和TRPLF)与类腐殖质组分(MHLF和HLF)变化趋势相反,且变化先后顺序为:TYRLF>TRPLF>HLF >MHLF。
(3)RDA分析表明水体中DOM的构成受到了水面覆盖与陆地面源输入的双重影响。
(4)同步荧光光谱主成分分析(SFS-PCA)可以根据荧光峰值的分布对水样进行分类,识别出不同水体DOM构成差异。
