川芎龙蛭汤对脑缺血损伤模型大鼠血清中TNF-α、Ang-1和VEGF水平影响及作用机制
2022-07-11孙锡萍王念龙刘天易祝明浩
孙锡萍 王念龙 刘天易 祝明浩
(1青岛市即墨区中医医院,山东 即墨 266200;2青岛市即墨区人民医院;3山东中医药大学附属医院)
脑缺血是脑血管常见疾病,指组织在一定时间缺血后组织受到损伤,使脑细胞产生炎性反应、能量障碍、凋亡基因激活等多种损伤,最终导致神经元损伤〔1〕。炎症反应可造成脑组织损伤,减少炎症反应可能对脑缺血损伤疾病的治疗及预后有积极影响,肿瘤坏死因子(TNF)-α具有多种免疫调节作用的蛋白,可介导白细胞介素(IL)-6等多种炎症细胞因子释放,TNF-α高表达可加重脑缺血,抑制TNF-α因子合成、分泌及表达,可减轻缺血再灌注脑损伤〔2,3〕。血管内皮生长因子(VEGF)为血管新生过程中调控因子,也是脑缺血后使血管再生的调控因子,可通过促进血管内皮细胞分裂、增殖等促进血管新生。血管紧张素(Ang)-1具有强烈促增殖和分化作用,参与内皮细胞迁移、增殖等多个环节调控新生血管,上调Ang-1表达可调控新生血管的重塑〔4,5〕。
脑缺血损伤属中医学“中风”范畴,是严重危害人类生活健康的主要疾病,西医临床治疗以溶栓和神经保护剂等为主,不良反应较重,成本高,不适合患者长期使用。中药有效成分对各种疾病的预防和治疗具有多环节和多靶点的优势,在减少脑缺血损伤方面也具有一定优势〔6〕。川芎龙蛭汤为青岛市即墨区中医医院在《寿世保元》卷五活血汤的基础上,加减化裁形成的院内协定方,对脑卒中类疾病具有较好的临床疗效,但其作用机制尚不明确〔7,8〕。本研究探讨川芎龙蛭汤对实验性脑缺血损伤模型大鼠TNF-α、Ang-1和VEGF水平的影响及作用机制。
1 材料与方法
1.1实验动物 清洁级SD大鼠,8周龄,体重(200±20)g,购自山东省实验动物中心〔SCXK-(鲁)2018-0001〕,室温饲养,自由饮水,适应性饲养3 d后进行实验。
1.2药品、试剂及仪器 川芎龙蛭汤方药组成:川芎10 g、地龙15 g、水蛭10 g、郁金10 g、石菖蒲15 g、胆南星10 g、生黄芪20 g、制首乌15 g、钩藤10 g、仙灵脾10 g、枸杞子10 g、女贞子10 g、丹参20 g、全蝎10 g、僵蚕10 g。上述中药饮片由青岛市即墨区中医医院中药房提供,药材加水煎煮2次,分别浓缩至含0.5、1.0、1.5 g/ml原药材的药液,作为川芎龙蛭汤低、中、高剂量组。芪蛭通络胶囊(0.5 g/粒,山西振东制药股份有限公司,生产批号:20181213),尼龙线栓购自北京沙东生物技术有限公司,水合氯醛购自国药集团化学试剂有限公司,苏木素-伊红(HE)染色试剂盒和2,3,5-氯化三苯基四氮唑(TTC)染色购自武汉阿斯本生物技术有限公司(批号分别为:AS1055A、AS1055B和AS1095),TNF-α、Ang-1和VEGF试剂盒购自碧云天生物科技有限公司(批号分别为:J190064、J190007和J180079),二喹啉甲酸(BCA)试剂盒和二氨基联苯胺(DAB)显色液(碧云天生物科技有限公司,批号分别为:201903171、201903115),Trizol提取试剂盒购自TaKaRa公司(批号:AKA5101),实时荧光定量聚合酶链反应(qPCR)试剂盒购自BIO-RAD公司(批号:L001751A),反转录试剂盒购自TaKaRa公司(批号:AK4102),TNF-α、Ang-1、VEGF和GAPDH引物购自生工生物工程(上海)股份有限公司,聚偏氟乙烯(PVDF)膜购自Millipore公司(批号:K5EA5859N),山羊抗兔IgG购自Abcam公司(批号:150077),TNF-α、Ang-1、VEGF单抗购自武汉阿斯本生物技术有限公司(批号分别为bs-4617R、bs-0920R和bs-0167R)。实验仪器:手术器械(苏州六六视觉医疗设备公司),BX60显微镜(日本Olympus Optical公司),ELx800酶标仪(美国伯腾仪器有限公司),电泳仪和转膜仪〔伯乐生命医学产品(上海)有限公司〕,SIM凝胶成像仪(美国西盟生命技术有限公司),反转录(RT)-PCR扩增分析系统(美国罗氏公司)。
1.3模型建立及分组 将60雄性SD大鼠用5%水合氯醛麻醉,随机分为对照组、模型组和川芎龙蛭汤低、中、高剂量组和阳性组各10只。除对照组外,其他5组采用改良闭塞线栓法栓塞大脑中动脉建立实验性脑缺血损伤大鼠模型〔9〕,去除大鼠右侧背部被毛,仰卧四肢固定于手术台板,颈部正中区域做竖切口,钝性分离双侧筋膜及腺体,充分暴露右侧颈动脉,显微镊分离颈外动脉和颈内动脉,靠近分叉处结扎颈外动脉,距右侧颈总动脉分叉近端丝线结扎,在右侧颈总动脉远端置丝线打一活结备用,逐层缝合筋膜和皮肤,切口用碘伏常规消毒。对照组除不插入线栓外,其余手术过程相同。
1.4给药方法 于造模24 h后进行干预。对照组和模型组给予生理盐水灌胃,川芎龙蛭汤低、中、高剂量组给予不同浓度的川芎龙蛭汤灌胃,剂量均为10 ml/kg,1次/d,给药7 d。阳性组给予芪蛭通络胶囊,取芪蛭通络胶囊内容物制成0.1 g/ml的药液,灌胃剂量为1.0 g/kg,1次/d,给药7 d。
1.5神经功能损伤程度 末次给药24 h后评价神经功能损伤程度,采用5级评分法〔10〕,无神经功能缺损症为0分;提尾悬空时对侧前爪不能伸展为1分;行走时出现向左侧转圈为2分;行走时出现困难且向左侧倾倒为3分;无自主活动且伴意识丧失为4分。
1.6脑梗死面积 采用TTC染色测定大脑梗死面积,脑片平铺于2%TTC染色液中,避光孵育0.5 h,脑片用10%甲醛固定,梗死组织呈白色,正常脑组织呈红色,通过Image-Pro Plus6.0 测量脑梗死面积。梗死体积=梗死体积/对侧大脑半球体积。
1.7炎症因子测定 处死各组大鼠前,眼球取血,离心,取上清,采用酶联免疫吸附试验(ELISA)测定各组血清TNF-α、Ang-1和VEGF水平,按照说明书操作。
1.8脑组织HE染色 分别于末次给药24 h后,眼球取血处死动物,取脑组织,生理盐水清洗,固定48 h后,二甲苯脱脂,酒精脱水,石蜡包埋,切片,乙醇水化,苏木素染色,1%盐酸乙醇溶液分化,自来水冲洗返蓝,浸入伊红染液,梯度酒精脱水,二甲苯透明,中性树胶进行封片,显微镜下观察。
1.9RT-PCR检测mRNA水平 取脑组织标本50 mg,Trizol法提取总RNA,取1 μl提取的RNA,采用微量分光光度计于A260和A280检测提取的RNA纯度,去除DNA后以GAPDH为内参进行cDNA 合成,采用RT-PCR和相关软件检测TNF-α、Ang-1和VEGF的mRNA,40个循环,预变性95℃ 30 s,变性95℃ 10 s,退火60℃ 30 s,延伸72℃ 30 s,延伸72℃ 5 min,测定mRNA的相对表达量。
1.10Western印迹检测蛋白 取100 mg皮肤组织标本,磷酸盐缓冲液(PBS)冲3次,加入含1 mmol/L苯甲基磺酰氟(PMSF)的RIPA低温研磨,离心取上清,BCA法检测蛋白浓度,562 nm测定OD值,计算蛋白浓度,将胶板安装于电泳槽中,倒入电泳液,按40 μg蛋白上样,电泳条件为电压80 V、30 min,样品进入分离胶后调节电压至120 V,电泳结束后,取出玻璃板,切去浓缩胶及分离胶,进行转膜,PVDF膜使用前浸于适量甲醇中活化,设置转膜条件(80 V、120 min),冰浴,取出PVDF膜,37℃恒温摇床封闭2 h,将PVDF膜裁成长条,置于TNF-α、Ang-1、VEGF一抗(1∶100)和GAPDH(1∶500),4℃恒温摇床孵育过夜,1×TBST 洗PVDF膜3次,夹取PVDF膜置入二抗(辣根酶标记山羊抗兔IgG,1∶5 000)1 h,1×TBST 洗PVDF膜3次,DAB显色,凝胶成像系统分析蛋白表达条带灰度,计算TNF-α、Ang-1和VEGF蛋白表达量。
1.11统计学方法 采用SPSS20.0软件进行单因素方差分析(ANOVA)、LSD法。
2 结 果
2.1各自神经功能损伤评分和脑梗死体积比较 与对照组比较,其余5组神经功能损伤评分和脑梗死体积显著升高(P<0.05);与模型组比较,川芎龙蛭汤低、中、高剂量组及阳性组神经功能损伤评分和脑梗死体积显著降低(P<0.05);与川芎龙蛭汤低剂量组比较,川芎龙蛭汤中、高剂量组和阳性组神经功能损伤评分和脑梗死体积显著降低(P<0.05)。见表1。
2.2各组血清TNF-α、Ang-1和VEGF水平比较 与对照组比较,其余5组血清TNF-α、Ang-1和VEGF水平显著升高(P<0.05);与模型组比较,川芎龙蛭汤低、中、高剂量组和阳性组血清TNF-α显著降低,而Ang-1和VEGF水平显著升高(P<0.05);与川芎龙蛭汤低剂量组比较,川芎龙蛭汤中、高剂量组TNF-α水平显著降低,Ang-1、VEGF水平显著升高(P<0.05),而阳性组各指标无明显差异(P>0.05)。见表1。
表1 各组神经功能损伤评分和脑梗死体积及血清TNF-α、Ang-1、VEGF水平比较
2.3各组脑组织HE染色 对照组脑组织正常,脑细胞排列有序,细胞轮廓清晰、结构完整,无水肿,形态正常,未见异常;与对照组比较,模型组细胞明显减少,大量细胞坏死且排列紊乱,梗死灶内细胞和血管坏死、脑组织细胞疏松、细胞形态改变、间质水肿,川芎龙蛭汤低、中、高剂量组和阳性组脑组织损伤减轻,细胞稍显疏松,水肿减轻。见图1。
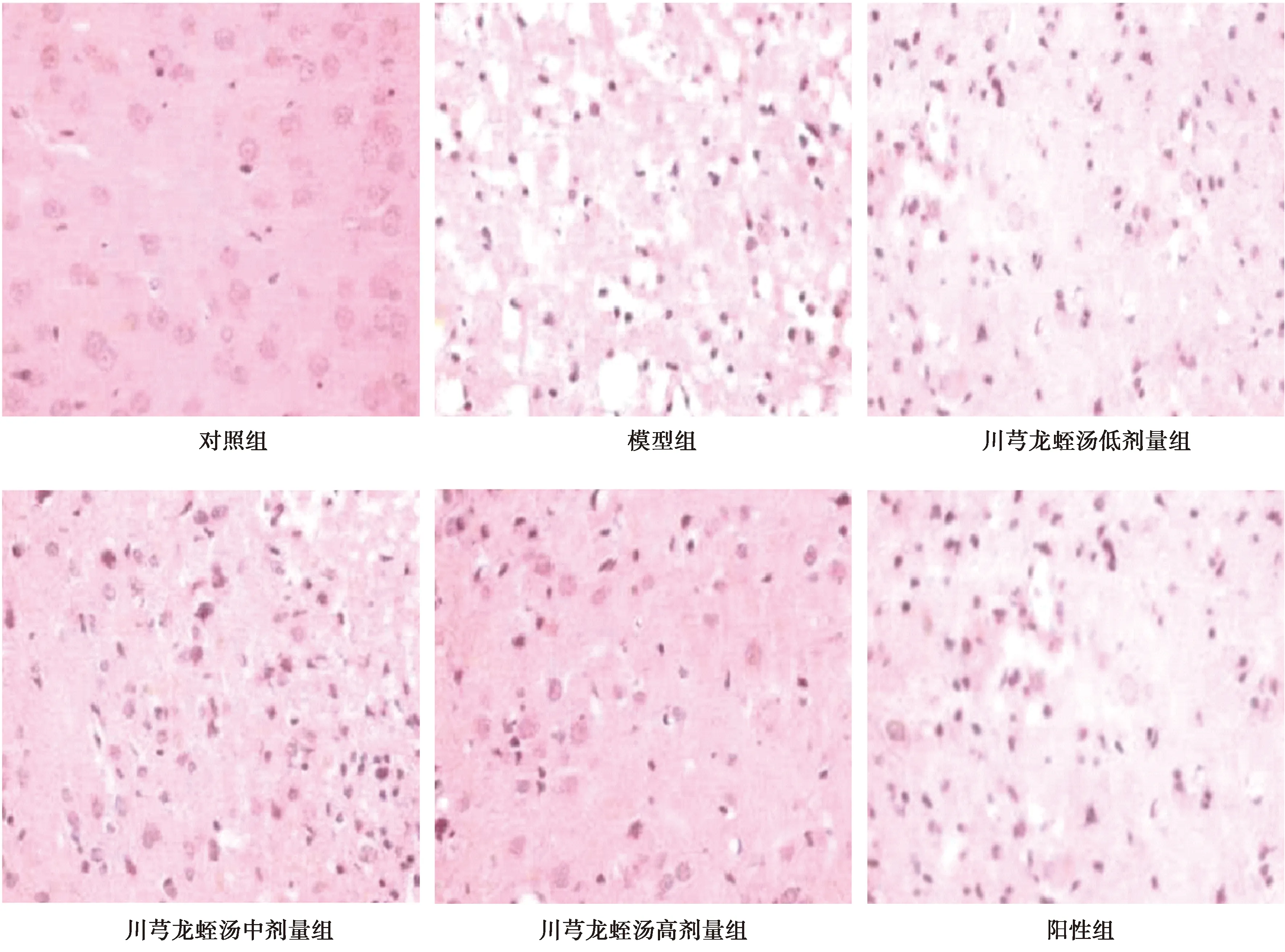
图1 各组脑组织HE染色(×200)
2.4各组TNF-α、Ang-1和VEGF mRNA及蛋白水平比较 与对照组比较,其余5组脑组织中TNF-α、Ang-1、VEGF mRNA及蛋白水平显著升高(P<0.05);与模型组比较,川芎龙蛭汤低、中、高剂量组和阳性组血清TNF-α mRNA及蛋白水平显著降低,而Ang-1、VEGF mRNA及蛋白水平显著升高(P<0.05);与川芎龙蛭汤低剂量组比较,川芎龙蛭汤中、高剂量组TNF-α mRNA及蛋白水平显著降低,Ang-1、VEGF mRNA及蛋白水平显著升高(P<0.05),而阳性组各指标mRNA及蛋白水平无明显差异(P>0.05)。见表2。
表2 各组TNF-α、Ang-1和VEGF mRNA及蛋白水平比较
3 讨 论
脑缺血损伤机制十分复杂,炎症反应在脑缺血损伤中具有重要作用,缺血脑组织中炎症因子的大量表达促进了炎症反应,其中TNF-α是大脑缺血损伤中最重要炎症细胞因子。TNF-α在脑组织中主要由星形细胞和小胶质细胞分泌。金平等〔11〕发现慢性脑缺血大鼠脑组织IL-1β、IL-6、TNF-α等免疫炎性因子与β淀粉样蛋白(Aβ)1~42表达水平明显升高,免疫炎性反应或与慢性脑缺血所导致的脑组织Aβ1~42异常沉积有关。本研究给予不同剂量川芎龙蛭汤后可显著降低血清TNF-α及脑组织中TNF-α mRNA和蛋白水平。这可能与川芎龙蛭汤方中枸杞多糖抑制核转录因子(NF)-κB和炎症反应有关,对缺血再灌注小鼠脑损伤有明显保护作用,石菖蒲、丹参、全蝎等通窍活血药降低大鼠脑缺血再灌注损伤时炎症细胞因子的水平,从而减轻脑缺血再灌注损伤程度〔12〕。
脑缺血损伤直接引发局部脑组织缺血和缺氧,新生血管能明显增加缺血周边的脑血流量,微血管新生是重建缺血缺氧区域血供的主要途径,血管新生程度直接关系到缺血组织预后。血管生成素是由血管内皮周围组织分泌的细胞生长因子,有很强的促血管生成作用,Ang-1在介导内皮细胞与周围基质和间质之间起着至关重要的作用,Ang-1低表达使新生血管不稳定且易发生渗漏,高表达可促进内皮细胞和邻近的周细胞、成纤维细胞增多,毛细血管紧密,保护新生血管〔13〕。张涓等〔14〕发现,Ang-1/内皮细胞TEK酪氨酸激酶(Tie)2信号通路参与血管生成的最后阶段,促进损伤神经功能恢复,在血管新生、神经再生中发挥重要作用。本研究给予不同剂量川芎龙蛭汤后可显著升高血清Ang-1和脑组织中Ang-1 mRNA及蛋白水平,这与川芎龙蛭汤方中川芎、地龙、水蛭等活血化瘀类中药通过血管生成素和整合素通路干预促进血管生成、提高脑血流量、增强相关基因转录、上调某些神经营养因子表达、使脑缺血部位的血管新生等有关〔15〕。
VEGF是血管生成的关键性因子,在脑缺血缺氧的诱导下迅速增多,启动血管生成,促进神经功能恢复,参与脑缺血损伤病理过程中参与神经和血管的重塑〔16〕。VEGF可促进血管新生,保护神经元免受缺血缺氧导致的损伤,参与并调控脑缺血后血管新生,脑缺血可诱导VEGF表达上调。脑缺血发作患者血清缺氧诱导因子(HIF)-1α、VEGF水平升高,腺苷预处理应用于局灶性脑缺血再灌注损伤大鼠,增加VEGF、HIF-1α表达以保护脑组织,从而保护缺血神经元〔17〕。本研究给予不同剂量川芎龙蛭汤后可显著升高血清VEGF及脑组织中VEGF mRNA和蛋白水平,这与川芎龙蛭汤方中川芎、生黄芪等激活HIF-1α/VEGF信号转导通路,升高缺血再灌注大鼠血清胶质纤维酸性蛋白(GFAP)、VEGF水平及缺血脑组织Notch1 mRNA表达、促进脑缺血损伤大鼠脑内血管新生等有关〔18〕。
综上,实验性脑缺血损伤模型大鼠TNF-α、Ang-1和VEGF水平显著升高,给予川芎龙蛭汤可显著改善脑组织损伤,其机制与降低TNF-α、升高Ang-1和VEGF水平有关。
