根系分泌物对土壤中多环芳烃降解及相关微生物的影响
2022-07-09武文涛陈希元王晓杰
武文涛,陈希元,王晓杰
(张家口学院,河北 张家口 075000)
多环芳烃(polycyclic aromatic hydrocarbons,PAH)是一类普遍存在于农业土壤中的有机污染物[1],具有难自然降解、低溶解、致畸、致癌和基因毒性等特性,对环境生态安全及人类健康构成严重威胁,如何有效修复土壤PAH污染已成为目前亟待解决的问题[2]。活性根修复是一种利用植物根系分泌物及其相关根际微生物降解环境污染物的生物修复策略,具有无污染、无公害、处理费用低廉等优势,成为控制和修复土壤污染的最佳选择之一[3]。
根系分泌物是植物光合作用产物从地上部转移到根系从而分泌至根际的一类化合物,是介导根际土壤微生态的主要驱动因素[4]。根系分泌物可充当表面活性剂,从而增加PAH溶解;同时可通过增加土壤含氧量、改善土壤团聚体结构、促进土壤劫持的PAH释放及生物利用度介导土壤PAH修复过程;根系分泌物还能促进根际微生物的增殖,形成独特的根际细菌群落[5]。一般而言,植物根系分泌物主要由有机酸、氨基酸、脂肪酸、酚类化合物、维生素及甾醇组成[6],其成分可充当根际微生物的碳源和能量来源,从而增强土壤中微生物生物量及其活性[7]。此外,有研究显示紫茎泽兰、黑麦草及水稻等植物根系分泌物可促进细菌群落结构的形成,且根际细菌比非根际细菌具有更强的代谢能力[4]。因此,根系分泌物被认为是PAH根部修复的潜在功能物质。
近年来,根系分泌物对土壤污染物降解的能力及其对相关降解基因的影响已成为土壤修复新的研究热点。前人研究表明,从黑麦草根系中释放的化合物可以上调根际细菌双加氧酶α亚基(PAH-RHDα)基因的表达水平,并介导土壤中PAH降解的特定功能细菌群落[8]。土壤微生物如假单胞菌属(Pseudomonas)和诺卡氏菌属(Nocardioides)编码可降解PAH的相关基因[9],基因丰度及功能菌数量是降解PAH潜力的重要表征[10]。因此,细菌群落结构特征是影响根际微生物修复效果的关键因素,PAH降解基因的丰度可作为衡量根际微生物降解能力的重要指标[9]。然而,在PAH降解过程中其降解效率与降解基因及微生物群落对根系分泌物添加的响应特征尚不清楚。基于此,本研究选用萘(NAP)、菲(PHE)和芘(PYR)为PAH代表物质,以人工根系分泌物和水稻根系分泌物为外源添加剂,nidA、nahAc和phe基因用作PAH降解物的指示基因[11],利用定量聚合酶链反应(qPCR)研究PAH降解基因对根系分泌物的反应特性,并通过高通量测序分析根系分泌物对PAH污染土壤细菌群落结构的影响。研究结果将有助于诠释不同根系分泌物对多环芳烃污染土壤的微生物修复机制。
1 材料与方法
1.1 供试材料
试验于2021年5—6月于河北农业大学农学院生长调控气候室(25±1℃)中进行。
人工根系分泌物由26.7 mmol/L葡萄糖、26.7 mmol/L果糖、26.7 mmol/L乳酸、19.8 mmol/L琥珀酸、13.3 mmol/L蔗糖、13.3 mmol/L丙氨酸、13.3 mmol/L丝氨酸、13 mmol/L柠檬酸和7.8 mmol/L谷氨酸配制而成[12],有机碳含量为10 g/L,原液稀释至100 mg/L,pH=6.0。
水稻根系分泌物购自上海丰科生物农业科技有限公司,原始浓度为258 mg/L,-70℃冷冻保存。在有机污染物降解方面表现出良好的性能[13]。
供试土壤取自河北农业大学农学院试验场(38°79′N,115°56′E)的0~20 cm表层土壤。去除植物残体及砂石,经自然风干后混匀过2 mm网筛备用。土壤类型为棕红壤,其理化性质为pH=6.55、有机质16.54 g/kg、全磷0.35 g/kg、碱解氮86.8 g/kg、有效磷3.92 mg/kg、速效钾122.79 mg/kg。土壤中NAP、PHE和PYR均未检出。
供试NAP(纯度98.78%)、PHE(纯度99.0%)和PYR(纯度99.05%)均为常规标准品,购自上海阿拉丁生化科技股份有限公司。用蒸馏水及丙酮混合物将NAP、PHE和PYR配制成供试土壤含量分别为9.15、9.28、9.38 mg/kg。
1.2 试验设计
试验采用完全随机设计,设置人工根系分泌物(A)及水稻根系分泌物(B)处理,分别设置10(10)、20(20)、40(40)、80(80)mg/kg共4个水平,以施用相同体积蒸馏水为对照(CK),共9个处理,重复8次。
采用棕色圆柱形聚乙烯塑料瓶(3cm×3 cm×6 cm)装土0.5 kg,用蒸馏水维持土壤含水量在田间持水量的60%。土壤样品在70%相对湿度的气候室中培养。在培养第14、28天每处理取3次重复样品用于试验分析。
1.3 样品采集及测定分析
1.3.1 土壤中多环芳烃浓度测定 培养结束后,将土壤样品在FDU-2110真空冷冻干燥机干燥24 h,分析前将土壤过0.15 mm标准筛,保存于-20℃待测。
采用超声波辅助溶剂萃取技术从土壤样品中提取多环芳烃,具体参照Wang等[14]的方法。将土壤样品采用10 mL正己烷和二氯甲烷(V∶V=1∶1)超声处理3次,每次30 min,离心并通过硅胶柱分离,随后用10 mL二氯甲烷洗脱。将样品蒸发并用1 mL甲醇溶解。配备紫外和荧光检测器的高效液相色谱(Shimadzu,Tokyo,Japan)用于分析通过0.22μm过滤器的PAH溶液。HPLC配备Φ4.6 mm×250 mm反相C18小柱,使用甲醇和超纯水作为流动相,流速为1 mL/min。色谱分析在40℃下进行,进样量为20μL,采用外标法确定NAP、PHE和PYR浓度。
1.3.2 土壤DNA提取及qRT-PCR分析 称取新鲜土壤样品250 mg,采用PowerSoil脱氧核糖核酸分离试剂盒 (MoBio Laboratories,Carlsbad,USA)提取gDNA。采用1.0%琼脂糖凝胶电泳和紫外分光光度法检测其纯度与浓度。使用QS3(Thermo,Waltham,CA,USA)系统扩增16S rRNA基因和PAH降解基因(nidA、nahAc、phe,表1)。使用SYBR GREEN PCR Master Mix(Toyobo,Osaka,Japan)和Bio-Rad CFX96实时检测系统进行定量检测。

表1 引物序列
qRT-PCR反应体系:10.0μL AceQ-qPCR SYBR Green Master混合物(Vazyme,南京,中国)、ddH2O 1.0μL、gDNA模板0.5μL、正、反向引物各0.4μL。qRT-PCR反应步骤:95℃10 min;95℃15 s,55℃30 s,72℃35 s,循环40次;95℃2 min,55℃30 s,95℃30 s。实时荧光定量PCR由StepOnePlus Real-Time PCR仪完成。
1.3.3 微生物群落的高通量测序 (1)土壤细菌DNA的提取:土壤细菌DNA采用E.Z.N.AⓇMag-Bind Soil DNA Kit(OMEGA)试剂盒进行提取。利用Qubit 3.0检测试剂盒对基因组DNA精确定量。采用338F(5′-ACTCCTACGGGAGGCAGCAG-3′),806R(5′-GGACTACHVGGGTWTCTAAT-3′)扩增细菌16S rRNA V3-V4区间。具体反应体系及步骤参照陈海念[15]的方法。PCR产物用2%琼脂糖凝胶电泳进行检测。
(2)DNA纯化及Illumina-MiSeq测序:对于扩增片段在400 bp以上的PCR产物,选用0.6倍磁珠(VAHTS TM DNA Clean Beads)处理。利用Qubit 3.0 DNA检测试剂盒对回收的DNA进行精确定量,每个样品DNA量取10 ng,利用Illumina Miseq平台进行高通量测序。
Illumina MiseqTM得到的原始图像数据经CASAVA碱基识别(Base Calling)分析转化为原始测序序列(Sequenced Reads),结果以FASTQ(.fq)文件格式存储。使用FLASH软件对测序有效数据进行拼接。使用Usearch软件,根据97%相似度对序列进行操作分类单元聚类[16]。利用RDP对每条序列与Silva数据库(SSU123)比对进行物种分类注释,设置置信度阈值为70%,得到每条序列从门到属的分类信息,基于分类学信息,在逐级分类水平上进行群落结构的统计分析[17]。利用Mothur软件统计每个生物样本的Chao 1和Shannon多样性指数[15]。以上分析委托上海派森诺生物科技股份有限公司完成。
1.4 数据处理与分析
采用Microsoft Excel 2013进行数据整理,采用SPSS 23.0软件进行单因素方差分析(ANOVA),采用邓肯氏多重比较进行统计分析,采用R语言、Origin 2018进行图形绘制。
2 结果与分析
2.1 根系分泌物对土壤中多环芳烃降解的影响
由图1可知,添加10、20、40、80 mg/kg人工根系分泌物和水稻根系分泌物皆有效促进了土壤中NAP、PHE和PYR的降解,整体来看,降解率随着根系分泌物浓度的增加呈先上升后降低趋势。人工根系分泌物处理中,与CK处理相比,培养28 d时NAP、PHE和PYR的平均降解率分别显著提高41.08%、68.32%和65.67%(P<0.05),NAP、PYR的降解率以40 mg/kg浓度处理最高,较CK处理分别显著提高20.77%、30.54%;PHE降解率14 d以40 mg/kg处理最高,28 d以80 mg/kg处理最高,分别比CK显著提高26.16%、38.92%。

图1 不同根系分泌物处理下土壤样品中萘(NAP)、菲(PHE)和芘(PYR)的降解率
水稻根系分泌物处理培养28 d时,NAP、PHE和PYR平均降解率较CK处理分别显著增加46.27%、91.80%和60.52%。当水稻根系分泌物的浓度从CK(0 mg/kg)增加到40 mg/kg时,NAP、PHE和PYR 的降解率分别从52.72%、38.02%和40.88%提高到85.16%、78.26%和78.36%;当根系分泌物浓度增加至80 mg/kg时,NAP、PHE和PYR的降解率分别下降至60.55%、61.26%和58.98%。
2.2 根系分泌物对土壤16S rRNA和PAH降解基因丰度的影响
由图2可知,与CK处理相比,添加人工和水稻根系分泌物皆降低了16S rRNA的基因拷贝数。人工根系分泌物处理中,培养14 d和28 d皆增加土壤中nidA、nahAc和phe的丰度,最大拷贝数分别达66.46×106、13.48×104和20.56×106,与CK处理相比,分别显著增加3.10、2.27、1.35倍。水稻根系分泌物处理中,培养14 d和28 d皆显著提高土壤中nahAc和phe的丰度,最高分别达55.55×104和24.31×106,比CK处理显著增加12.45倍和1.99倍;但nidA的丰度低于CK处理。

图2 不同根系分泌物对土壤16SrRNA和相关降解基因绝对丰度的影响
2.3 根系分泌物对污染土壤中细菌Alpha多样性的影响
基于高通量测序结果,从30(10×3)个样本中共获得2 036 692条细菌16S rRNA基因序列。Alpha多样性用于评估细菌多样性(Shannon)和丰富度(Chao 1)在培养过程中的变化。如图3所示,在OTU、Chao 1和Shannon指数中,人工根系分泌物(A)及水稻根系分泌物(B)在培养第14 d均高于CK处理,但在培养第28 d均低于CK处理,表明细菌的多样性和丰富度在培养过程中处于动态变化。在培养28 d的水稻分泌物处理中,10、80 mg/kg浓度处理下的OTU、Chao 1和Shannon指数皆显著低于CK处理,对细菌多样性和丰富度的影响大于添加人工根系分泌物。

图3 不同根系分泌物对污染土壤中细菌Alpha多样性的影响
2.4 根系分泌物对污染土壤中细菌群落结构的影响
由图4可知,所有土壤样品中细菌共确定10个门,CK处理和根系分泌物处理中优势细菌门相同,均为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)和芽单胞菌门(Gemmatimonadetes),其相对丰度CK处理分别为30.36% ~30.53%、28.08% ~29.34%、15.87% ~16.69%和9.89%~10.50%,两种根系分泌物处理分别为25.18%~40.15%、11.45%~37.24%、7.52%~17.89%和7.49%~20.44%。

图4 不同根系分泌物对污染土壤中细菌群落结构的影响(门水平)
2.5 根系分泌物对污染土壤中细菌群落聚类及分布的影响
如图5所示,CK处理、人工根系分泌物(A)、水稻根系分泌物(B)的前50个属热图的细菌群落在属水平组成上存在一定差异。培养第14 d,CK处理、人工根系分泌物、水稻根系分泌物皆以芽单胞菌属(Gemmatimonas,5.64% ~9.99%)、Gp6(7.14% ~9.31%)、Betaproteobacteria_unclassified(5.18% ~6.69%)、鞘氨醇单胞菌属(Sphingomonas,4.53% ~4.96%)和Gp4(3.60%~4.34%)为优势属。28 d时CK处理的优势属为Gp6(8.10%)、放线菌属(Actinophytocola,6.95%)、鞘氨醇单胞菌属(Sphingomonas,5.62%)、Rhizobiale s_unclassified(5.02%)和Deltaproteobacteria_unclassified(4.03%);Chloroflexi_unclassified(5.72%~10.24%)、Streptomycetaceae_unclassified(5.62% ~7.13%)、Actinomycetales_unclassified(4.06%~7.11%)、红杆菌属(Solirubrobacter,3.49% ~5.49%)和Actinobacteria_unclassified(2.33%~4.78%)是根系分泌物处理群落中的优势菌属。
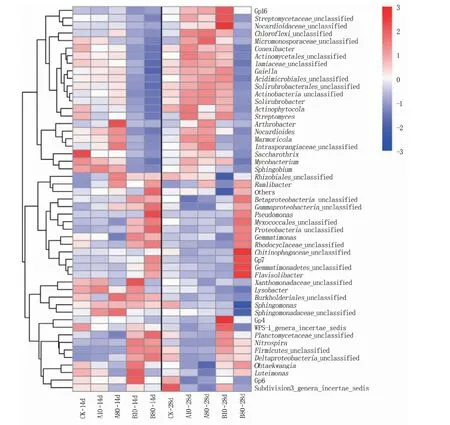
图5 不同根系分泌物处理属水平的相对丰度热图
在前50个细菌属中,14个细菌属已被报道为PAH 降 解 功 能 细 菌[10,18],包 括 芽 单 胞 菌 属(Gemmatimonas,5.64% ~10.24%)、鞘氨醇单胞菌属(Sphingomonas,2.84% ~4.95%)、诺卡氏属(Nocardioides,0.70% ~3.79%)、溶杆菌属(Lysobacter,0.92%~2.29%)、Actinomycetales_unclassified(0.54% ~2.33%)、Sphingomonadaceae_unclassified(0.51% ~1.71%)、节杆菌属(Arthrobacter,0.15% ~1.23%)、分支杆菌属(Mycobacterium,0.14% ~1.29%)、Burkholderiales_unclassified(0.53% ~0.87%)、鞘脂菌属(Sphingobium,0.12% ~1.13%)、假单胞菌属(Pseudomonas,0.07%~3.52%)、链霉菌属(Streptomyces,0.22% ~0.95%)、黄单胞菌属(Luteimonas,0.24%~0.82%)、Rhodocyclaceae_unclassified(0.26%~0.86%),该14属主要隶属于芽单胞菌门(Gemmatimonas)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)。
在第14 d,与CK处理相比,10 mg/kg和80 mg/kg人工根系分泌物处理(A)均显著增加了鞘氨醇单胞菌属(Sphingomonas)、类诺卡氏属(Nocardioides)、Sphingomonadaceae_unclassified和节杆菌属(Arthrobacter)的相对丰度,其最高值均出现在80 mg/kg浓度下,分别占总细菌群落丰度的4.92%、3.79%、1.71%和1.23%。与CK、B10处理相比,80 mg/kg水稻根系分泌物处理(B)显著增加了假单胞菌属(Pseudomonas)和Rhodocyclaceae_unclassified的相对丰度。
在第28 d,与CK处理相比,添加10 mg/kg和80 mg/kg的人工根系分泌物显著增加了类诺卡氏属(Nocardioides)、Actinomycetales_unclassified、节杆菌属(Arthrobacter)、分枝杆菌属(Mycobacterium)和链霉菌属(Streptomyces)的相对丰度,分别显著提高55.66%、69.81%,39.60%、56.38%,1.00、2.91倍,63.29%、29.11%和78.47%、29.11%。类诺卡氏属(Nocardioides)和节杆菌属(Arthrobacter)的相对丰度最高值出现在80 mg/kg处理,分别占细菌群落丰度的3.60%和0.90%。与CK、B10处理相比,80 mg/kg的水稻根系分泌物处理中芽单胞菌属(Gemmatimonas)、假单胞菌属(Pseudomonas)的相对丰度显著增加了8.78%、46.76%,7.11、26.33倍。总体而言,某些功能菌属的相对丰度因根系分泌物的类型和浓度以及培养时间而异,降解菌属相对丰度的增加可能是根系分泌物促进土壤中多环芳烃生物降解的重要原因。
2.6 根系分泌物处理下PAH降解率、降解基因及微生物群落间的相关性分析
2.6.1 根系分泌物处理下PAH降解率与降解基因间的相关性分析 由表2可知,nidA基因的绝对丰度与人工根系分泌物处理土壤中NAP、PHE、PYR的降解率呈极显著正相关(P<0.01),nahAc基因的绝对丰度与水稻根系分泌物处理中NAP、PHE和PYR含量呈极显著正相关。因此,人工根系分泌物中的nidA降解基因和水稻根系分泌物中的nahAc降解基因绝对丰度的增加可能是土壤中两种根系分泌物促进PAH生物降解的主要原因。

表2 根系分泌物处理下PAH降解率与降解基因间的相关性分析
2.6.2 根系分泌物处理下PAH降解率与功能菌间的相关性分析 由表3可知,在人工根系分泌物中,NAP降解率与诺卡氏菌属(Nocardioides)、分枝杆菌属(Mycobacterium)、Rhodocyclaceae_unclassified极显著正相关(P<0.01),与Burkholderiales_unclassified显著正相关(P<0.05)。PHE降解率与诺卡氏菌属(Nocardioides)、分枝杆菌属(Mycobacterium)极显著正相关,与黄单胞菌属(Luteimonas)显著正相关。PYR降解率与诺卡氏菌属(Nocardioides)、分枝杆菌属(Mycobacterium)呈极显著正相关,与芽单胞菌属(Gemmatimonas)、鞘氨醇单胞菌属(Sphingomonas)、溶杆菌属(Lysobacter)、链霉菌属(Streptomyces)及黄单胞菌属(Luteimonas)呈显著正相关。
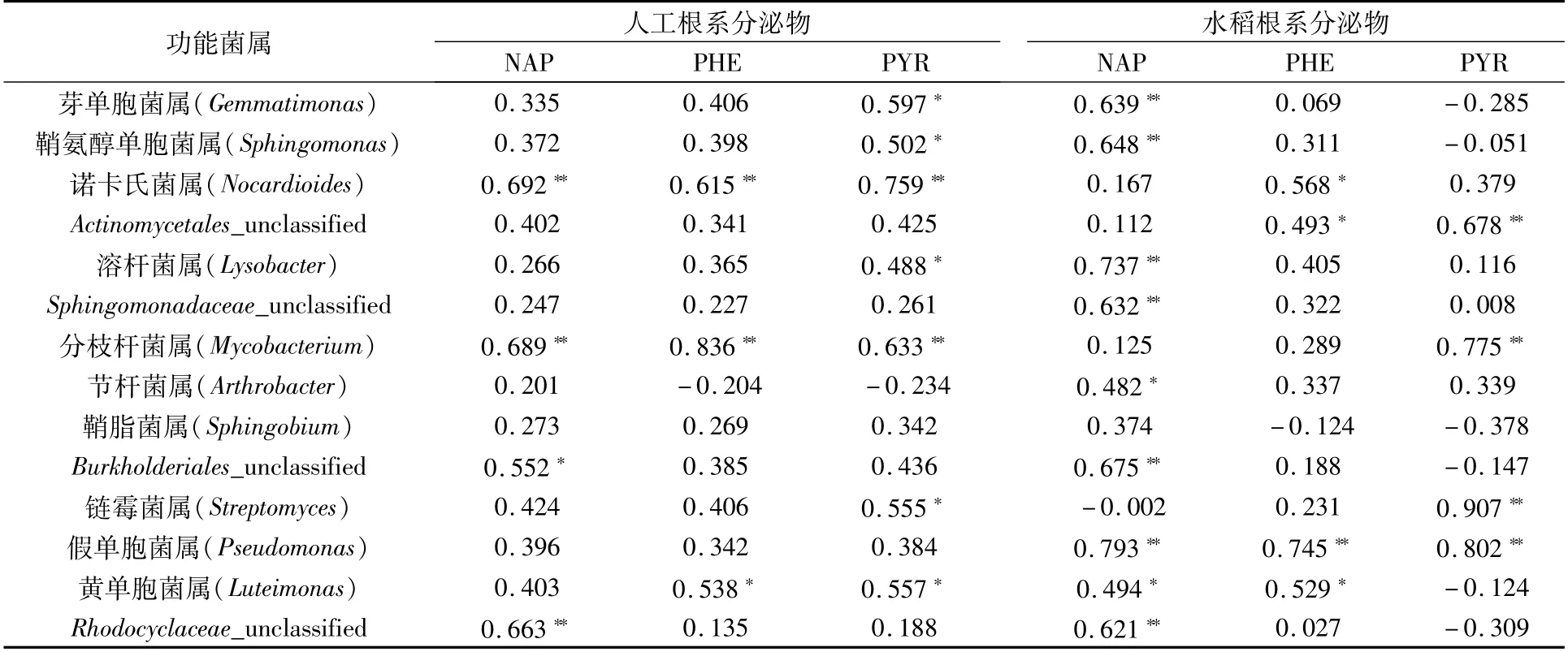
表3 根系分泌物处理下PAH降解率与功能菌间的相关性分析
在水稻根系分泌物中,NAP降解率与芽单胞菌属(Gemmatimonas)、鞘氨醇单胞菌属(Sphingomonas)、溶杆菌属(Lysobacter)、Sphingomonadaceae_unclassified、Burkholderiales_unclassified、假单胞菌属(Pseudomonas)、Rhodocyclaceae_unclassified呈极显著正相关,与节杆菌属(Arthrobacter)、黄单胞菌属(Luteimonas)呈显著正相关。PYR降解率与Actinomycetales_unclassified、分枝杆菌属(Mycobacterium)、链霉菌属(Streptomyces)、假单胞菌属(Pseudomonas)呈极显著正相关。PHE降解率与诺卡氏菌属(Nocardioides)、Actinomycetales_unclassified、黄单胞菌属(Luteimonas)呈显著正相关,与假单胞菌属(Pseudomonas)呈极显著正相关。
2.6.3 根系分泌物处理下降解基因与功能菌间的相关性分析 由表4可知,在人工根系分泌物的处理中,诺卡氏菌属(Nocardioides)和分枝杆菌属(Mycobacterium)与3个降解基因(nidA、nahAc和phe)皆呈极显著正相关(P<0.01)。nidA与Sphingomonadaceae_unclassified和Burkholderiales_unclassified呈极显著正相关,nahAc与Sphingomonadaceae_unclassified呈显著正相关。

表4 不同根系分泌物处理下PAH功能菌丰度与降解基因的相关性分析
在水稻根系分泌物处理中,假单胞菌属(Pseudomonas)与3个降解基因(nidA、nahAc和phe)皆呈极显著正相关(P<0.01)。芽单胞菌属(Gemmatimonas)、Sphingomonadaceae_unclassified、Rhodocyclaceae_unclassified与nahAc和phe皆呈极显著正相关,而与nidA呈极显著负相关。nidA与诺卡氏菌(Nocardioides)、Actinomycetales_unclassified、分枝杆菌属(Mycobacterium)、鞘脂菌属(Sphingobium)及链霉菌属(Streptomyces)呈极显著正相关,与溶杆菌属(Lysobacter)、Sphingomonadaceae_unclassified、Rhodocyclaceae_unclassified以及Burkholderiales_unclassified呈极显著负相关。
3 讨论与结论
本研究表明,在一定浓度范围内,添加人工根系分泌物和水稻根分泌物皆有效促进了土壤中NAP、PHE和PYR的生物降解。Xie等[5]研究表明,随着黑麦草根系分泌物浓度的增加,PYR的降解率先增加后减少,以32.75 mg/kg根系分泌物处理时PYR的降解率最高。本研究中,人工根系分泌物和水稻根系分泌物在降解PAH规律方面趋于一致,且当人工根系分泌物和水稻根系分泌物在40 mg/kg时均具有较大值或峰值,表明添加适量浓度的根系分泌物有利于促进土壤中细菌生长和PAH的降解[19]。这可能是由于根系分泌物中含有有机酸,导致根际土壤pH值的降低和铝的有效释放,介导土壤微生物群落发生变化、微生物活性的升高所致[20]。但人工根系分泌物和水稻根系分泌物的降解率存在差异,这可能由于人工根系分泌物的组成与水稻根系分泌物相比,缺少胞外效应物质和潜在的复杂化学信号传导分子物质[21]。
不同多环芳烃在土壤中具有特定的环境行为。研究表明,PAH的生物降解率随芳香环的增加而降低[22]。因此,与低分子量PAH相比,微生物对高分子量PAH的降解效率较低[23]。在CK处理中,NAP、PHE和PYR的降解率随培养时间的增加整体呈增加趋势,但降解率皆较低。分泌物处理下NAP、PHE和PYR的降解率皆显著提升,且两种根系分泌物对NAP的降解率整体高于PHE和PYR。这可能是由于根系分泌物对NAP功能菌倾向诱导性影响,也可能是微生物和根系分泌物的共代谢过程促进了NAP在土壤中的降解[24]。
PAH的微生物降解及代谢依赖于各种功能基因,这些基因的表达丰度是评估细菌群落在污染土壤中降解多环芳烃潜力的重要表征[25]。nidA、nahAc和phe基因在PAH降解功能菌存在环境中被普遍诱导表达,这有助于催化PAH双加氧酶和单加氧酶基因的转录[8,22]。根据这些酶的底物利用范围,nidA基因来自革兰氏阳性菌,可同时降解低分子量和高分子量PAH。nahAc基因来自革兰氏阴性菌,主要介导降解低分子量PAH[26]。本研究中,与CK处理相比,PAH降解基因(nidA、nahAc、phe)的绝对丰度与两种根系分泌物处理中的PAH降解率具有显著正相关关系,这可能是由于水稻根系分泌物可为土壤微生物提供底物营养(例如C、N)[7,20]。本研究也发现,水稻根系分泌物处理土壤中的nidA基因丰度整体低于CK处理,这可能是由于水稻根系分泌物抑制了携带nidA基因功能菌的生长。此外,在土壤中添加任一浓度的人工根系分泌物或水稻根系分泌物处理中16SrRNA基因的丰度均整体低于CK处理,说明由于添加根系分泌物,土壤细菌群落发生了变化,敏感性细菌的丰度下降,导致16SrRNA基因的总丰度下降[27]。
Alpha多样性数据表明,添加根系分泌物和延长培养时间皆可影响土壤细菌群落的丰富度和多样性,水稻根系分泌物处理影响更加明显。根系分泌物浓度过高会破坏土壤细菌群落的原微生态平衡,同时随着培养时间的延长,敏感性较强的细菌数量减少,而具有耐受性或具有潜在PAH降解能力的细菌因此积累[7,28]。与CK处理相比,根系分泌物处理导致土壤中细菌群落丰富度和多样性下降,但促进了相关PAH降解功能菌的数量。水稻根系分泌物显著增加了假单胞菌属(Pseudomonas)和Rhodocyclaceae_unclassified的相对丰度,人工根系分泌物显著增加了诺卡氏菌属(Nocardioides)、分枝杆菌属(Mycobacterium)、Actinomycetales_unclassified、节杆菌属(Arthrobacter)和链霉菌属(Streptomyces)的相对丰度。
在污染的土壤中,PAH降解率往往与细菌总数量无明显相关性,而是与介导降解过程的特定功能菌数量相关[29]。目前已确定变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和芽单胞菌门(Gematimonadetes)为主的PAH降解菌[30]。本研究中,鉴定到14个降解PAH的功能菌属,人工根系分泌物和水稻根系分泌物可对某些PAH降解功能菌的相对丰度产生积极影响。PAH降解率与降解基因间的相关分析表明nidA基因与人工分泌物处理下的PAH降解率皆呈极显著正相关,nahAc基因与水稻根系分泌物处理下的PAH降解率皆呈极显著正相关。PAH降解率与功能菌间的相关分析表明,诺卡氏菌属(Nocardioides)和分枝杆菌属(Mycobacterium)与人工分泌物处理下的PAH降解率极显著正相关,假单胞菌属(Pseudomonas)与水稻根系分泌物处理下的PAH降解率极显著正相关。降解基因绝对丰度与功能菌相对丰度的相关性分析表明,人工根系分泌物处理下降解基因与诺卡氏菌属(Nocardioides)和分枝杆菌属(Mycobacterium)皆呈极显著正相关,水稻根系分泌物处理下降解基因与假单胞菌属(Pseudomonas)极显著正相关。因此,根系分泌物处理下降解率、降解基因丰度及功能菌丰度之间互相存在着很强的相关性[9,31]。
综上,人工根系分泌物和水稻根系分泌物皆可提高PAH相关降解基因和功能菌丰度从而促进对NAP、PHE和PYR的生物降解。
