贝莱斯芽胞杆菌Bacillus velezensis YL2021嗜铁素合成基因dhbC的功能研究
2022-07-09沈佳慧乔俊卿刘永锋刘邮洲
沈佳慧,左 杨,乔俊卿,刘永锋,刘邮洲*
(1.南京农业大学植物保护学院,南京 210095;2.江苏省农业科学院植物保护研究所,南京 210014)
铁元素,是生命有机体维持生长发育不可缺少的微量元素,铁元素不仅是细胞色素、铁氧化还原蛋白以及各种酶等物质的组成成分[1],并且参与了生命体重要的生长代谢过程,如分子氧的存储及运输、碳的同化、过氧化氢物的分解等[2]。虽然铁元素在自然界中含量极为丰富,占地壳元素含量的5%[3],但土壤中的铁元素基本上都是以氧化铁的形式存在,其溶解性差,大部分不能被生物体利用[4]。为满足自身生命活动需求,生物体需要形成一套高效的铁吸收机制,分泌嗜铁素(Siderophore,别名铁载体)螯合外界铁离子是其中的一种重要机制[4]。
嗜铁素,是生物体在长期进化过程中,应对在低铁环境条件下铁元素的获取,所分泌的一种小分子量的螯合因子,与Fe3+的结合能力非常强(生成常数可达1023~1052),且具有特异性[4]。在缺铁条件下,细菌合成的嗜铁素体种类较多,结构复杂,但最主要的两种为儿茶酚型(catecholate)铁载体和异羟肟酸型(hydroxamate)铁载体及其衍生物。芽胞杆菌Bacillusspp.一般会合成儿茶酚型嗜铁素,该类嗜铁素含有两个-多个二羟基苯甲酸(Dihydroxybenzoate,DHB)单元[5,6]。DHB合成基因簇,主要包含dhbA、dhbB、dhbC、dhbE和dhbF五个基因,其中dhbC编码异分支酸酶isochorismatase,是DHB合成过程中最重要的酶[7]。
贝莱斯芽胞杆菌 YL2021(CGMCC No.24302)是实验室分离获得的一株对多种病原细菌(水稻白叶枯病菌Xanthomonasoryzaepv.oryzae、水稻细菌性条斑病菌Xanthomonasoryzaepv.oryzicola、欧文氏菌Erwiniaspp.等)均有较强抑制作用的生防菌[8]。全基因组的生物信息学分析结果显示:贝莱斯芽胞杆菌YL2021基因组中含有完整的 DHB合成基因簇。据此,本研究采用同源重组技术,构建贝莱斯芽胞杆菌YL2021嗜铁素合成基因dhbC突变体,解析其功能,旨在为贝莱斯芽胞杆菌YL2021在实际生产上的应用及生防机制的研究提供科学依据。
1 材料与方法
1.1 供试菌株和质粒
贝莱斯芽胞杆菌B.velezensisYL2021由江苏省农业科学院植物保护研究所水稻病害研究室分离并保存。供试细菌-水稻白叶枯病菌X.oryzaepv.oryzae和巨大芽胞杆菌B.megaterium均由本实验室保存并提供。
质粒pAD43-25(含氯霉素Chloramphenicol抗性片段)由南京农业大学惠赠,pMD19 (Simple)-T载体和大肠杆菌DH5α购自TAKARA公司。
1.2 主要试剂、培养基和培养条件
DNA Marker、限制性内切酶、TaqDNA聚合酶、T4 DNA连接酶、细菌基因组DNA提取试剂盒、质粒提取试剂盒购自宝生物工程(大连)有限公司;PCR产物回收试剂盒购自Axygen公司;其他试剂均为国产分析纯。
LB培养基:胰蛋白胨10.0 g、酵母粉5.0 g、NaCl 10.0 g、蒸馏水1000 mL;
M9培养基(铁限制培养基):KH2PO43.0 g、Na2HPO46.0 g、NaCl 0.5 g、NH4Cl 1.0 g、MgSO4·7H2O 0.5 g、CaCl20.1 g、葡萄糖2.0 g、蒸馏水1000 mL,用NaOH调节pH 7.0;
GCHE培养基:磷酸钾缓冲液(K2HPO4:KH2PO4=14.0 g:5.3 g)、谷氨酸2.0 g、柠檬酸三钠(带水合)0.9 g、MgSO4·7H2O 0.7 g、柠檬酸铁铵22.0 mg、色氨酸50.0 mg、葡萄糖10.0 g、干酪素水解产物1.0 g、蒸馏水1000 mL;
GE培养基:磷酸钾缓冲液(K2HPO4:KH2PO4=14.0 g:5.3 g)、谷氨酸2.0 g、MgSO4·7H2O 0.7 g、柠檬酸铁铵22.0 mg、色氨酸50.0 mg、葡萄糖10.0 g、蒸馏水1000 mL;
嗜铁素检测培养基(即CAS检测培养基):CAS 60.5 mg、FeCl3·6H2O 0.3 g、HDTMA 72.9 mg、琼脂20.0 g、蒸馏水1000 mL;
泳动能力检测培养基:胰蛋白胨10.0 g,NaCl 5.0 g,琼脂糖 3.0 g,蒸馏水1000 mL;
群集运动能力检测培养基:胰蛋白胨10.0 g,NaCl 5.0 g,琼脂糖7.0 g,蒸馏水1000 mL;
MSgg 培养基:Potassium phosphate(pH 7.0)1.3 g、Mops(pH 7.0)20.9 g、MgCl20.4 g、CaCl20.1 g、MnCl210.0 mg、FeCl313.0 mg、ZnCl20.2 mg、thiamine 0.7 mg、甘油5 mL、谷氨酸钠0.6 g、tryptophan 50.0 mg、phenylalanine 50.0 mg、蒸馏水补足至1000 mL。
抗生素用量:氨苄青霉素(Amp)100 μg/mL,氯霉素(Cm)10 μg/mL。
大肠杆菌Escherichiacoli培养温度为37 ℃,贝莱斯芽胞杆菌B.velezensis、水稻白叶枯病菌X.oryzaepv.oryzae和巨大芽胞杆菌B.megaterium培养温度均为28 ℃。
1.3 引物设计、合成和dhbC基因的克隆
以贝莱斯芽胞杆菌YL2021中dhbC基因为试验对象,构建dhbC基因突变体。根据NCBI数据库中芽胞杆菌dhbC的同源序列(GenBank登录号:CP009611.1、CP050424.1、CP034037.1、CP030097.1),首先PCR扩增dhbC全序列,连接载体pMD19-T。提取质粒后,在目的基因dhbC序列上设计双酶切位点,切开质粒,再连上相同酶切位点的抗性基因(自带启动子),然后进行同源重组,获得突变株。用BioXM v2.6软件设计引物dhbC-F1和dhbC-R1(表1),由上海生工生物工程有限公司合成。
挑取贝莱斯芽胞杆菌YL2021单菌落接种到5 mL LB液体培养基中,28 ℃、150 r/min过夜培养,采用试剂盒提取细菌基因组DNA。目的基因dhbC的PCR反应体系为:10×TransTaq-T Buffer(Mg2+)2.5 μL,dNTP 2 μL,引物dhbC-F1 和dhbC-R1 各 0.5 μL,TransTaq-T DNA polymerase 0.3 μL,模板 DNA 0.3 μL,ddH2O补足至25 μL。目的基因dhbC的梯度PCR程序:95 ℃预变性5 min;94 ℃变性30 s,55 ℃~70 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃延伸10 min;16 ℃保温。使用PCR回收试剂盒对PCR产物进行割胶回收。
1.4 突变株ΔdhbC的构建
目的基因dhbC扩增片段与pMD19-T载体连接,遗传转化大肠杆菌DH5α后进行蓝白斑筛选,在相应的Amp 100+X-gal 50 μg/mL的LB平板上挑选白色单菌落。利用引物dhbC-F1/dhbC-R2进行菌落PCR验证。提取质粒,在目的基因dhbC序列上设计酶切位点EcoRV(GATATC,260 bp处)和BglII(AGATCT,502 bp处),进行双酶切,质粒抽提、双酶切根据参考文献[9]进行。酶切产物割胶回收后,用PCR产物回收试剂盒(Axygen公司)进行纯化。
根据上述EcoRV和BglII酶切位点,设计引物(表1)扩增质粒pAD43-25中Cm抗性片段(自带启动子),割胶回收并纯化后,与pMD19-dhbC进行连接。重组质粒遗传转化大肠杆菌DH5α,在相应的Amp 100 μg/mL+Cm 10 μg/mL的LB平板上挑选单菌落,利用引物dhbC-F1/dhbC-R1进行菌落PCR,验证正确后提取质粒。
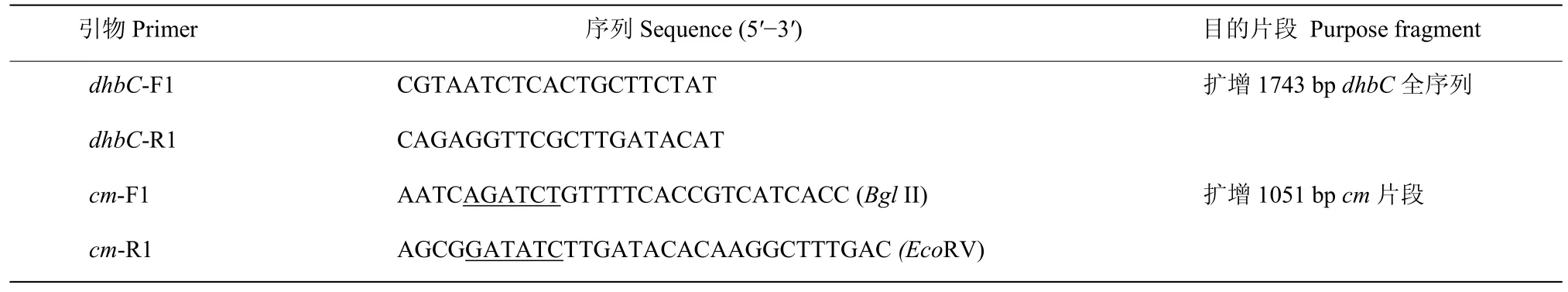
表1 试验所用的引物Table 1 Primers used in this study
同源重组试验根据参考文献[10]进行,贝莱斯芽胞杆菌YL2021平板划线,挑取单菌落至GCHE培养液,37 ℃、200 r/mim振荡培养过夜。取1 mL菌液加入24 mL GCHE培养基中,37 ℃、200 r/mim振荡培养2~3 h,制备感受态细胞。加入2 μg质粒后,37 ℃、75 r/mim振荡培养30 min,随后37 ℃、200 r/mim振荡培养1.5 h,8000 r/mim离心,加入150 μL GE培养基重悬。因为重组质粒不能自主复制,所以重组质粒携带的dhbC基因片段会与受体菌—贝莱斯芽胞杆菌YL2021的染色体dhbC基因发生同源重组。将上述培养液涂布在含有Cm 10 μg/mL的LB平板上37 ℃培养,挑取转化子于5 mL LB液体培养基中、28 ℃、150 r/mim振荡培养过夜;-70 ℃甘油保存。
转化子的检测:采用试剂盒提取转化子基因组 DNA作为模板,根据目的基因dhbC的引物dhbC-F1/dhbC-R1和Cm抗性片段引物cm-F1/cm-R1分别进行PCR扩增,用1%琼脂糖凝胶电泳检测扩增片段的大小,PCR产物送上海生工生物工程有限公司完成测序。测序正确的转化子即为贝莱斯芽胞杆菌YL2021的dhbC基因突变株,命名为ΔdhbC。
1.5 dhbC基因的功能研究
挑取野生型菌株YL2021和突变株ΔdhbC单菌落接种到20 mL LB液体培养基中,28 ℃、150 r/mim振荡培养至OD600为1.0,备用。
1.5.1 嗜铁素的产生与检测 在嗜铁素检测平板(即CAS检测平板)中心分别点接野生型菌株YL2021和突变株ΔdhbC的菌液5 μL,28 ℃培养2~7 d,观察嗜铁素检测平板有无黄色晕圈产生。每处理重复3次。
Arnow反应根据参考文献[11]进行:分别吸取1 mL野生型菌株YL2021和突变株ΔdhbC菌液,以1:100的比例接种到LB和M9液体培养基中,28 ℃、150 r/mim振荡培养3 d。取2 mL菌液10000 r/mim离心3 min,吸取1 mL上清液,依次加入1 mL 0.5 mol/L HCl,1 mL钼酸盐溶液,溶液变黄,再加入1 mL 1 mol/L的NaOH,颜色由黄变红,并保持15 min不变色,说明有儿茶酚型铁载体的产生。
HPLC检测:嗜铁素的提取见参考文献[12,13]。分别吸取1 mL野生型菌株YL2021和突变株ΔdhbC菌液,以1:100的比例接种到M9液体培养基中,28 ℃、150 r/mim振荡培养3 d。菌液10000 r/mim离心20 min,用6 mol/L HCl调节pH值到2.0,乙酸乙酯萃取过夜后,弃水相保留有机相,0.1个真空度旋转蒸发后用1 mL无水甲醇溶解,0.22 μm 有机滤膜过滤后,进行HPLC(仪器型号Shimadzu LC-6AD,Japan)检测。色谱条件如下:色谱柱:RP-Amide C18(4.6×250 mm,5 μmol/L,Agilent);流动相:水+0.1%甲酸(A),乙腈+0.1%甲酸(B),0 min,95% A;2 min,95% A;2~25 min 50% A;25~33 min,5% A;33~37 min,95% A。流速:0.8 mL/min,检测波长:225 nm;柱温:25 ℃;进样量 20 μL。
1.5.2 菌体生长的影响 操作方法根据参考文献[14]进行。分别吸取 1 mL野生型菌株 YL2021和突变株ΔdhbC菌液,按照1:100的比例分别接种到100 mL LB和M9液体培养基中,28 ℃、150 r/mim振荡培养,每隔6 h取样,测定OD600,3次重复,取平均值。
1.5.3 泳动能力和群集运动能力的影响 操作方法根据参考文献[15]进行,分别吸取 1 μL野生型菌株YL2021和突变株ΔdhbC菌液,点接在泳动能力和群集运动能力检测培养基上,37 ℃培养24 h。细菌会依赖鞭毛运动在培养基的表面以接种点为圆心向周围生长,形成大小不一的圆环。
1.5.4 细胞膜形成的影响 细胞膜形成试验根据参考文献[9]进行。在24孔板中加入MSgg培养基1 mL,分别加入10 μL野生型菌株YL2021和突变株ΔdhbC菌液,28 ℃静置培养2 d,6次重复。挑取孔表面被膜,晾干,称重。
1.5.5 室内抑菌作用的影响 水稻白叶枯病菌和巨大芽胞杆菌用LB培养液28 ℃、150 r/mim振荡培养48 h,用无菌水稀释至2.0×108cfu/mL,备用。
吸取野生型菌株YL2021和突变株ΔdhbC的菌液5 μL,点接在LB或M9平板中央,吹干。供试细菌稀释液均匀喷雾平板1秒,28 ℃培养过夜,调查抑菌圈直径。每处理重复3次,取平均值。清水对照。
吸取野生型菌株YL2021和突变株ΔdhbC的嗜铁素提取液(见1.5.1)20 μL,点接在M9平板中央,吹干。供试细菌稀释液均匀喷雾平板1 s,28 ℃培养过夜,调查抑菌圈直径。每处理重复3次,取平均值。甲醇溶剂对照。
2 结果与分析
2.1 dhbC基因和cm基因序列的扩增
以野生型菌株YL2021的DNA为模板、引物dhbC-F1/dhbC-R1进行PCR扩增,获得1743 bp的条带(图1a),以质粒pAD43-25为模板、引物cm-F1/cm-R1进行PCR扩增,获得1051 bp的条带(图1b),回收PCR产物进行测序,序列比对与原始序列的同源性为100%。

图1 dhbC序列(a)和cm序列(b)的PCR扩增Fig.1 PCR amplification of dhbC (a) and cm (b) sequences from strain YL2021
2.2 重组质粒的构建和转化
目的基因dhbC进行TA克隆,蓝白斑筛选后挑选的5个转化子经菌落PCR验证均为阳性克隆。抽提质粒,用BglII和EcoRV进行双酶切,获得pMD19-dhbC片段条带和一条 250 bp左右的条带(图 2)。利用相同的酶切位点,将dhbC片段与cm序列连接,构建重组质粒。转化结果表明,挑选的5个转化子均为阳性克隆,引物dhbC-F1/dhbC-R1扩增片段大小为2600 bp左右(图3a),引物cm-F1/cm-R1扩增片段大小为1000 bp左右(图3b),转化试验成功。
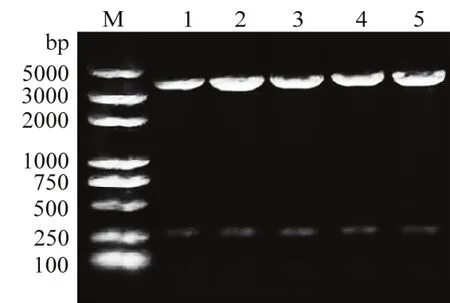
图2 dhbC双酶切图谱Fig.2 Restriction map of plasmid pMD19-dhbC
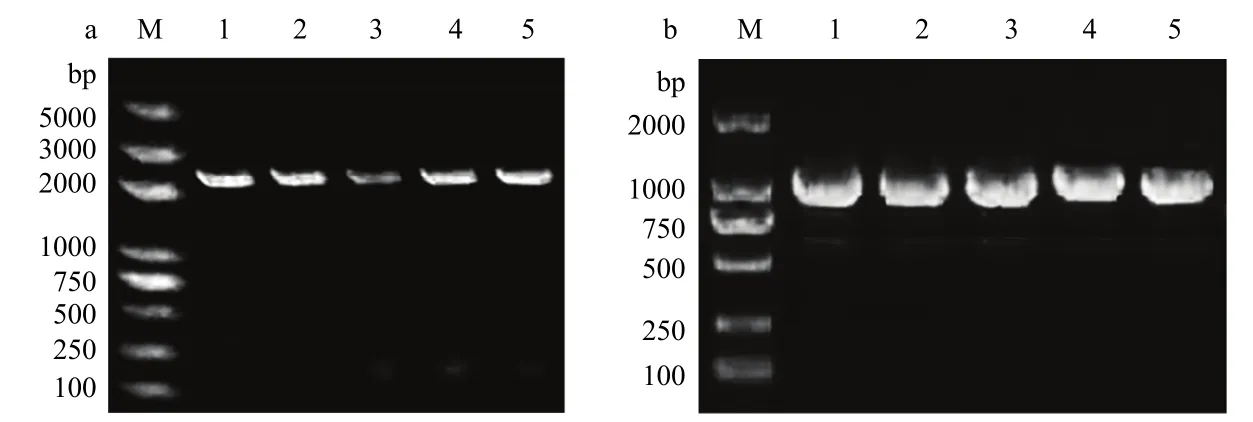
图3 重组质粒转化大肠杆菌DH5α后菌落PCR结果Fig.3 PCR results of colony after transforming E.coli DH5α with recombinant plasmid
2.3 突变株ΔdhbC的获得和验证
重组质粒转化野生型菌株 YL2021,同源重组后以获得的转化子基因组为模板,用引物dhbCF1/dhbC-R1进行PCR扩增,挑选的5个转化子比野生型菌株YL2021多800 bp左右的片段(图4),测序比对进行验证,结果表明突变株ΔdhbC构建成功。
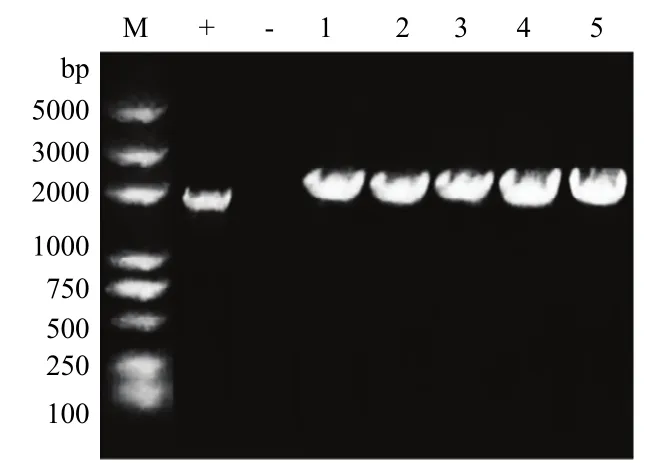
图4 同源重组后菌落PCRFig.4 Colony PCR after homologous recombinant
2.4 突变株产生的嗜铁素检测
野生型菌株YL2021在CAS检测平板上可以形成明显的黄色晕圈(图5a),LB培养条件下Arnow反应不变色,M9培养条件下Arnow反应呈红色(图5b),表明菌株YL2021在缺铁条件下产生的嗜铁素是儿茶酚型嗜铁素;而突变株无上述反应,表明其在LB培养基和M9培养基中均不能产生嗜铁素。HPLC检测结果表明(图5c):在波长210~350 nm条件下,菌株YL2021嗜铁素提取液有3个出峰,收集这3个峰的样本,Arnow反应均呈红色,表明菌株YL2021在缺铁条件下能产生3个不同的儿茶酚型嗜铁素;突变株ΔdhbC的提取液没有出峰。
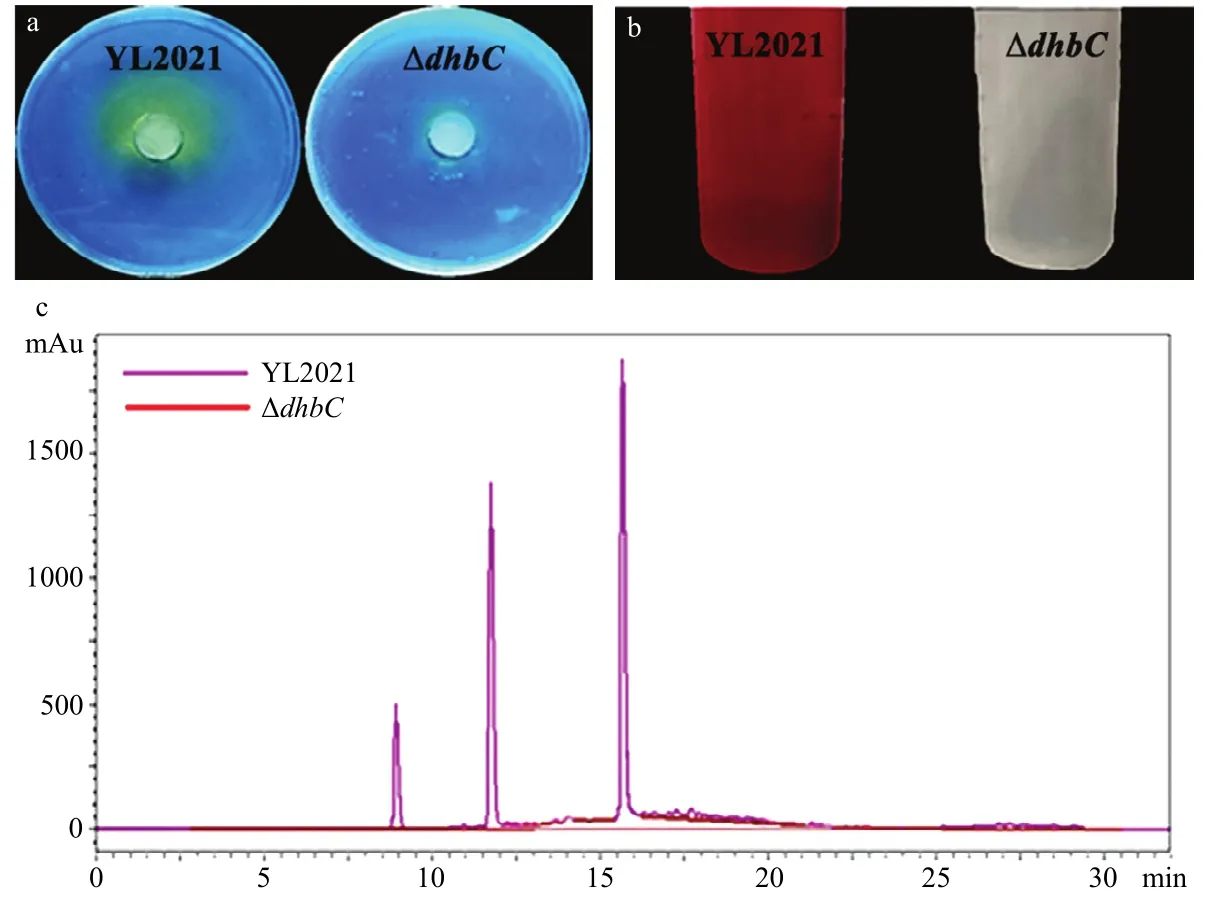
图5 野生型菌株YL2021和突变株ΔdhbC产生的嗜铁素检测Fig.5 Measurement of siderophore produced by wild type strain YL2021 and the mutant ΔdhbC in low-iron medium
2.5 突变株的生长曲线
野生型菌株YL2021和突变株ΔdhbC在LB培养基中生长基本一致,0~18 h菌株生长较快,5 h后野生型菌株YL2021和突变株ΔdhbC菌液的OD600值均达到1.0左右,24 h菌株生长趋于稳定,OD600值达到2.4~2.5,试验结果表明:在LB培养基中,嗜铁素合成基因dhbC的突变对菌株生长几乎没有影响(图6a)。
缺铁条件下(M9培养基中),野生型菌株YL2021在0~36 h 缓慢生长,24 h野生型菌株YL2021发酵菌液的OD600值达到0.9左右,36 h后生长趋于稳定,OD600值达到0.3。突变株ΔdhbC在M9培养基中生长微弱,36 h突变株ΔdhbC发酵菌液的OD600值仅为0.1。试验结果表明:在M9培养基中,嗜铁素合成基因dhbC的突变降低突变株的生长能力(图6b)。

图6 野生型菌株YL2021和突变株ΔdhbC在不同培养基中的生长曲线Fig.6 Cell growth of wild type strain YL2021 and the mutant ΔdhbC in LB and M9 medium
2.6 突变株的泳动能力和群集运动能力
泳动能力的检测结果表明:37 ℃培养24 h,野生型菌株YL2021几乎铺满平板,而突变株ΔdhbC只能形成非常有限的菌落(图 7a),突变株的泳动能力明显下降。群集运动能力的检测结果表明:37 ℃培养24 h,野生型菌株YL2021和突变株ΔdhbC都能形成圆环,两者圆环的大小几乎无差别(图7b)。

图7 野生型菌株YL2021和突变株ΔdhbC运动能力检测Fig.7 Cell motility assays of wild type strain YL2021 and the mutant ΔdhbC
2.7 突变株的生物膜形成能力
野生型菌株YL2021和突变株ΔdhbC在MSgg培养基中形成生物膜的能力完全不一致。培养24 h后,野生型菌株YL2021在孔表面形成完整的生物膜,而突变株ΔdhbC不能形成,培养液表面透明清澈(图8a)。培养48 h后,野生型菌株YL2021形成的生物膜紧密结实,突变株ΔdhbC才刚刚形成生物膜,且非常稀薄不紧密(图8b)。培养2 d 后,野生型菌株YL2021和突变株ΔdhbC的生物膜重量差异显著,分别为(7.1±0.2)和(2.3±0.3)mg/孔。

图8 野生型菌株YL2021和突变株ΔdhbC生物膜形成能力检测Fig.8 Measurement of biofilm formation of wild type strain YL2021 and the mutant ΔdhbC
2.8 突变株的抑菌能力
LB平板培养时,野生型菌株YL2021和突变株ΔdhbC对革兰氏阴性菌-水稻白叶枯病菌和革兰氏阳性菌-巨大芽胞杆菌均具有较好的室内抑制作用,形成明显的抑菌圈。野生型菌株YL2021和突变株ΔdhbC对水稻白叶枯病菌的抑菌圈直径为29.1~33.2 mm,对巨大芽胞杆菌的抑菌圈直径为24.4~26.8 mm(图9a)。
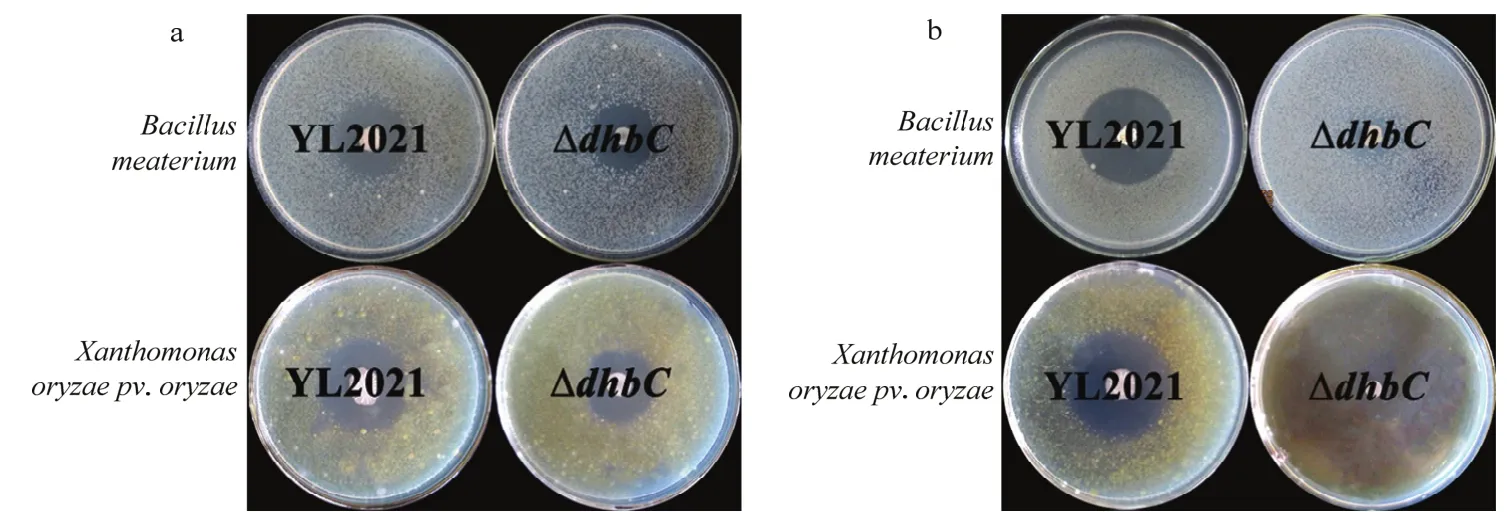
图9 野生型菌株YL2021和突变株ΔdhbC的室内抑菌能力检测Fig.9 Antibacterial activity of wild type strain YL2021 and the mutant ΔdhbC in LB or M9 medium
M9平板培养时,野生型菌株YL2021对革兰氏阴性菌-水稻白叶枯病菌和革兰氏阳性菌-巨大芽胞杆菌具有较好的室内抑制作用,抑菌圈直径分别为(40.5±0.6)和(38.6±0.3)mm。嗜铁素合成基因dhbC突变后,突变株ΔdhbC几乎丧失了室内抑菌能力,不能形成抑菌圈(图9b)。
野生型菌株YL2021嗜铁素粗提液对巨大芽胞杆菌和水稻白叶枯病菌均具有一定的抑制作用,抑菌圈直径分别为(15.7±0.2)和(18.3±0.3)mm。突变株ΔdhbC嗜铁素粗提液无抑菌作用(图10)。

图10 野生型菌株YL2021和突变株ΔdhbC嗜铁素提取液的室内抑菌能力检测Fig.10 Antibacterial activity of siderophore produced by wild type strain YL2021 and the mutant ΔdhbC in M9 medium
3 讨论
关于嗜铁素的生防作用,目前普遍认为在缺铁环境中,生防菌产生的嗜铁素可以螯合周围铁离子,所形成的复合物不能被其他微生物尤其病原菌利用,使病原菌得不到足够的铁营养,生长发育受到抑制[16]。如:许煜泉等[17]发现假单胞菌Pseudomonasspp.JKD-2在无铁环境下能分泌高亲和力的铁载体,抑制稻瘟病菌Magnaportheoryzae的生长,而在富铁环境下则不能分泌;Chen等[18]研究结果表明,台湾假单胞菌P.taiwanensis在缺铁条件下可以产生荧光性嗜铁素(Pyoverdine,PVD),对水稻白叶枯病菌X.oryzaepv.oryzae的生长有抑制作用;余贤美等[19]研究结果表明,枯草芽胞杆菌Bs-15在缺铁条件下可有效提高对于甜椒枯萎病菌的防效,高达44.44%,而在铁离子存在情况下,防效仅为12.50%。Dimopoulou等[20]报道在缺铁条件下,解淀粉芽胞杆菌B.amyloliquefaciensMBI600分泌的儿茶酚型嗜铁素bacillibactin对丁香假单胞菌P.syringae具有较强的抑制作用。除此之外,越来越多的医学研究人员对微生物的铁吸收系统非常有兴趣,由此引发药物的“特洛伊木马策略”,即利用铁载体摄取机制,将药物和铁载体偶联,使药物更容易进入靶向病原微生物,同时还不会产生抗药性[21,22]。因此,开发利用高产嗜铁素的生防菌、开展嗜铁素功能研究具有重要意义。
众所周知,微生物产生的次级代谢产物及其抗菌活性可能因生长培养基的不同而不同。有报道抗生素溶杆菌L02和L08在R2A培养基上具有较强的抗真菌活性,但在PDA培养基上几乎丧失抑菌活性[23]。绿针假单胞菌YL-1在铁充足的LB培养基中分泌的主要抑菌物质是吩嗪,野生型菌株和嗜铁素突变株均对多种病原细菌有较强的抑制作用,抑菌活性几乎没有差异;但是在缺铁条件下,绿针假单胞菌YL-1产生的主要抑菌物质是荧光性嗜铁素(Pyoverdine,PVD),嗜铁素突变株不能产生PVD,几乎丧失抑菌活性[24,25]。本文试验结果表明:在营养丰富的LB培养基上,野生型菌株YL2021和突变株ΔdhbC均不产生嗜铁素,对革兰氏阳性菌-巨大芽胞杆菌和革兰氏阴性菌-水稻白叶枯病菌的抑制作用无明显差异;但在缺铁的 M9培养基中,产嗜铁素的野生型菌株 YL2021仍具有较好的室内抑菌作用;而不产嗜铁素的突变株ΔdhbC完全丧失抑菌作用。推测在缺铁条件下,嗜铁素是芽胞杆菌发挥其抑菌作用所必需的。随后的嗜铁素粗提液室内抑菌试验也再次证明了上述推测。
此外,Rowland等[26]报道了枯草芽胞杆菌B.subtills中异分支酸酶的两个相同合成基因menF和dhbC的生物功能,突变株ΔmenF依旧可以正常产生Menaquinone(MK,呼吸链成分之一)和DHB,反之,突变株ΔdhbC则丧失了合成DHB的功能,保留了MK的合成能力,dhbC对于嗜铁素合成起着决定性的调控作用。本文中野生型菌株YL2021和突变株ΔdhbC在营养条件下均不能产生嗜铁素,生长和抑菌作用几乎无差异;但是在缺铁条件下,嗜铁素合成基因突变株ΔdhbC不能产生嗜铁素,生长能力下降明显,且丧失抑菌作用。研究结果表明:缺铁条件下,嗜铁素除了是贝莱斯芽胞杆菌YL2021发挥抑菌作用的主要物质之外,也是一个重要的生长因子。
细菌生物被膜是粘附于物体表面的由细菌细胞及其胞外物质组成的复杂膜样物聚集体,具有很强的耐药性和免疫逃逸能力[27]。影响生物被膜的因素包括很多方面:比如鞭毛、菌毛等细菌附属物引起的细菌泳动、蹭行和群集运动等行为[27-29];群体感应(Quorum sensing,QS)[30-32]、环二核苷酸信号系统(c-di-GMP)[33-35]和多糖调控系统等对细菌生物被膜形成和结构稳定均有影响[36-38]。此外,铁也是微生物形成生物膜的重要条件,嗜铁素可以高效结合铁离子,因此嗜铁素的产生有利于微生物生物膜的形成。Hasmik等[39]研究发现:蜡样芽胞杆菌B.cereus在缺铁条件下可以产生bacillibactin和petrobactin两种不同的嗜铁素,可以形成生物膜,补充外源铁后菌株的生物膜形成能力增强。Masum等[40]报道:病原菌Acidovoraxoryzae在无拮抗菌的情况下可以形成生物膜,两株解淀粉芽胞杆菌K5-3和PPB6分泌的嗜铁素可以显著抑制病原菌生物膜的形成,分别减少 65%和 61%。此外,Li等[41]发现细菌CupriavidusnecatorJMP134分泌嗜铁素 cupriabactin,其嗜铁素合成基因突变株 ΔcubA的泳动能力显著下降,突变株 ΔcubE则完全丧失泳动能力,添加外源铁后,突变株ΔcubA和ΔcubE均可表现出较强的泳动能力。本文的研究结果与前人报道基本一致,贝莱斯芽胞杆菌YL2021嗜铁素合成基因dhbC突变后,突变株的泳动能力和生物膜形成能力明显下降,但突变株的群集运动能力基本不变。有报道在丁香假单胞菌P.syringae中,c-di-GMP调控细胞运动、生物膜形成、嗜铁素产生和氧化应激反应等[42]。Kang等[43]报道在致病细菌-铜绿假单胞菌中生物膜的形成是嗜铁素产生及其发挥毒性因子所必须的。但在贝莱斯芽胞杆菌YL2021中细胞运动能力、嗜铁素、生物膜之间的关联性及调控机制还有待深入研究。
