深低温冷冻对大鼠髌腱肌腱干细胞干性及多向分化能力的影响
2022-07-06代广春李荥娟刘俊延芮云峰
代广春,李荥娟,刘俊延,芮云峰
(1.东南大学附属中大医院 骨科,江苏 南京 210009; 2.东南大学 医学院,江苏 南京 210009;3.东南大学附属中大医院 创伤中心,江苏 南京 210009; 4.东南大学 骨科研究所,江苏 南京 210009; 5.东南大学附属中大医院 老年科,江苏 南京 210009)
1 材料和方法
1.1 材料
1.2 大鼠TDSCs的分离和培养
1.3 干细胞标志物检测
1.4 成骨分化能力检测
1.5 成脂分化能力检测
1.6 成软骨分化能力检测
1.7 肌腱标志物检测
将不同组TDSCs以5×103cm-2的密度接种,待细胞融合度达80%~90%时收获细胞,提取细胞mRNA,qRT- PCR检测肌腱标志物Col1、SCX和TNMD,同时用细胞免疫荧光检测Col1和TNMD蛋白表达变化。
1.8 qR PCR
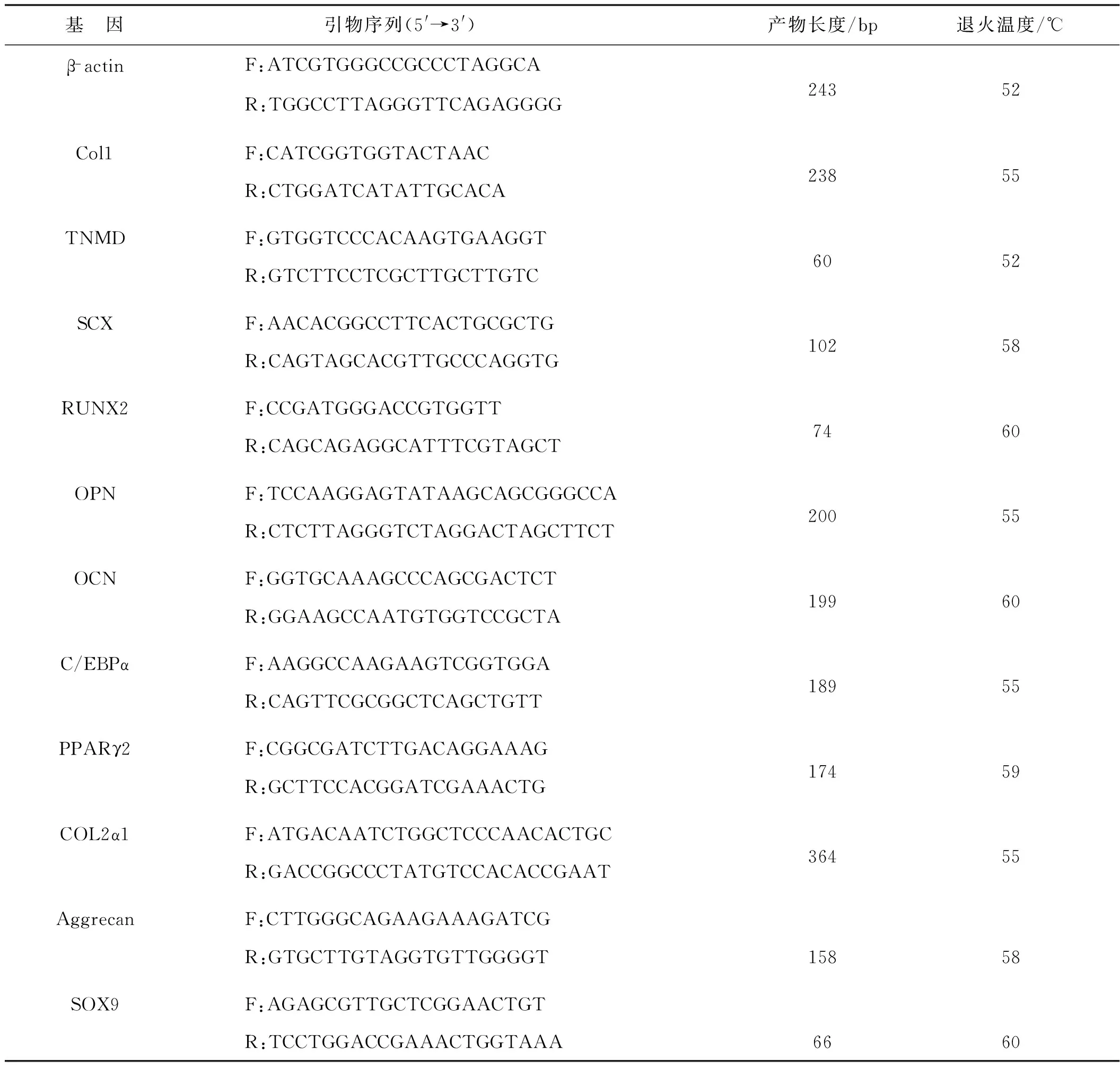
表1 目的基因引物序列、产物长度和退火温度Tab 1 Primer sequences, product size and annealing temperature of target genes
1.9 统计学处理
采用SPSS 22.0统计软件进行分析。数据以均数±标准差表示,多组间比较使用单因素方差分析,两组间比较使用独立样本t检验。P<0.05为差异具有统计学意义。
2 结 果
2.1 细胞形态学
P0代时,两组均可见大的多边形和星形细胞形态。P3代时,两组均可见均一的成纤维样细胞形态。见图1。
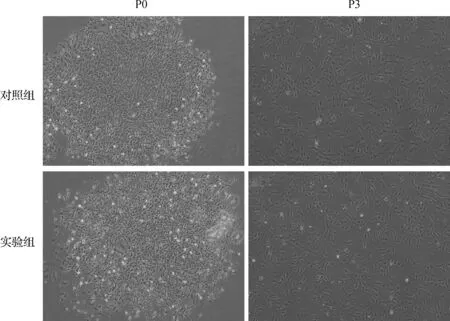
图1 细胞形态学观察(×40)Fig 1 Cell morphology observation(×40)
2.2 干细胞标志物表达
两组TDSCs均有干细胞标志物蛋白,包括Nanog、Oct4和Sox2的表达,主要位于胞核中。同时,这些标志物表达强度的半定量分析表明,两组TDSCs的蛋白表达量之间差异无统计学意义(P>0.05)。见图2。
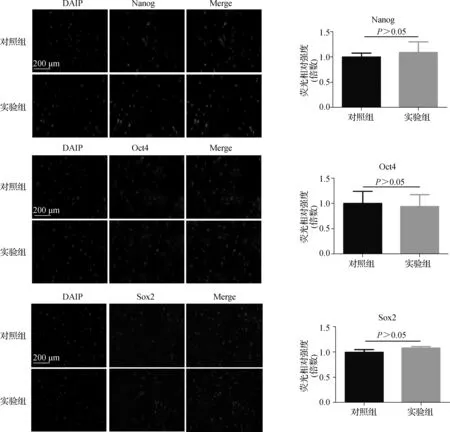
图2 干细胞标志物表达水平Fig 2 Expression levels of stemnes related markers
2.3 成骨分化能力
茜素红染色显示普通培养基培养下两组TDSCs的细胞外基质中均未见矿化物质(图3A、B),成骨诱导培养基培养下两组TDSC的细胞外基质中均可见大量矿化物质出现(图3C、D)。与普通培养基相比,诱导培养基培养下TDSCs的细胞外基质的矿化物质明显更多。半定量结果显示4组吸光度值(OD)之间存在明显差异(F=83.926,P<0.001);两两比较显示诱导培养基培养下两组TDSCs的OD均高于普通组(P<0.05),但是两组TDSCs的OD在诱导培养基和普通培养基之间均无差异(P>0.05)(图3E)。

A~D.茜素红染色结果;E.半定量检测OD;F.成骨分化标志物mRNA表达值图3 成骨分化能力比较(×40)Fig 3 Comparison of osteogenic differentiation ability(×40)
4组TDSC中Runx2(F=8.978,P=0.006)、OPN(F=183.387,P<0.001)和OCN(F=55.855,P<0.001)的mRNA表达值之间均存在明显差异;两两比较显示诱导培养基培养下两组TDSC中Runx2、OPN和OCN的mRNA表达显著高于普通培养基(P<0.05),但是两组TDSCs中Runx2、OPN和OCN的mRNA表达在诱导培养基和普通培养基之间均无差异(P>0.05)(图3F)。
2.4 成脂分化能力
油红O染色显示普通培养基培养下两组TDSCs的细胞外基质中均未见油红O阳性脂滴(图4A、B),成脂诱导培养基培养下两组TDSCs的细胞外基质中均可见大量油红O阳性脂滴(图4C- F)。与普通培养基相比,诱导培养基培养下TDSCs的细胞外基质的油红O阳性脂滴明显更多。半定量结果4组OD之间差异有统计学意义(F=49.199,P<0.001);两两比较显示诱导培养基培养下两组TDSCs的OD值均高于普通组(P<0.05),但是两组TDSCs的OD值在诱导培养基和普通培养基之间均无差异(P>0.05)(图4G)。
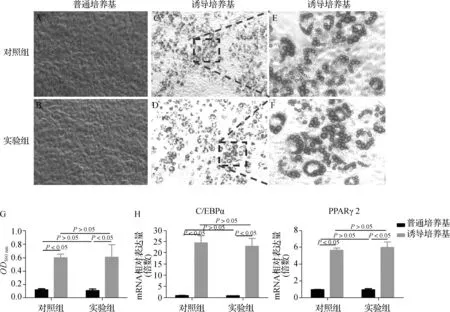
A~F.油红O染色结果;G.半定量检测OD;H.成脂分化标志物mRNA表达值图4 成脂分化能力比较(×40)Fig 4 Comparison of adipogenic differentiation ability(×40)
4组TDSC中C/EBPα(F=31.106,P<0.001)和PPARγ2(F=61.929,P<0.001)的mRNA表达值之间差异均有统计学意义;两两比较显示诱导培养基培养下两组TDSC中C/EBPα和PPARγ2的mRNA表达显著高于普通培养基(P<0.05),但是两组TDSCs中C/EBPα和PPARγ2的mRNA表达在诱导培养基和普通培养基之间均无差异(P>0.05)(图4H)。
2.5 软骨分化潜力
两组TDSCs的阿利新蓝染色显示,均可观察到软骨样细胞的存在和酸性黏多糖(蓝色)的形成(图5A、B)。
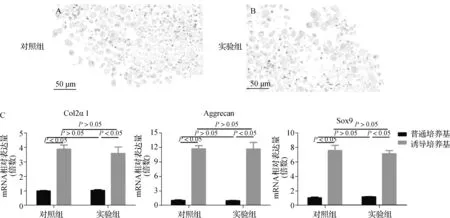
A、B.阿利新蓝染色结果;C.成软骨分化标志物mRNA表达值图5 成软骨分化能力比较Fig 5 Comparison of chondrogenic differentiation ability
4组TDSCs中Col2α1(F=36.318,P<0.001)、Aggrecan(F=67.608,P<0.001)和Sox9(F=74.030,P<0.001)的mRNA表达值之间差异均有统计学意义;两两比较显示诱导培养基培养下两组TDSC中Col2α1、Aggrecan和Sox9的mRNA表达显著高于普通培养基(P<0.05),但是两组TDSCs中Col2α1、Aggrecan和Sox9的mRNA表达在诱导培养基和普通培养基之间均无差异(P>0.05)(图5C)。
2.6 肌腱相关标志物表达

A.qR PCR检测肌腱相关标志物mRNA表达;B~E.细胞免疫荧光检测标志物蛋白表达图6 肌腱相关标志物的表达水平Fig 6 Expression levels of tendo related markers
3 讨 论
近年来,TDSCs已先后在小鼠、人[11]、大鼠[12]和兔子[15]等肌腱组织中被分离和鉴定出,这些干细胞被证实对肌腱损伤的修复、愈合和再生具有非常重要的作用。本研究探讨深低温冷冻处理对TDSCs的干性和多向分化能力的影响,结果显示深低温冷冻处理的肌腱组织中可成功分离出有活性的TDSCs,且TDSCs的干性和多向分化能力在冷冻前后未受影响。
成年哺乳动物干细胞以沉默状态和活跃状态存在于组织中,并在维持组织代谢平衡和参与组织修复中发挥重要作用[16]。肌腱损伤后,肌腱愈合过程中通常会发生TDSCs被激活从而分化为肌腱细胞来促进组织修复[15]。TDSCs的增殖、克隆形成和多向分化能力对于损伤的修复至关重要[17]。增殖和克隆形成能力常与修复的速率息息相关[18]。我们前期的研究[14]表明,TDSCs的增殖和克隆形成能力在冷冻前后没有明显改变。在人的冷冻脂肪组织同样发现组织内间质血管细胞的增殖能力仍良好保持着[19]。Nanog、Oct4和Sox2常与干细胞的多能性和自我更新有关,是未分化状态和未分化细胞的重要指标[18,20]。因此,本研究选择这3个指标为TDSCs的干性指标。在人的冷冻睾丸组织可观察到有活性的精原干细胞,且细胞干性标志物能正常表达[21]。在人的冷冻牙滤泡组织可分离出牙髓干细胞,且与未处理组细胞保持相似的多向分化能力[22]。本研究结果显示TDSCs保留了干性和多向分化能力,说明在利用同种异体移植肌腱修复肌腱缺损时,存活的TDSCs可以作为细胞池进而为肌腱细胞提供源源不断的来源,很好地促进组织的修复。
对肌腱组织损伤后愈合机制的进一步了解将有助于在治疗过程中制定更有效的策略。同样,该概念还可以应用于其他肌腱和韧带模型中,包括前交叉韧带、跟腱和“肩袖”肌腱等,此类组织经深低温冷冻处理后是否存在有活性的干细胞值得进一步探究。同时,这样的技术还可以应用到包括关节软骨和半月板等其他组织模型中,后续值得探究。
本研究也存在局限性,例如没有体内试验、参与研究的样本量有限、冷冻时间较短等因素。因此,后续实验可扩大样本量、延长冷冻时间和进行体内实验;同时,还可研究深低温冷冻保存同种异体组织的免疫原性、组织学和生物力学变化以及临床应用效果。
