纳米单质铁对厌氧氨氧化脱氮性能的影响
2022-06-29曾天续党鸿钟李维维陈永志
马 娇,曾天续,宋 珺,党鸿钟,李维维,5,陈永志*
纳米单质铁对厌氧氨氧化脱氮性能的影响
马 娇1,2,3,曾天续1,2,3,宋 珺4,党鸿钟1,2,3,李维维1,2,3,5,陈永志1,2,3*
(1.兰州交通大学,甘肃省黄河水环境重点实验室,甘肃 兰州 730070;2.兰州交通大学环境与市政工程学院,甘肃 兰州 730070;3.甘肃省污水处理行业技术中心,甘肃 兰州 730070;4.中国国家铁路集团有限公司发展与改革部,北京 100844;5.甘肃省轻工研究院有限责任公司,甘肃 兰州 730070)
通过向厌氧氨氧化反应器(ASBR)中投加纳米单质铁(nZVI),考察了其对厌氧氨氧化反应(ANAMMOX)脱氮性能的影响.结果表明,在温度为(25±0.5)℃,pH值为7.5±0.5,进水NH4+-N和NO2--N浓度分别为30.35mg/L和37.89mg/L条件下,分别投加0,10,50,100.200,500,1000mg/L nZVI时,总氮去除率(NRE)分别达到70.27%、74.25%、83.45%、90.16%、68.59%、57.18%、50.93%.用修正的Boltzmann、Gompertz、Logistic模型对其进行动力学分析,2值分别为0.9963、0.9944、0.9851,总氮(TN)出水浓度和NRE的预测值与实际值比较,其均方误差值分别为2.13、6.31、8.48和6.93、7.47、10.95.
纳米单质铁;厌氧氨氧化;脱氮效能;动力学模型
厌氧氨氧化(ANAMMOX)是一项经济高效的废水生物脱氮技术.该技术在厌氧或缺氧条件下,以亚硝酸盐(NO2-)作为电子受体进行氨(NH4+)的氧化,生成氮气(N2)和硝酸盐(NO3-),具有反应历程短、节省有机碳源量及曝气量、温室气体排放量少、污泥产量低的特点[1].
适量投加一些金属类元素对厌氧氨氧化过程具有促进作用,如铁、铜、锌、锰等元素,对ANAMMOX菌的生长繁殖有着积极的作用[2].铁是自然界中含量最丰富的过渡金属,被加入到蛋白质辅助因子中,具有催化、氧化还原和调控作用[3].Fe元素通常是作为氧化还原酶的金属辅助因子,参与ANAMMOX菌的代谢过程[4].ANAMMOX菌非常依赖含铁蛋白,特别是细胞色素c,来保存它们的能量[5].铁元素是ANAMMOX菌生长代谢的关键元素,ANAMMOX菌利用Fe2+、Fe3+生长.ANAMMOX菌内具有高含量的细胞色素c,铁是该细胞色素的重要组成部分[6].因此,nZVI被反应器中的溶解氧、水、硝酸盐氧化生成的Fe2+、Fe3+有利于细胞色素c的合成,从而加速ANAMMOX菌的生长[7].此外,ZVI产生的铁离子通过电荷中和、双层压缩和胞外聚合物的分泌来加强反应器中微生物的团聚[8].
与其他形式的单质铁相比,纳米单质铁比表面积大且具有更好的溶解性和活性,从而更易扩散到细胞内[8];由于其具有还原性,当加入到厌氧氨氧化系统中不仅有助于维持适合ANAMMOX菌生长的厌氧环境,还可以减少硝酸盐产量,进一步提高氮去除率[3]. Erdim等[2]在厌氧氨氧化反应器中添加5000μg/LnZVI后,NH4+-N和NO2--N去除率分别比对照组提高了(1~1.5)倍和(1~2)倍.Ren等[8]发现在nZVI的作用下, NH4+-N和NO2--N去除率分别高达93.80%和96.60%;Zhang等[9]和Xu等[10]报道100mg/L以上的nZVI则会对厌氧氨氧化脱氮产生不利影响.毛佩玥[11]也得出500mg/LnZVI会导致总氮去除率显著下降.然而Guo等[12]报道nZVI添加量为1000mg/L时, NH4+-N和NO2--N去除率分别比对照组增加了16.00%和11.00%.因此,进一步研究并优化nZVI投加量是促进其在厌氧氨氧化工艺中应用的关键.
以上研究由于nZVI的添加量及试验操作条件等方面存在不同,对厌氧氨氧化脱氮性能的影响各不相同,另外,nZVI的浓度梯度设置较少,因此较难总结出不同浓度nZVI对厌氧氨氧化的影响规律.本试验设置了7个nZVI浓度梯度来研究其在厌氧氨氧化脱氮过程中的影响规律,确定最适添加量,为nZVI强化厌氧氨氧化脱氮进一步提供理论依据.此外,从动力学方面评价nZVI在厌氧氨氧化中的作用鲜见报道,本试验使用修正的Boltzmann、Gompertz和Logistic动力学模型考察nZVI作用下ASBR反应器内氮素去除动力学特性,以期为实际应用提供一定参考.
1 材料与方法
1.1 试验装置与工作条件
ASBR厌氧氨氧化反应器的主要材质为有机玻璃,直径为14cm,高为45cm,有效容积为5L.设有搅拌装置、水封瓶、缓冲瓶、温控仪和pH计等(图1).控制温度为(25±0.5)℃,pH值为7.5±0.5,反应器维持密闭并避光放置.
1.2 进水水源与接种污泥
ASBR进水采用人工配水,具体水质情况见表1.
试验接种污泥取自取本实验室培养成功的厌氧氨氧化污泥,其MLSS值为2230mg/L~3100mg/L, SV30为29%~32%.
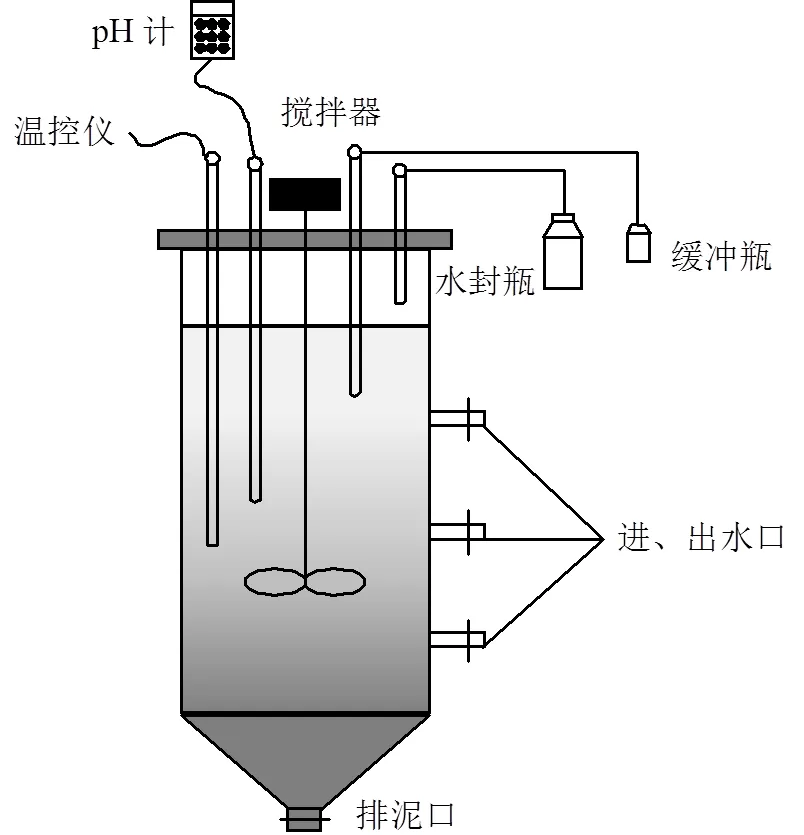
图1 ASBR试验装置示意

表1 ABSR进水水质
1.3 项目检测方法
于反应器中取定量水样,再使用定性滤纸(0.45μm)进行过滤后,按照国际标准规定的方法对NH4+-N、NO3--N、NO2--N浓度进行测定[13].详见表2所示.

表2 检测项目及方法
1.4 动力学模型
总氮去除率计算公式:

式中:NRE为总氮去除率,%;TN-inf表示进水总氮浓度,mg/L;TN-eff表示出水总氮浓度,mg/L.
采用修正的Boltzmann、Gompertz、Logistic模型来描述单个运行周期内的脱氮特性[14].
1.4.1 修正的Boltzmann模型

联合式(1)和(2)表示为:

式中:NREmax为最大总氮去除率,%;NREmin为最小总氮去除率,%;c为1/2NRE所对应的时间,h;d为时间常数,h.
1.4.2 修正的Gompertz模型

联合式(1)和(4)表示为:
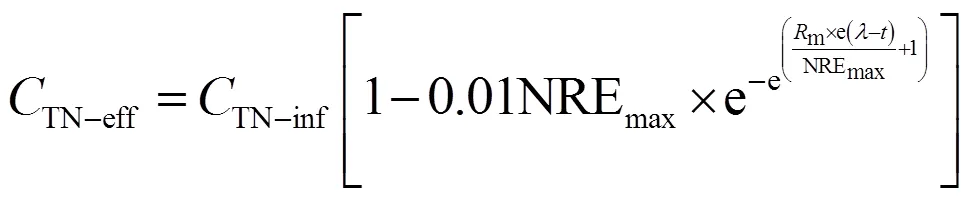
式中:为周期内某时刻,h;m为最大脱氮速率,%/h;为ANAMMOX菌脱氮的延迟时间,h.
1.4.3 修正的Logistic模型

联合式(1)和(6)表示为:
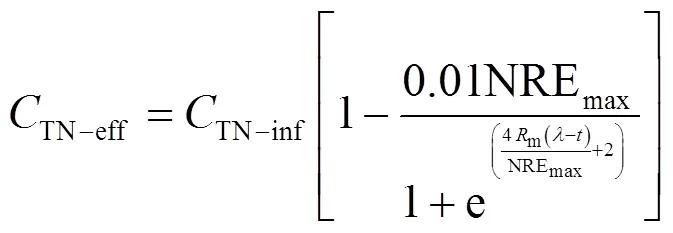
1.5 试验运行方案
ASBR反应器每天运行两个周期,每个周期为12h.一个运行周期内的进料时间20min、反应时间10h、沉淀时间1h、排水时间15min、空闲时间25min.排水比为90%,水力停留时间(HRT)为12h.ASBR反应器共运行140d,整个试验过程可以分为八个阶段,不同浓度的nZVI以固体粉末的形式在每个周期开始时投加到反应器中,每个周期运行结束后换水清洗厌氧氨氧化污泥,以除去剩余铁粉.第一阶段1~15d,不投加nZVI;第二阶段16~30d,投加10mg/ LnZVI;第三阶段31~50d,投加50mg/LnZVI;第四阶段51~72d,投加100mg/LnZVI;第五阶段73~94d,投加200mg/LnZVI;第六阶段95~116d,投加500mg/ LnZVI;第七阶段117~127d,投加1000mg/LnZVI;第八阶段128~140d,停止投加nZVI.
2 结果与讨论
2.1 nZVI对系统脱氮性能的影响
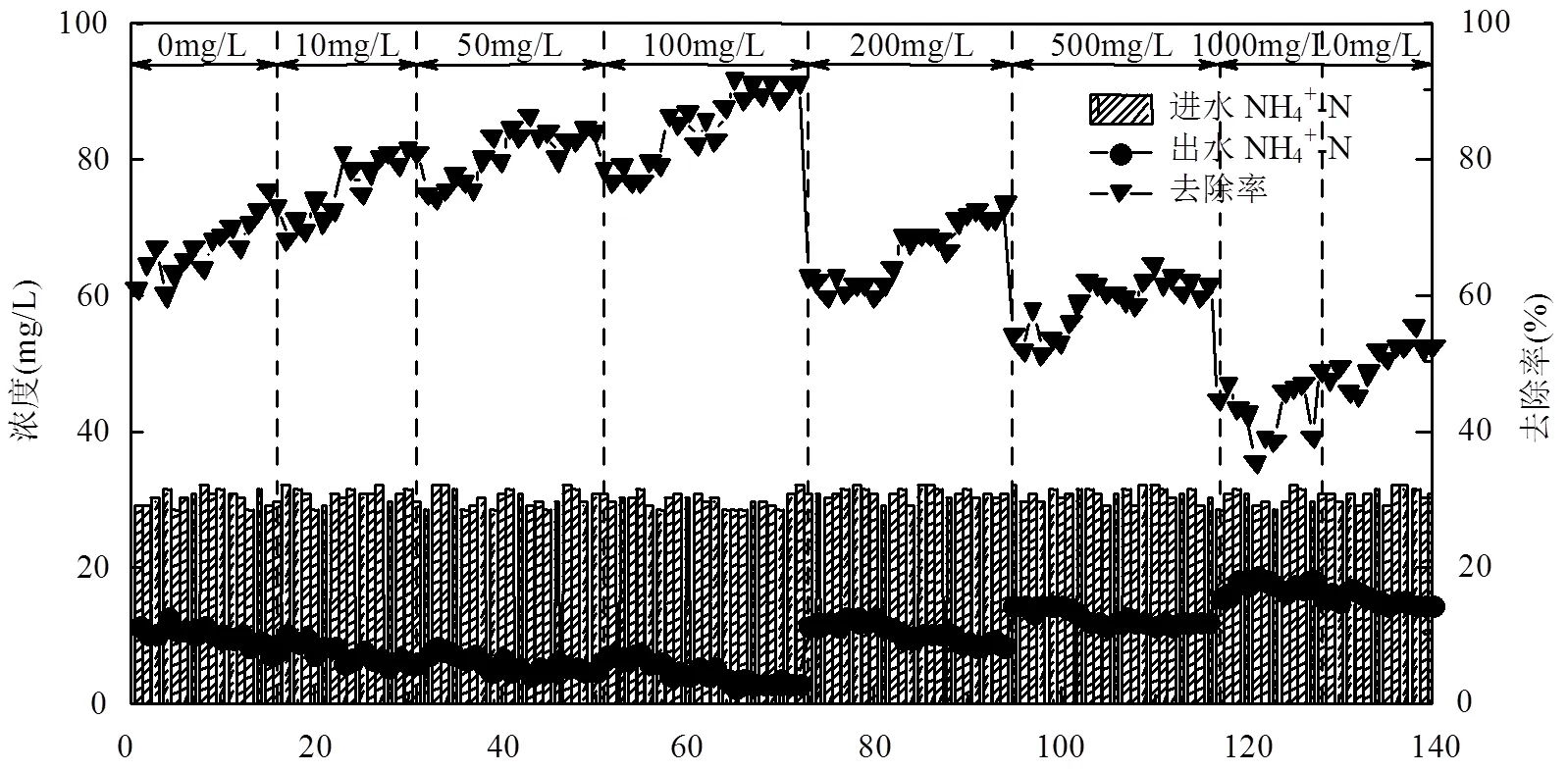
于ASBR中考察投加不同浓度nZVI时的脱氮性能,试验分为八个阶段(图2),进水NH4+-N和NO2--N的平均浓度分别为30.35mg/L和37.89mg/L.阶段I(1~15d),不投加nZVI.NH4+-N、NO2--N去除率由第1d时的60.95%、73.64%在第14d时逐渐升高到72.37%、82.74%,此后趋于稳定.
在阶段II(16~30d)和III(31~50d),nZVI投加量分别为10mg/L和50mg/L.反应前期由于nZVI粉末的溶解性较低,对ANAMMOX系统造成冲击,nZVI粉末吸附在污泥上,降低传质效率[12],导致其活性减弱,出水NH4+-N及NO2--N浓度升高.经一段时间运行,nZVI氧化为铁离子,缓慢扩散到细菌中开始被利用[10],到第23d和39d时NH4+-N去除率分别达到81.00%和83.18%,NO2--N去除率达到81.15%和82.73%,进入活性升高阶段[15].稳定阶段的NH4+-N、NO2--N去除率分别可以达到81.54%、84.00%和84.18%、85.50%,出水NO3--N浓度为7mg/L左右,与第一阶段相比,脱氮效能提升.阶段IV(51d~ 72d)nZVI投加量增至100mg/L.该阶段氮素去除特性与阶段III相似,第62d时,出水NH4+-N、NO2--N浓度为4.16mg/L、3.90mg/L,出水NO3--N浓度低于7mg/L,这是由于nZVI还原了部分NO3--N[16-17].此外,nZVI不仅可以刺激ANAMMOX菌分泌EPS[18],促进微生物聚集[19],而且可以通过非生物硝酸盐还原作用消耗残留溶解氧,为ANAMMOX菌的生长创造有利条件[20-21].NH4+-N和NO2--N的去除率在第72d达到91.08%和91.77%.说明投加100mg/LnZVI时,厌氧氨氧化系统的脱氮效果更好.
在阶段V(73~94d),投加200mg/LnZVI,系统的脱氮效果不升反降,在第73d时出水NH4+-N和NO2--N浓度增大至11.32mg/L和11.98mg/L,去除率降至62.83%和67.06%,低于阶段I的去除效果,第80d时,出水NH4+-N和NO2--N浓度高达12.39mg/L和12.85mg/L.此后,二者去除率缓慢上升,在第94d时出水NH4+-N、NO2--N浓度降至8.21mg/L和7.99mg/L,去除率上升至73.41%和78.31%,与未添加nZVI相比,其脱氮效果可恢复80%左右.
当nZVI投加量进一步增大至500mg/L(阶段VI)和1000mg/L(阶段VII),脱氮效果依次恶化.与阶段V相似之处是投加nZVI后,系统脱氮性能都有一个下降、适应和恢复的过程,但持续时间更长.原因是过量nZVI吸附于厌氧氨氧化细菌上,使其传质效率下降[22];而且随着H+的消耗,在碱性条件下由nZVI氧化成的Fe2+/Fe3+又逐渐转化成Fe(OH)2/Fe(OH)3沉淀,导致反应速度减慢,脱氮效率降低[23].第128d时停止投加nZVI,在第140d时,脱氮效率与阶段I相比能恢复65%左右,比Zhang等[9]的恢复程度低,原因是本实验投加的nZVI浓度比其高出5倍.
2.2 不同浓度nZVI下的化学计量关系
由图3可见,未投加nZVI时,ANAMMOX系统中NO2--N去除量与NH4+-N去除量之比(DNO2--N/DNH4+-N)值为1.48,高于理论值1.32,这是因为存在少量反硝化菌[1],使NO2--N降解量偏大.加入10、50、100mg/L nZVI后,(DNO2--N/DNH4+-N)值分别为1.36、1.34、1.31,说明nZVI的投加提高了NH4+-N和NO2--N的去除效率.但NO3--N生成量与NH4+-N去除量之比(DNO3-- N/DNH4+-N)值均低于理论值0.26,分别为0.21、0.18、0.17,这是因为nZVI还原了一部分NO3-- N[21].加入200,500,1000mg/L nZVI后,NH4+-N消耗量和NO3--N生成量均减少,DNO2--N/DNH4+-N值分别为1.34、1.37、1.47,DNO3--N/DNH4+-N值分别为0.24、0.21、0.10.因此,DNO2-- N/DNH4+-N、DNO3--N/DNH4+-N和理论值的偏差与系统内反硝化菌等共生菌的存在有一定关系[8,24].但ANAMMOX菌对Fe2+和Fe3+的反应比反硝化菌更灵敏,反应活性更强[25].结合不同nZVI浓度下氮素浓度变化特性,可以说明在投加不同浓度nZVI条件下,系统中主体反应一直是厌氧氨氧化反应[10].

图3 不同浓度nZVI下的化学计量比
2.3 典型周期内氮素去除特性
由图4可见,投加100和1000mg/LnZVI时,对系统脱氮性能的影响分别为最佳和最不利.投加100mg/LnZVI时,NH4+-N、NO2--N、总氮浓度均呈下降趋势,而D总氮、NRE逐渐升高.在第9h时,总氮浓度降至18.84mg/L,NRE升高至72.86%.之后,反应速度减慢,反应结束时总氮浓度仅为6.83mg/L;NRE达到90.16%.NO3--N浓度在第9 h时达到6.91 mg/L,然而反应结束时降至3.81mg/L.这是因为前期厌氧氨氧化反应占据优势,导致NO3--N积累,后期随着nZVI的还原作用及其对反硝化促进作用的增强,NO3--N被还原为N2.
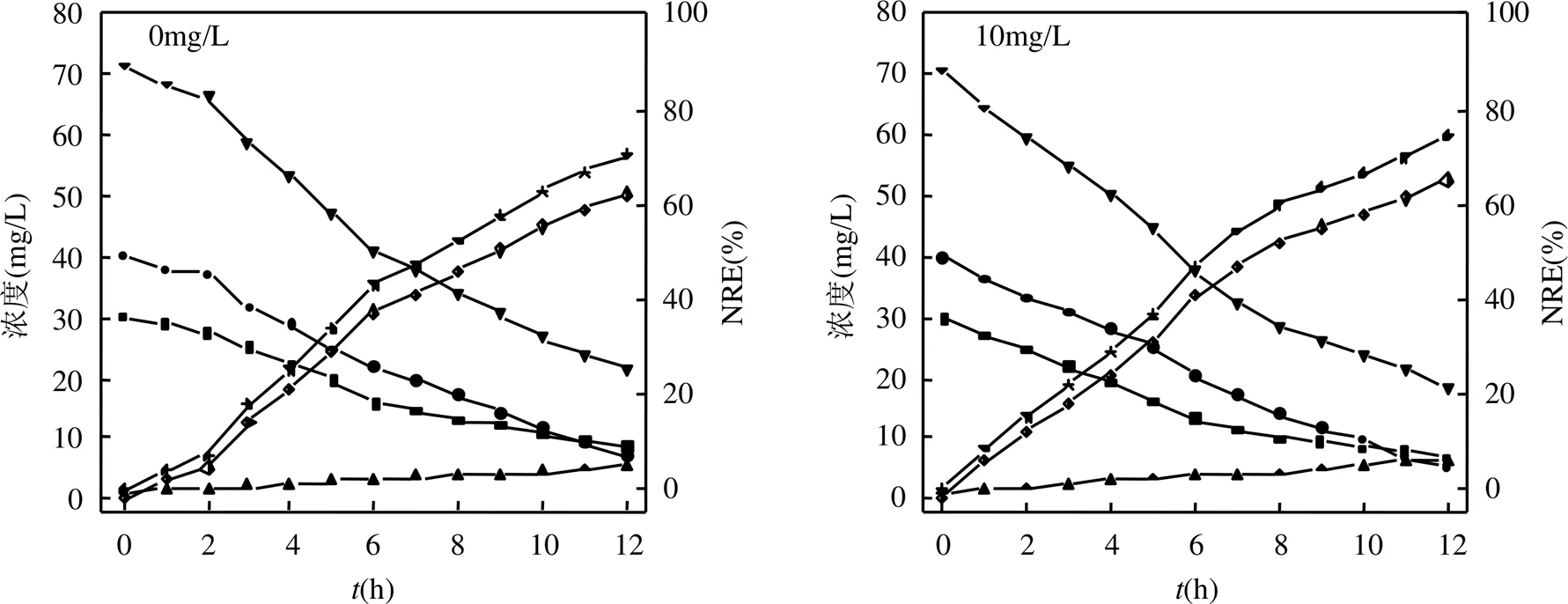
可以看出,当投加0,10,50,100mg/LnZVI时,厌氧氨氧化系统的氮素降解性能随nZVI浓度的增加而增强;当投加200,500,1000mg/LnZVI时,系统的脱氮性能随nZVI浓度增大而减弱.说明适当浓度的nZVI对厌氧氨氧化作用有促进作用,而浓度过高会抑制反应进行,不利于氮素的去除.
2.4 动力学分析
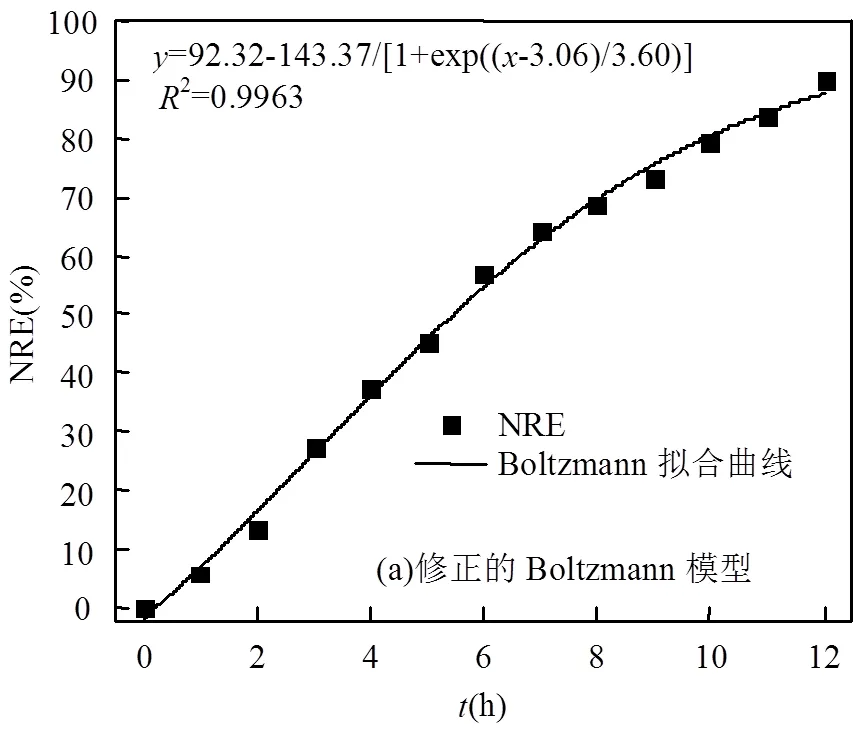
使用修正的Boltzmann、Gompertz、Logistic动力学模型,对投加100mg/LnZVI时典型周期内的总氮去除率(NRE)进行非线性模型拟合(图5),拟合结果表明,修正的Boltzmann模型拟合得到的最大总氮去除率(NREmax)为92.32%,1/2NREmax所对应的时间c为3.06h,时间常数d为3.60h,相关系数2为0.9963.修正的Gompertz模型拟合得到的NREmax为92.97%,最大脱氮效率m为10.48%/h,脱氮延迟时间为0.75h,相关系数2为0.9944.修正的Logistic模型拟合得到的NREmax为86.19%,最大脱氮效率m为11.31%/h,脱氮延迟时间为1.06h,相关系数2为0.9851.模型拟合的方差及显著性分析见表4.可见,以上三种模型的2值均接近于1,说明拟合度良好.其中,修正的Boltzmann模型拟合的残差值最小,NREmax与实际值偏差最小,2值最大,说明该模型对nZVI作用下厌氧氨氧化反应总氮去除率的拟合程度最好.
修正的Boltzmann模型拟合投加0,1000mg/ LnZVI时典型周期内NRE的结果见图6拟合得到的NREmax值分别为77.05%、74.50%,c、d值分别为4.40h、3.12h和8.09h、4.00h,相关系数2值分别为0.9966、0.9970.比较投加0,100,1000mg/LnZVI时的模型拟合结果可以看出,不同浓度下的模型拟合度均较好,且100mg/LnZVI作用下的c值比0mg/L和1000mg/L分别缩减了1.34h和5.03h.这是因为100mg/LnZVI提高了系统的脱氮性能,脱氮速率加快,而1000mg/L nZVI使系统脱氮的动力学行为受到不利影响,脱氮性能恶化.
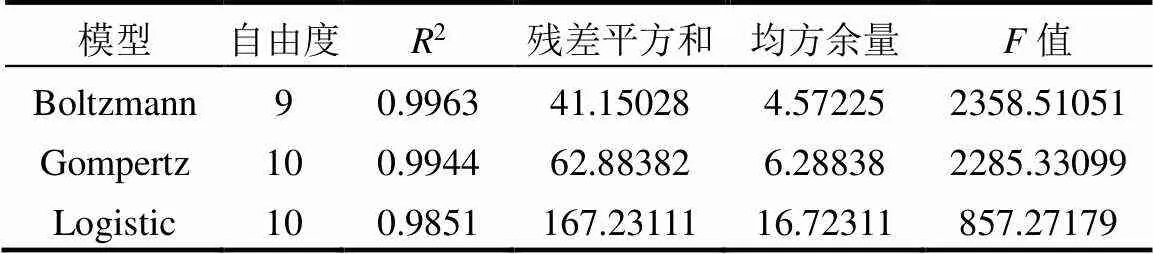
表3 方差及显著性分析
为了验证动力学模型的精确度和实用性,采用以上三种模型预测投加100mg/LnZVI的总氮出水浓度和总氮去除率(图7).总氮出水浓度和总氮去除率的预测值与实验值之间的均方误差分别为2.13、6.31、8.48和6.93、7.47、10.95,修正的Boltzmann模型预测值比修正的Gompertz、Logistic模型预测值更接近实验值.进一步表明修正的Boltzmann模型在厌氧氨氧化动力学分析中的适用性较好,这与黄硕[26]、李伟刚[27]和唐佳佳[28]的研究结果一致.


说明修正的Boltzmann模型更适合描述nZVI作用下厌氧氨氧化反应器内氮素降解过程,其动力学参数可用于评价一定浓度nZVI对厌氧氨氧化反应器脱氮性能的影响,为nZVI提升厌氧氨氧化系统的脱氮性能提供动力学解释.
3 结论
3.1 当nZVI浓度从0增加到100mg/L时,厌氧氨氧化的脱氮效果逐渐增强,总氮去除率最高可达90.16%;继续增大其浓度,脱氮效果恶化,当其浓度为1000mg/L时,总氮去除率仅为38.71%.
3.2 停止投加1000mg/LnZVI后12d,总氮去除率可以恢复到52.01%,表明高浓度nZVI对厌氧氨氧化脱氮性能的抑制是暂时的.
3.3 相比修正的Gompertz、Logistic模型,修正的Boltzmann模型拟合程度最好,R2为0.9963,总氮出水浓度和总氮去除率的预测值与实验值之间的均方误差值仅为2.13和6.93.
[1] 吕 恺,王康舟,姚雪薇,等.基于氨氮,硝氮及乙酸条件下Anammox菌的培养[J]. 中国环境科学, 2020,40(10):4348-4353.
Lv K, Wang K Z, Yao X W, et al. Enrichment of Anammox under conditions of ammonium, nitrate and acetic acid as substrates [J]. China Environmental Science, 2020,40(10):4348-4353.
[2] Erdim E, Yücesoy Ö Z,Kurt H, et al. Overcoming challenges in mainstream Anammox applications: Utilization of nanoscale zero valent iron (nZVI) [J]. The Science of the total environment, 2019, 651(2):3023-3033.
[3] Zhang Y, An X, Quan X. Enhancement of sludge granulation in a zero valence iron packed anaerobic reactor with a hydraulic circulation [J]. Process Biochemistry, 2011,46(2):471-476.
[4] Christina F, Simon L H, Frauke B M, et al. Iron assimilation and utilization in anaerobic ammonium oxidizing bacteria [J]. Current Opinion in Chemical Biology, 2017,37(5):129-136.
[5] 董子阳,胡宝兰,韩佳慧.厌氧氨氧化细菌Candidatus Kuenenia stuttgartiensis铁的吸收利用研究进展[J]. 微生物学通报, 2021, 48(5):1780-1787.
Dong Z Y, Hu B L, Han J H. Research progress in the uptake and utilization of iron by the anaerobic ammonium-oxidizing bacterium Candidatus Kuenenia stuttgartiensis [J]. Microbiology China, 2021, 48(5):1780-1787.
[6] Peng D, Zhang J J. Research progress on treatment of low ammonia nitrogen wastewater by anaerobic ammonia oxidation process [J]. International Core Journal of Engineering, 2021,7(5):460-469.
[7] 雷 欣,闫 荣,慕玉洁,等.铁元素对厌氧氨氧化菌脱氮效能的影响[J]. 化工进展, 2021,40(5):2730-2738.
Lei X, Yan R, Mu Y J, et al. Effect of iron on nitrogen removal efficiency of anaerobic ammonium oxidation bacteria [J]. Chemical Industry and Engineering Progress, 2021,40(5):2730-2738.
[8] Ren L F, Ni S Q, Liu C,et al. Effect of zero-valent iron on the start-up performance of anaerobic ammonium oxidation(anammox)process [J]. Environment Science and Pollution Research International, 2015, 22(4):2925-3400.
[9] Zhang Z Z, Xu J J, Shi Z J, et al. Unraveling the impact of nanoscale zero-valent iron on the nitrogen removal performance and microbial community of anammox sludge [J]. Bioresource Technology, 2017, 243:883-892.
[10] Xu J J, Zhang Z Z, Ji Z Q, et al. Short-term effects of nanoscale Zero-Valent Iron (nZVI) and hydraulic shock during high-rate anammox wastewater treatment [J]. Journal of Environmental Management, 2018,215:248-257.
[11] 毛佩玥.短程反硝化耦合厌氧氨氧化处理生活污水试验研究[D]. 兰州:兰州交通大学, 2021.
Mao P Y. Study on partial denitrification coupled with anaerobic ammonia oxidation to treat domestic sewage [D]. Lanzhou: Lanzhou Jiaotong University, 2021.
[12] Guo B B, Chen Y H, Lv L, et al. Transformation of the zero valent iron dosage effect on anammox after long-term culture: From inhibition to promotion [J]. Process Biochemistry, 2019,78:132-139.
[13] 国家环境保护总局.水和废水监测分析方法[M]. 4版.北京:中国环境科学出版社, 2002.
[14] Feng L, Li J, Ma H R, et al. Effect of Fe(II) on simultaneous marine anammox and Feammox treating nitrogen-laden saline wastewater under low temperature: Enhanced performance and kinetics [J]. Desalination, 2020,478(C):114287-114297.
[15] Wang B, Sun B, Liu Y L, et al. Start-up of Anammox and Effect of Fe on Nitrogen Removal Rate [J]. IOP Conference Series: Earth and Environmental Science, 2021,787(1).
[16] Bi Z, Zhang W J, Song G, et al. Iron-dependent nitrate reduction by anammox consortia in continuous-flow reactors: A novel prospective scheme for autotrophic nitrogen removal [J]. Science of the Total Environment, 2019,692(C):582-588.
[17] Dong L W, Yan H S, A Q D, et al. Effects of nanoscale zero-valent iron particles on biological nitrogen and phosphorus removal and microorganisms in activated sludge [J]. Journal of Hazardous Materials, 2013,262:649-655.
[18] Ni S Q, Sun N, Yang H L, et al. Distribution of extracellular polymeric substances in anammox granules and their important roles during anammox granulation [J]. Biochemical Engineering Journal, 2015,101: 126-133.
[19] Lefevre E, Bossa N, Wiesner M R, Gunsch C K, et al. A review of the environmental implications of in situ remediation by nanoscale zero valent iron (nZVI): Behavior, transport and impacts on microbial communities [J]. Science of the Total Environment, 2016,565: 889- 901.
[20] 谢 丽,何莹莹,陆 熙,等.铁对厌氧氨氧化过程及其微生物群落的影响[J]. 同济大学学报(自然科学版), 2020,48(8):1169-1178.
Xie L, He Y Y, Lu X, et al. Effect of Iron on ANAMMOX Process and Microbial Community [J]. Journal of Tongji University (Natural Science), 2020,48(8):1169-1178.
[21] Yan Y, Wang Y Y, Wang W G, et al. Comparison of short-term dosing ferrous ion and nanoscale zero-valent iron for rapid recovery of anammox activity from dissolved oxygen inhibition [J]. Water Research, 2019,153:284-294.
[22] Mak C Y, Lin J G, Chen W H, et al. The short- and long-term inhibitory effects of Fe (II) on anaerobic ammonium oxidizing (anammox) process [J]. Water Science & Technology, 2019,79(10): 1860-1867.
[23] Gao F, Zhang H M,Yang F L, et al. The effects of zero-valent iron (ZVI) and ferro ferric oxide (Fe3O4) on anammox activity and granulation in anaerobic continuously stirred tank reactors (CSTR) [J]. Process Biochemistry, 2014,49(11):1970-1978.
[24] Zhang S Q, Zhang L Q, Yao H N, et al. Responses of anammox process to elevated Fe(III) stress: reactor performance, microbial community and functional genes [J]. Journal of Hazardous Materials, 2021,414.
[25] Liu S T, Horn H. Effects of Fe(II) and Fe(III) on the single-stage deammonification process treating high-strength reject water from sludge dewatering [J]. Bioresource Technology, 2012,114:12-19.
[26] 黄 硕,于德爽,陈光辉,等.氧化石墨烯强化Anammox菌的脱氮性能[J]. 中国环境科学, 2019,39(5):1945-1953.
Huang S, Yu D S, Chen G H, et al. Improvement of the activity of ANAMMOX bacteria using graphene oxide [J]. China Environmental Science, 2019,39(5):1945-1953.
[27] 李伟刚,于德爽,李 津.ASBR反应器厌氧氨氧化脱氮Ⅱ:反应动力学[J]. 中国环境科学, 2013,33(12):2191-2200.
Li W G, Yu D S, Li J. Nitrogen removal in the Anammox sequencing batch reactor II: Kinetics characteristics [J]. China Environmental Science, 2013,33(12):2191-2200.
[28] 唐佳佳,于德爽,王晓霞,等.盐度对中试厌氧氨氧化脱氮特性的影响及其恢复动力学 [J]. 环境科学, 2018,39(11):5081-5089.
Tang J J, Yu D S, Wang X X, et al. Effect of salinity on nitrogen removal performance of a pilot-scale anaerobic ammonia oxidation process and its recovery kinetics [J]. Environmental Science, 2018,39(11):5081-5089.
Effect of nanoscale zero-valent iron on the denitrification performance of anaerobic ammonia oxidation.
MA Jiao1,2,3, ZENG Tian-xu1,2,3, SONG Jun4, DANG Hong-zhong1,2,3, LI Wei-wei1,2,3,5, CHEN Yong-zhi1,2,3*
(1.Key Laboratory of Yellow River Water Environment in Gansu Province, Lanzhou Jiaotong University, Lanzhou 730070, China;2.School of Environmental and Municipal Engineering, Lanzhou Jiaotong University, Lanzhou 730070, China;3.Technical Center of Sewage Treatment Industry in Gansu Province, Lanzhou 730070, China;4.Development and Reform Ministry of China State Railway Group Co.,Ltd, Beijing 100844, China;5.Gansu Research Institute of Light Industry Co.,Ltd, Lanzhou 730070, China)., 2022,42(6):2619~2627
The effect of nanoscale zero-valent iron (nZVI) powder on the denitrification performance of anaerobic ammonia oxidation (ANAMMOX) reaction was investigated by adding nZVI into ASBR. When the concentrations of nZVI were 0, 10, 50, 100, 200, 500, and 1000mg/L at the temperatures of (25±0.5)℃, and the pH value of 7.5±0.5, the total nitrogen removal efficiencies (NRE) were 70.27%, 74.25%, 83.45%, 90.16%, 68.59%, 57.18%, and 50.93% under the influent NH4+-N and NO2--N concentrations of 30.35mg/L and 37.89mg/L, respectively. The kinetic analysis was carried out by the modified Boltzmann, Gompertz, and Logistic models,the2values were 0.9963, 0.9944, and 0.9851, respectively. The mean square errors of the effluent concentration of total nitrogen (TN) and NRE compared with the actual values were 2.13, 6.31, 8.48, and 6.93, 7.47, 10.95, respectively.
nZVI;ANAMMOX;nitrogen removal efficiency;kineticmodels
X703.1
A
1000-6923(2022)06-2619-09
马 娇(1998-),女,甘肃民勤人,兰州交通大学硕士研究生,主要研究方向为污(废)水生物处理.
2021-11-12
兰州交通大学甘肃省黄河水环境重点实验室开放基金项目(21YRWEK006);甘肃省青年科技基金计划(20JR5RA075)
* 责任作者, 教授, 476411589@qq.com
