LDHA及LDHB对胃癌组织中免疫微环境的影响及临床意义
2022-06-28聂佳琪李晓宁崔海康张旭东张文杰
聂佳琪,潘 凤,李晓宁,崔海康,张旭东,杨 兰,张文杰
胃癌是全球常见的恶性肿瘤之一,每年全球新确诊病例超过100万[1]。能量代谢的重新编程和免疫逃避[2]是癌症的两个新兴标志[3]。乳酸代谢中的关键酶——乳酸脱氢酶(lactate dehydrogenase, LDH)常以LDHA和LDHB两种不同的亚型存在,LDHA负责丙酮酸转化为乳酸和NAD+,而LDHB负责将乳酸转化为丙酮酸,促进氧化代谢[4]。在肿瘤细胞中,即使在氧气充足的情况下,丙酮酸也易被LDHA催化成乳酸,称为Warburg效应,也称为有氧糖酵解[5]。增加Warburg效应可以促进肿瘤细胞增殖,通过合成代谢过程避免细胞凋亡[6]。值得注意的是,产生的乳酸会导致酸性肿瘤微环境的形成,这种低pH环境可影响肿瘤免疫监测的各个部分,以驱动免疫逃逸[7],因此,有必要探究LDH表达在胃癌中的临床价值以及对免疫微环境可能产生的影响。虽然,目前已有大量的体外研究关注LDHA在胃癌中的调控作用,包括其上下游的靶向结合关系[8],以及对糖酵解的影响[9],但鲜有研究关注LDHB在胃癌中的作用以及预后价值。因此,本实验重点探讨LDHA和LDHB表达与胃癌患者预后的关系,并使用ssGSEA算法探究不同亚型对胃癌组织免疫微环境的影响。
1 材料与方法
1.1 数据集来源及预处理从TCGA(https://portal.gdc.cancer.gov/)数据库下载HTseq-FPKM格式的407例胃癌患者的转录组数据,对原始数据进行log2转化后,比较组织中LDH mRNA的表达。另外,从上述数据库下载全体胃癌患者的临床数据,对407例具有LDH表达信息的样本与临床信息进行匹配,最终纳入375例具有完整LDH表达信息和临床病理数据的胃癌标本。从HPA(https://www.proteinatlas.org/)数据库下载胃癌患者的LDH免疫组化染色图片,其中LDHA染色包括11例正常人群及36例胃癌患者;LDHB染色包括12例正常人群及44例胃癌患者,对所有图片使用Image pro plus软件分析光密度值(IOD)。
1.2 生物信息学ssGSEA算法其根据每个样本中全转录组数据的表达,计算每个基因的rank值,对24种免疫细胞的含量进行评估。24种免疫细胞包括aDC细胞、B细胞、CD8+T细胞、细胞毒细胞、DC细胞、嗜酸性粒细胞、iDC细胞、巨噬细胞、肥大细胞、中性粒细胞、NK CD56bright细胞、NK CD56dim细胞、NK细胞、pDC细胞、T细胞、辅助T细胞、Tcm细胞、Tem细胞、TFH细胞、Tgd细胞、Th1细胞、Th17细胞、Th2细胞和Treg细胞。
1.3 统计学分析采用R软件v4.0版本进行统计学分析,Image pro plus软件计算免疫组化染色的IOD值。采用t检验分析计量资料差异,采用χ2检验分析计数资料差异,采用Cox回归模型筛选患者预后相关的独立预测因素,采用Kaplan-Meier法进行生存分析并进行Log-rank检验。采用Pearson法进行免疫组化分析,P<0.05为差异有统计学意义。
2 结果
2.1 胃癌组织及正常组织中LDHA和LDHB的表达与癌旁正常组织相比,胃癌组织中LDHA的mRNA表达量明显上调(P<0.05,图1A)。IOD半定量分析显示,胃癌组织中LDHA蛋白表达量明显上调(P<0.05,图1B),并且染色强度更深(图1C)。另外,胃癌组织中LDHB的mRNA(图1D)及蛋白表达量(图1E)同样明显上调(P均<0.05),且染色强度更深(图1F)。
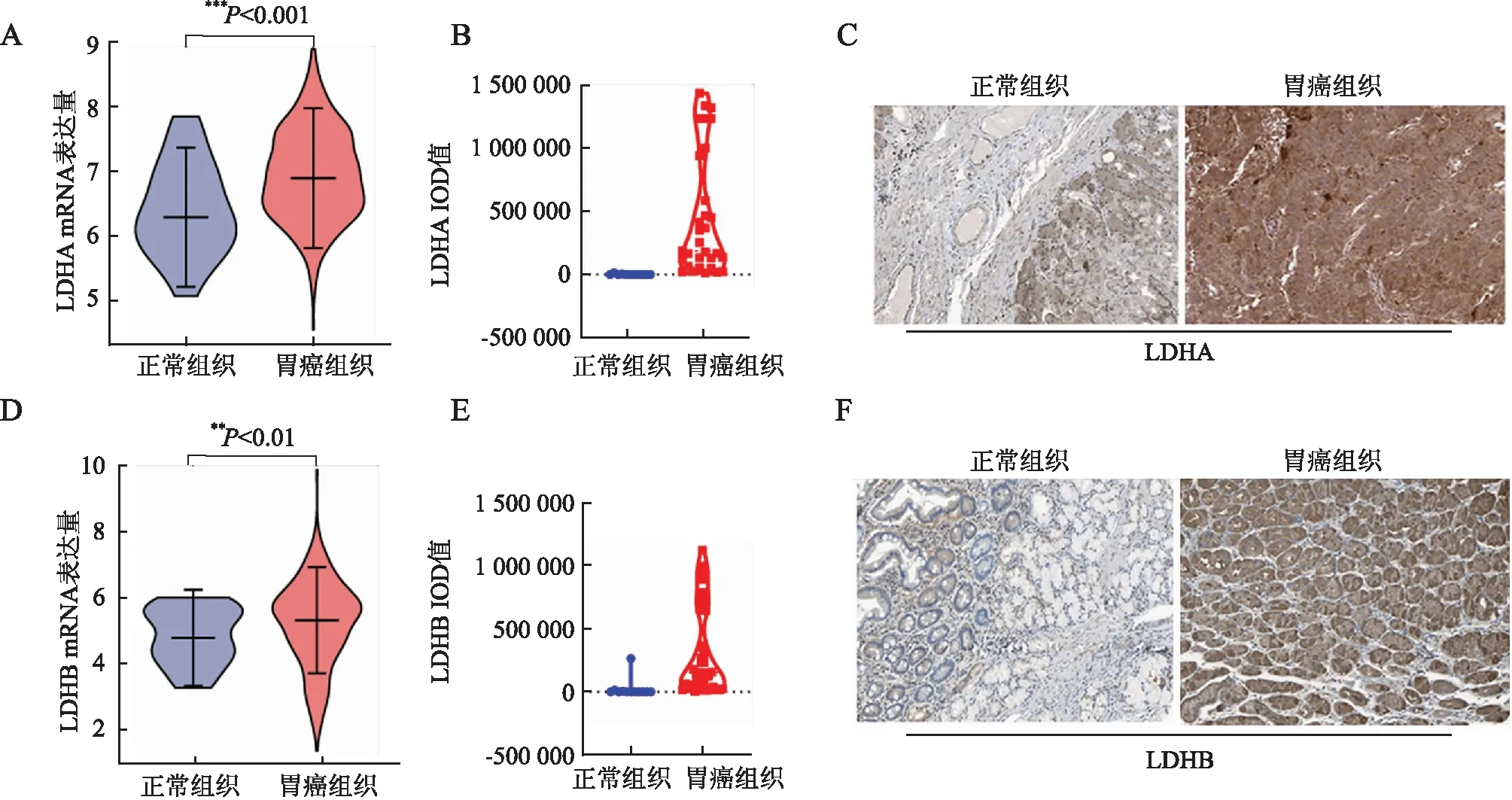
图1 胃癌组织及癌旁正常组织中LDHA和LDHB的表达:A.LDHA mRNA的表达量;B.LDHA蛋白的IOD数值;C.LDHA的免疫组化染色,SP法;D.LDHB mRNA的表达量;E.LDHB蛋白的IOD数值;F.LDHB的免疫组化染色,SP法
2.2 LDHA及LDHB表达与胃癌临床病理特征的关系以LDHA和LDHB表达的中位值作为截断值,将全体患者分为高表达组(188例)和低表达组(187例),发现LDHA表达与患者性别和年龄有关;LDHB表达与患者性别、T分期、病理分期、组织学分级有关(P均<0.05,表1)。
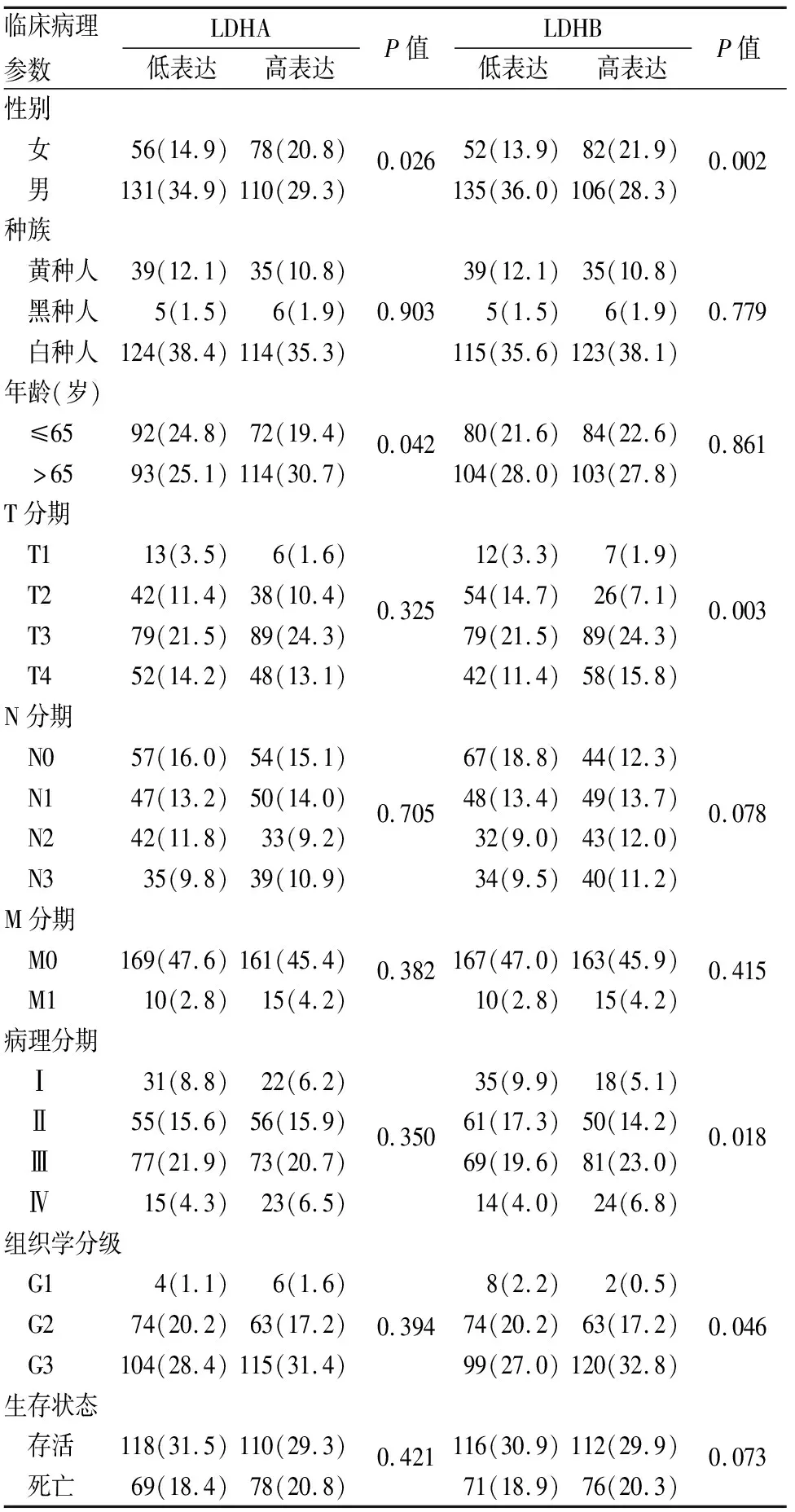
表1 LDHA及LDHB表达与胃癌临床病理特征的关系
2.3 LDHA及LDHB表达与胃癌患者总生存期(overall survival, OS)的关系LDHA高表达组患者的OS明显短于低表达组患者(P<0.05);LDHB高、低表达组患者的OS无明显差异(P>0.05,图2)。Cox回归分析结果显示,LDHA表达与患者年龄、M分期一样,均是胃癌患者OS的独立预后因素(P均<0.05,表2)。LDHB表达与患者OS无关(P>0.05),但年龄和M分期仍是胃癌患者OS的独立预后因素(P均<0.05)。
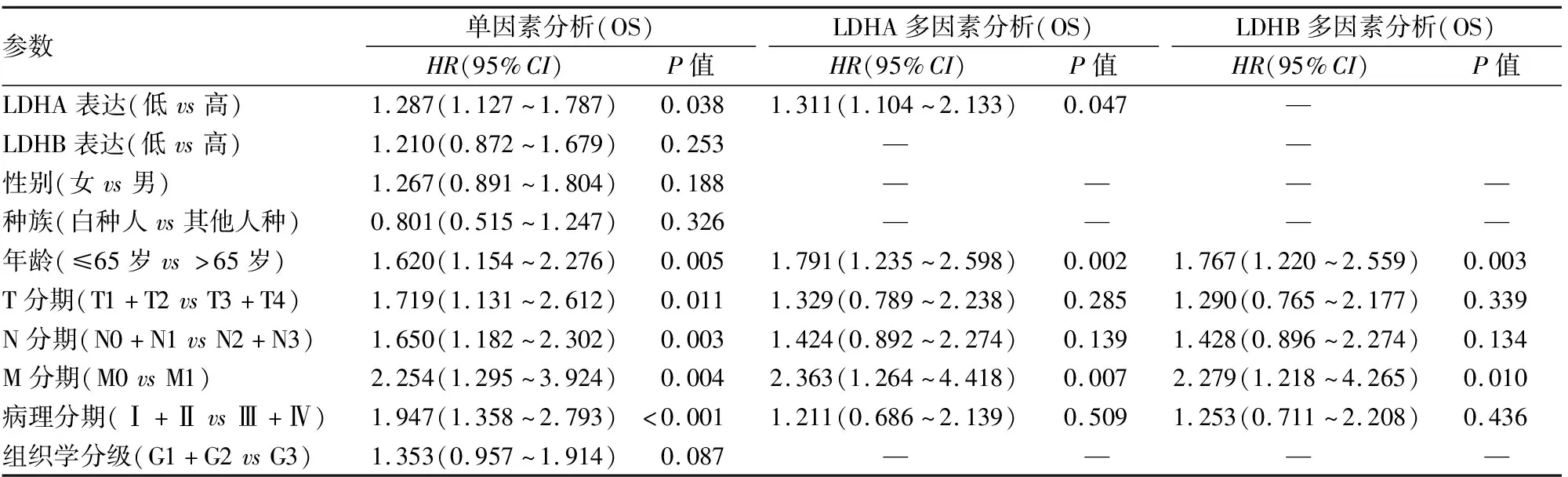
表2 Cox回归分析患者OS的相关因素
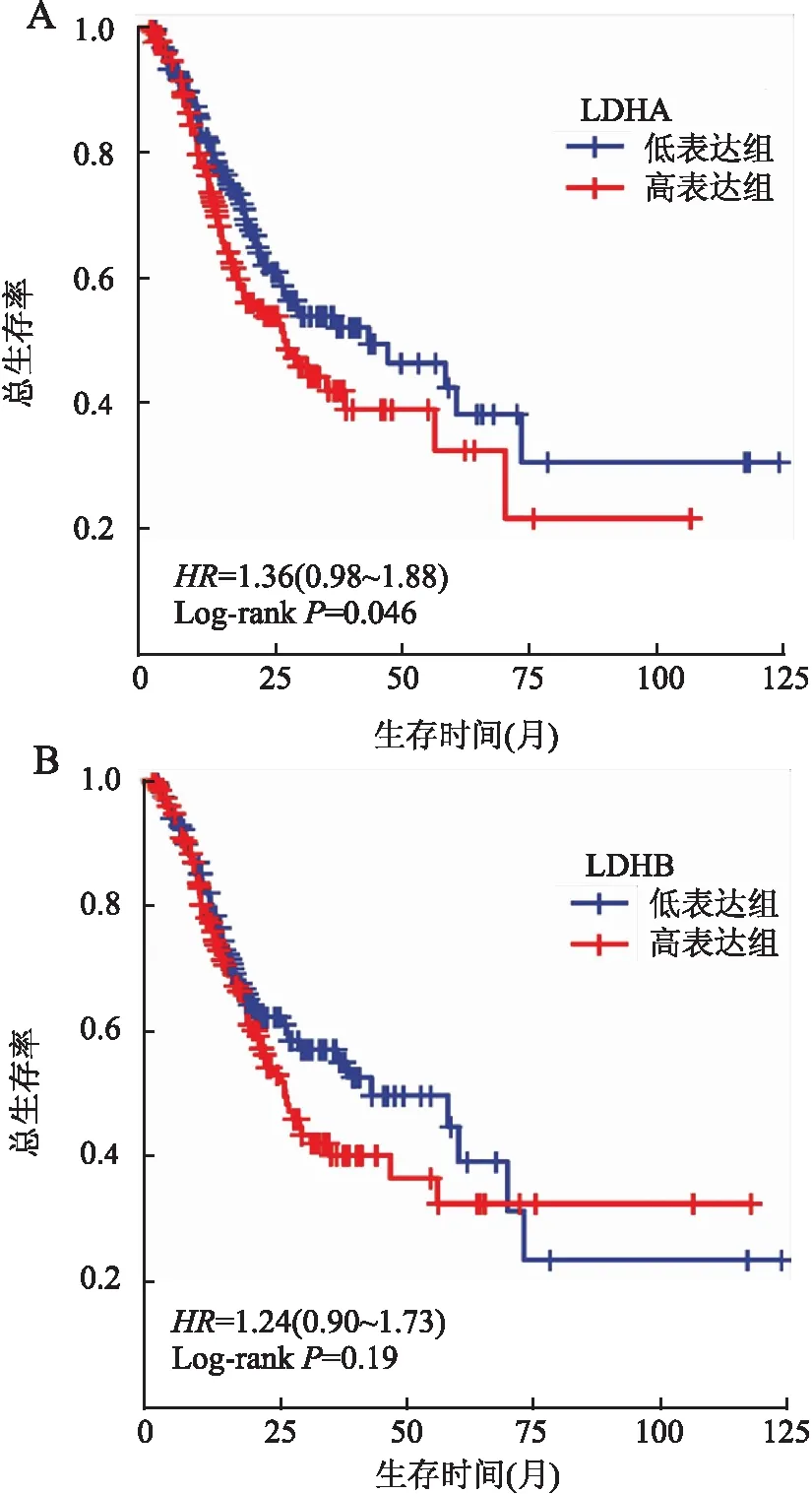
图2 A.LDHA表达与胃癌患者总生存期的关系;B.LDHB表达与胃癌患者总生存期的关系
2.4 LDHA及LDHB表达与胃癌患者无瘤生存期(disease-free survival, DFS)的关系LDHA高表达组患者的DFS与低表达组患者相比,差异无显著性(P>0.05);LDHB高表达组患者的DFS与低表达组患者相比明显缩短(P<0.05,图3)。Cox回归分析结果显示,LDHA表达与患者的DFS无关(P>0.05),LDHB表达对患者DFS具有较强的独立预后价值(P<0.05,表3)。
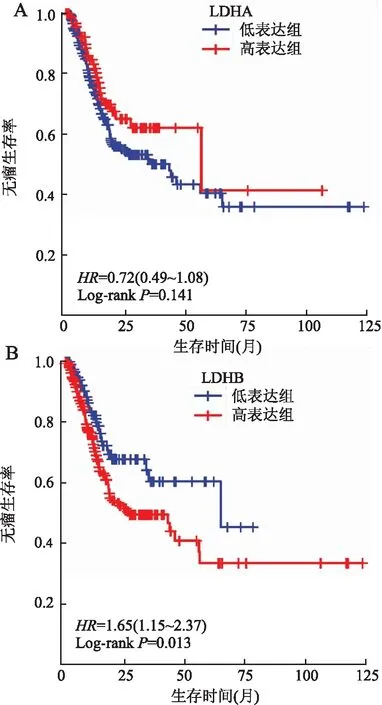
图3 A.LDHA表达与胃癌患者无瘤生存期的关系;B.LDHB表达与胃癌患者无瘤生存期的关系
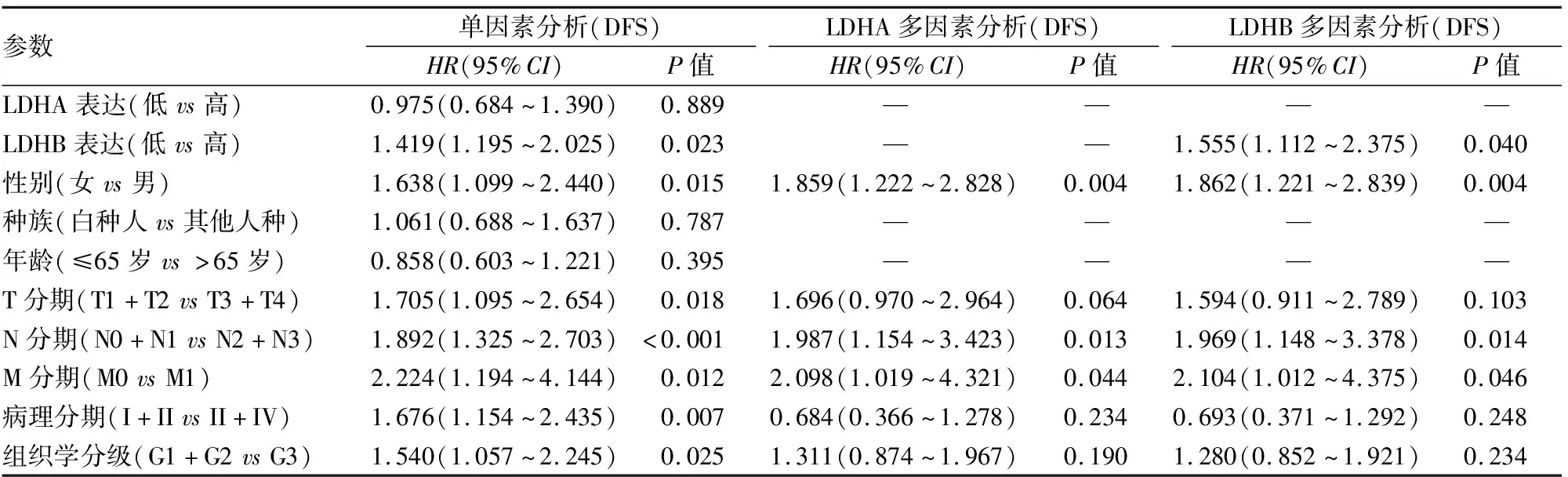
表3 Cox回归分析患者DFS的相关因素
2.5 LDHA及LDHB表达对胃癌组织免疫微环境的影响LDHA表达与Th2细胞、NK CD56dim细胞、aDC细胞、Th1细胞、中性粒细胞、细胞毒细胞、巨噬细胞的含量呈正相关(P均<0.05);与NK CD56bright细胞、嗜酸性粒细胞、pDC细胞、B细胞、肥大细胞、Tem细胞、Tcm细胞、TFH细胞以及NK细胞的含量呈负相关(P均<0.05)。仅NK细胞与LDHB表达呈负相关(P<0.05);LDHB表达与Th2细胞、NK CD56dim细胞、aDC细胞、Th1细胞、中性粒细胞、细胞毒细胞、巨噬细胞、Treg细胞以及辅助T细胞含量呈正相关(P均<0.05,图4)。另外,LDHB高、低表达组中有差异的免疫细胞数目较少。在不同LDHB表达的患者中,嗜酸性粒细胞、pDC细胞、辅助T细胞、Tem细胞、Th17细胞、Th2细胞的含量具有明显差异(6/24)(P<0.05)。值得注意的是,在不同LDHA表达的患者中,大部分免疫细胞的含量差异均有显著性(14/24)(P<0.05,图5)。
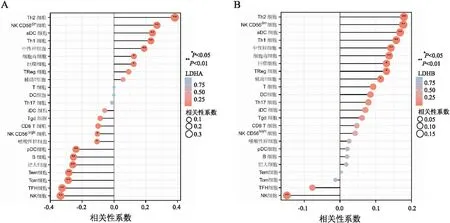
图4 A.LDHA表达与24种免疫细胞的相关性分析;B.LDHB表达与24种免疫细胞的相关性分析
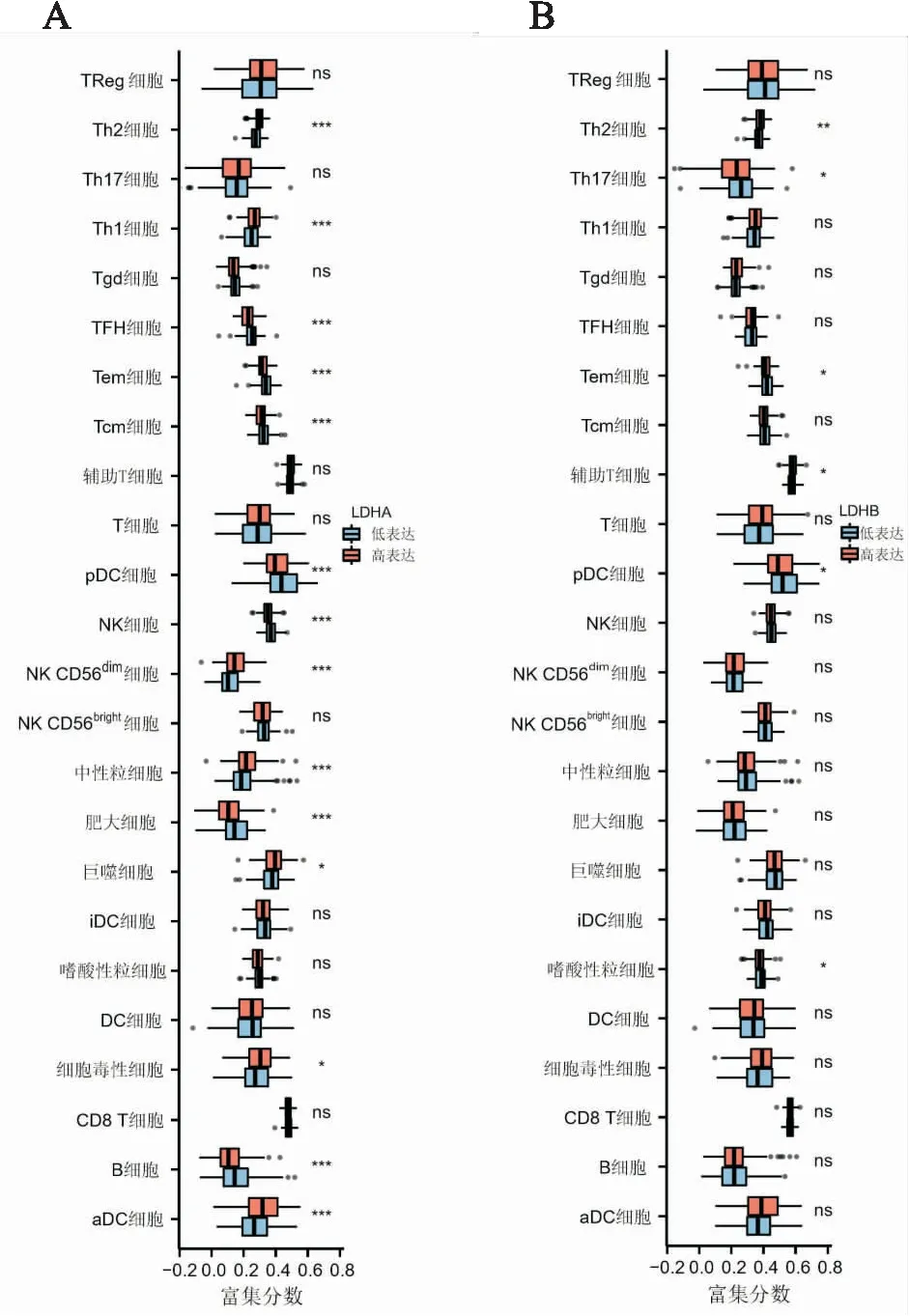
图5 A.LDHA高、低表达组与24种免疫细胞含量的差异分析;B.LDHB高、低表达组与24种免疫细胞含量的差异分析;*P<0.05;**P<0.01;***P<0.001
3 讨论
胃癌是消化系统最常见的恶性肿瘤,发病率位居恶性肿瘤的第2位,病死率位居第3位,仅次于肺癌和肝癌[1]。在酸性环境中的肿瘤代谢重编程[10]与PD-L1等相关的免疫逃逸机制已被证明在胃癌中具有重要作用[11]。因此,本实验着重探讨导致肿瘤酸性环境关键酶的两种亚型对胃癌的临床价值以及对肿瘤免疫微环境的影响。
乳酸生成的增加和H+离子的积累,最终导致肿瘤微环境的酸化,目前相关研究已证明肿瘤组织中酸性环境与免疫反应之间存在密切联系[12]。大多数情况下,酸性环境导致CD8+T细胞、自然杀伤细胞和树突状细胞的活性下调,而促进调节性T细胞和骨髓源性抑制细胞的招募,从而刺激免疫抑制[13]。另外,相关研究支持LDH在肿瘤进展中的作用,如在C57BL/6小鼠胰腺癌模型成瘤实验中,敲除LDHA表达后肿瘤大小小于对照组;在相同的模型中,LDHA敲低的肿瘤中NK细胞表现出更高的活性[14]。与此同时,黑色素瘤中LDH相关的乳酸积累被证明可以抑制T细胞和NK细胞对肿瘤的监测作用,但有趣的是其抑制作用被认为涉及乳酸诱导的T细胞和NK细胞中NFAT的下调,从而减少了IFNγ的产生[15]。该结论提示,LDH活化可能在不同环境下同时具有促炎和抗炎作用。目前,LDHA在胃癌中表达的研究报道较多,如mTOR/PKM2和STAT3/C-Myc信号通路可降低LDHA的表达,并调节其能量代谢和肿瘤微环境[16]。且相关临床研究结果亦表明,LDH的水平对胃癌患者预后有着较强的预测价值[17],检测化疗前LDH水平也可预测中晚期胃癌患者姑息性化疗预后[18]。同以往文献报道一致,本实验亦认为LDHA与患者预后密切相关,并且在OS中有着较好的独立预测价值。另外本实验确定了LDHA表达与Th2细胞、NK CD56dim细胞、aDC细胞、Th1细胞、中性粒细胞、细胞毒细胞、巨噬细胞的含量呈正相关;与NK CD56bright
细胞、嗜酸性粒细胞、pDC细胞、B细胞、肥大细胞、Tem细胞、Tcm细胞、TFH细胞以及NK细胞的含量呈负相关。这些结果也可为我们未来在LDH与免疫逃逸的基础研究中提新思路。另外,不同LDHA表达的胃癌患者,其DFS结局差异无统计学意义。但随后本实验发现LDHB是胃癌患者DFS的独立危险因素,其结果可作为LDHA的补充。遗憾的是,关于LDHB对胃癌组织中免疫微环境和预后价值的研究较少。但本实验提供了该亚型对胃癌患者DFS的预后价值,并且揭示了LDHB表达对免疫细胞浸润丰度的影响,包括嗜酸性粒细胞、pDC细胞、辅助T细胞、Tem细胞、Th17细胞、Th2细胞。这些结果提示,LDHB的表达可能同LDHA一样,也具有一定的免疫调节价值。
目前,虽然胃癌中已有部分标志物的预后作用被深入研究,如SPIN1[19]、AXIN2[20]等,但本实验对探究胃癌中乳酸代谢关键酶的关键作用提供了新思路。本实验也存在一定的局限性:(1)根据美国公开回顾性数据集,LDH的预后效能可能还需国内病例数据进行下一步验证。(2)由于该数据集缺乏统一的病理分型,未进行各病理亚型的分层分析,如传统病理分型或分子亚型。虽然,ssGSEA算法在生物信息学领域已被广泛应用,但仍需体外实验验证。另外,值得注意的是,本实验虽然提示LDHA及LDHB表达对免疫细胞的影响,并且阻断肿瘤乳酸代谢可能是肿瘤治疗的另一种可以尝试的途径,但目前针对免疫细胞的治疗方法具有强毒性,得出的某些实验结果需谨慎应用。
