不同体积分数二甲基亚砜对DNA变性的影响
2022-06-23徐敏王艳伟杨光参
徐敏,王艳伟,杨光参
(温州大学 数理学院,浙江 温州 325035)

图1 DMSO的分子结构Fig.1 The molecular structure of DMSO
DNA是由核苷酸组成的长聚合物,其对遗传信息进行编码,在许多生物过程中发挥着重要作用。DNA的转录和复制是维持生命延续的两个核心且重要的过程,涉及到DNA分子的动态变化,研究DNA变性是了解这两个过程的有效途径。DNA变性是指当DNA配对碱基之间的氢键发生断裂时,DNA双链分离成两个单链,DNA的二级结构遭到破坏。使DNA发生变性的方法主要有酸和碱[1- 2]、离子[3-4]、有机试剂[5-6]、高温[7-8]等,一般来说,DNA可以通过加热、化学处理(如某些有机溶剂)或其组合来变性,化学处理更便于DNA变性研究。有机溶剂二甲基亚砜(DMSO)最早于1867年由二甲硫醚氧化合成[9],其结构式如图1所示,DMSO分子含有硫、氧和碳原子,具有与金字塔形状类似的结构,硫原子在中心,而两个甲基和氧原子则位于角落,具有一个亲水亚砜基团和两个疏水甲基基团,这种结构使其同时具有亲水性和疏水性。DMSO在分子生物学中具有广泛应用,也是DNA变性的常用化学试剂。先前有实验表明,至少需要体积分数为10%的DMSO溶液才能获得在室温下检测到DNA变性[10-11]。然而,近年来利用更完善的实验及模拟手段研究DMSO对生物大分子影响的结果表明,即使在低浓度下,DMSO也能够对一些生物大分子产生显著影响[12-14],模拟发现DNA甚至能在特定条件下形成Z-DNA[15]。因此,研究DMSO对DNA的影响,特别是在低浓度范围内的影响,有助于更好地理解DNA的变性过程。传统检测DNA变性的方法缺点是会隐藏DNA变性的拓扑结构转变过程。单分子技术如原子力显微镜、磁镊、光镊等已被广泛应用于研究DNA的个体分子行为[16-18]、DNA与其他金属离子或蛋白质等的相互作用[19-21]以及DNA的力学性质[22]等,但有关DNA变性的研究鲜有报道,因此,利用单分子手段对DNA的变性行为进行研究能为DNA局部变性过程以及DNA拓扑结构在DNA代谢过程中的生理作用提供新的视角。为研究低体积分数DMSO对DNA变性的影响,本文结合单分子原子力显微镜(AFM)技术与传统动态光散射方法,研究了不同体积分数DMSO致质粒及线性DNA变性过程中的形貌及粒径变化。
1 仪器与材料
1.1 实验仪器
NanoWizard Ⅲ原子力显微镜(德国 JPK instrument AG 公司),NCHR-50原子力探针(瑞士Nano World 公司),Zetasizer nano ZS90 动态光散射装置(英国 Malvern公司),实验清洗仪器和Milli-Q 纯水机(美国Millipore公司)。
1.2 实验材料
pBR322 DNA(4 361 bp)及5 000 bp DNA购自美国Thermo Fisher Scientific公司,λ-phage DNA (48 502 bp)、Tris(hydroxymethyl) aminomethane (TRIS)、(3-amino-propyl) Triethoxysilane (APTES, 纯度≥99 %)及DMSO(纯度≥99.8%)购自美国sigma公司,实验用的缓冲液为1 mmol/L TRIS-HCl(pH=7.5)缓冲液。
2 实验原理与方法
2.1 原子力显微镜
原子力显微镜是扫描探针显微镜中的一种,广泛地应用于生命科学领域,图2是原子力显微镜的工作原理图,原子力显微镜使用一根具有弹性的探针来测量针尖与样品间的相互作用力。实验中我们用到的是轻敲模式,轻敲模式具有相对接触模式侧向力更小、对样品影响更小等优点,所以非常适合对生物大分子、聚合物等软物质样品的成像。原子力探针在320 kHz的共振频率下驱动,成像过程中,云母表面以1.0 Hz的速率扫描。硅烷化云母片的主要优点是在待测溶液pH高达10的大范围内仍保持质子化(带正电),且不带二价阳离子,极大地提高了使用的灵活性,对样品产生的影响也非常小,其次硅烷化处理的云母片制备的样品能够在几个月内保持稳定。
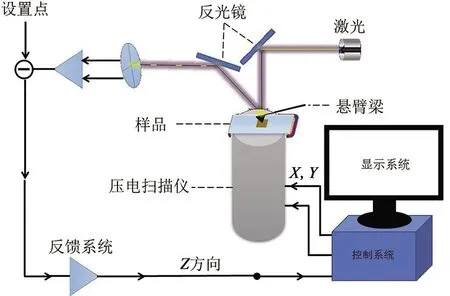
图2 原子力显微镜的工作原理图Fig.2 The fundamental diagram of atomic force microscopy
2.2 动态光散射

图3 动态光散射系统Fig.3 Dynamic light scattering system
测量纳米粒子直径的技术中,动态光散射具有快速、准确、可重复性好等优点,是最受欢迎的技术之一,本实验用到的动态光散射系统如图3所示。测量的基本原理是粒子在溶液中的布朗运动会引起光强的波动,且布朗运动的速度受粒子的大小和溶液黏度的影响,因此测量光强的波动随时间的变化,然后利用斯托克斯-爱因斯坦关系,由扩散系数d计算出粒径及其分布。
(1)
其中,kB是玻尔兹曼常数,T是温度,η是溶液的黏度,D是分子在溶液中的粒径。
2.3 样品制备
2.3.1 原子力显微镜样品制备
硅烷化云母片的主要优点是在待测溶液pH高达10的大范围内仍保持质子化(带正电),且不带二价阳离子,极大地提高了使用的灵活性,对样品产生的影响也非常小,其次硅烷化处理的云母片制备的样品能够在几个月内保持稳定,因此用经3-氨丙基三乙氧基硅烷(APTES)改性的云母作为基底制备原子力显微镜成像样品。样品的制备过程如下(图4):将云母切成约1 cm2的方形片并贴在载玻片上;在通风柜中通过蒸发体积分数4%的APTES溶液4 h,对新解离的云母表面进行APTES修饰;将处理过的云母片放入烘干箱中,在120 ℃下钝化云母表面30 min;使用Tris-HCl缓冲液(pH=7.5)配置不同体积分数的DMSO溶液,使用时取200 μL,加入DNA,最终待测溶液的DNA质量浓度为1 ng/μL,室温下在微型旋转仪上旋转30 min,使DNA与DMSO的反应充分且均匀;40 μL待测溶液沉积在经APTES处理的云母上,室温孵育3 min后除去多余溶液,目的是使DNA能够很好地固定在云母片上以保持形态不再发生变化,并避免其余步骤对成像结果的影响;最后,用约200 μL的去离子水冲洗样品,并用氮气吹干。为保证成像结果的准确性,每组实验至少进行了3次成像。
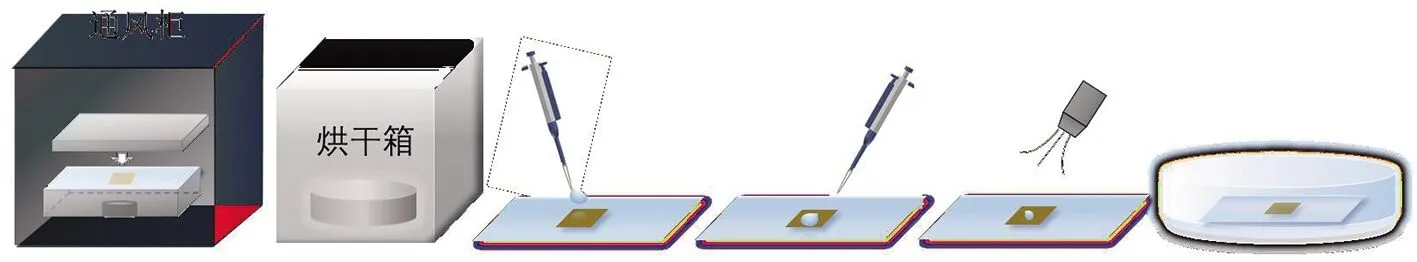
图4 原子力显微镜样品制备步骤示意图Fig.4 Sample preparation procedure for atomic force microscope
2.3.2 动态光散射样品制备
使用的待测液制备方法与原子力显微镜相同,25 ℃条件下进行待测液的测量,每次样品池中滴入40 μL的待测液,同一浓度的样品至少测量3次,每次3组以保证实验数据的准确性。
3 实验结果
3.1 原子力显微镜实验
通过原子力显微镜能够直接观察到DNA等生物大分子,因此为研究不同DMSO体积分数对DNA变性的形态及结构影响,首先利用原子力显微镜观察了不同DMSO体积分数对3种不同类型DNA的影响。
图5显示了云母表面环状质粒pBR322 DNA的原子力显微镜图像,作为对照组,我们首先在与DMSO相同的缓冲条件下单独成像DNA,图5(a)显示了DMSO体积分数为0时DNA的典型环状构象;图5(b)显示了DMSO体积分数为1%时的图像,DNA形态发生明显改变,首先,DNA双链更加柔软,其次,可以观察到由于变性产生的单链DNA坍塌而导致的局部小泡或扭结,此外,部分DNA形成超螺旋结构;当DMSO体积分数进一步增加至10%时,如图5(c)所示,可以观察到DNA分子产生了紧密的超螺旋结构。

图5 pBR322 DNA在不同DMSO体积分数下扫描的原子力显微镜图像Fig.5 AFM images of pBR322 plasmids at different volume fractions of DMSO
图6显示了5 000 bp线性DNA的原子力显微镜图像,其长度与质粒DNA相近。图6(a)显示了在DMSO体积分数为0时,可以观察到自然舒展的线状DNA形态;当DMSO体积分数增加至1%时,如图6(b)所示,DNA链交叉及重叠,形成小环及扭结;当DMSO体积分数进一步增加至10%时,如图6(c)所示,DNA分子结构更加紧凑,无法清晰地观察出其线状结构。

图6 5 000 bp DNA在不同DMSO体积分数下扫描的原子力显微镜图像Fig.6 AFM images of 5 000 bp DNA at different volume fractions of DMSO
图7显示了λ-DNA的原子力显微镜图像,图7(a)显示了DMSO体积分数0时DNA自由松散的形态;图7(b)显示了加入DMSO体积分数1%时,与5 000 bp线性DNA相似,DNA出现部分小环及扭结;当DMSO体积分数进一步增加至10%时,如图7(c)所示,DNA扭结更加明显,由于DNA较长,因此仍可观察出其线状结构。

图7 λ-DNA在不同DMSO体积分数下扫描的原子力显微镜图像Fig.7 AFM images of λ-DNA at different volume fractions of DMSO
3.2 动态光散射实验
由3.1节可见,DMSO还会使DNA的聚拢程度发生明显变化,而粒径大小能够更加准确且定量地反映DNA的聚拢程度,因此为验证并定量分析这一现象,使用动态光散射测量了不同DMSO浓度下三种类型DNA粒径的变化,实验结果如图8和图9所示。图8为DNA的粒径分布图,从图8中可以看出,随DMSO体积分数的增加,粒径的峰值逐渐左移;图9为DNA的平均粒径随DMSO体积分数的变化曲线,pBR322 DNA的平均粒径从未添加DMSO时的(474±10) nm变化至添加DMSO体积分数为10%时的(257±8) nm,5 000 bp DNA的粒径从(554±11) nm变化至(282±18) nm,λ-DNA的粒径从(871±17) nm变化至(449±21) nm。根据此实验结果可得,三种类型DNA的粒径都随DMSO体积分数的增加而减小,这与原子力显微镜观察到的结果对应,两种实验得出的结论有较好的一致性;三种类型DNA平均粒径的变化趋势大致相同,而由于λ-DNA的长度远大于pBR322 DNA及5 000 bp DNA长度,因此粒径也较大;pBR322 DNA与5 000 bp DNA长度相似,但环状DNA受到连接数的限制,更易收缩并形成超螺旋结构,因此粒径较5 000 bp DNA偏小。
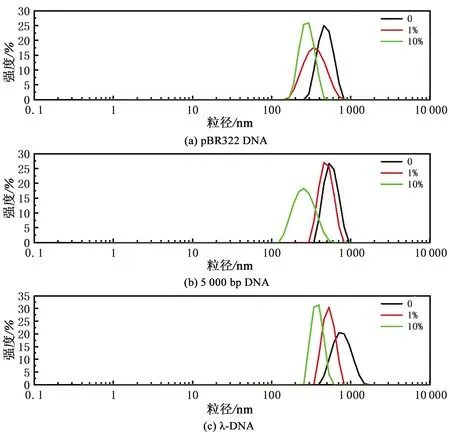
图8 不同DMSO体积分数下三种类型DNA的粒径分布Fig.8 The size distribution of DNA at different DMSO volume fractions
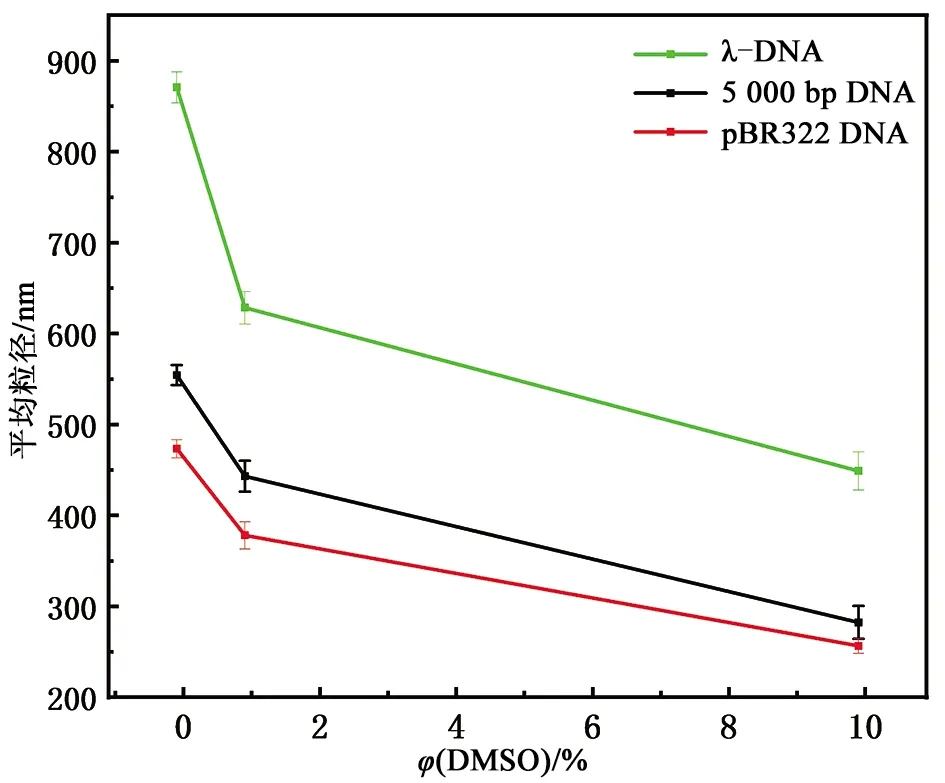
图9 pBR322 DNA、5 000 bp DNA及λ-DNA在不同DMSO体积分数下的平均粒径Fig.9 The average particle size of pBR322 DNA, 5 000 bp DNA, and λ-DNA at different volume fractions of DMSO
4 讨论与结论
4.1 结果讨论
利用原子力显微镜和动态光散射实验,首次观测到低体积分数DMSO对DNA的显著影响。首先,通过直接观察原子力显微镜图像可知低体积分数DMSO(1%)也能使DNA发生变性,且DMSO的变性能力会随体积分数增加而增强。DMSO的变性能力可以归因于DMSO亚砜官能团的强氢键接受性质和甲基的疏水性质:DMSO与鸟嘌呤碱基的胺基通过DMSO的氧基团与NH2的氢原子之间的氢键相互作用,破坏了DNA碱基配对的稳定性,使更多单链区域产生。
其次,观察到随DMSO体积分数的增加,DNA的构象发生显著变化,即逐渐产生超螺旋或扭结结构。这些现象可以根据以下原因得到合理地解释:一方面由于变性的单链会发生卷曲,使DNA看上去更加柔软;另一方面根据Călugăreanu-White-Fuller定理[23-24]:
Lk=Wr+Tw。
(2)
对于一个封闭的环状DNA分子,两条螺旋链连接在一起的次数,即DNA的连接数(Lk)是一个常数,只有通过破坏DNA骨架才能改变它。Wr为缠绕数或超螺旋数,是衡量DNA轴缠绕程度的指标,而Tw是扭转数,反映了DNA链相互之间的螺旋缠绕。因此,DMSO变性DNA产生的单链导致了DNA扭转数的减少,为保持连接数不变,DNA产生的扭转应力增强了超螺旋的形成,即增加了螺旋数,形成超螺旋结构。随着DMSO体积分数的增加,变性区域逐渐增多,DNA扭转数不断减小,螺旋数不断增加,因此使质粒DNA形成越来越紧密的超螺旋结构。而对于线性DNA,链的两端不能被认为是完全自由的,因此会产生小环及扭结结构。
最后,通过原子力显微镜的图像观察和动态光散射的测量结果,发现DNA的聚拢程度也随DMSO体积分数的增加而增加,这是由于质粒及线性DNA超螺旋及扭结结构的逐步形成,以及DNA单链区域的逐渐增加,且单链DNA的持久长度远小于双链DNA的持久长度,会使DNA的聚拢程度发生变化。
4.2 结论
本文通过单分子技术原子力显微镜和传统动态光散射结合,观测了低体积分数的DMSO致DNA变性引起的形貌结构及粒径的变化,较为系统地研究了低体积分数的DMSO致DNA变性的过程。结果表明即使DMSO体积分数1%也能诱导DNA发生局部变性;由于连接数的限制,DNA会形成DNA超螺旋及扭结结构;同时,由于超螺旋结构及单链的产生,DNA的聚拢程度会随DMSO体积分数的增加而增加。本研究可以为DNA变性的过程、DNA超螺旋结构在DNA代谢过程中的生理作用以及低体积分数的DMSO对DNA的影响等方面的研究提供新的视角及理论指导。
