鼠李糖乳杆菌LP216高密度发酵培养基优化
2022-06-22李盼盼张庆芳刘春莹迟乃玉
李盼盼,张庆芳,刘春莹,迟乃玉,
(1.大连大学 生命科学与技术学院,辽宁 大连 116622;2.辽宁省海洋微生物工程技术研究中心,辽宁 大连 116622)
鼠李糖乳杆菌(Lactobacillus rhamnosus)多存在于人和动物的肠道内[1],具有增强肠道屏障以及调节肠道菌群组成[2]、降糖[3]、降胆固醇[4]、保护肝脏[5]、辅助降血脂[6]、抑制关节疼痛[7]、提高机体免疫应答等功能[8]。以固体或液体形式应用于人和动物,在功能性食品和饮料(乳制品、非乳制品饮料、婴儿配方奶粉、谷物、肉类、面包)、膳食补充剂、饲料等领域应用广泛[9]。
新型冠状病毒导致人们的消费模式升级,并最终影响到消费者对饮食的需求。大多数消费者开始选择含有营养增强剂的产品以提高免疫力,从而增加了对益生菌的需求。在美国,益生菌类产品2020年的销量突然上升了33%。因此对益生菌进行高密度培养具有很高的科研和商业价值[10]。目前高密度培养菌株常用且最有效的方法依然是培养基发酵优化,常用的试验方法有单因素试验结合响应面法(response surface method,RSM)[11]。响应面法是通过建立连续变量曲面模型,对影响试验指标的各因子水平及其交互作用进行优化和评价,可快速有效的确定多因子系统的最佳条件[12]。郑柳青等[13]采用响应面优化法优化鼠李糖乳杆菌LR-ZB1107-01培养条件,在最优条件下,菌体浓度达9.08×109CFU/mL。
本实验室前期从西藏康马镇萨马达乡娟珊养殖区的健康耗牛乳和粪便中筛选得到一株鼠李糖乳杆菌(Lactobacillus rhamnosus)LP216。本研究对菌株LP216进行高密度培养,对MRS培养基成分的添加量进行单因素及响应面优化试验,得到发酵培养基最佳添加量,旨在满足鼠李糖LP216菌剂工业化生产需求,解决其产量不足等问题提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
鼠李糖乳杆菌(Lactobacillus rhamnosus)LP216:筛选自西藏康马镇萨马达乡娟珊养殖区的健康耗牛乳和粪便,保藏于辽宁省海洋微生物工程技术研究中心。
1.1.2 化学试剂
蛋白胨、酵母提取物、牛肉膏(均为生化试剂)、乙酸钠、硫酸镁、葡萄糖、柠檬酸二铵、磷酸氢二钾、硫酸锰(均为分析纯):北京索莱宝科技有限公司。
1.1.3 培养基
MRS液体培养基:蛋白胨10 g/L、酵母提取物5 g/L、乙酸钠(CH3COONa)1.0 g/L、硫酸镁(MgSO4·7H2O)0.2 g/L、吐温80 1.0 g/L、牛肉膏10.0 g/L、葡萄糖20 g/L、柠檬酸二铵2.0 g/L、磷酸氢二钾(K2HPO4)2.0 g/L、硫酸锰(MnSO4)0.05 g/L、初始pH 6.5。121 ℃灭菌20 min。
MRS固体培养基:MRS液体培养基中添加琼脂粉25 g/L。121 ℃灭菌20 min。
1.2 仪器与设备
LTI-700恒温培养箱:上海爱朗仪器有限公司;Multiskan GO酶标仪:赛默飞世尔科技(中国)有限公司;YXQ-LS-100S立式压力蒸汽灭菌锅:弗尔德(上海)仪器设备有限公司;SX-610 pH检测笔:上海三信仪表厂;1510紫外可见分光光度计:北京昊诺斯科技有限公司;ZWY-21020恒温振荡摇床:上海智城分析仪器制造有限公司。
1.3 方法
1.3.1 菌株LP216种子液的制备
挑选一环活化好的固体培养基保藏的单菌落接种在液体MRS中,35 ℃、160 r/min振荡培养24 h至光密度(optical density,OD600nm)值0.5~0.6,得到菌株LP216的种子液。
1.3.2 菌株LP216菌体密度和菌落总数检测
按照比浊法测定菌体密度,以OD600nm值表示;稀释琼脂平板计数法测定菌落总数[11]。
1.3.3 菌株LP216高密度发酵培养基优化[14-16]
(1)培养基优化单因素试验
蛋白胨添加量分别为0、5 g/L、10 g/L、15 g/L、20 g/L;牛肉膏添加量分别为0、5 g/L、10 g/L、15 g/L、20 g/L;酵母提取物添加量分别为0、5 g/L、10 g/L、15 g/L、20 g/L;葡萄糖添加量分别为10 g/L、15 g/L、20 g/L、25 g/L、30 g/L;CH3COONa添加量分别为3 g/L、4 g/L、5 g/L、6 g/L、7 g/L;吐温80添加量分别为0、0.5 g/L、1.0 g/L、1.5 g/L、2.0 g/L;MgSO4·7H2O添加量分别为0.10 g/L、0.15 g/L、0.20 g/L、0.25 g/L、0.3 g/L;柠檬酸二铵添加量分别为1.0 g/L、1.5 g/L、2.0 g/L、2.5 g/L、3.0 g/L;K2HPO4添加量分别为1.0 g/L、1.5 g/L、2.0 g/L、2.5 g/L、3.0 g/L;MnSO4添加量分别为0、0.05 g/L、0.10 g/L、0.15 g/L、0.20g/L、0.25 g/L;接种量3%、温度35 ℃条件静置培养48 h,检测菌体生长量(OD600nm值)。每组试验重复3次。
(2)Plackett-Burman试验设计
在单因素试验优化培养基的基础上,设置N=20的10因素2水平Plackett-Burman(PB)试验,PB试验设计见表1。

表1 Plackett-Burman试验设计因素与水平Table 1 Factors and levels of Plackett-Burman experiments design
(3)最陡爬坡试验
根据Plackett-Burman试验结果选择影响菌株LP216生长密度的3个主要因素,进行最陡爬坡试验,每组试验重复3次。
(4)Box-Behnken试验设计
根据PB试验和最陡爬坡试验结果,使用Design-Expert 8.0.6软件进行响应面试验设计,试验设计见表2,每组试验3个平行。

表2 Box-Behnken试验设计因素与水平Table 2 Factors and levels of Box-Behnken experiments design
1.3.4 菌株LP216生长曲线测定
菌株LP216生长曲线绘制:将待测鼠李糖乳杆菌LP216种子液转接到装液量为100 mL/250 mL MRS液体培养基中。摇匀后每支试管准确移入15 mL菌液,置于恒温振荡培养箱中按照优化后的发酵条件培养,每隔6 h取出一组试管测定其OD600nm值,稀释平板法测定活菌数,进行3组平行试验,绘制菌株LP216生长曲线。
1.3.5 数据处理
使用Graphpad prism软件7.0进行单因素数据分析,Minitab 15软件进行PB试验设计和结果分析;Design-Expert 8.0.6软件进行RSM试验设计和结果分析。响应面数据分析通常采用二次多项式回归模型。并且当满足以下标准时模型是拟合和可靠的:①模型显著(模型P值<0.05),②失拟项不显著(失拟项P值>0.05),③决定系数R2>0.9。
2 结果与分析
2.1 菌株LP216高密度发酵培养基优化单因素试验
以MRS培养基为对照,对培养基10种成分的添加量进行优化,结果见图1。

图1 发酵培养基中各组分添加量对菌株LP216生长的影响Fig.1 Effect of each component addition in fermentation medium on the growth of strain LP216
氮源为细胞生长提供氨基酸合成所需的营养物质,其添加量会影响鼠李糖乳杆菌LP216的生长[17]。由图1a可知,菌株LP216的生长量随着蛋白胨添加量在0~15 g/L范围内增加而增大;当蛋白胨添加量在15 g/L时,菌株LP216的生长量最大,OD600nm值为2.09;当蛋白胨添加量>15 g/L之后,菌株LP216的生长量随之下降。因此,蛋白胨最适添加量为15 g/L。
由图1b可知,菌株LP216的生长量随着牛肉膏添加量在0~5 g/L范围内增加而增大;当牛肉膏添加量为5 g/L时,菌株LP216生长量最大,OD600nm值为1.94;当牛肉膏添加量>5 g/L之后,菌株LP216的生长量随之下降。牛肉膏通过影响蛋白质的合成影响菌株的生长[9],因此,牛肉膏最适添加量为5 g/L。
由图1c可知,酵母提取物添加量在0~15 g/L时,菌株LP216的生长量随之增加;酵母提取物添加量在15 g/L时,菌株LP216的生长量最大,OD600nm值为2.13;当酵母提取物添加量>15 g/L之后,菌株LP216的生长量受到抑制。因为乳酸菌细胞酶系简单[18],酵母提取液过低时,营养物质不够菌株生长利用,MRS培养基是一个复合氮源培养基,酵母提取液过高时,可能会影响菌株对其他氮源的利用。因此,酵母提取物最适添加量为15 g/L。
由图1d可知,随着葡萄糖添加量在10~25 g/L范围内的增加,菌株LP216的生长量随之增加;当葡萄糖添加量为25 g/L时,菌株LP216的生长量最大,OD600nm值为2.20;当葡萄糖添加量>25 g/L之后,菌株LP216的生长量随之下降。因为改变葡萄糖的添加量,会改变培养基的碳氮比[19]。培养基中碳氮比过低,菌株生长过快,会发生提前自溶的现象;碳氮比过高会使培养基过快酸化,从而导致菌体过早死亡,同样不利于菌体LP216生长繁殖。因此,葡萄糖最适添加量为25 g/L。
由图1e可知,菌株LP216生长量随着CH3COONa添加量在3~4 g/L范围内的增加而增大;当CH3COONa添加量为4 g/L时,菌株LP216生长量最大,OD600nm值为1.95;当CH3COONa>4 g/L之后,菌株LP216的生长量随之下降。因此,CH3COONa的最适添加量为4 g/L。
由图1f可知,菌株LP216的生长量随着吐温80添加量在0~1.5 g/L范围内的增加而增大;当吐温80添加量为1.5 g/L时,菌株LP216生长量最大,OD600nm值为2.05;当吐温80添加量>1.5 g/L之后,菌株LP216生长量随之下降。因为吐温80作为亲水的表面活性剂,其添加量改变会影响菌株对自身生长所需的营养物质的吸收。因此,吐温80的最适添加量为1.5 g/L。
由图1g可知,当MgSO4·7H2O添加量在0.10~0.25 g/L时,菌株LP216生长量随之增长;当MgSO4·7H2O为0.25 g/L时,菌株LP216生长量最大,OD600nm值为2.06;MgSO4·7H2O>0.25 g/L之后,菌株LP216生长量随之减小。因为适量Mg2+在发酵过程会被菌体利用促进细胞转录水平,过量时会抑制细胞转录水平从而抑制菌株的生长。因此,MgSO4·7H2O的最适添加量为0.25 g/L。
由图1h可知,柠檬酸二胺添加量在1.0~2.0 g/L时,菌株LP216生长量随之增加;当柠檬酸二胺添加量为2.0 g/L时,菌株LP216生长量最大,OD600nm值为1.95;当柠檬酸二胺添加量>2.0 g/L之后,菌株LP216生长量随之下降。因为柠檬酸氢二胺为缓冲盐,缓冲盐与菌株LP216生长过程中产生的乳酸结合,生成乳酸盐从而降低或消除乳酸对菌体生长繁殖的抑制作用[20]。因此,柠檬酸氢二胺的最适添加量为2.0 g/L。
由图1i可知,当K2HPO4添加量为1~2 g/L时,菌株LP216生长量随之增加;当K2HPO4添加量为2 g/L,菌株LP216生长量最大,OD600nm值为1.95;当K2HPO4添加量>2 g/L之后,菌株LP216生长量随之下降。乳酸菌发酵过程中产生某些有机酸(乳酸、乙酸等),发酵过程中pH值会逐渐降低。K2HPO4作为缓冲剂,可以在菌株发酵过程中调节培养基的pH,在发酵过程中维持适宜的pH对菌株的生长十分有利。因此,K2HPO4的最适添加量为2 g/L。
由图1j可知,菌株LP216生长量随着MnSO4的添加量在0~0.2 g/L范围内增加而增大;当MnSO4添加量为0.2 g/L,菌体生长量最大,OD600nm值为2.2;当K2HPO4添加量>0.2 g/L之后,菌株LP216生长量随之下降。金属离子会通过影响酶活性,进而影响细胞生长。因此,MnSO4的最适添加量为0.2 g/L。
2.2 Plackett-Burman试验设计
根据表1影响细菌发酵的各因素和水平,采用Minitab 15软件设置N=20的Plackett-Burman试验,发酵48 h后测其OD600nm值,每组试验3个平行,结果见表3,Plackett-Burman试验回归分析见表4。
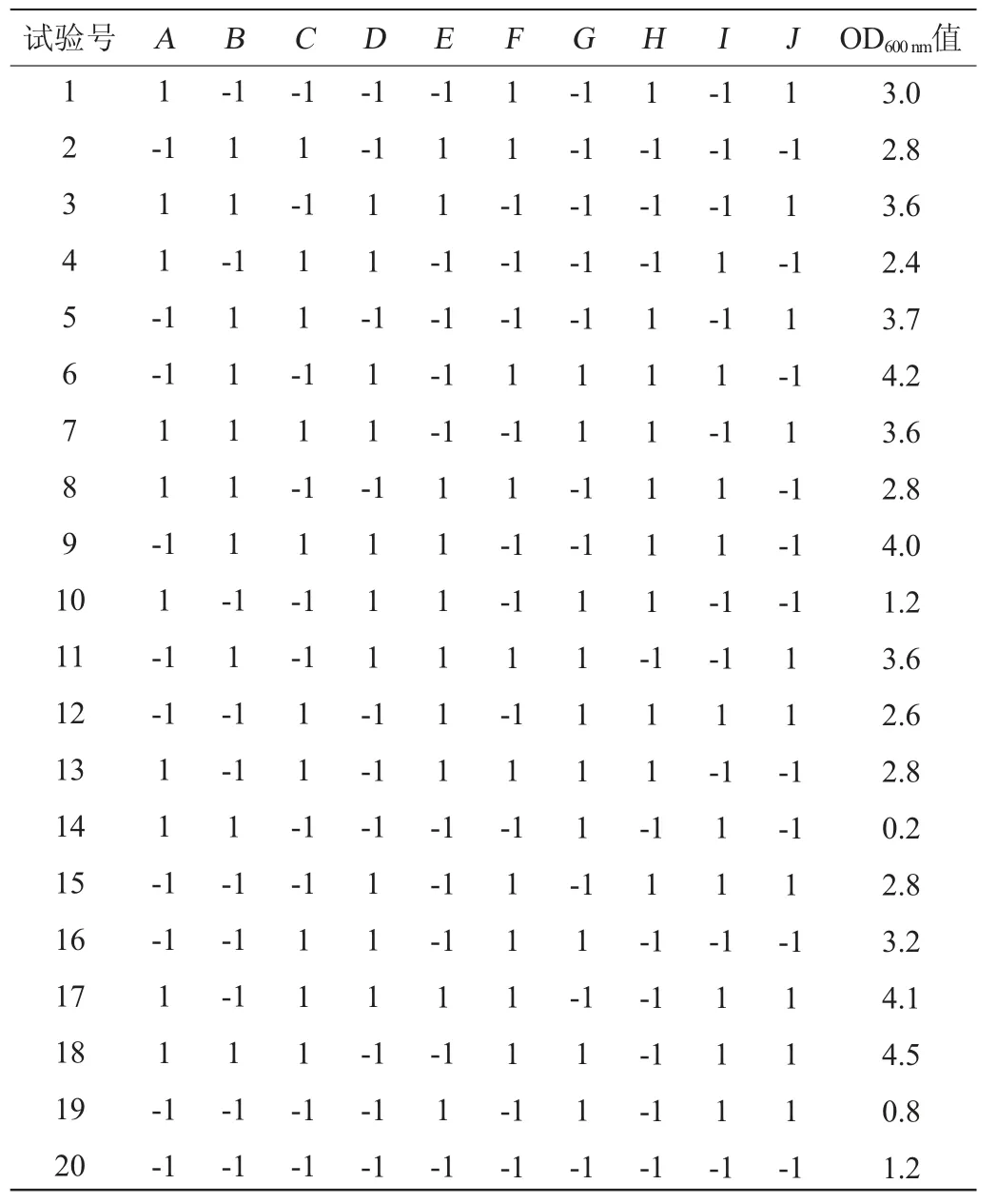
表3 Plackett-Burman试验设计及结果Table 3 Design and results of Plackett-Burman experiments

表4 Plackett-Burman试验回归分析Table 4 Regression analysis of Plackett-Burman experiments
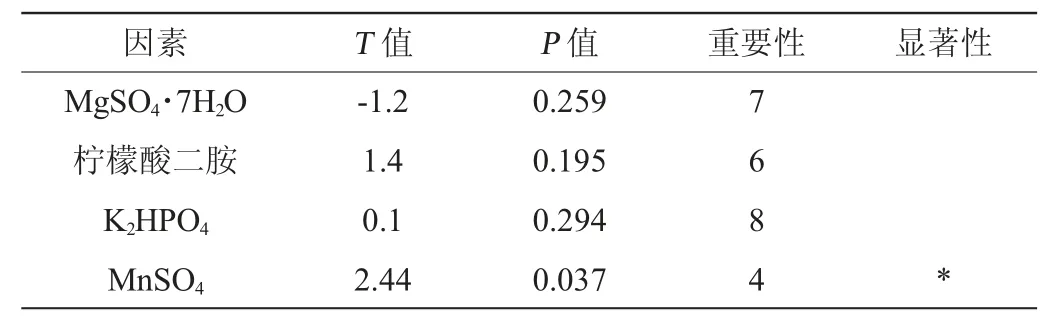
续表
由表4可知,酵母提取物、蛋白胨、葡萄糖、MnSO4、吐温80添加量对菌株LP216生长量的影响达到显著水平(P<0.05),其中酵母提取物、蛋白胨、葡萄糖这3个因素的影响效果最为显著,因此选这3个因素进行最陡爬坡试验。
2.3 最陡爬坡试验
最陡爬坡试验可以快速确定最佳中心点,结果见表5。由表5可知,3个显著影响因素的最佳组合因子在第3 组试验附近,因此,以第3组的数据作为响应面试验的中心点,即酵母提取物添加量(X1)、蛋白胨添加量(X2)、葡萄糖添加量(X3)分别为16 g/L、13 g/L、30 g/L。
2.4 响应面试验优化设计
根据最陡爬坡试验结果,运用Design-Expert.V8.0.5b软件以酵母提取物添加量(X1)、蛋白胨添加量(X2)、葡萄糖添加量(X3)为自变量,以菌株LP216生长量(Y)为响应值,设计N=17的3因素3水平的响应面优化试验,每组试验重复3次,Box-Behnken试验结果见表6,方差分析见表7。
利用Design-Expert 8.0.6软件对表6试验结果进行分析,得到二次多项回归方程:

表6 Box-Behnken试验设计及结果Table 6 Design and results of Box-Behnken experiments
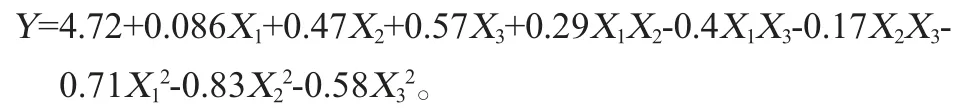
由表7可知,该回归方程模型P<0.01,表示对结果影响极显著;失拟项P=0.135 3>0.1证明该模型拟合较好,对本试验的优化分析有意义[21-22];回归方程决定系数R2=0.969 5>0.9,校正决定系数R2Adj=0.930 4>0.9,信噪比>4,说明试验误差较小,模型相关性较好[23-25]。该模型一次项X2、X3,交互项X2X3,二次项X22、X32对结果影响极显著(P<0.01);交互项X1X2、X1X3对结果影响显著(P<0.05)。

表7 回归模型方差分析Table 7 Variance analysis of regression model
通过回归方程分析,得到最佳酵母提取物添加量X1、蛋白胨添加量X2、葡萄糖添加量X3分别为16.25 g/L、13.42 g/L、30.28 g/L时,菌株LP216生长量理论OD600nm值为4.83。根据实际试验操作情况,将最优培养基组分调整为酵母粉添加量16 g/L、蛋白胨添加量13 g/L、葡萄糖添加量30 g/L。在此最优培养基组分条件下,进行3组平行验证试验,菌株LP216生长量实际OD600nm值为4.85,与响应面优化试验的理论值相近,证明该响应面优化模型可行。
2.5 菌株LP216生长曲线的测定
由图2可知,优化培养基及发酵条件后菌株LP216,发酵时间0~18 h为延滞期,相比对照组优化前活菌数延滞期缩短了6 h;发酵时间18~32 h为指数增长期;发酵时间32~42 h为平稳期。在优化后培养基组分中培养42 h后,菌株LP216的最大菌体数达到8.9×109CFU/mL,是优化前活菌数的2.71倍,证明本试验提高了发酵效率。
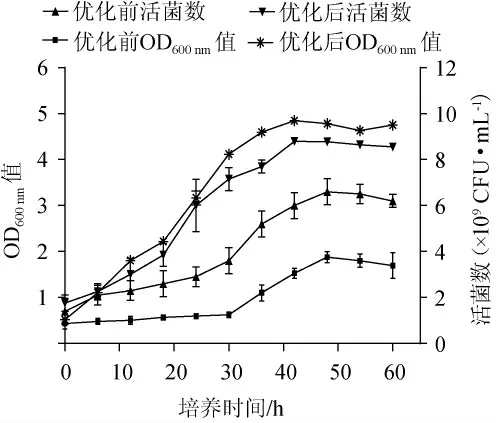
图2 菌株LP216的生长曲线Fig.2 Growth curve of strain LP216
3 结论
本研究通过对菌株LP21培养基组分进行单因素及响应面试验优化培养基为酵母粉16 g/L、蛋白胨13 g/L、葡萄糖30 g/L、牛肉膏5 g/L、CH3COONa 4 g/L、吐温80 1.5 g/L、MgSO4·7H2O 0.25 g/L、柠檬酸二胺2.0 g/L、K2HPO42.0 g/L、MnSO40.2 g/L在此优化条件下,菌株LP21活菌数达8.9×109CFU/mL,是未优化MRS培养基的2.71倍。本研究进行高密度菌株LP216发酵优化,提高了发酵效率,为后续的鼠李糖乳酸菌产品的工业化发展提供参考。
