不同紫细菌外周捕光复合体的特征比较
2022-06-20岳慧英杨素萍赵春贵
岳慧英,杨素萍,赵春贵
(1.山西中医药大学 基础医学院,晋中 030619;2.华侨大学 生物工程与技术系,厦门 361021)
紫细菌的光合单元是由一系列定位在内质膜上的色素蛋白复合体(Pigment protein complex,PPC)所构成,光合作用过程是外周捕光复合体(Light-harvesting complex 2,LH2,也称 B800-850)吸收光能,再经核心捕光复合体(LH1)传递到反应中心(Reaction center,RC)完成光化学反应[1]。紫细菌光合单元结构简单,是阐明光合作用机理的良好模型,但目前仅报道有3种紫细菌的LH2晶体结构,分别是Rhodopseudomonasacidophila(2.0 Å)[2]、Phaeospirillummolischianum(2.4 Å)[3]和Ectothiorhodospirahaloalkaliphila(3.4 Å)[4]。相对紫细菌物种数量而言,LH2结构学的报道只是冰山一角,远不如RC研究深入,这可能与不同紫细菌LH2的多样性有关,例如编码LH2蛋白基因(pucBA)序列和拷贝数的多样性、类胡萝卜素组成的多样性,这增加了结构均一的LH2纯化和结晶难度。目前,有关LH2分离纯化、光谱特征、色素组成、能量传递效率、稳定性、环境适应性机制等研究报道较多[5-7],尤其阐明了异常光谱LH2(例如LH3和LH4)形成机制和环境调控机制,紫细菌为更好适应生存环境,往往通过合成不同光谱类型的LH2来调控其光合生长,即使是同一菌株,其LH2的合成受环境因素调控也表现出不同的光谱类型和能量传递活性[6]。
研究LH2的结构、功能和性质,首先要纯化LH2。PPC是膜整合蛋白,因此LH2的制备首先使用去垢剂将其从内质膜上解离下来,然后再用盐析、蔗糖密度梯度离心或差速离心等方法进行粗分离,离子交换层析法和分子筛细分离,但不同文献使用的去垢剂种类、浓度和增溶时间、盐析浓度、离子交换层析洗脱盐度均存在差异,即使同一物种,其分离条件也不相同。引起这种差异的原因,至今尚不明确,这可能与不同菌种(株)中的LH2结构特征不同有关。Brotosudarmo等[8]曾用分子筛方法比较了不同物种的LH2分子大小,但有关表面电荷、疏水性、与内质膜结合能力等特征的比较研究未见报道。Rhodobacter(Rba.)和Rhodopseudomonas(Rps.)以及LDAO是LH2研究常用物种和去垢剂[9-11],因此,本文选用Rba.azotoformansR7和Rps.palustrisCQV97菌株,研究比较了去垢剂LDAO增溶时间、盐析浓度和NaCl洗脱梯度,对2种不同物种的2种不同类型LH2与内质膜结合能力强弱、表面电荷及疏水性等特征。另外,CQV97 类胡萝卜素(Car)构象对LH2能量传递效率的影响未见报道,进一步探求了纯化LH2吸收光谱、Car组分、构象与能量传递效率之间的关系。研究为不同种属LH2特征分析提供了一种方法,也有助于了解不同紫细菌LH2结构信息及其环境适应性机制。
1 材料和方法
1.1 主要仪器和试剂
紫外可见分光光度计(UV-3200,MAPADA);高效液相色谱仪(CTO-20A,Shimadzu);LC/MS(1200 series,Agilent Technology);自动蛋白核酸纯化仪(KTA purifier 100,GE Healthcare);稳态瞬态荧光仪(FLS920,Edinburgh);共聚焦拉曼光谱仪(InVia,Renishow);十二烷基二甲基氧化胺(LDAO,Fluka);DEAE-32(Whatman);甲醇、丙酮和乙腈为色谱纯试剂,其他试剂均为国产分析纯。
1.2 菌株及培养条件
Rps.palustrisCQV97菌株和Rba.azotoformansR7菌株,GenBank登录号分别为EU882154和EU604757。按照文献[6,11]方法配置培养基,于30 ℃、3 000 lx光照厌氧静置培养, 对数后期收获菌体。
1.3 LH2的制备
LH2的制备采用硫酸铵分级分离结合DEAE-32阴离子交换层析法[12]。在KTA蛋白核酸纯化仪上进行分子筛层析,层析柱为Sephacryl S-200(2.6 cm×125 cm,GE Healthcare),以pH 8.0 TL(10 mmol/L Tris-HCl,体积分数为0.1%,LDAO)缓冲液作为洗脱液,流速为0.5 mL/min,检测波长为280、380 和480 nm。
1.4 SDS-PAGE
采用Bradford方法进行蛋白质的定量。利用吸收光谱和SDS-PAGE进行LH2纯度鉴定[12]。
1.5 Car色素组分分析
-80 ℃真空冷冻干燥LH2,用丙酮∶甲醇(体积比为7∶2)抽提其中光合色素,离心收集上清液,残余物继续加入提取剂重复上述抽提过程,合并提取液,氮气吹干,用色谱纯甲醇溶解,膜过滤,用HPLC进行色素组分分析。
HPLC测定采用反向C18柱(Shim-pack VP-ODS, 150 mm×4.6 mm,Shimadzu),柱温25 ℃,流动相为甲醇∶乙腈水溶液(体积比为95∶5),流速0.7 mL/min,DAD检测器检测范围为190~800 nm,检测波长为475 nm。LC/MS法测定分子量,LC条件:柱温30 ℃,等度洗脱,流速0.8 mL/min。MS条件:采用正离子模式,毛细管电压5 500 ev,干燥气流速12 L/min,干燥气温度350 ℃,雾化器压力207 kPa,扫描范围200~1 200 m/z。
1.6 光谱测定
在TL缓冲液中,室温测定样品的吸收光谱、荧光光谱和共聚焦拉曼光谱,测定方法参照文献[13]进行。
2 结果与分析
2.1 分离纯化特征比较
两种LH2分离纯化条件比较结果见表1。破细胞壁后上清液用体积分数为1%的LDAO增溶,增溶使溶液浊度逐渐下降,280 nm蛋白特征峰显现,各色素吸收峰逐渐增强,表明色素蛋白复合体(PPC)与内质膜分离。R7和CQV97破壁上清液分别增溶2 h和12 h,BChl Qy带不再增强,表明R7中LH2(A-LH2)与内质膜结合弱,而CQV97中LH2(P-LH2)和内质膜结合较强。增溶上清液经40%、60%和80%(mg/mL)硫酸铵分级分离,获得3个盐析组分,OD800测定结果显示,R7中各盐析组分分别约占PPC总量的29.7%、55.6%和14.7%,根据吸收光谱判断A-LH2主要集中在40%~60%(mg/mL)盐析组分中;CQV97中各盐析组分分别占PPC总量的12.7%、26.7%和60.6%,P-LH2主要集中在60%~80%(mg/mL)盐析组分中,表明两种LH2的表面电荷和亲水程度不同,A-LH2所带电荷少和疏水性强,P-LH2所带电荷较多且亲水性强。分别针对上述两个富含LH2的盐析组分进行DEAE-32阴离子交换层析进一步分离纯化,A-LH2集中在较高的NaCl洗脱梯度,表明其表面所带负电荷数量较多。经离子交换层析获得的LH2进一步进行分子筛层析,结果见图1,A-LH2和P-LH2的洗脱体积分别为37.15 和37.83 mL,较小的洗脱体积暗示了A-LH2复合物的分子半径略大于P-LH2。

表1 两种紫细菌中LH2的分离纯化条件比较

图1 A-LH2(a)和P-LH2(b)的分子筛层析
2.2 吸收光谱测定
两种LH2的吸收光谱如图2所示。A-LH2具有典型的376、590、798和848 nm BChla吸收峰,以及典型的455、488和512 nm Car吸收峰,与文献[14]Rhodobacter属中LH2的吸收光谱相似,A798/A848也在0.65±0.03范围内。P-LH2具有376、590、803和855 nm BChla吸收峰,以及典型的480、510和531 nm Car吸收峰,与文献[6]Rhodopseudomonas属中LH2的吸收光谱相似,A803/A855约为0.93。比较吸收光谱可以判断两种LH2的主要差异有:(1)P-LH2中Qy带发生了5~7 nm红移,A800/A850比值不同;(2)Car特征峰不同,在A-LH2中为球形烯系Car,在P-LH2中为螺菌黄质系Car,Car组成需要进一步分析。

图2 纯化的A-LH2(a)和P-LH2(b)吸收光谱
2.3 SDS-PAGE
两种纯化LH2的SDS-PAGE,见图3。结果表明:P-LH2具有两条电泳条带,分子质量分别为6 ku和10 ku,对应Rps.palustrisLH2中的α和β多肽[6]。A-LH2呈现1条电泳条带,分子质量约为6 ku,与文献报道LH2分子质量约为6 ku的LH2的α和β两个亚基相对应[15]。电泳图谱中除了LH2的α和β多肽之外没有多余蛋白条带出现,表明两种LH2都达到了电泳纯。

L1: A-LH2;L2: P-LH2;L3: Marker。
2.4 Car色素组分分析
A-LH2和P-LH2中色素提取液的HPLC洗脱曲线如图4所示,A-LH2主要含有1个Car组分,H1;P-LH2主要含有4个Car组分,H2-H5。依据二极管阵列检测器(DAD)检测的吸收光谱(未显示)及特征吸收峰(表2)分析,这5个洗脱峰中包含5种Car组分,采用LC-MS对5种不同的Car组分进行分子量测定,结果见表2。依据两个菌株的色素代谢途径、保留时间、特征吸收峰和MS数据等综合分析,表明洗脱峰H1至H5分别为球形烯(spheroidene,共轭双键N=10)、3,4-双脱氢玫红品(3,4-didehydrorhodopin,N=12)、玫红品(rhodopin,N=11)、脱水紫菌红醇(anhydrorhodovibrin,N=12)和番茄红素(lycopene,N=11)。厌氧条件下Rba.sphaeroides2.4.1 LH2中Car以球形烯为主,同时含有球形烯酮和链孢红素[16],而本文A-LH2中只含有单一Car,简单的Car组分对进一步开展球形烯在LH2中的光化学活性研究具有重要价值。在Rps.palustris2.1.6中LH2积累4种Car,螺菌黄质含量约占Car总量的60%[17],而本文P-LH2中3,4-双脱氢玫红品为主要Car,根据HPLC洗脱峰面积估算含量高达约46.5%,这可能与碳源调控Car合成有关,Rps.palustris2.1.6菌株采用琥珀酸钠为碳源,CQV97则以乙酸钠为碳源。

图4 纯化A-LH2(a)和 P-LH2(b)的类胡萝卜素组成分析

表2 LH2中Car色素组分的HPLC分析和分子量测定
2.5 能量传递活性的测定
纯化LH2的吸收光谱和荧光激发光谱在BChl Qx带(590 nm)归一化处理,如图5所示。根据Cogdell的方法[18],通过计算Car吸收峰值与激发峰值峰值比率的平均值,即求得LH2分子中Car到BChl的单线态能量传递效率,A-LH2和P-LH2中分别为78.7%和55.3%,在A-LH2中的能量传递效率比在P-LH2中的高。
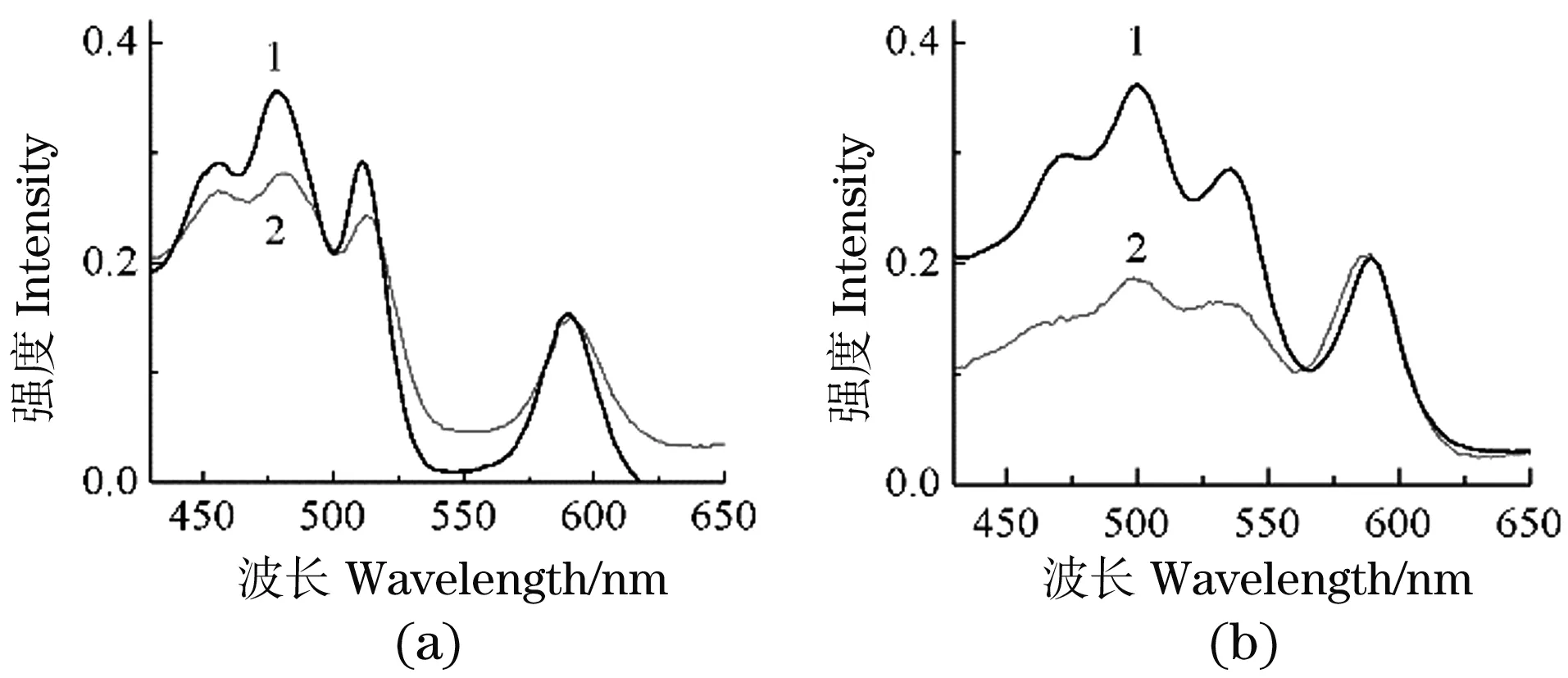
(a)A-LH2;(b)P-LH2。1:吸收光谱;2:荧光激发光谱。
2.6 Car构象分析
PPC中Car与蛋白亚基结合可以产生强的拉曼信号,这些拉曼信号可反映出Car的结构和构象[19-20]。LH2中ν1谱带反映Car共轭体系的大小,Car的共轭体系增大,ν1谱带向低波数方向移动[19]。ν4谱带与Car和αβ多肽的相互作用有关,若Car呈平面构象,ν4谱带较弱,若呈扭曲构象,则信号增强[21]。图6所示为两种LH2的室温拉曼光谱,与A-LH2相比,P-LH2中ν1谱带从1 515 cm-1移动至1 506 cm-1,表明P-LH2的Car具有相对大的π-电子共轭体系,与Car组分的分析结果一致。ν4谱带强度较高,表明P-LH2中Car呈扭曲构象,而A-LH2结合的Car则呈平面构象。

图6 室温下A-LH2(a)和P-LH2(b)的共聚焦拉曼光谱
3 讨论
目前文献将PPC从膜上解离下来的去垢剂主要包括LDAO、OG、β-OG、LDS、DodM等,不同菌种(株)使用的去垢剂种类、浓度和增溶时间也不一样,这预示着不同物种LH2与内质膜结合力存在差异。如果选择相同去垢剂类型和使用浓度,则增溶时间的差异应该能够反映PPC和膜结合程度的差异。目前分离纯化LH2的目的只是为了制备LH2样品,并没有阐明不同菌种(株)中LH2与内质膜结合能力、表面电荷和疏水性等特征的差异。本文特色是通过增溶时间、盐析浓度和离子交换层析洗脱盐度比较分析了Rba.azotoformansR7和Rps.palustrisCQV97 LH2性质的差异,为紫细菌LH2性质分析提供了方法和研究思路。
在相同浓度LDAO(体积分数为1%)下,比较了LH2增溶时间。与P-LH2相比,A-LH2增溶时间短(2 h),表明A-LH2与膜脂分子的相互作用较弱。中性盐硫酸铵常用于蛋白质盐析分离,通常高浓度硫酸铵能将PPC全部沉淀下来,再进行LH2的精制。采用40%、60%和80%(mg/mL)硫酸铵进行PPC的分级分离,获得了PPC的不同组分。A-LH2富含在较低浓度(40%~60%,mg/mL)的盐析组分中,而P-LH2则富含在较高浓度(60%~80%,mg/mL)的盐析组分中,说明A-LH2疏水性较强,易于盐析沉淀。DEAE离子交换层析是根据蛋白表面负电荷数量进行蛋白分离,A-LH2的洗脱盐度为0.15~0.2 mol/L NaCl,而P-LH2则在较低盐度(0.05~0.1 mol/L NaCl)被洗脱,表明A-LH2表面负电荷较多,而P-LH2表面负电荷较少。此方法可用于紫细菌LH2表面电荷、疏水性和膜结合能力等性质的比较分析,这种方法是否具有普适性有待更多菌株的验证,尤其是性质相近的LH2。
不同Rps.palustris菌株LH2含有5种或8种Car组分,主要Car组分为玫红品[20,22]。研究表明,P-LH2含有4种Car,其中,3,4-双脱氢玫红品(共轭长度N=12)为主要组分,这与文献[20]和[22]报道的不同。另P-LH2中的Car以卷曲构象方式与LH2结合,且Car到BChl的能量传递效率为55.3%。这与文献[20]报道相吻合。光照厌氧条件下,Rhodobactersphaeroides2.4.1的LH2主要组分Car是球形烯,也含有球形烯酮和链孢红素等[16]。结果表明,A-LH2只检测到球形烯Car,这与文献[16]报道不同。单一Car组分的LH2光化学活性的研究更有利于解析Car种类LH2能量传递活性和光保护作用。普遍认为短共轭双键的Car和平面构象有利于LH2中Car到BChl的能量传递[20]。拉曼分析显示出A-LH2中Car的共轭长度低于P-LH2中Car的共轭长度,这与Car组分分析结果相一致。A-LH2 Car为平面构象,能量传递效率相对较高,而P-LH2中Car为卷曲构象,能量传递效率相对较低,这与文献[20]报道规律一致。分子筛层析表明,LH2分子半径大小顺序为Rhodospirullummolishianum(8聚体)
