高温胁迫下萝卜苗期的转录组分析
2022-06-15周娜郑阳陆景伟胡燕陶伟林雷开荣潘晓雪
周娜 郑阳 陆景伟 胡燕 陶伟林 雷开荣 潘晓雪


摘要:【目的】對高温胁迫下萝卜幼苗进行转录组测序分析,筛选不同耐热性萝卜品种间的差异表达基因,为阐明萝卜幼苗响应高温胁迫的分子机制提供理论参考。【方法】以耐热萝卜品种1116T和热敏感萝卜品种Wr129为对象,对其进行高温(40 ℃)胁迫处理0(常温,对照)和24 h,提取各时间点样品总RNA进行转录组测序,以|log2Fold Change|≥1,P<0.05且TPM≥10为标准,筛选出差异表达基因(DEGs),并进行GO功能注释和KEGG代谢通路富集分析。【结果】随着高温胁迫时间的增加,Wr129和1116T幼苗茎叶逐渐发生萎蔫,胁迫24 h后Wr129叶片萎蔫下垂且干枯变黄,而1116T叶片轻度萎蔫下垂,仍保持绿色。12个文库共获得81.45 Gb Clean data,平均有62.30%的reads比对到萝卜参考基因组的一个位置。从2个不同耐热性品种中共鉴定到2701个差异表达基因。GO功能注释结果显示,2629个差异表达基因在GO数据库中得到注释,其中,有559个差异表达基因被注释为细胞组分类别中的叶绿体被膜、叶绿体基质和叶绿体类囊体3个条目,470个差异表达基因被注释为与胁迫响应相关的生物学过程。KEGG代谢通路富集结果显示,1166个差异表达基因富集到124条代谢通路,其中,有74个差异表达基因富集到光合作用和光合作用-天线蛋白代谢通路,23个基因富集到卟啉和叶绿素代谢通路,大部分基因在高温胁迫下被诱导;35个差异表达基因富集到谷胱甘肽代谢途径,其中14个谷胱甘肽-S-转移酶基因(GSTs)在高温胁迫下上调表达。高温胁迫24 h,Wr129和1116T幼苗叶片PSII的最大光化学效率(Fv/Fm)和总叶绿素含量均下降,但1116T的下降幅度较小。【结论】Wr129和1116T的耐热性存在明显差异,其原因是1116T植株可通过调控光合作用和抗氧化系统相关基因的表达,减缓Fv/Fm和叶绿素含量下降速率,从而提高植株对高温胁迫的耐受能力。
关键词: 萝卜;高温胁迫;转录组;耐热性;光合作用;谷胱甘肽代谢
中图分类号: S631.103.6 文献标志码: A 文章编号:2095-1191(2022)03-0665-11
Transcriptome analysis of Raphanus sativus seedlings in response to high temperature stress
ZHOU Na ZHENG Yang LU Jing-wei HU Yan TAO Wei-lin LEI Kai-rong PAN Xiao-xue
(1Vegetable and Flower Research Institute,Chongqing Academy of Agricultural Sciences,Chongqing 401329, China;
2Biotechnology Research Institute, Chongqing Academy of Agricultural Sciences/Municipal-level Key
Laboratory of Adversity Agriculture in Chongqing, Chongqing 401329, China)
Abstract:【Objective】To investigate the difference of gene expression in Raphanus sativus seedlings responding to the high temperature through transcriptome sequencing analysis,so as to provide theoretical basis for the molecular mechanism of tolerance to heat stress in R. sativus. 【Method】The heat-resistant radish variety 1116T and heat-sensitive radish variety Wr129 were treated with high temperature (40 ℃) stress for 0 (room temperature, control) and 24 h. The total RNA of samples at each time point was extracted for transcriptome sequencing. Taking | log2 Fold Change |≥1, P<0.05 and TPM≥10 as the standard, the differentially expressed genes (DEGs) were screened, and GO function and KEGG metabolic pathway enrichment analysis were performed. 【Result】With the increase of heat stress time,the stems and leaves of Wr129 and 1116T seedlings gradually wilted. After 24 h of stress,the leaves of Wr129 wilted, drooped and became dry and yellow,while the leaves of 1116T were slightly wilted, drooped and remained green. A total of 81.45 Gb clean data were obtained from 12 libraries,and on average of 62.30% of the reads were mapped to the reference genome. In total,2701 DEGs were screened. Through GO functional annotation analysis,2629 DEGs were annotated in the GO database,of which 559 DEGs were enriched to three items of chloroplast envelope,chloroplast stroma and chloroplast thylakoid in cellular component categories,and 470 DEGs were annotated as related to stress response in biological process. KEGG metabolic pathway enrichment showed that 1166 DEGs were annotated into 124 metabolic pathways,of which 74 DEGs were enriched in photosynthetic pathway and the photosynthesis-antenna protein pathway,23 DEGs were enriched in the porphyrin and chlorophyll metabolic pathway,and most genes were induced under heat stress. While 35 DEGs involved in the glutathione metabolism pathway,and 14 glutathione-S-transferase genes(GSTs) up-regulated in this pathway. The maximum photochemical efficiency (Fv/Fm) and total chlorophyll content of PSII in leaves of Wr129 and 1116T seedlings decreased under high temperature stress for 24 h, but the decrease of 1116T was small. 【Conclusion】The heat tolerance of Wr129 and 1116T is obviously different,because 1116T can improve its heat resistance by the regulation of metabolic process relating to antioxidant and photosynthetic systems and slow the Fv/Fmvalue and chlorophyll content rate.0C38D6C5-CCD8-4036-9CA4-D1323DE818F9
Key words: Raphanus sativus; heat stress; transcriptome; heat tolerance; photosynthesis; glutathione metabolism
Foundation items: Special Fund Project for Construction of National Modern Agricultural Industry Technology System(CARS-25); Technology Innovation and Application Development Program of Chongqing(cstc2019jscx-gksbX0143)
0 引言
【研究意义】随着全球气候变暖,夏季极端高溫天气的出现频率和持续时间增加,高温已成为制约作物生长和造成蔬菜生产减产的最主要因素之一(郭仰东等,2018)。萝卜(Raphanus sativus L.)为十字花科萝卜属一、二年生根菜类蔬菜,因具有高产稳产、适应性强、营养丰富等特点,在我国广泛种植(Kitashiba et al.,2014)。但萝卜喜冷凉气候,最适生长温度为5~25 ℃,当温度超过30 ℃时,会减缓萝卜幼苗的生长速度,甚至死苗,严重制约了萝卜的优质生产与均衡供应(初敏等,2014)。因此,研究萝卜幼苗在高温胁迫下的分子机制,对萝卜优良基因资源的挖掘及耐热的萝卜新品种培育具有重要意义。【前人研究进展】高温不仅对植物造成明显的外部损伤,还会损害叶绿体结构、破坏光合系统、诱导细胞内活性氧(Reactive oxygen species,ROS)积累、损伤细胞膜系统、引起代谢功能和生理过程发生紊乱等,从而影响植物的生长和产量形成,甚至造成植株死亡(Higashi et al.,2015;Li et al.,2018;Zhao et al.,2020)。为适应高温胁迫,植物则通过一系列被动的改变来缓解高温热害,如降低叶绿素总含量(Mathur et al.,2014)、积累渗透调节物质(Wang et al.,2018)、产生抗氧化酶和抗氧化剂来清除 ROS对细胞的伤害(梁国旺等,2020)。Sheng等(2006)研究发现,高温胁迫下草坪草中的抗坏血酸(Ascorbate,AsA)和谷胱甘肽(Glutathione,GSH)含量显著高于对照(未高温处理),表明高温胁迫下草坪草可通过调控抗氧化剂的含量从而维持细胞内氧代谢平衡。苏小雨等(2021)研究发现,与热敏性芝麻品种SP19相比,耐热芝麻品种郑太芝3号可通过提高抗氧化酶活性、保持光系统Ⅱ(PSII)活性及降低叶绿素降解速率来提高植株对高温胁迫的耐受能力。除此之外,植物还可通过激活一系列胁迫响应基因如转录因子、蛋白激酶、热激蛋白等基因的表达来应对高温胁迫(Goloubinoff,2012)。转录组测序技术(RNA-Seq)由于其精确的数字化信号、较高的检测通量和低成本的特点,已被广泛应用于解析植物对高温胁迫的响应机制。Lu等(2017)通过小麦(Triticum aestivum L.)转录组测序分析发现,高温胁迫处理后谷胱甘肽-S-转移酶(Glutathione-S-transferase,GST)基因可能在细胞抵抗氧化胁迫中发挥重要作用。Wang等(2019)通过辣椒(Capsicum annuum L.)转录组测序分析发现,谷胱甘肽代谢途径在耐热品种幼苗响应高温胁迫中发挥关键作用,推测其相关基因表达和代谢物积累是辣椒耐热品种具有较高耐热性的主要原因之一。Ma等(2020)通过半夏(Pinellia ternate L.)转录组测序分析发现,高温胁迫处理后差异表达基因主要涉及钙离子信号、植物激素信号转导和光合作用代谢等通路。Zhang等(2020)通过茄子(Solanum melongena L.)转录组测序分析发现,高温胁迫下大量与抗氧化酶系统、植物激素和转录因子相关的基因差异表达。Yang等(2021)通过枣(Ziziphus jujuba Mill.)转录组测序分析发现,高温胁迫处理后叶片中的差异表达基因富集到与光合作用相关及叶绿体组织相关的条目。【本研究切入点】近年来,对萝卜耐热性研究主要集中在耐热品种和生理指标的筛选等方面(初敏等,2014)。利用转录组测序技术研究萝卜幼苗耐热方面的报道极少,仅有研究比较单一基因型在常温和高温胁迫下基因的差异表达(Wang et al.,2018;Yang et al.,2019),而未比较耐热基因型与热敏感基因型在高温胁迫下基因的表达差异。【拟解决的关键问题】以耐热萝卜品种1116T和热敏感萝卜品种Wr129为试验材料,通过分析其叶片在常温和高温下转录水平上的差异,以期为萝卜耐热机制解析提供依据,也为萝卜优良基因资源的挖掘及利用提供理论支持。
1 材料与方法
1. 1 试验材料
供试萝卜品种Wr129A2A1(简称Wr129)和11162-3-1T-1(简称1116T)由重庆市农业科学院蔬菜花卉研究所提供。TRIzol? 试剂购自美国Invitrogen公司;Reverse Transcription System反转录试剂盒购自美国Promega公司;SYBR Green PCR Master Mix定量试剂盒购自TaKaRa公司。主要仪器设备:Climacell222人工气候箱(MMM,德国)、Applied Biosystems 7500定量PCR仪(ABI,美国)。
1. 2 试验方法
1. 2. 1 萝卜幼苗高温胁迫处理 将饱满干净大小一致的种子放入55~58 ℃热水中浸泡30 min,然后置于有两层滤纸的培养皿中发芽,种子萌发后点播于装有育苗基质的营养钵中,每盆定苗6株,放入驯化室培养(昼夜温度25 ℃,12 h光照/12 h黑暗,相对湿度60%~70%)。待苗生长至五叶一心期后在人工气候箱中进行高温(40 ℃)胁迫处理24 h,0 h作为对照(常温),取相同部位的叶片进行液氮速冻,于-80 ℃保存备用,所有处理均设3个重复。0C38D6C5-CCD8-4036-9CA4-D1323DE818F9
1. 2. 2 Fv/Fm值和叶绿素含量测定 参照吴思佳等(2021)的方法测定PSII最大光化学效率(Fv/Fm),设10次重复。参照王红娟(2020)的方法测定叶绿素含量。
1. 2. 3 转录组测序分析 利用TRIzol?试剂提取各时间点样品总RNA,将其送至杭州联川生物技术股份有限公司,并委托其完成质控、建库及Illumina NovaseqTM 6000双末端测序(测序读长为PE150)工作。原始数据(Raw reads)在NCBI数据库的登录号为SUB11454056。首先,利用FastQC Version 0.11.5(Bolger et al.,2014)对原始测序数据进行过滤处理得到Clean reads,利用HISAT2 Version hisat2-2.0.4 (Kim et al.,2019)將得到的Clean reads比对到萝卜品种象牙白参考基因组(http://Brassica_Genome_data/ Rapsa_Xiang_V1.0)得到bam文件。然后,利用StringTie Version stringtie-1.3.4d.Linux_x86_64将所有样本的初组装结果进行合并,再使用gffcompare Version gffcompare-0.9.8.Linux_x86_64检测转录本与参考注释,比较得到最终的组装注释结果。最后,使用R包Rsubread Version 1.22.2(Liao et al.,2019)计算每个基因的TPM(Transcripts per million),使用R包edgeR(Robinson et al.,2010)对样本之间进行显著差异分析,以|log2 Fold Change|≥1,P<0.05且TPM≥10为标准筛选差异表达基因(Differentially expressed genes,DEGs)。利用ClusterProfiler对差异表达基因进行GO(Gene ontology)功能注释分类和KEGG (Kyoto encyclopedia of genes and genomes)代谢通路富集分析,矫正后P<0.05。
1. 2. 4 qRT-PCR检测 为验证转录组测序得到差异表达基因的正确性,利用Trizol试剂参照说明书提取各时间点样品总RNA并按照Reverse Transcription System反转录试剂盒进行cDNA的第一链合成。以cDNA为模板、RsActin为内参(Xu et al.,2012),利用SYBR Green PCR Master Mix定量试剂盒检测差异表达基因的相对表达量。qRT-PCR反应体系20 μL为:反应液中含2×SYBR Green PCR Master Mix 10 μL,cDNA模板2 μL,10 μmol/L上、下游引物各1 μL,ddH2O 补充至20 μL。扩增程序:95 ℃ 3 min;95 ℃ 5 s,58 ℃ 30 s,72 ℃ 10 s,进行40个循环;60 ℃收集荧光。每个反应均设置3次生物学重复和3次技术重复,基因相对表达量采用2-ΔΔCt法计算。所有基因特异引物(表1)由生工生物工程(上海)股份有限公司合成。
1. 3 统计分析
利用SPSS 20.0的双尾检验法进行显著性分析,使用Origin 2019b绘图。
2 结果与分析
2. 1 高温胁迫下植株形态观察结果
由图1可知,Wr129和1116T的五叶一心幼苗未受高温胁迫(0 h)时植株形态正常,随着高温胁迫时间的增加,萝卜幼苗茎叶逐渐发生萎蔫,胁迫24 h 后Wr129叶片全部萎蔫下垂,干枯变黄,而1116T叶片轻度萎蔫下垂,仍然保持绿色,说明Wr129和1116T的耐热性存在明显差异。将高温胁迫24 h后的植株放在室温恢复7 d,结果发现Wr129全部死亡,而1116T老叶全部枯死,新叶恢复生机。根据上述幼苗形态变化,选择高温胁迫24 h的植株进行后续高温响应基因鉴定。
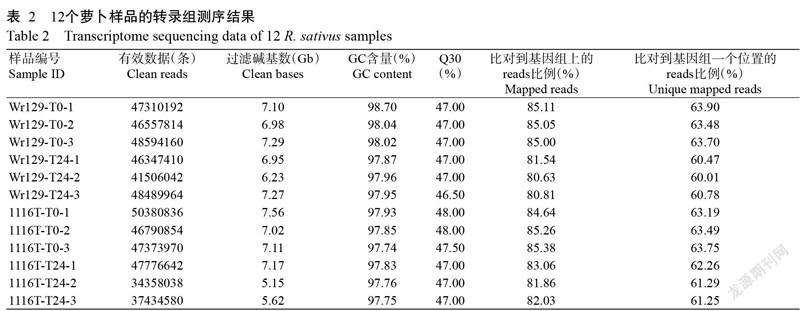
2. 2 萝卜转录组测序分析结果
对Wr129和1116T高温胁迫处理0和24 h两个时间点的12个样品 RNA 进行测序,去掉接头、低质量的reads后,12个文库共获得81.45 Gb Clean data,每个文库的测序超过34358038条,Q30值在97.74%及以上。利用Hisat 对各样品Clean reads进行组装及拼接后,能比对到参考基因组上的reads比对效率为80.63%~85.38%,平均有62.30%的reads能比对到基因组的一个位置(表2)。12个样品的整体质量满足后续分析要求。
2. 3 高温胁迫下差异表达基因筛选
以|log2 Fold Change|≥1,P<0.05且TPM≥10为标准筛选差异表达基因, 结果(表3)发现1116T-T0/Wr129-T0组合中有669个差异表达基因,其中,上调基因259个,下调基因410个;1116T-T24/Wr129-T24组合中有2263个差异表达基因,其中,上调基因1337个,下调基因926个。由于有231个差异表达基因在两个组合中均差异表达,最终在这两个不同耐热性的品种中共筛选到2701个差异表达基因。表明在高温胁迫下不同耐热性萝卜的部分基因在转录水平上存在明显差异。
2. 4 差异表达基因的GO功能注释分析结果
对上述筛选获得的2701个差异表达基因进行GO功能注释,结果发现2629个差异表达基因在 GO 数据库中得到注释,主要涉及细胞组分(Cellular component)、分子功能(Molecular function)和生物过程(Biological process)三个大类。在前20个条目中,细胞组分和生物过程分别占60%和35%,其中,559个差异表达基因被注释为细胞组分类别中的叶绿体被膜、叶绿体基质和叶绿体类囊体3个条目,470个差异表达基因被注释为与胁迫响应相关的生物学过程(图2)。0C38D6C5-CCD8-4036-9CA4-D1323DE818F9
2. 5 差异表达基因的KEGG代谢通路富集结果
利用KEGG数据库对所有差异表达基因的代谢通路进行富集分析,结果发现有1166个差异表达基因富集到124条代谢通路,其中显著富集的KEGG(P<0.05)通路有16条,包括光合作用(Photosynthesis)(57个)、光合作用-天线蛋白(Photosynthesis-antenna proteins)(17个)、光合生物碳固定(Carbon fixation in photosynthetic organisms)(36个)、卟啉和叶绿素代谢(Porphyrin and chlorophyll metabolism)(23个)、谷胱甘肽代谢(Glutathione metabolism)(35个)和内质网蛋白质加工(Protein processing in endoplasmic reticulum)(68个)等信号通路(图3)。
2. 6 高温胁迫响应相关差异表达基因在代谢通路中的功能分析结果
2. 6. 1 光合作用代谢通路 KEGG富集分析结果表明,高温胁迫导致与光合作用相关的能量代谢和对植物代谢至关重要的基本生理过程发生明显变化(图3)。74个差异表达基因富集到光合作用和光合作用-天线蛋白2条通路。与热敏感品种Wr129相比,高温胁迫24 h后大多数与PSI亚基(PsaD、PsaE、PsaF、PsaG、PsaH、PsaK、PsaL和PsaO)、PSII亚基(Psb27、PsbA、PsbO、PsbQ、PsbS和PsbW)、细胞色素b6f复合体(Cytb6f)(PetA)、电子传递(PetF和PetH)、ATP合酶(ATPF0B、 ATPF1D和ATPF1G)和捕光叶绿素a/b结合蛋白(LCHA1、LCHA3、LCHA4、LCHA5、LCHB1、LCHB2、LCHB3、LCHB5和LCHB6)等相关基因在耐热品种1116T幼苗叶片中上调表达(图4-A~图4-F),其中,1116T中的捕光叶绿素a/b结合蛋白家族基因LHCB2的表达量是Wr129的4.48倍。在与光合作用暗反应相关的差异表达基因中,32个(91.43%)相关基因包括核酮糖-1,5-二磷酸羧化/加氧酶小亚基(RBCS)、磷酸核糖激酶(PRK)、磷酸甘油酸激酶(PGK)、甘油醛3-磷酸脱氢酶(GAPA)和苹果酸脱氢酶(MDH)在耐热材料1116T幼苗叶片中上调表达(图4-G),表明耐热材料1116T在高温胁迫下能维持较高的光合能力,植株才得以缓慢生长,因此其耐热性更强。
2. 6. 2 卟啉和叶绿素代谢通路 PSII的最大光化学效率(Fv/Fm)用于反映植物在逆境胁迫下的光抑制程度。高温胁迫24 h后,Wr129和1116T幼苗叶片Fv/Fm均呈下降趋势,分别降低79.20%和23.28%,二者存在极显著差异(P<0.01,下同),室温恢复生长7 d后,1116T的Fv/Fm为0.703,几乎能恢复到正常水平,而Wr129仅为0.254,二者仍存在极显著差异(图5-A)。同样,高温处理24 h后Wr129和1116T叶片总叶绿素含量也减少,Wr129和1116T分别降低72.80%和38.53%(图5-B)。且与Wr129相比,高温胁迫24 h后大多数参与叶绿素合成途径的谷氨酰-tRNA还原酶(hemA)、Mg2+螯合酶(CHLD、CHLH和CHLP)、谷氨酸-1-半醛转氨酶(hemL)、尿卟啉原脱羧酶(hemE)、二乙烯还原酶(DVR)、原卟啉原Ⅸ氧化酶(PPOX)和叶绿素合酶(CHLG)基因在1116T幼苗叶片中上调表达,而与叶绿素降解相关的持绿基因(SGR)则下调表达(图5-C)。
2. 6. 3 谷胱甘肽代谢通路 植物在受到非生物胁迫时,细胞内会产生多余的活性氧,从而造成氧化胁迫。谷胱甘肽作为一种在植物中普遍存在的抗氧化剂,能够清除多余的活性氧,使细胞处于氧化还原反应的稳态。本研究中35个差异表达基因富集在谷胱甘肽代谢通路上,其中有22个基因持续上调表达,包括1个谷胱甘肽合成酶(Glutathione synthetase,GSS)基因和14个谷胱甘肽-S-转移酶(Glutathione S-transferase, GST)基因(图6-A)。随机选取8个GSTs基因进行qRT-PCR检测,结果如图6-B~图6-I所示。与Wr129相比,1116T中除Rsa10032310(GST)在高温胁迫0和24 h显著上调表达外,其余GSTs基因仅在高温胁迫24 h显著上调,表明耐热品种1116T通过调控谷胱甘肽代谢通路相关GSTs基因的表达,减少细胞内脂类物质的过氧化反应,从而提高对高温胁迫的耐受能力。
3 讨论
高温是制约萝卜的优质生产与均衡供应的主要限制因素(初敏等,2014)。为了了解萝卜幼苗对高温胁迫响应的分子机制,本研究以耐热品种1116T和热敏感品种Wr129为研究对象,通过转录组测序数据比较分析两者在高温胁迫24 h后在转录水平上响应高温胁迫的基因差异,共鉴定了2701个差异表达基因),表明高温胁迫下不同耐热性萝卜品种在差异表达基因转录水平上存在明显差异,且GO功能注释分析结果显示,1029个差异表达基因被富集到细胞组分类别中的叶绿体被膜、叶绿体基质和叶绿体类囊体及与胁迫响应相关的生物学过程;KEGG 代谢通路富集分析结果显示,144个差异表达基因富集到光合作用和谷胱甘肽代谢通路,说明光合作用和谷胱甘肽代谢途径相关基因在萝卜幼苗响应高温胁迫中发挥重要的调控作用。
光合作用是植物对温度变化最敏感的代谢反应,高温胁迫主要影响叶绿体光系统 I(PSI)和光系统 II(PSII)中的光反应及基质中的碳同化反应(Zhao et al.,2020)。叶绿素含量和Fv/Fm通常被作为判断植物耐受逆境胁迫的重要指标(吴思佳等,2021)。研究表明,耐热型水稻可在高温条件下通过维持较高的叶绿素含量从而提高对高温的耐受能力(Sailaja et al.,2015),转基因拟南芥过表达BrHSF16基因会导致Fv/Fm显著增加,并在高温条件下表现出明显的生长优势(张慧敏等,2021)。本研究结果显示,高温处理24 h后,虽然1116T和Wr129的叶绿素含量和Fv/Fm值均下降,但1116T的下降幅度明显小于Wr129,且与Wr129相比,1116T中大多数叶绿素合成相关基因的转录水平显著上调,表明1116T在高温胁迫下可通过减缓Fv/Fm和叶绿素含量下降速率来维持较高的光合能力,导致其耐热性更强。此外,KEGG代谢通路富集分析结果显示,109个差异表达基因富集到光合作用的光反应、暗反应和光合作用-天线蛋白通路;与Wr129相比,1116T中大多数基因在高温胁迫后迅速上调表达,表明耐热品种1116T可通過调控光合作用相关基因的表达,以此减少高温胁迫对植株的生理伤害和对光合作用的抑制。0C38D6C5-CCD8-4036-9CA4-D1323DE818F9
作物受高温等逆境胁迫时,细胞内氧代谢平衡失调,ROS含量升高,促进多聚不饱和脂肪酸降解并产生丙二醛,进而对植物组织和细胞进一步损伤。谷胱甘肽是一种在植物体内普遍存在的非酶系统抗氧化剂,在调节细胞内氧化还原信号转导中发挥重要作用(Zagorchev et al.,2013)。研究发现,高温显著影响辣椒的抗氧化酶系统,谷胱甘肽代谢途径相关基因可在短期内迅速响应高温胁迫并参与辣椒的耐热调控(Wang et al.,2019)。本研究KEGG代谢通路富集分析结果显示,35个差异表达基因富集在谷胱甘肽代谢途径上,与Wr129相比,25个基因在高温胁迫24 h后上调表达,说明其在萝卜响应高温胁迫的过程中发挥作用。谷胱甘肽转移酶是具有多种功能的蛋白超家族,能以GSH为底物催化过氧化氢的转化,保护细胞免受氧化所导致的损伤,在植物抵御外源物质毒害和非生物胁迫中发挥重要作用(Chi et al.,2011)。本研究发现,与Wr129相比,1116T中14个GSTs基因在高温胁迫后上调表达,说明在高温胁迫下耐热品种1116T也与水稻(Lee et al.,2007)、小麦(Lu et al.,2017)、辣椒(Wang et al.,2019)一样通过积累GST来提高自身对高温胁迫的耐受能力,但是具体调控机制有待进一步探究。
4 结论
Wr129和1116T的耐热性存在明显差异,其原因是1116T可通过调控光合作用和抗氧化系统相关基因的表达,并减缓Fv/Fm和叶绿素含量下降速率提高植株对高温胁迫的耐受能力。
参考文献:
初敏,庄志群,王秀峰,王淑芬,杨凤娟,魏珉,史庆华. 2014. 不同耐热性萝卜幼苗对高温胁迫的生理响应[J]. 山东农业大学学报(自然科学版),45(3):334-339. [Chu M,Zhuang Z Q,Wang X F,Wang S F,Yang F J,Wei M,Shi Q H. 2014. Study on physiological response to high temperature stress in different heat tolerance radish seedlings[J]. Journal of Shandong Agricultural University (Na-tural Science Edition),45(3):334-339.] doi:10.3969/j.issn. 1000-2324.2014.03.003.
郭仰東,张磊,李双桃,曹芸运,齐传东,王晋芳. 2018. 蔬菜作物应答非生物逆境胁迫的分子生物学研究进展[J]. 中国农业科学,51(6):1167-1181. [Guo Y D,Zhang L,Li S T,Cao Y Y,Qi C D,Wang J F. 2018. Progresses in research on molecular biology of abiotic stress responses in vegetable crops[J]. Scientia Agricultura Sinica,51(6):1167-1181.] doi:10.3864/j.issn.0578-1752.2018.06.015.
梁国旺,李增强,周步进,常蒙蒙,陈涛,陈鹏. 2020. 红麻谷胱甘肽还原酶基因(HcGR)的克隆及盐胁迫下表达分析[J]. 南方农业学报,51(10):2412-2419. [Liang G W,Li Z Q,Zhou B J,Chang M M,Chen T,Chen P. 2020. Clo-ning of glutathione reductase gene(HcGR)and its expression in response to salt stress of kenaf(Hibiscus cannabinus)[J]. Journal of Southern Agriculture,51 (10):2412-2419.] doi:10.3969/j.issn.2095-1191.2020.10.012.
苏小雨,高桐梅,李丰,魏利斌,田媛,王东勇,朱松涛,卫双玲. 2021. 不同耐热基因型芝麻苗期对高温胁迫的生理响应机制[J]. 华北农学报,36(6):96-105. [Su X Y,Gao T M,Li F,Wei L B,Tian Y,Wang D Y,Zhu S T,Wei S L. 2021. Physiological response mechanism to high temperature stress in different heat-tolerant genotypes of sesame seedlings[J]. Acta Agriculturae Boreali-Sinica,36(6):96-105.] doi:10.7668/hbnxb.20192 390.
王红娟,於春,路献勇,江本利,胡积送,余黎明,朱加保,闫晓明. 2020. 不同氮浓度对薏苡幼苗生长和光合特性的影响[J]. 南方农业学报,51(8):1925-1931. [Wang H J,Yu C,Lu X Y,Jiang B L,Hu J S,Yu L M,Zhu J B,Yan X M. 2020. Effects of different nitrogen concentrations on seedling growth and photosynthetic characteristics of coix[J]. Journal of Southern Agriculture,51(8):1925-1931.] doi:10.3969/j.issn.2095-1191.2020.08.017.0C38D6C5-CCD8-4036-9CA4-D1323DE818F9
吳思佳,李仁英,谢晓金,张婍,陈佳林,徐向华,胡宗荟,卢炳浩,张娜. 2021. 抽穗期高温对水稻叶片光合特性、叶绿素荧光特性和产量构成因素的影响[J]. 南方农业学报,52(1):20-27. [Wu S J,Li R Y,Xie X J,Zhang Q,Chen J L,Xu X H,Hu Z H,Lu B H,Zhang N. 2021. Effects of high temperature on characteristics of photosynthesis and chlorophyll fluorescence and yield components of rice at heading stage[J]. Journal of Southern Agriculture,52(1):20-27.] doi:10.3969/j.issn.2095-1191.2021.01.003.
张慧敏,赵乾宇,李红颖,卢玲,张一卉,邱念伟,王凤德,高建伟. 2021. 过量表达大白菜BrHSF16基因提高转基因拟南芥耐热性[J]. 植物生理学报,57(10):1915-1925. [Zhang H M,Zhao Q Y,Li H Y,Lu L,Zhang Y H,Qiu N W,Wang F D,Gao J W. 2021. Overexpression of BrHSF16 gene in Chinese cabbage improves heat tole-rance of transgenic Arabidopsis[J]. Plant Physiology Journal,57(10):1915-192.] doi:10.13592/j.cnki.ppj.2021. 0206.
Bolger A M,Lohse M,Usadel B. 2014. Trimmomatic:A flexible trimmer for Illumina sequence data[J]. Bioinforma-tics,30(15):2114-2120. doi:10.1093/bioinformatics/btu 170.
Chi Y H,Cheng Y S,Vanitha J,Kumar N,Ramamoorthy R,Ramachandran S,Jiang S Y. 2011. Expansion mechanisms and functional divergence of the glutathione S-transferase family in sorghum and other higher plants[J]. DNA Research,18(1):1-16. doi:10.1093/dnares/dsq031.
Goloubinoff F P. 2012. How do plants feel the heat ? [J]. Trends in Biochemical Sciences,37(3):118-125. doi:10.1016/j.tibs.2011.11.007.
Higashi Y,Okazaki Y,Myouga F,Shinozaki K,Saito K. 2015. Landscape of the lipidome and transcriptome under heat stress in Arabidopsis thaliana[J]. Scientific Reports,27(5):10533. doi:10.1038/srep10533.
Kim D,Paggi J M,Park C,Bennett C,Salzberg S L. 2019. Graph-based genome alignment and genotyping with HISAT2 and HISAT-genotype[J]. Nature Biotechnology,37(8):907-915. doi:10.1038/s41587-019-0201-4.
Kitashiba H,Li F,Hirakawa H,Kawanabe T,Zou Z,Hasegawa Y,Tonosaki K,Shirasawa S,Fukushima A,Yokoi S,Takahata Y,Kakizaki T,Ishida M,Okamoto S,Sakamoto K,Shirasawa K,Tabata S,Nishio T. 2014. Draft sequen-ces of the radish(Raphanus sativus L.) genome[J]. DNA Research,21(5):481-490. doi:10.1093/dnares/dsu014.
Lee D G,Ahsan N,Lee S H,Kang K Y,Bahk J D,Lee I J,Lee B H. 2007. A proteomic approach in analyzing heat-responsive proteins in rice leaves [J]. Proteomics,7(18):3369-3383. doi:10.1002/pmic.200700266.
Li B J,Gao K,Ren H M,Tang W Q. 2018. Molecular mechanisms governing plant responses to high temperatures[J]. Journal of Integrative Plant Biology,60(9):757-779. doi:10.1111/jipb.12701.
Liao Y,Smyth G K,Shi W. 2019. The R package Rsubread is easier,faster,cheaper and better for alignment and quantification of RNA sequencing reads[J]. Nucleic Acids Research,47(8):e47. doi:10.1093/nar/gkz114.0C38D6C5-CCD8-4036-9CA4-D1323DE818F9
Lu Y Z,Li R Q,Wang R C,Wang X M,Zheng W J,Sun Q X,Tong S M,Dai S J,Xu S B. 2017. Comparative proteomic analysis of flag leaves reveals new insight into wheat heat adaptation[J]. Frontiers in Plant Science,8:1086. doi:10.3389/fpls.2017.01086.
Ma G J,Zhang M D,Xu J L,Zhou W X,Cao L W. 2020. Transcriptomic analysis of short-term heat stress response in Pinellia ternata provided novel insights into the improved thermotolerance by spermidine and melatonin[J]. Ecotoxicology and Environmental Safety,202:110877. doi:10.1016/j.ecoenv.2020.110877.
Mathur S,Agrawal D,Jajoo A. 2014. Photosynthesis:Response to high temperature stress[J]. Journal of Photochemistry & Photobiology.,B Biology,137:116-126. doi:10.1016/j.jphotobiol.2014.01.010.
Robinson M D,McCarthy D J,Smyth G K. 2010. edgeR:A bioconductor package for differential expression analysis of digital gene expression data[J]. Bioinformatics,26(1):139-140. doi:10.1093/bioinformatics/btp616.
Sailaja B,Subrahmanyam D,Neelamraju S,Vishnukiran T,Rao Y V,Vijayalakshmi P,Voleti S R,Bhadana V P,Mangrauthia S K. 2015. Integrated physiological,biochemical,and molecular analysis identifies important traits and mechanisms associated with differential response of rice genotypes to elevated temperature[J]. Frontiers in Plant Science,6:1044. doi:10.3389/fpls.2015.01044.
Sheng X,Li J L,Zhang X Q,Wei H,Cui L J. 2006. Effects of heat acclimation pretreatment on changes of membrane lipid peroxidation,antioxidant metabolites,and ultrastructure of chloroplasts in two cool-season turfgrass species under heat stress[J]. Environmental & Experimental Botany,56(3):274-285. doi:10.1016/j.envexpbot.2005.03.002.
Tang R M,Gupta S K,Niu S Y,Li X Q,Yang Q,Chen G S,Zhu W J,Haroon M. 2020. Transcriptome analysis of heat stress response genes in potato leaves[J]. Molecular Biology Reports,47(6):4311-4321. doi:10.1007/s11033-020-05485-5.
Wang J,Lv J H,Liu Z B,Liu Y H,Song J H,Ma Y Q,Ou L J,Zhang X L,Liang C L,Wang F,Juntawong N,Jiao C H,Chen W C,Zou X X. 2019. Integration of transcriptomics and metabolomics for pepper(Capsicum annuum L.) in response to heat stress[J]. International Journal of Molecular Sciences,20(20):5042. doi:10.3390/ijms2020 5042.
Wang L,Liu L,Ma Y,Li S,Dong S,Zu W. 2018. Transcriptome profilling analysis characterized the gene expression patterns responded to combined drought and heat stresses in soybean[J]. Computational Biology and Che-mistry,77:413-429. doi:10.1016/j.compbiolchem.2018.09. 012.0C38D6C5-CCD8-4036-9CA4-D1323DE818F9
Wang R H,Mei Y,Xu L,Zhu X W,Wang Y,Guo J,Liu L W. 2018. Genome-wide characterization of differentially expressed genes provides insights into regulatory network of heat stress response in radish(Raphanus sativus L.) [J]. Functional & Integrative Genomics,18(2):225-239. doi:10.1007/s10142-017-0587-3.
Xu Y Y,Zhu X W,Gong Y Q,Xu L,Wang Y,Liu L W. 2012. Evaluation of reference genes for gene expression studies in radish(Raphanus sativus L.) using quantitative real-time PCR[J]. Biochemical and Biophysical Research Communications,424(3):398-403. doi:10.1016/j.bbrc. 2012.06.119.
Yang L,Jin J,Fan D Y,Hao Q,Niu J X. 2021. Transcriptome analysis of jujube(Ziziphus jujuba Mill.) response to heat stress[J]. International Journal Genomics,2021:3442277. doi:10.1155/2021/3442277.
Yang Z,Li W,Su X,Ge P F,Zhou Y,Hao Y Y,Shu H Y,Gao C L,Cheng S H,Zhu G P,Wang Z W. 2019. Early response of radish to heat stress by strand-specific transcriptome and miRNA analysis[J]. Internation Journal Molecular Sciences,20(13):3321. doi:10.3390/ijms2013 3321.
Zagorchev L,Seal C E,Kranner I,Odjakova M. 2013. A central role for thiols in plant tolerance to abiotic stress[J]. Internation Journal Molecular Sciences,14(4):7405-7432. doi:10.3390/ijms14047405.
Zhang A D,Zhu Z W,Shang J,Zhang S M,Shen H B,Wu X X,Zha D S. 2020. Transcriptome profiling and gene expression analyses of eggplant(Solanum melongena L.) under heat stress[J]. PLoS One,15(8):e0236980. doi:10. 1371/journal.pone.0236980.
Zhao J G,Lu Z G,Wang L,Jin B. 2020. Plant responses to heat stress:Physiology,transcription,noncoding RNAs,and epigenetics[J]. Internation Journal Molecular Scien-ces,22(1):117. doi:10.3390/ijms22010117.
(責任编辑 陈 燕)0C38D6C5-CCD8-4036-9CA4-D1323DE818F9
