轻度认知障碍患者内侧颞叶微结构变化的磁共振扩散峰度成像研究
2022-06-14王倩楠孙慧勤孙卫红白胜杰李晨旭张青山
王倩楠 孙慧勤 孙卫红 白胜杰 宋 璞 赵 莉 李晨旭 张青山
1)蚌埠医学院研究生院,安徽 蚌埠 233030 2)徐州市中心医院,江苏 徐州 221009
轻度认知障碍(mild cognitive impairment,MCI)是认知功能正常的老年人向阿尔茨海默病(Alzheimer’s disease,AD)转化过程中的一个过渡状态,以近记忆障碍为主要表现,可伴有其他领域认知功能的减退,且不符合痴呆的诊断标准[1]。研究发现,每年10%~15%的MCI 患者发展为AD[2]。目前AD尚无治愈疗法,利用辅助手段对MCI疾病的早期病理生理指标进行量化,对了解疾病进程至关重要,有助于早期干预,延缓认知衰退进程[3-4]。
随着影像技术的发展,磁共振扩散成像越来越多地被应用到神经系统退行性疾病中[5]。目前,磁共振弥散张量成像(diffusion tensor imaging,DTI)是研究MCI 较为广泛的磁共振扩散成像技术,对于脑白质完整性的分析具有非常重要的作用,但DTI技术不能用来描绘水分子的非高斯分布[6]。磁共振扩散峰度成像(diffusion kurtosis imaging,DKI)是在DTI的基础上延伸出来的一种新兴技术,能够量化组织中水分子非正态分布的特性,其峰度值受干扰因素影响较小,较DTI 而言,DKI 能更加准确地反映MCI 患者大脑复杂的组织微观结构,反映疾病的病理生理改变,有利于对疾病早期的精确诊断[7]。许多研究表明,DKI对各种疾病的组织微结构变化敏感[8]。研究表明,MCI患者内侧颞叶皮质更容易受到影响,尤其是海马和内嗅皮层萎缩更加明显[9]。但目前利用DKI技术对MCI患者内侧颞叶皮质的国内外研究仍然很少,本研究拟采用DKI 技术对MCI 患者内侧颞叶皮质相关参数进行分析,探讨DKI 技术在MCI 患者诊断中的临床应用价值。
1 对象和方法
1.1 研究对象选取2020-08—2021-11 于徐州市中心医院神经内科就诊的脑小血管病患者总共45例作为研究对象,使用蒙特利尔认知评估量表(Montreal cognitive assessment scale,MoCA)进行整体认知功能评估,并根据是否存在MCI 分为MCI 组和无MCI组,记录2组患者的一般资料,包括年龄、性别、接受教育时间。
1.2 纳入与排除标准纳入标准:(1)年龄≥60岁;(2)有一侧或者两侧脑小血管病的磁共振影像学表现;(3)具有独立的日常生活能力;(4)使用MoCA 进行评估,具有至少1个认知领域功能损害的客观依据或者存在无总体认知功能受损的客观依据;(5)尚未达到痴呆的诊断标准[10];(6)行头颅MRI 成像和DKI扫描。
排除标准:(1)其他原因引起的认知功能障碍,如帕金森病;(2)存在严重的心、肝、肾等器官疾病;(3)存在明显的焦虑或抑郁症状;(4)有MRI检查禁忌者,如心脏起搏器;(5)有长期酗酒或药物滥用史者。此研究方案通过本医院的伦理委员会审核批准。
1.3 方法研究对象均采用MoCA量表进行总体认知功能的评估,确定患者具有总体认知功能损害的情况为:初中及以上文化患者的MoCA评分则需≤24分,小学文化患者的MoCA评分需≤19 分,文盲患者的MoCA 评分需≤13 分,否则视为无总体认知功能损害。
1.4 MRI数据采集所有患者均接受20 通道头颈线圈的3 Tesla全身磁共振系统(Siemens Skyra)进行扫描。采集时每位患者均利用泡沫衬垫限制患者头动、橡皮耳塞降低噪声。扩散成像采取基于自旋回波的回波平面成像,分成两次采集:第一组参数为TR=5 600 ms,TE=97 ms,成像矩阵=128×128,视野=240 mm×240 mm,层数=30,层厚=4.5 mm,b=0、1 000 s/mm2、2 000 s/mm2,30个梯度方向,PAT=2,采集时间为6 min 50 s;第2组参数与第一组大致相同,但b 值仅为0 s/mm2,10 次平均。典型病例影像图片见图1。

图1 典型病例影像学检查Figure 1 Imaging examination of typical cases
1.5 DKI 数据处理将设备采集的DICOM 数据转换成可分析的NIFTI格式图像,并对所有数据的成像质量进行检查,主要包括数据采集是否完整以及有无严重的伪影。采用FSL 软件对DTI 数据采集过程中的湍流效应以及头动进行校正,并对校正后的张量信息进行校正。使用DKI toolkit 进行定量指标的计算,生成DKI 的参数图,包括轴向扩散系数(axial diffusiyity,AD)、垂直扩散系数(radical diffusiyity,RD)、平均扩散系数(mean diffusiyity,MD)、部分各向异性(fractional anisotropy,FA)、轴向扩散峰度(axial kurtosis,AK)、径向扩散峰度(radial kurtosis,RK)、平均 峰 度(mean kurtosis,MK)和 峰 度 各 向 异 性(kurtosis anisotropy,KFA)。对数据进行空间标准化,用半高宽为8 mm×8 mm×8 mm 的高斯核进行高斯平滑,进一步去除噪声,使待统计分析的数据符合正态分布。根据解剖学自动标记(anatomical automatic labeling,AAL)模板,选择双侧嗅皮质、海马和海马旁回为感兴趣区,并自动提取出所有定量指标在每个脑区的平均值。对于MCI 组,对比感兴趣区的左右侧,计算出每个脑区的均值、方差,并进行独立样本t检验,P<0.05为差异有统计学意义。进行MCI 与对照组的统计分析,计算出每个感兴趣区的均值、方差,并进行独立样本t检验,P<0.05为差异有统计学意义。将MCI组所有定量指标的所有感兴趣区与MoCA量表进行相关性分析,得到相关系数r值和相关显著性P值。
1.6 统计学分析对数据的分析采用SPSS 26.0 统计软件,符合正态分布的计量资料用均数±标准差(±s)表示,2 组间数据比较采取t 检验,不符合正态分布的计量资料用M(Q1,Q3)表示,2 组间数据的比较使用Mann Whitney U 检验;计数资料采用百分率(%)表示,2组间的比较使用χ2检验,以P<0.05为差异有统计学意义。采用Pearson 相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 2 组一般资料比较无MCI 组的MoCA 评分高于MCI组,差异有统计学意义(P<0.05);2组间患者的性别、年龄、接受教育时间比较,差异无统计学意义(P>0.05)。见表1。

表1 2组一般资料比较Table 1 Comparison of general data between two groups of patients with cerebrovascular disease
2.2 2 组患者感兴趣区参数比较MCI 组患者双侧嗅皮质、海马及海马旁回的AD、MD、RD 值较无MCI组明显增加,差异有统计学意义(P<0.05),MCI组患者双侧嗅皮质、海马及海马旁回的FA、AK、MK、RK及KFA 值较无MCI 组明显降低,差异有统计学意义(P<0.05),见表2、表3、表4。MCI 组患者左右两侧嗅皮质及海马旁回的DKI 各项参数比较,差异均无统计学意义(P>0.05),MCI组患者左侧海马的FA、MK、RK、KFA 值与右侧相比明显增加,差异有统计学意义(P<0.05),见表5。
表2 MCI组与无MCI组嗅皮质区DKI各项参数比较 (±s)Table 2 Comparison of DKI parameters in olfactory cortex between MCI group and non-MCI group (±s)
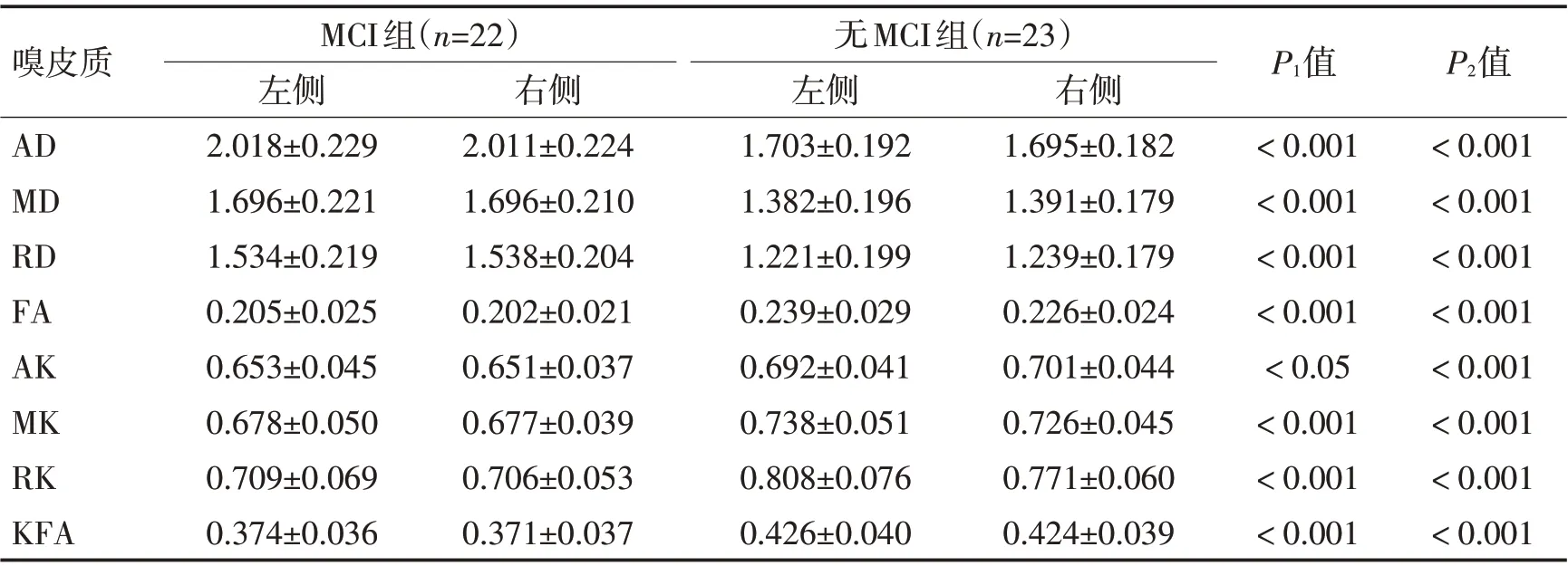
表2 MCI组与无MCI组嗅皮质区DKI各项参数比较 (±s)Table 2 Comparison of DKI parameters in olfactory cortex between MCI group and non-MCI group (±s)
注:P1值为2组左侧比较,P2值为2组右侧比较
嗅皮质AD MD RD FA AK MK RK KFA MCI组(n=22)左侧2.018±0.229 1.696±0.221 1.534±0.219 0.205±0.025 0.653±0.045 0.678±0.050 0.709±0.069 0.374±0.036无MCI组(n=23)右侧2.011±0.224 1.696±0.210 1.538±0.204 0.202±0.021 0.651±0.037 0.677±0.039 0.706±0.053 0.371±0.037左侧1.703±0.192 1.382±0.196 1.221±0.199 0.239±0.029 0.692±0.041 0.738±0.051 0.808±0.076 0.426±0.040右侧1.695±0.182 1.391±0.179 1.239±0.179 0.226±0.024 0.701±0.044 0.726±0.045 0.771±0.060 0.424±0.039 P1值<0.001<0.001<0.001<0.001<0.05<0.001<0.001<0.001 P2值<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001
表3 MCI组与无MCI组海马区DKI各项参数比较 (±s)Table 3 Comparison of DKI parameters in hippocampus between MCI group and non-MCI group (±s)
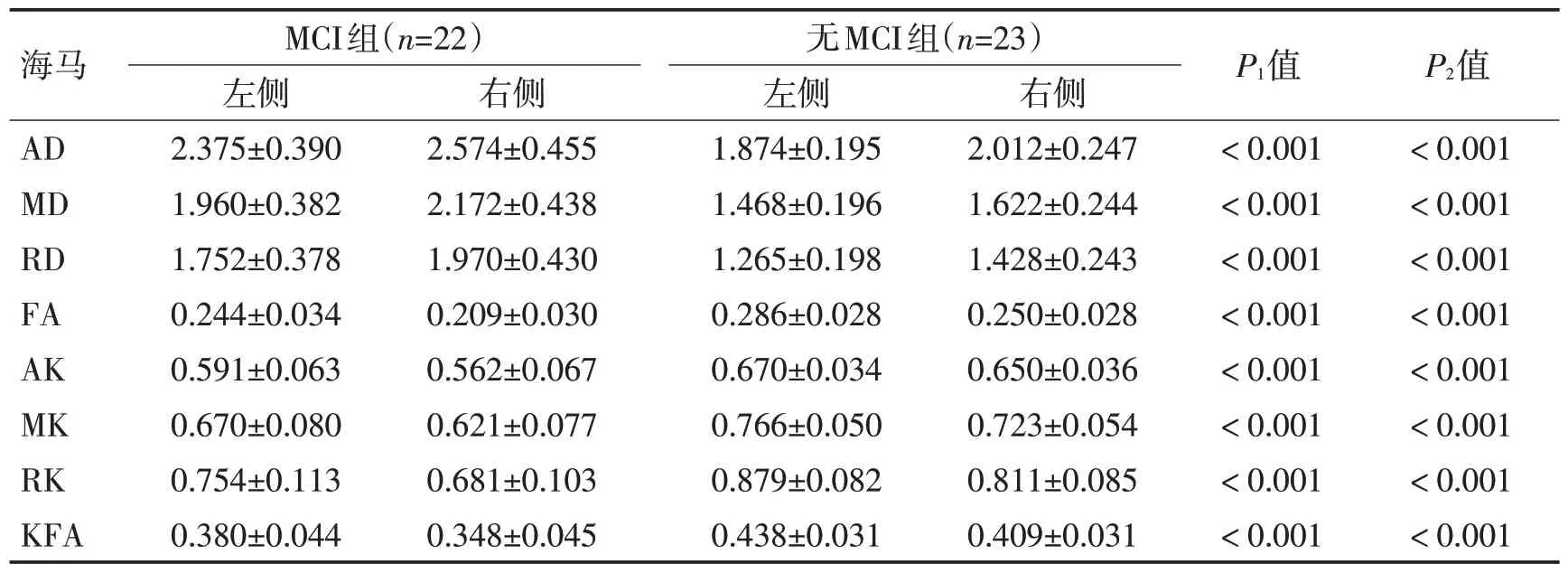
表3 MCI组与无MCI组海马区DKI各项参数比较 (±s)Table 3 Comparison of DKI parameters in hippocampus between MCI group and non-MCI group (±s)
注:P1值为2组左侧比较,P2值为2组右侧比较
海马AD MD RD FA AK MK RK KFA MCI组(n=22)左侧2.375±0.390 1.960±0.382 1.752±0.378 0.244±0.034 0.591±0.063 0.670±0.080 0.754±0.113 0.380±0.044无MCI组(n=23)右侧2.574±0.455 2.172±0.438 1.970±0.430 0.209±0.030 0.562±0.067 0.621±0.077 0.681±0.103 0.348±0.045左侧1.874±0.195 1.468±0.196 1.265±0.198 0.286±0.028 0.670±0.034 0.766±0.050 0.879±0.082 0.438±0.031右侧2.012±0.247 1.622±0.244 1.428±0.243 0.250±0.028 0.650±0.036 0.723±0.054 0.811±0.085 0.409±0.031 P1值<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001 P2值<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001
表4 MCI组与无MCI组海马旁回DKI各项参数比较 (±s)Table 4 Comparison of DKI parameters in parahippocampal gyrus between MCI group and non-MCI group (±s)

表4 MCI组与无MCI组海马旁回DKI各项参数比较 (±s)Table 4 Comparison of DKI parameters in parahippocampal gyrus between MCI group and non-MCI group (±s)
注:P1值为2组左侧比较,P2值为2组右侧比较
海马旁回AD MD RD FA AK MK RK KFA MCI(n=22)左侧2.298±0.324 1.982±0.305 1.824±0.297 0.176±0.017 0.614±0.052 0.626±0.049 0.639±0.055 0.352±0.041无MCI组(n=23)P2值<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001右侧2.455±0.309 2.121±0.283 1.954±0.271 0.173±0.013 0.593±0.051 0.612±0.043 0.628±0.046 0.335±0.035左侧1.830±0.194 1.543±0.180 1.399±0.175 0.197±0.015 0.688±0.031 0.695±0.033 0.713±0.041 0.407±0.029右侧2.081±0.220 1.768±0.203 1.612±0.195 0.191±0.011 0.652±0.034 0.668±0.036 0.688±0.043 0.381±0.028 P1值<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001
表5 MCI组左右两侧各感兴趣区DKI各项参数比较 (±s)Table 5 Comparison of DKI parameters in the regions of interest on the left and right sides of MCI group (±s)

表5 MCI组左右两侧各感兴趣区DKI各项参数比较 (±s)Table 5 Comparison of DKI parameters in the regions of interest on the left and right sides of MCI group (±s)
注:P1为MCI组患者左右侧嗅皮质比较,P2为MCI组患者左右侧海马比较,P3为MCI组患者左右侧海马旁回比较
参数AD MD RD FA AK MK RK KFA嗅皮质左侧2.018±0.229 1.696±0.221 1.534±0.219 0.205±0.025 0.653±0.045 0.678±0.050 0.709±0.069 0.374±0.036右侧2.011±0.224 1.696±0.210 1.538±0.204 0.201±0.021 0.651±0.037 0.677±0.039 0.706±0.053 0.371±0.037海马左侧2.375±0.390 1.960±0.382 1.752±0.378 0.244±0.034 0.591±0.063 0.670±0.080 0.754±0.113 0.380±0.044右侧2.574±0.455 2.172±0.438 1.970±0.430 0.209±0.030 0.562±0.067 0.621±0.077 0.681±0.103 0.348±0.045海马旁回左侧2.298±0.324 1.982±0.306 1.824±0.297 0.176±0.017 0.614±0.052 0.626±0.049 0.639±0.055 0.352±0.041右侧2.455±0.309 2.121±0.283 1.954±0.271 0.173±0.013 0.593±0.051 0.612±0.043 0.628±0.046 0.335±0.035 P1值>0.05>0.05>0.05>0.05>0.05>0.05>0.05>0.05 P2值>0.05>0.05>0.05<0.001>0.05<0.05<0.05<0.05 P3值>0.05>0.05>0.05>0.05>0.05>0.05>0.05>0.05
2.3 相关性分析MCI 组患者双侧嗅皮质、海马及海马旁回的AD、MD、RD 与MoCA评分均呈负相关(P<0.05),FA、AK、MK、RK、KFA与MoCA评分均呈正相关(P<0.05)。见表6。

表6 感兴趣区DKI各项参数与MoCA评分的Pearson相关分析Table 6 Pearson correlation analysis between DKI parameters and MoCA score in the region of interest
3 讨论
DTI 的技术原理认为水在组织中的扩散服从高斯分布,但在真正情况下并不完全符合高斯分布,而是呈非正态分布,因此DTI不能如实反映机体的真实情况和数据,也无法检测生物组织中扩散的异质性[11]。DKI 技术使用了更高b 值的磁共振敏感梯度场来拟合非高斯分布,较DTI相比,能更真实、更敏感地检测出脑组织微结构的变化,更能准确分析灰白质结构的复杂性[12]。因此,越来越广泛地被应用到神经系统疾病的研究中,如帕金森病、缺血性脑损伤、多发性硬化[13]等。
DKI 的主要参数包括AD、RD、MD、FA、AK、RK、MK和KFA,其中最具代表性的参数MK值,表示的是各个扩散方向上峰度系数的平均值,可反映大脑中水分子扩散受限的程度以及组织微观结构的复杂程度。组织微观结构越复杂,水分子扩散受限就越明显,MK值就越大。GONG等[14]使用基于感兴趣区的分析方法进行研究,结果发现在MCI早期,在大脑无明显萎缩的情况下,更多深灰质区域显示DKI 参数的明显异常。同时,在所有DKI 的参数中,MK 值的变化最为显著。另外,FALANGOLA等[15]采用DKI技术进行研究也发现,MCI患者的MK值显著降低。分析其原因可能与MCI患者早期神经元结构复杂性的降低有关。在DKI的各项参数中,MD可反映水分子的扩散能力,但与方向无关。AD代表了水分子沿轴突扩散的能力,可反映轴突的完整性;RD 代表了垂直于长轴方向的扩散系数,可反映髓鞘的完整性。AK表示平行于轴突方向的峰度信息,AK值越大,代表组织微结构越紧密。RK 表示垂直于扩散张量长轴方向的扩散峰度值,在脑白质中,由于细胞膜和髓鞘的阻碍导致水分子的扩散运动呈非高斯分布,RK值较高。KFA 值是对FA 信息的补充,其值越大,表示水分子扩散越趋向于各向异性扩散[16]。组织结构越紧密、越规则,KFA 值越大[17]。既往BRUEGGEN等[18]研究发现,MCI组与健康对照组相比,患者颞叶的广泛区域MD 值升高,FA 值降低。本研究显示,MCI患者嗅皮质区、海马区、海马旁回AD、MD、RD值显著增加,FA、RK、MK、KFA值显著降低。原因可能是MCI患者的嗅皮质、海马区及海马旁回萎缩,细胞外空间增大,导致扩散系数增加[15];神经胞体、树突、轴突及髓鞘受损,脑组织微结构的复杂程度下降,导致FA、RK、MK、KFA值显著降低[19-20]。MCI 组患者左侧嗅皮质及海马旁回的DKI各项参数较右侧无明显变化,而MCI组患者左侧海马的FA、MK、RK、KFA值较右侧显著增加,表明MCI 患者左右侧海马微结构改变程度不一致,分析其原因可能与正常人群中左右侧海马的不对称性有关,左侧海马体积小于右侧[21]。本研究显示,MCI 患者嗅皮质、海马及海马旁回的AD、MD、RD 值均与MoCA 评分呈负相关,FA、AK、MK、RK、KFA均与MoCA评分呈正相关,表明DKI相关参数的改变与认知功能的减退存在相关性,脑微结构的改变可导致认知功能减退。
利用DKI技术可以捕获MCI患者脑组织的微结构变化,可以对MCI患者的早期诊断提供影像学参考。本研究具有以下局限性:本研究的病例数量相对较少,缺乏患者的长期随访数据,在以后的研究中可以增加此类患者的病例数量以及患者的长期随访数据,进一步明确DKI 技术在MCI 患者早期诊断中的影像学价值。
