奥拉帕利片治疗结直肠癌根治术患者的疗效及对TSLPR、MAPs、Cx43 表达的影响
2022-06-14孙梦喆曲冬
孙梦喆,曲冬
(黑龙江省佳木斯市中心医院东院区肿瘤外科,黑龙江 佳木斯 154000)
结直肠癌是下消化道常见的恶性肿瘤疾病,是存在于齿状线至直肠乙状结肠等处的肿瘤癌变,呈息肉状和溃疡性病灶[1]。临床对于结直肠癌根治术患者术后推荐进行辅助化疗[2],伊立替康+亚叶酸钙+氟尿嘧啶(FOLFIRI)方案是结直肠癌患者术后常用的多药联合化疗方案,对癌细胞有较好的抑制杀灭作用,但也存在着细胞毒性大、免疫功能下降及耐药现象等问题[3]。奥拉帕利是一种新型的小分子靶向药物,为聚腺苷二磷酸核糖聚合酶抑制剂(Poly adenosine diphosphate ribose polymerase inhibitor,PARPi),其主要适应证是用于卵巢癌、输卵管癌、腹膜癌等恶性肿瘤疾病的治疗,近几年也有报道用于消化道肿瘤、泌尿肿瘤疾病的治疗并取得了良好效果[4]。相关报道显示[5],胸腺基质淋巴细胞生成素受体(Thymic stromal lymphopoietin receptor,TSLPR)、微 管 相 关 蛋 白(Microtubule associated protein,MAPs)、缝隙连接蛋白43(Connexin 43,Cx43)在癌症肿瘤疾病中呈现异常表达,与结直肠癌病情进展有一定关联,可作为结直肠癌诊断、疗效评估的标志物。为此,本研究以结直肠癌术后患者为治疗对象,在FOLFIRI 方案基础上增加奥拉帕利片治疗,评估对患者的治疗效果及对TSLPR、MAPs、Cx43 表达的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2019 年1 月—2021 年10 月本院收治的110例结直肠癌患者为研究对象,纳入标准:①经诊断确诊为结直肠癌,符合《结直肠癌CT 和MRI 标注专家共识(2020)》[6]中诊断标准;②年龄50~80 岁;③均接受根治术治疗,具有相应的手术治疗指征;④术后均接受辅助化疗治疗,对治疗药物奥拉帕利、伊立替康、亚叶酸钙、氟尿嘧啶等药物无禁忌。排除标准:①合并其他全身恶性肿瘤者;②存在手术禁忌证者;③术后出现严重并发症转入其他科室治疗的患者;④入组本研究中已经接受其他药物治疗的患者;⑤未严格执行化疗方案的患者;⑥化疗过程中出现严重不良反应需终止治疗的患者;⑦评价指标数据收集不完整不能准确评估治疗效果的患者。采用随机数字表法分为观察组和对照组,每组55 例。两组一般资料比较,差异无统计学意义(P>0.05),见表1。研究方案可行性通过医院伦理学委员会审查通过(伦理学批件号:KYLL20190105),患者对研究治疗方案知情并自愿参与。
表1 两组一般资料比较[(±s),n]
表1 两组一般资料比较[(±s),n]
组别 例数 性别 年龄(岁) 病灶(cm) TNM 分期 ASA 分级男性 女性 Ⅰ级 Ⅱ级 Ⅰ级 Ⅱ级观察组 55 30 25 63.27±9.97 5.18±1.27 33 22 28 27对照组 55 34 21 64.81±9.28 5.46±1.29 38 17 25 30 t/c2 值 0.598 0.839 1.147 0.993 0.328 P 值 0.439 0.404 0.264 0.319 0.567
1.2 方法
所有患者均进行结直肠癌根治术治疗,对照组术后以FOLFIRI 方案治疗,患者化疗周期第1 d以盐酸伊立替康注射液(上海创诺制药,规格:2 ml∶40 mg,国药准字H20123191)+250 ml 5%葡萄糖注射液稀释后静脉滴注,给药剂量为180 mg/m2,滴注时间不少于60 min;以化疗周期第1 d~第2 d 注射用亚叶酸钙(国药一心制药,规格:100 mg,国药准字H20053382)+250ml 0.9%氯化钠注射液中稀释后静脉滴注,给药剂量为200 mg/m2,滴注时间60 min;化疗周期第1d~第2d 以注射用氟尿嘧啶(海南普利制药,规格:0.25 g,国药准字H20050330)+500 ml 0.9%氯化钠注射液稀释后静脉滴注,给药剂量为600 mg/m2,滴注时间不少于120 min;以14 天为1 个化疗周期,连续化疗6 个周期。观察组在对照组基础上增加奥拉帕利片治疗,FOLFIRI 方案所用药物来源、规格、用法用量与对照组完全相同,同时以奥拉帕利片(阿斯利康公司,国药准字H20180048,规格:100 mg,批号:AZ20200110B)口服,剂量为200 mg/次,每日2 次于早晚分次服用,以14天为1 个疗程,连续治疗6 个疗程。
1.3 评价指标
①临床疗效:参照《中国直肠癌侧方淋巴结转移诊疗专家共识(2019 版)》制定[7],完全缓解(CR):CT探查显示结直肠癌病灶完全消失且此状态持续超过3 个月;部分缓解(PR):CT 探查患者结直肠癌缩小超过体积大于原病灶体积50%,且持续时间不少于3个月;稳定(SD):CT 探讨结直肠癌病灶体积减少幅度0%~50%,且保持时间不少于3 个月;进展(PD):患者治疗后的病灶体积无减小且有增大;客观缓解率(ORR)=(CR+PR)/总例数×100%;疾病控制率(DCR)=(CR+PR+SD)/总例数×100%。
②肿瘤标志物水平:于治疗前、治疗后1 d 采集空腹静脉血5 ml,以GT10-1 型台式高速离心机(北京新时代北利医疗器械公司)离心分离,参数为:转速5000 rpm、离心半径10 cm、离心时间15 min。血清上清液标本以HLF-240 型全自动生化分析仪(山东海力孚医疗设备公司)检测患者的糖链抗原19-9(Carbohydrate antigen 19-9,CA19-9)、糖链抗原242(Sugar chain antigen 242,CA242)、癌 胚 抗 原(Carcinoembryonic antigen,CEA),试剂盒由上海华美生物技术公司提供。
③免疫功能指标:血清上清液样本采用FACS Canto10 型荧光流式细胞仪(美国BD 公司)检测患者CD3+、CD4+、CD8+细胞水平,计算CD4+/CD8+,试剂盒由上海沪鼎生物技术公司提供。
④炎症损伤指标水平:血清上清液标本以酶免疫分析法检测患者的TSLPR、MAPs、Cx43 水平,检测仪器为PT-3502G 型多功能酶标仪(北京普天新桥医疗设备公司),试剂盒由青岛捷世康生物科技公司提供。
⑤治疗安全性:统计比较两组患者治疗期间恶心呕吐、高血压、腹泻腹痛、肝功能损伤、肾损伤等不良反应发生率。
1.4 统计学方法
采用SPSS 25.0 统计学软件进行数据分析。计量资料以(±s)表示,采用t检验;计数资料以[n(%)]表示,采用χ2检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 两组临床疗效比较
观察组ORR、DCR 高于对照组(P<0.05),见表2。
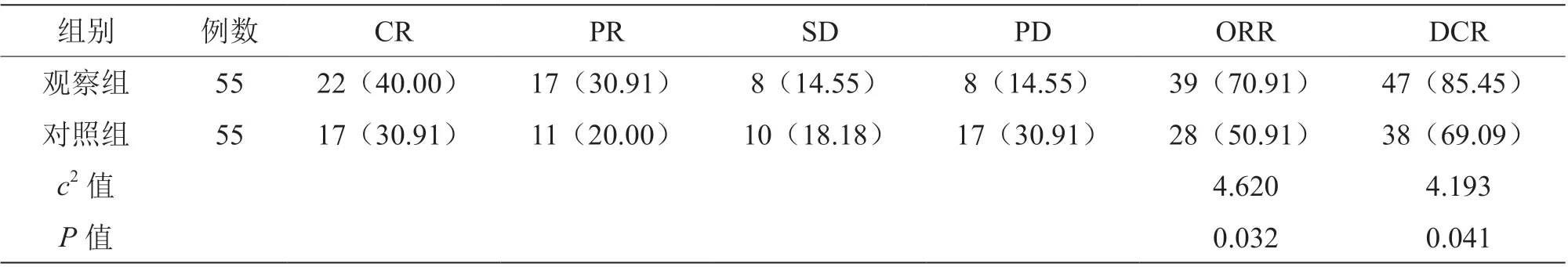
表2 两组临床疗效比较[n(%)]
2.2 两组肿瘤标志物水平比较
治疗后,两组CA19-9、CA242、CEA 水平低于治疗前,且观察组低于对照组(P<0.05),见表3。
表3 两组肿瘤标志物水平比较(±s)
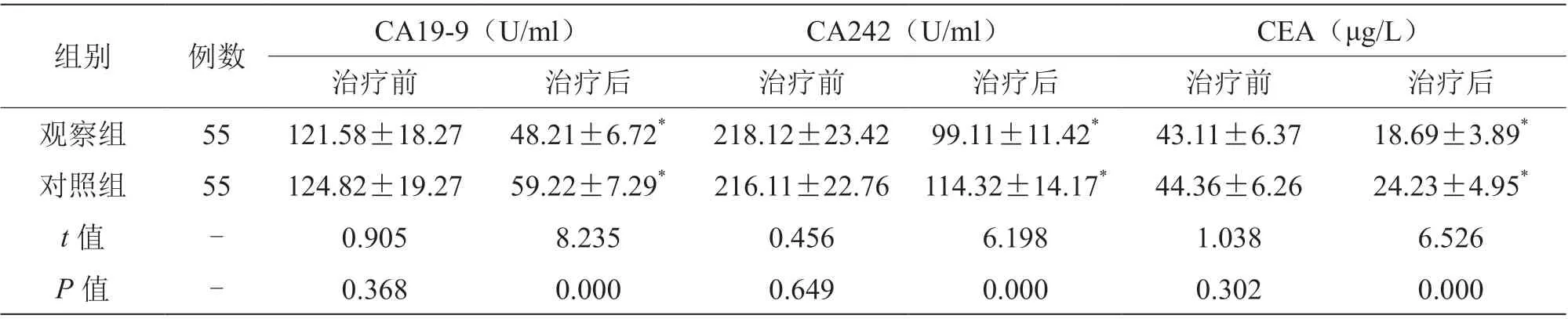
表3 两组肿瘤标志物水平比较(±s)
注:与同组治疗前比较,*P<0.05
组别 例数 CA19-9(U/ml) CA242(U/ml) CEA(μg/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后观察组 55 121.58±18.27 48.21±6.72* 218.12±23.42 99.11±11.42* 43.11±6.37 18.69±3.89*对照组 55 124.82±19.27 59.22±7.29* 216.11±22.76 114.32±14.17* 44.36±6.26 24.23±4.95*t 值 - 0.905 8.235 0.456 6.198 1.038 6.526 P 值 - 0.368 0.000 0.649 0.000 0.302 0.000
2.3 两组免疫功能指标比较
治 疗 后,两 组CD3+、CD4+、CD4+/CD8+高于治疗前,CD8+低于治疗前,且观察组CD3+、CD4+、CD4+/CD8+高于对照组,CD8+低于对照组(P<0.05),见表4。
表4 两组免疫功能指标比较(±s)
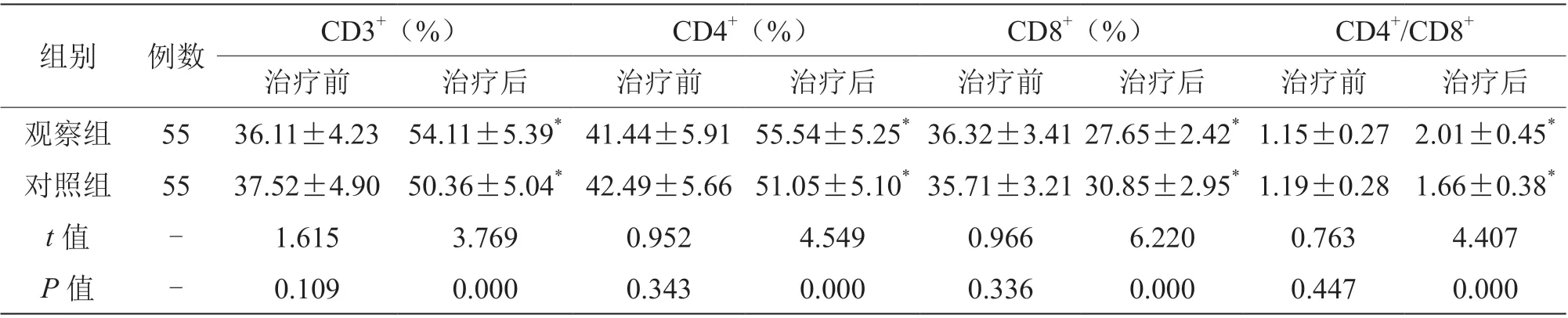
表4 两组免疫功能指标比较(±s)
注:与同组治疗前比较,*P<0.05
组别 例数 CD3+(%) CD4+(%) CD8+(%) CD4+/CD8+治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后观察组 55 36.11±4.23 54.11±5.39* 41.44±5.91 55.54±5.25* 36.32±3.41 27.65±2.42* 1.15±0.27 2.01±0.45*对照组 55 37.52±4.90 50.36±5.04* 42.49±5.66 51.05±5.10* 35.71±3.21 30.85±2.95* 1.19±0.28 1.66±0.38*t 值 - 1.615 3.769 0.952 4.549 0.966 6.220 0.763 4.407 P 值 - 0.109 0.000 0.343 0.000 0.336 0.000 0.447 0.000
2.4 两组炎症相关蛋白比较
治疗后,两组TSLPR、MAPs、Cx43 水平低于治疗前,且观察组低于对照组(P<0.05),见表5。
表5 两组炎症相关蛋白比较(±s)
注:与同组治疗前比较,*P<0.05
组别 例数 TSLPR(ng/L) MAPs(ng/L) Cx43(ng/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后观察组 55 89.23±10.72 35.73±5.82* 132.76±17.83 58.82±8.25* 53.27±6.19 14.98±3.54*对照组 55 90.72±11.05 41.05±6.07* 130.65±18.36 65.11±8.91* 52.38±6.54 18.49±4.82*t 值 - 0.718 4.692 0.611 3.842 0.733 4.353 P 值 - 0.474 0.000 0.542 0.000 0.465 0.000
2.5 两组治疗安全性比较
观察组与对照组不良反应发生率比较,差异无统计学意义(P>0.05),见表6。
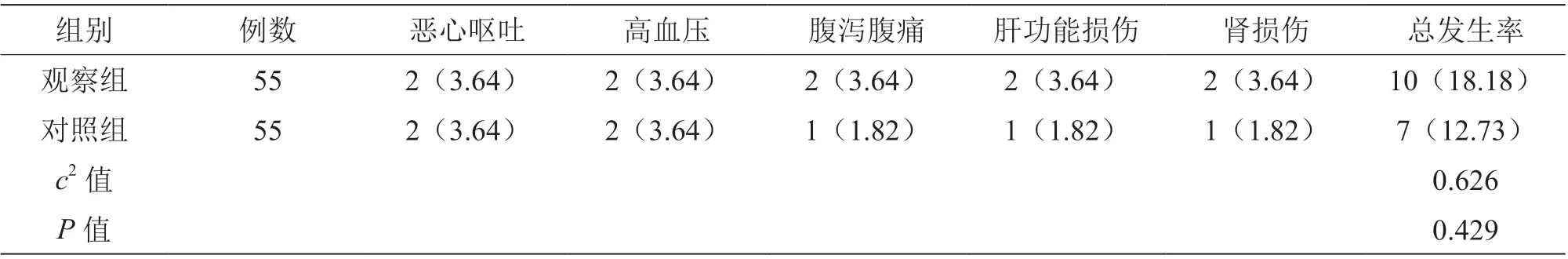
表6 两组治疗安全性比较[n(%)]
3 讨论
3.1 奥拉帕利对结直肠癌患者治疗效果分析
本研究结果显示,观察组ORR、DCR 高于对照组(P<0.05),表明奥拉帕利在结直肠癌术后辅助化疗中有良好效果,与既往临床报道结果一致[8],这是因为奥拉帕利为靶向PARPi 抑制剂,具有独特的作用机制,能够靶向抑制和捕获DNA 损伤修复酶PARP,使得受损DNA 既不能进行碱基切除修复,也不能进行高保真的双链修复,最终导致肿瘤细胞死亡[9]。同时,奥拉帕利对存在同源重组修复缺陷肿瘤细胞的选择性有致死作用,即临床所称的“合成致死效应”在DNA 损伤修复与细胞凋亡中发挥重要作用。因此,奥拉帕利在结直肠癌患者术后的辅助化疗中有良好的抗肿瘤作用。CA19-9、CA242、CEA 均为直肠癌患者最常见的肿瘤标志物,能够反映患者的病情变化。本研究中观察组治疗后肿瘤标志物CA19-9、CA242、CEA均低于对照组,从分子生物学角度证实了奥拉帕利对于直肠癌患者有良好的治疗效果[10]。
3.2 奥拉帕利对结直肠癌患者免疫功能的影响
癌症患者的免疫功能处于较低水平,表现为免疫功能指标水平紊乱,其中CD3+能反映细胞免疫功能状态,CD4+为调控免疫反应最重要的枢纽细胞,CD8+为免疫反应中直接杀伤性细胞,CD4+/CD8+比值代表细胞免疫功能平衡。本研究中观察组治疗后CD3+、CD4+、CD4+/CD8+高于对照组,CD8+低于对照组(P<0.05),表明奥拉帕利的应用能够提升患者的免疫功能,这得益于奥拉帕利能够改善患者的肿瘤免疫微环境,提升患者免疫功能,这也验证了既往临床报道中关于奥拉帕利提升癌症患者免疫功能的论断[11]。
3.3 奥拉帕利对结直肠癌炎症相关蛋白表达的影响
本研究中观察组治疗后TSLPR、MAPs、Cx43水平均低于对照组(P<0.05),表明奥拉帕利的应用能够抑制结直肠癌患者炎症性损伤,得益于奥拉帕利的抗氧化应激作用及增加机体的免疫力,抑制肿瘤细胞增殖引起的炎症性损伤。在治疗安全性方面,观察组不良反应未显著增加,表明奥拉帕利在结直肠癌患者治疗中安全性良好。
综上所述,奥拉帕利片在结直肠癌术后患者中的应用效果良好,能够提高患者的疾病缓解率和疾病控制率,降低患者肿瘤标志物水平,提升患者免疫功能,抑制TSLPR、MAPs、Cx43 等炎症相关蛋白的表达,且治疗安全性良好,可在结直肠癌术后患者中推广应用。
