伪狂犬病毒在BHK-21悬浮细胞中的增殖特性
2022-06-12陈丽倪敏舒徐悦鲍熹恽君雯冯磊郭美锦
陈丽 倪敏舒 徐悦 鲍熹 恽君雯 冯磊 郭美锦





摘要:为考察BHK-21悬浮细胞增殖伪狂犬病毒(Pseudorabies virus,PRV)工艺参数及病毒增殖过程中代谢动力学,将PRV接种于BHK-21悬浮细胞,考察接毒时细胞密度、病毒感染复数(MOI)及收毒时间对病毒效价的影响,测定培养过程中葡萄糖(Gluc)、乳酸(Lac)和谷氨酰胺(Gln)浓度,计算病毒增殖过程中各参数代谢速率。结果显示,将MOI为0.01 的PRV病毒接种BHK-21悬浮细胞,其病毒滴度在42 h达最高8.5 lgTCID50/mL。代谢参数检测结果表明,BHK-21细胞在接毒36 h后细胞开始出现死亡。PRV在BHK-21悬浮细胞中的增殖特性为伪狂犬病毒的规模化培养及疫苗开发提供了技术基础。
关键词:BHK-21细胞;伪狂犬病毒;悬浮培养;细胞代谢特性
中图分类号:S852.65+5 文献标志码: A
文章编号:1002-1302(2022)10-0166-05
伪狂犬病是一种由伪狂犬病毒(pseudorabies virus,PRV)诱发的急性传染病[1-2]。该病具有传播速度快、病死率高、病原体顽固等特点[3-4]。世界范围内已有几十个地区报道过该病,约有35种动物可感染此病,猪是主要的病毒储存宿主和传染源[5]。中国自从在1947年第一次发现该病,现已扩展到多个地区,给我国养猪产业带来沉重的经济损失,并且该病具有不断蔓延的趋势[6-7]。防治和消灭PRV的主要手段是接种疫苗[8-9]。目前,国内的伪狂犬病疫苗生产工艺沿用传统技术,采用Vero、BHK-21 等贴壁细胞培养,其操作要求高、工艺复杂、病毒效价不稳定,实际应用有限[10]。因此,建立高效的病毒悬浮培养体系尤为重要[11]。幼地仓鼠肾细胞(baby hamster kidney,BHK-21)可进行体外增殖PRV,是PRV增殖的最优宿主细胞之一[12-13]。利用生物反应器连续悬浮生产具有操作简单、易放大、易控制、产品纯度高、稳定性好等特点[14-15],可提高病毒制备效率。因此,反应器悬浮培养是当今生物医药、兽用医药行业的核心技术。
本研究以伪狂犬病毒为对象,对其在BHK-21悬浮细胞上的生长、代谢及PRV增殖能力进行研究,建立了最佳病毒培养工艺,以期为大规模工业制备伪狂犬病疫苗奠定技术基础。
1 材料与方法
1.1 细胞及毒株
BHK-21细胞、BHK-21悬浮细胞和PRV毒种,均由江苏省农业科学院动物免疫工程研究所提供。
1.2 主要试剂及设备
DMEM 培养基,新生牛血清(newborn calf serum,NBS),购自Gibco公司;悬浮培养基,购自内蒙古金源康公司;二氧化碳培养箱(Thermo);生物反应器(Applikon);-80 ℃超低温冰箱(Thermo);倒置显微镜(OLYMPUS);二氧化碳摇床等。
1.3 不同细胞密度接毒对病毒滴度影响
调整BHK-21悬浮细胞密度为0.5×106、1.0×106、2.0×106、3.0×106 cells/mL,按MOI 0.01接毒PRV,置于37 ℃、5.0% 二氧化碳摇床中 170 r/min 培养,分别在接毒后24 h和48 h取样,测定病毒滴度。
1.4 不同MOI和收毒时间对病毒滴度影响
调整BHK-21悬浮细胞密度为1×106 cells/mL,分别接种MOI为0.0 001、0.001、0.01、0.1 PRV,置于37 ℃、5.0% 二氧化碳摇床中170 r/min培养,分别在接毒后不同时间取样,测定病毒滴度。
1.5 营养物、代谢物检测及代谢速率计算
BHK-21细胞比生长速率μ(h-1)计算公式:
μ=1t·lnCtC0。(1)
式中:t为时间,h;Ct为在时间t时活细胞的密度,个/mL;C0为初始活细胞密度,个/mL。
采用Nova 400生化分析仪测出葡萄糖、谷氨酰胺及乳酸浓度。葡萄糖比消耗速率(qGlu)、谷氨酰胺比消耗速率(qGln)、乳酸比生成速率(qLac),乳酸对葡萄糖消耗的得率系数(YLac/Glu)分别按公式 (2)~(4)进行计算:
qGlu或qGln=1x·dSdt;(2)
qLac=1x·dPdt;(3)
YLax/Glu=-dPdS。(4)
式中:X为活细胞密度,106个/mL;t为时间,h;S为葡萄糖浓度或谷氨酰胺浓度,mmol/L;P为乳酸浓度,mmol/L。
摄氧率[OUR,mmol/(L·h)]及比耗氧速率[SOUR,mmol/(g·h)]测定:以进气和尾气中惰性气体N2维持恒定建立平衡方程[16-17],计算OUR和SOUR:
OUR=FinVCO2in-C惰in·CO2in1-(CO2out+CCO2out·f;(5)
f=273273+Tin·Pin·11+h×10-5;(6)
SOUR=OURX。(7)
式中:Fin表示进气流量,min;V表示反应器细胞总体积,L;C惰in表示进气中惰性气体质量分率;CO2in表示进气中O2质量分率;CCO2in表示进气中CO2质量分率;CO2out表示排气中O2质量分率;CCO2out表示排氣中CO2质量分率;Tin表示进气温度 ℃;Pin表示进气压强,Pa;h表示进气相对湿度,%;X表示活细胞密度,106个/mL。
1.6 PRV在BHK-21悬浮细胞中增殖培养方法
溶氧(DO)电极和pH标定完后,与1 L罐体一起用121 ℃高压灭菌40 min,BHK-21悬浮细胞以初始细胞密度为5×105 cells/mL,DO为50%,pH值为7.2,搅拌速度为150 r/min,培养温度为37 ℃ 进行培养。细胞密度达4×106 cells/mL后分配至4个平行生物反应器中,不同时间取样细胞计数,测定病毒效价以及葡萄糖、乳酸、谷氨酰胺等浓度。
1.7 病毒滴度的测定
含10%牛血清正常培养的BHK-21细胞在96孔板上长至单层时,弃上清,接入10倍连续梯度稀释的病毒样品,每孔加入100 μL,病毒稀释液采用含2%牛血清DMEM培养基,设正常细胞对照仅加维持液100 μL;放置于37 ℃、5.0% CO2培养箱中培养,每天观察接毒后细胞与空白对照细胞形态,连续观察4~5 d直至细胞病变不再增加,记录最终结果,按Reed-Muench两氏法计算病毒滴度,结果以lg TCID50/mL表示。
2 结果与分析
2.1 不同细胞密度接毒对病毒滴度的影响
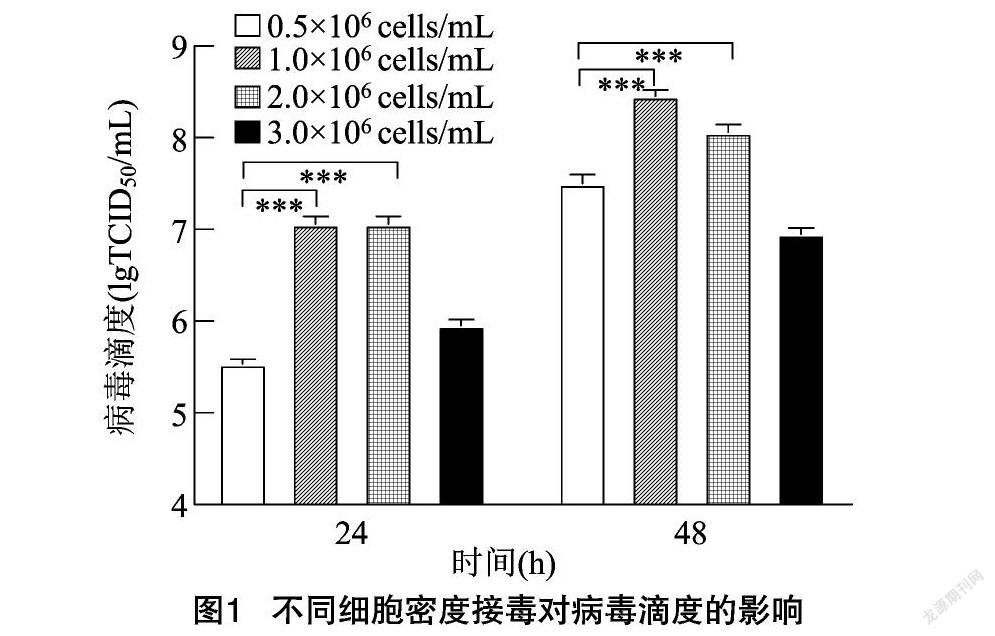
BHK-21不同细胞密度增殖PRV病毒滴度结果见图1。由图1可知,MOI为0.01时,PRV在BHK-21细胞密度分别为0.5×106 和3×106 cells/mL接毒时 48 h 病毒滴度明显低于1×106 和2×106 cells/mL接毒时滴度,1×106 cells/mL细胞密度接毒时病毒滴度最高。从培养基、种子培养时间与产品效价综合考虑,降低接毒时细胞密度可节约培养基用量和细胞培养时间,降低疫苗生产成本,因此生产中最佳接毒细胞密度为1×106 cells/mL。
2.2 不同MOI和收毒时间对病毒滴度的影响
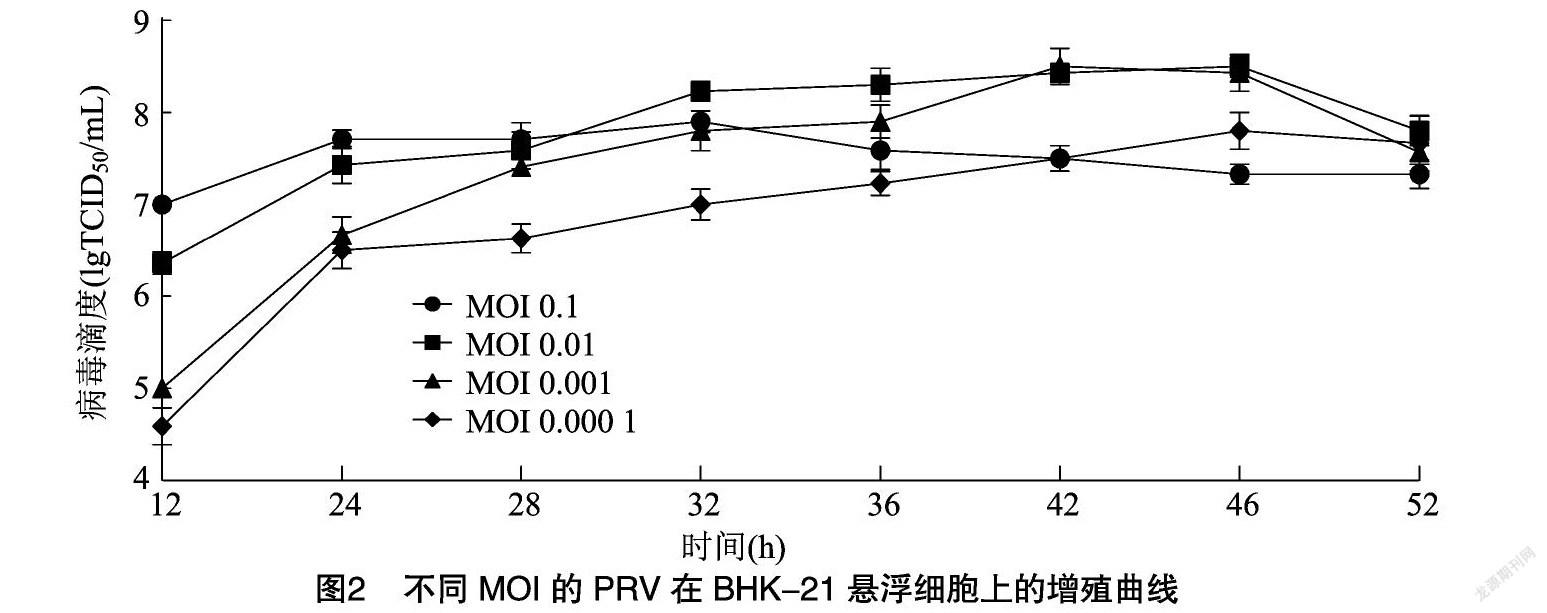
不同MOI接种BHK-21悬浮细胞后的病毒增殖滴度结果见图2。由图2可知,PRV在BHK-21细胞中增殖速度较快,即使MOI为0.000 1时,24 h病毒滴度仍能达6.0 lgTCID50/mL以上,MOI为0.01和0.001时最高病毒滴度在42 h和46 h无明显差异,均达8.5 lgTCID50/mL,优于其他病毒接毒指数。因此,以MOI为0.01接毒42 h后收获最佳。
2.3 PRV接毒后细胞存活率变化
BHK-21悬浮细胞以MOI为0.01接毒PRV,在整个细胞生长增殖过程中,每24 h进行取样。由图3可知,PRV病毒增殖过程中细胞存活率(viability)结果表明,PRV感染36 h前对照细胞和接毒细胞存活率差异不显著,均维持在95% 以上,这可能是由于在初始阶段病毒还未大量增殖裂解。接毒42 h后细胞存活率急剧下降,说明大量病毒已经释放到胞外。
2.4 PRV增殖过程中代谢分析
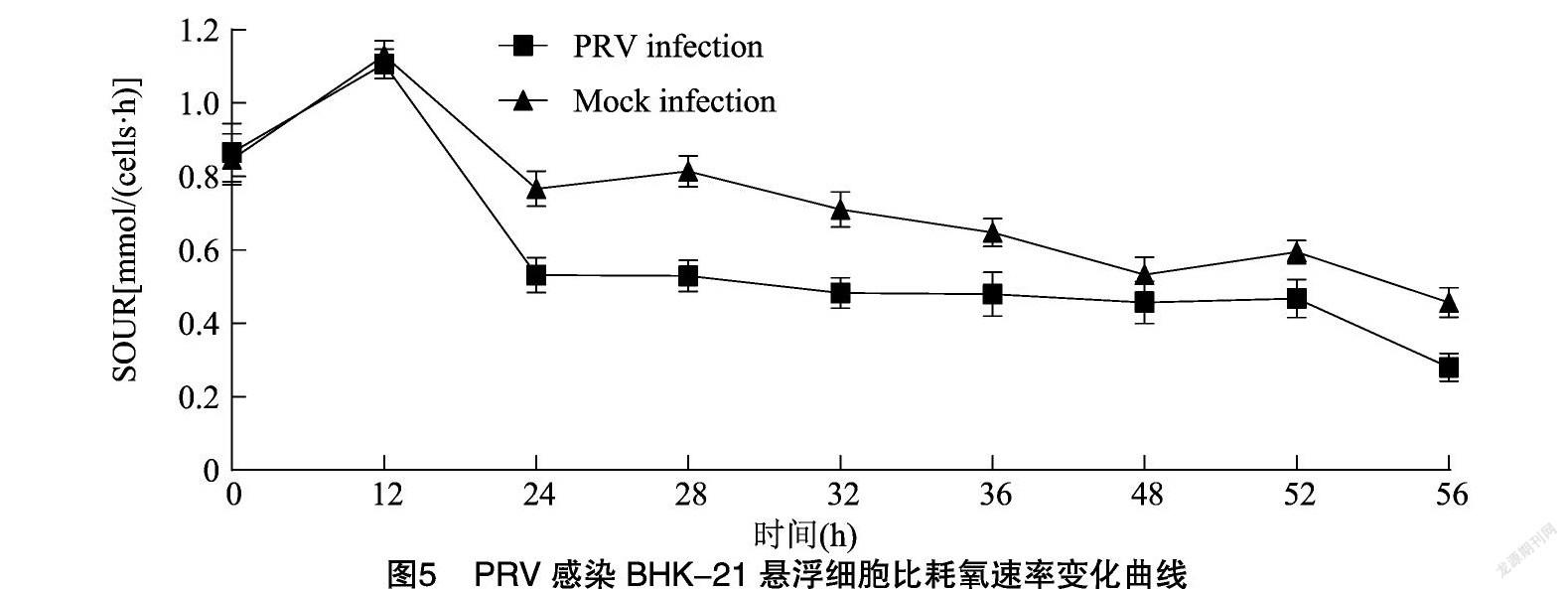
摄氧速率(oxygen uptake rate,OUR)及比耗氧速率(specific oxygen uptake rate,SOUR)可以反映细胞的耗氧能力及生理状态,由图4、图5可知,OUR和SOUR在接毒后12 h前保持较高的水平,说明细胞依然处于高速生长代谢状态,而接毒后24~36 h 2组细胞耗氧能力略有下降,36 h OUR和SOUR明显下降,说明细胞开始出现死亡现象。
病毒增殖后通过对胞外游离氨基酸的测定,由图6可知,发现天冬氨酸、苏氨酸和丝氨酸浓度随时间逐渐降低,而甘氨酸和脯氨酸则上升,说明在病毒增殖过程中对不同氨基酸有不同需求,可根据代谢分析对培养基进行优化。由接毒细胞和对照细胞各代谢参数结果(表1)可知,接毒后BHK-21细胞μ、qgluc及qGln明显低于对照组细胞,而qLac结果与对照组相当,表现为YLac/Glu系数升高,这可能是接毒后,在葡萄糖代谢过程中,仅有部分糖酵解产生的丙酮酸进入三羧酸循环 进而导致丙酮酸在细胞质中积累,并通过乳酸脱氢酶转化为乳酸[18-19]。
3 结论与讨论
本研究考察了BHK-21悬浮细胞增殖伪狂犬病毒工艺参数及病毒增殖过程中代谢速率变化。病毒增殖过程中受到诸多因素影响,如病毒接毒时细胞密度、MOI、收毒时间、培养液组成及pH值等[20],结果显示,BHK-21接毒时细胞密度为1×106病毒滴度略高于2×106 cells/mL,随着MOI增加病毒最佳收毒时间逐渐缩短,从接毒量与产品效价综合考虑,用MOI为0.01接毒42 h收毒最佳。因此,该病毒最佳接毒时细胞密度为1×106 cells/mL,MOI指数为0.01,收毒时间为42 h左右。MOI低于相关文献[21],可能是由于本研究采用悬浮BHK-21细胞进行接毒培养,增殖能力优于贴壁细胞。
细胞的摄氧率(OUR)直接反映了细胞代谢底物碳源(如葡萄糖)能量的生理状况 而比耗氧速率(SOUR)反映单位细胞消耗氧的快慢速率,它主要与细胞所利用的碳源还原度及细胞内代谢途径有关[22-24]。在大规模培养过程中,OUR可作为活细胞密度等参数的“预警”指标[25]。本研究中PRV接毒后36 h,OUR不断下降表明细胞耗氧减少,表明BHK-21细胞开始出现死亡现象。
在许多情况下,体外培养细胞的新陈代谢可能会发生变化,包括营养浓度的变化、培养形式的变化、代谢产物的累积和环境的改变等[26-27]。葡萄糖和谷氨酰胺是细胞培养基中的主要碳源和能源,葡萄糖可以采用糖酵解途径为细胞供应物质和能量,进而产生乳酸,僅仅有少部分进入磷酸戊糖途径和三羧酸循环(TCA)[28-29]。本研究PRV接毒后乳酸对葡萄糖的得率系数升高(表1),说明接毒后很多葡萄糖采用糖酵解方式为细胞提供碳源和能源,从而引起氨基酸代谢通量发生改变(图6)。本研究获得BHK-21悬浮细胞增殖PRV的最佳培养条件,为获得伪狂犬病毒的规模化培养及疫苗开发提供了技术基础。
参考文献:
[1]Müller T,Hahn E C,Tottewitz F,et al. Pseudorabies virus in wild swine:a global perspective[J]. Archives of Virology,2011,156(10):1691-1705.
[2]Tan L,Yao J,Yang Y D,et al. Current status and challenge of pseudorabies virus infection in China[J]. Virologica Sinica,2021,36(4):588-607.
[3]Sozzi E,Moreno A,Lelli D,et al. Genomic characterization of pseudorabies virus strains isolated in Italy[J]. Transboundary and Emerging Diseases,2014,61(4):334-340.
[4]Zhou M M,Wu X J,Jiang D D,et al. Characterization of a moderately pathogenic pseudorabies virus variant isolated in China,2014[J]. Infection,Genetics and Evolution,2019,68:161-171.
[5]Vallbracht M,Fuchs W,Klupp B G,et al. Functional relevance of the transmembrane domain and cytoplasmic tail of the pseudorabies virus glycoprotein H for membrane fusion[J]. Journal of Virology,2018,92(12):e00376-18.
[6]Yan K,Liu J E,Guan X A,et al. The carboxyl Terminus of tegument protein pUL21 contributes to pseudorabies virus neuroinvasion[J]. Journal of Virology,2019,93(7):e02052-18.
[7]An T Q,Peng J M,Tian Z J,et al. Pseudorabies virus variant in Bartha-K61-vaccinated pigs,China,2012[J]. Emerging Infectious Diseases,2013,19(11):1749-1755.
[8]Wang J C,Guo R L,Qiao Y F,et al. An inactivated gE-deleted pseudorabies vaccine provides complete clinical protection and reduces virus shedding against challenge by a Chinese pseudorabies variant[J]. BMC Veterinary Research,2016,12(1):277.
[9]Delva J L,Nauwynck H J,Mettenleiter T C,et al. The attenuated pseudorabies virus vaccine strain bartha K61:a brief review on the knowledge gathered during 60 years of research[J]. Pathogens,2020,9(11):897.
[10]Wang G S,Du Y J,Wu J Q,et al. Vaccine resistant pseudorabies virus causes mink infection in China[J]. BMC Veterinary Research,2018,14(1):20.
[11]Nikolay A,Castilho L R,Reichl U,et al. Propagation of Brazilian Zika virus strains in static and suspension cultures using Vero and BHK cells[J]. Vaccine,2018,36(22):3140-3145.
[12]Lv C J,Liu W K,Wang B,et al. Ivermectin inhibits DNA polymerase UL42 of pseudorabies virus entrance into the nucleus and proliferation of the virus in vitro and vivo[J]. Antiviral Research,2018,159:55-62.
[13]陈 丽,冯 磊,鲍 熹,等. 一株幼地仓鼠肾细胞低免疫力细胞株及其构建方法和应用:CN112048478A[P]. 2020-12-08.
[14]Núez E G F,Leme J,de Almeida Parizotto L,et al. Approach toward an efficient inoculum preparation stage for suspension BHK-21 cell culture[J]. Cytotechnology,2016,68(1):95-104.
[15]馮 磊,王伟峰,吴培培,等. 生物反应器中PRRSV工业规模增殖工艺的建立[J]. 江苏农业科学,2016,44(2):247-251.
[16]Chen L,Mohsin A,Chu J,et al. Enhanced protein production by sorbitol co-feeding with methanol in recombinant Pichia pastoris strains[J]. Biotechnology and Bioprocess Engineering,2017,22(6):767-773.
[17]馮 磊,吴培培,褚 轩,等. MDCK单细胞悬浮生长的驯化筛选及其在AIV增殖上的初步应用[J]. 浙江农业学报,2015,27(6):913-920.
[18]Gou H C,Zhao M Q,Yuan J,et al. Metabolic profiles in cell lines infected with classical swine fever virus[J]. Frontiers in Microbiology,2017,8:691.
[19]Nolan R P,Lee K.Dynamic model of CHO cell metabolism[J]. Metabolic Engineering,2011,13(1):108-124.
[20]Bora M,Yousuf R W,Dhar P,et al. An overview of process intensification and thermo stabilization for upscaling of Peste des petits ruminants vaccines in view of global control and eradication[J]. VirusDisease,2018,29(3):285-296.
[21]Wang J C,Song Z C,Ge A M,et al. Safety and immunogenicity of an attenuated Chinese pseudorabies variant by dual deletion of TK&gE genes[J]. BMC Veterinary Research,2018,14(1):287.
[22]陈 丽. 多拷贝毕赤酵母重组菌表达PIP生理特性和动力学研究[D]. 上海:华东理工大学,2011.
[23]Martínez-Monge I,Comas P,Triquell J,et al. A new strategy for fed-batch process control of HEK293 cell cultures based on alkali buffer addition monitoring:comparison with O.U.R.dynamic method[J]. Applied Microbiology and Biotechnology,2018,102(24):10469-10483.
[24]Rodriguez A,Escobar S,Gomez E,et al. Behavior of several Pseudomonas putida strains growth under different agitation and oxygen supply conditions[J]. Biotechnology Progress,2018,34(4):900-909.
[25]Maralingannavar V,Parmar D,Pant T,et al. CHO Cells adapted to inorganic phosphate limitation show higher growth and higher pyruvate carboxylase flux in phosphate replete conditions[J]. Biotechnology Progress,2017,33(3):749-758.
[26]Gou H C,Bian Z B,Li Y,et al. Metabolomics exploration of pseudorabies virus reprogramming metabolic profiles of PK-15 cells to enhance viral replication[J]. Frontiers in Cellular and Infection Microbiology,2021,10:599087.
[27]Crémillieux Y,Dumont U,Mazuel L,et al. Online quantification of lactate concentration in microdialysate during cerebral activation using 1 H-MRS and sensitive NMR microcoil[J]. Frontiers in Cellular Neuroscience,2019,13:89.
[28]Kelly W,Veigne S,Li X H,et al. Optimizing performance of semi-continuous cell culture in an ambr15? microbioreactor using dynamic flux balance modeling[J]. Biotechnology Progress,2018,34(2):420-431.
[29]Villaverde A F,Bongard S,Mauch K,et al. Metabolic engineering with multi-objective optimization of kinetic models[J]. Journal of Biotechnology,2016,222:1-8.
