江苏省大豆上一种新粉虱传病毒的分子鉴定及系统进化分析
2022-06-12吉颖吴淑华崔晓艳涂丽琴高丹娜程兆榜周益军陈新季英华郭青云
吉颖 吴淑华 崔晓艳 涂丽琴 高丹娜 程兆榜 周益军 陈新 季英华 郭青云





摘要:2019年在对江苏大豆上病毒病进行调查时,发现徐州和淮安大豆田间出现一种表现叶片黄化、花叶症状的病毒病,为明确其伴随病毒种类,对田间采集的70份疑似病样进行分子检测和鉴定,结果在利用香石竹潜隐病毒属(Carlavirus)通用引物检测时发现,70份疑似病样中有15份样品扩增到800 bp左右的目的片段,序列测定后BLAST分析结果显示,其与一种粉虱传病毒——豇豆轻斑驳病毒CpMMV(cowpea mild mottle virus,CpMMV)的同源性最高,暗示了其可能是CpMMV的一个分离物。针对CpMMV编码的CP基因设计特异性引物,检测结果显示15份阳性样品均扩增到目的片段,对获得的CP基因片段进行克隆测序,发现其序列全长867 bp,编码分子量约为32ku的蛋白;序列聚类分析结果显示,其与已报道的CpMMV分离物有较高的同源性,并聚类到同一个大的分支,其中与安徽、海南等地分离物相对近缘,聚在同一个小分支。这些结果表明江苏大豆存在豇豆轻斑驳病毒的侵染危害,生产上需要密切关注。
关键词:大豆;豇豆轻斑驳病毒;分子鉴定;聚类分析;进化树构建
中图分类号: S435.651 文献标志码: A
文章编号:1002-1302(2022)10-0030-07
大豆(Glycine max L.)作为一种重要的经济作物,既是最常见油料作物,也是食品、饲料等行业的主要植物蛋白来源,在世界各地均有种植[1]。随着种植区域的扩张,大豆上病毒病的发生呈现多发常发态势。据报道,在美国可侵染大豆的病毒有110种,在中国也有50多种[2],例如大豆花叶病毒(soybean mosaic virus,SMV)、花生轻型斑驳病毒(peanut mild mottle virus,PMMV)、大豆矮缩病毒(soybean dwarf virus,SbDV)、黄瓜花叶病毒(cucumber mosaic virus,CMV)、苜蓿花叶病毒(alfalfa mosaic virus,AMV)、豇豆轻斑驳病毒(cowpea mild mottle virus,CpMMV)等[3-5]。
豇豆轻斑驳病毒(cowpea mild mottle virus,CpMMV)是一种烟粉虱传播的植物病毒[6],有相关报道亦可种传[7-8],可侵染豆科、茄科、藜科和葫芦科等多种植物。CpMMV侵染寄主植物常引起叶片斑驳症状,有些作物叶片会伴有系统性斑點、畸形、褪绿甚至坏死等症状[8],严重影响作物产量和品质。1973年,Brunt 等首次报道加纳豇豆上出现CpMMV的危害[8],随后该病毒迅速蔓延,在巴西[9]、尼日利亚[10]、约旦[11]、泰国[12]、印度[13]、坦桑尼亚[14]、以色列[15]、苏丹[16]、阿根廷[17]、伊朗[18]、波多黎各[19]、委内瑞拉[20]、美国[21]、贝宁[22]、乌干达[23]、墨西哥[24]、肯尼亚[25]等多个国家和地区均有该病毒的报道。在中国,2013年Chang等首次报道台湾豇豆和四季豆上存在CpMMV的侵染危害[26];2015年刘雪建利用小RNA深度测序及RT-PCR技术在江西四季豆上检测到CpMMV[27];2019年,杨晓等报道海南豇豆上也出现CpMMV的危害[5];但目前CpMMV在大豆上仅安徽有危害报道[28]。
CpMMV隶属于芜菁黄花叶病毒目(Tymovirales)乙型线状病毒科(Betaflexiviridae)香石竹潜隐病毒属(Carlavirus)[29],其基因组是正单链RNA,长度约为8 200 bp,病毒粒子为弯曲的丝状颗粒(约650 nm×15 nm),具有5′末端帽子结构和3′末端Poly(A)尾,编码6个蛋白:ORF1编码复制酶蛋白,含4个保守的基序,即甲基转移酶、C23肽酶、解旋酶和RNA聚合酶(RNA dependent RNA polymerase,RdRp)[30-33];ORF2、ORF3和ORF4编码病毒运动所必需的三重基因模块(TGB1-3,大小分别为250、11.6、7.5 ku);ORF5编码外壳蛋白(coat protein,CP,32 ku);ORF6编码一个核酸结合蛋白(nucleic acid binding protein,NBP,15.2 ku)[34]。其中外壳蛋白是CpMMV重要的结构蛋白,且能结合TGB1-3参与病毒胞间运动[35-36],在病毒分类上也是该属一个重要的参考指标[37]。
CpMMV在我国首次报道是2013年(中国台湾地区)[26],随后江西、海南也出现该病毒发生危害的报道[5,27],而对于大豆,只在安徽有侵染危害报道[28]。2019年笔者在江苏徐州和淮安的田间发现出现疑似病毒感染的大豆病株,大豆病样采集后经分子检测与鉴定,结果在大豆病样中检测到CpMMV,之后的序列分析结果也证实了这一结果,说明CpMMV在江苏大豆上已存在危害。
1 材料与方法
1.1 供试病样
病样为2019年采自江苏省徐州市和淮安市疑似感染病毒病的大豆样本,共70份,对照为网室内培养的健康大豆苗,样本采集后用液氮处理,于 -80 ℃ 保存备用。
1.2 病样总RNA提取
取在超低温冰箱中的大豆样品,液氮处理后置于研磨机中研磨至粉末,采取Trizol法[38]提取样品总RNA,保存于-80℃冰箱备用。
1.3 病样RT-PCR检测
以病样总RNA为模板,用PrimeScriptTM RT Master Mix进行反转录得到cDNA。反应体系(20 μL):病样总RNA 1 μL,5×PrimeScript RT Master Mix 4 μL,用RNase-Free H2O补足至总体积20 μL。反应程序:37 ℃恒温15 min,85 ℃变性 5 s,4 ℃保存,获得cDNA。对其进行PCR检测,PCR反应体系(10 μL):2×Taq Master Mix 5 μL,ddH2O 3 μL,Car_F2b和Car_R(表1)各0.5 μL,cDNA 1 μL。反应程序:95 ℃预变性3 min;95 ℃变性 15 s,47 ℃退火15 s,72 ℃延伸55 s,32个循环;72 ℃ 延伸6 min,4 ℃保存。取5 μL PCR反应产物在0.5 × TAE电泳缓冲液中,用1%琼脂糖凝胶电泳分离PCR产物并拍照,将扩增出的与目的片段一致的产物送通用生物系统(安徽)有限公司测序。
1.4 CpMMV CP基因克隆
依据CpMMV外壳蛋白序列设计一对特异引物CpMMCP_F和CpMMCP_R(表1),以检测结果为阳性的cDNA为模板进行RT-PCR扩增。扩增体系(20 μL):2×Rapid Taq Master Mix 10 μL,CpMMCP_F和CpMMCP_R各 1 μL,cDNA 1 μL,ddH2O 7 μL;PCR反应程序:95 ℃ 3 min;95 ℃ 15 s,51 ℃ 15 s,72 ℃ 30 s,循环 34 次;72 ℃ 5 min,4 ℃保存。PCR产物于经1%琼脂糖凝胶电泳检测,回收纯化目的片段,将其与pMD-18T载体在16 ℃下连接过夜。连接产物转化大肠杆菌Trans1-T1感受态细胞后涂布到含有氨苄青霉素的LB平板上,在37 ℃恒温培养箱倒置培养。挑LB平板上的单克隆进行菌落PCR和酶切验证,鉴定无误后将菌液送通用生物系统(安徽)公司进行测序。
1.5 序列测定及分析
委托通用生物系统(安徽)公司完成测序。使用ClustalX、BioEdit、DNAstar、MEGA6等软件及NCBI网站上的BLAST程序(http://www.ncbi.nlm.nih.gov/BLAST/Blast.cgi)完成聚类分析及进化树构建,进化树的可信度使用1 000次自导复制实现评价。
2 结果与分析
2.1 病害田间症状
2019年,笔者在对江苏大豆上病害进行调查时发现徐州和淮安大豆上存在疑似病毒侵染的病株,发病大豆植株田间主要表现叶片黄化、花叶等症状(图1),病害田间多呈零星发生,个别田块局部区域发病较重。
2.2 香石竹潜隐病毒属(Carlavirus)病毒检测
大豆上发生的病毒病多种多样,对大豆病样的RNA进行RT-PCR检测能明确其感染的病毒种类,在利用Carlavirus通用引物Car_F2b和Car_R对大豆样品进行检测时发现, 70份疑似病样中有15份(徐州14份,淮安1份)扩增到与目的条带(800 bp)大小相近的片段,而健康对照中没有扩增到条带(图2),说明大豆病样中可能有香石竹潜隐病毒属病毒的感染。为明确病毒的种类,抽选5份样品进行序列测定,序列BLAST分析结果显示其与豇豆轻斑驳病毒(MN908944)同源性最高(9891%),说明在徐州和淮安采集的大豆样品中可能存在着豇豆轻斑驳病毒的侵染。
2.3 豇豆轻斑驳病毒的分子检测
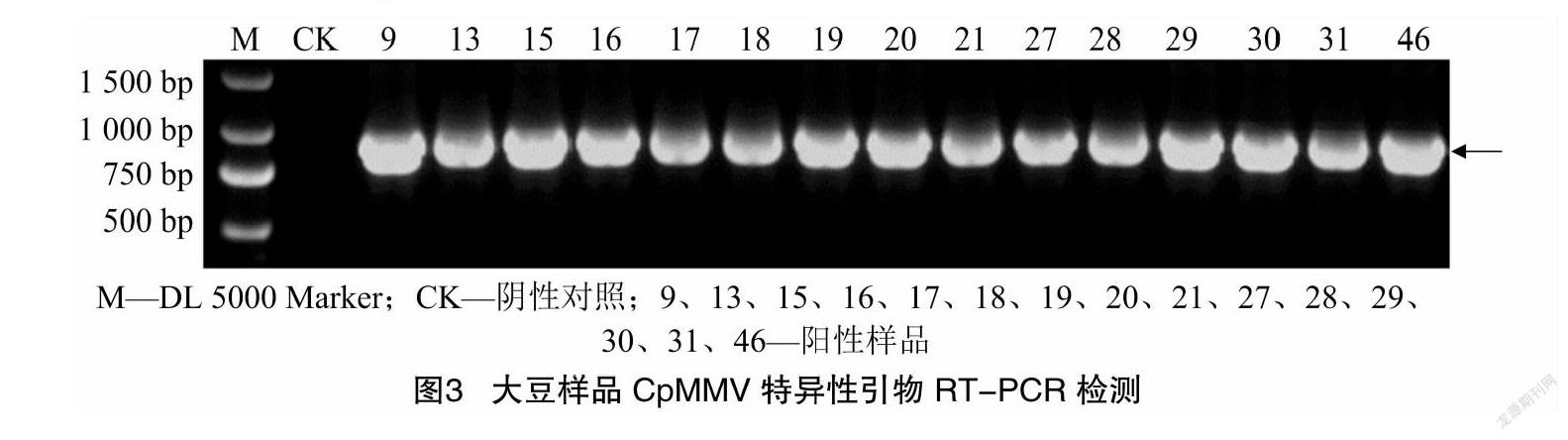
为进一步验证检测到的病毒是CpMMV,笔者针对CpMMV的CP基因设计一对特异性扩增引物CPMMCP_F和CPMMCP_R,RT-PCR结果显示,15份阳性样品均扩增到了与目的条带大小(867 bp)相近的特异性条带(图3),即CpMMV的CP基因条带,这进一步说明样品中确有可能存在CpMMV的感染。
2.4 豇豆轻斑驳病毒CP基因克隆及其序列分析
随机抽选3个样品进行CP基因PCR扩增(图4-a),经单菌落PCR和酶切验证(图4-b)后送通用生物系统(安徽)公司进行测序。
对获取的6个CP基因克隆进行测序,结果显示,序列全长都为867 bp,编码一个由289个氨基酸组成的分子量约32 ku的蛋白。序列之间有很高的同源性,BLAST分析結果表明,它们与CpMMV(MT232837)同源性最高(99%),暗示了其属于CpMMV的一个分离物。
2.5 豇豆轻斑驳病毒CP基因系统进化分析
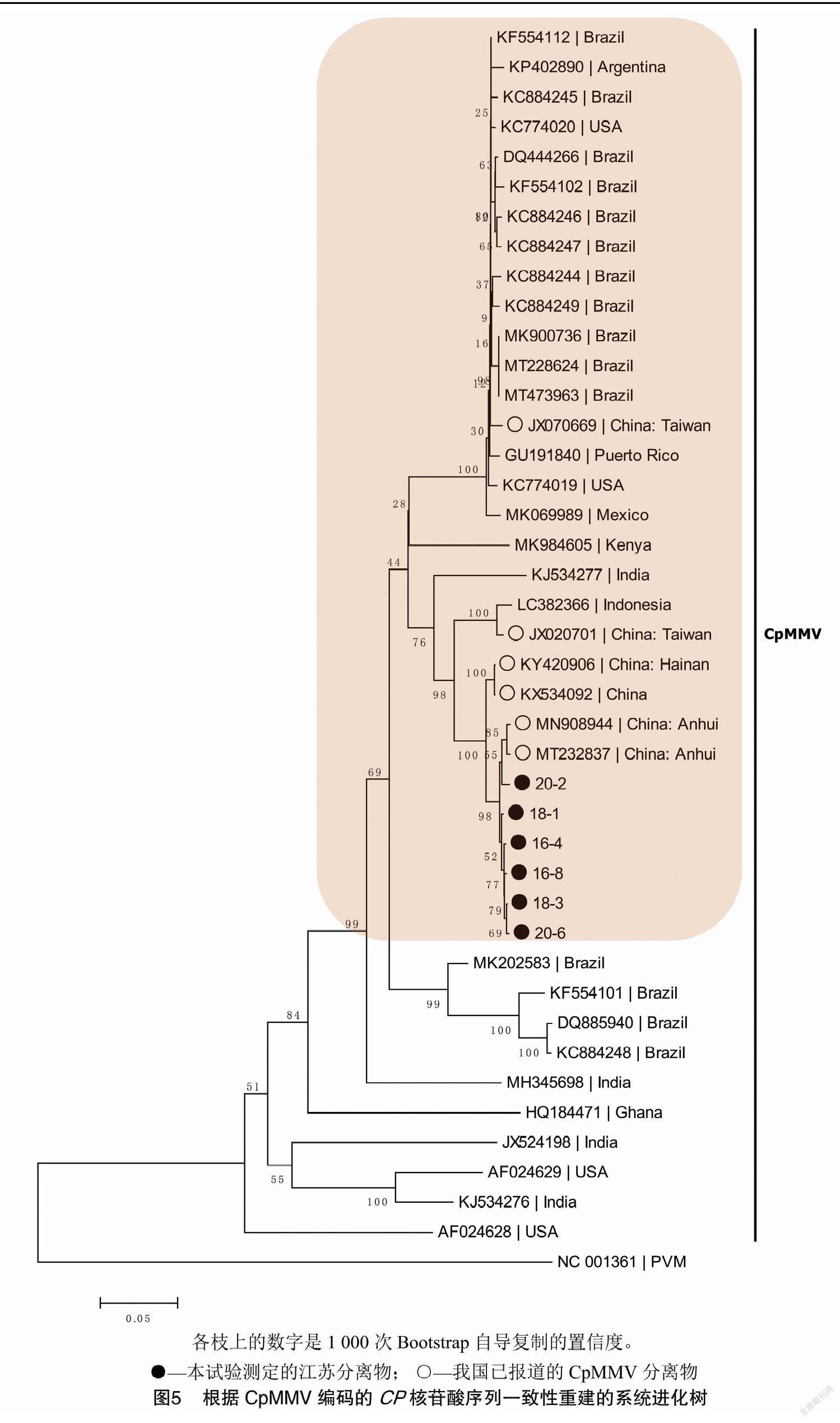
使用ClustalX等软件将本研究测定的CpMMV CP序列与已公开的其他CpMMV分离物CP基因序列(表2)进行比对,同时利用MEGA 6软件,使用临近法(neighbor-joining,NJ)、Kimura 2-parameter模型重建了系统进化树(图5),各个分枝的Bootstrap置信度用1 000次自导复制来评价。
基于CP核苷酸序列重建的系统进化分析结果(图5、表2)显示,本研究测定的分离物在进化树中全部聚类到CpMMV大分支中,说明检测到的病毒为CpMMV的一个分离物;同时结果还显示,江苏分离物与我国的安徽大豆分离物、海南豇豆分离物、台湾菜豆分离物(JX020701)、印尼大豆分离物及印度黑吉豆分离物(KJ534277)相对近缘共同聚类到一个分支,其中与安徽大豆分离物最为近缘,而与中国台湾豇豆分离物(JX070669)及其他国外分离物相对远缘,分别处在不同的分支上。这些分析结果进一步说明本研究在江苏大豆上检测到的病毒为CpMMV的一个分离物。
3 讨论
江苏省大豆栽植面积在25万hm2左右,是我国重要的大豆产区之一[40]。近年来随着各地经贸往来(种苗调运)的频繁和农业种植模式的改变,加之传播介体的大发生,大豆病毒病呈多发态势,而大豆病毒病危害通常会导致10%~15%的产量损失,复合侵染往往会加重产量损失[21]。本研究对2019年采集于江苏省徐州和淮安地区的大豆病样进行检测时,发现其中伴随有病毒侵染,进一步通过基因克隆及序列分析等方法对其进行了鉴定,结果显示,它属于CpMMV的一个分离物,该病毒之前在我国台湾(菜豆、四季豆)[26]、江西(四季豆)[27]、海南(豇豆)[5]和安徽(大豆)[28]有发生危害的报道,但江苏尚未有发生危害的报道,因此本研究是CpMMV侵染江苏大豆的第1个报道,同时CpMMV也是第1个侵染危害江苏省大豆的粉虱传病毒。
CpMMV是我国近几年来新发生的一种重要的粉虱传播的植物病毒,能够侵染豆科和茄科多种作物,目前已广泛分布于亚洲、美洲和非洲[7-8,21],对包括大豆在内的多种作物造成了严重的经济损失[8]。目前我国安徽、海南等地已经出现CpMMV发生危害,本研究报道江苏也有该病毒发生危害,但目前我国大豆对该病毒的抗性尚不明确,而该病毒可由烟粉虱传播,且近几年来病毒传播介体烟粉虱的大发生,极有可能导致该病毒在更大范围流行危害,因此生产上应当高度重视,密切关注该病毒的危害动态,早发现、早防控,避免扩散蔓延至全国范围造成更大的危害和损失。
由于大豆上的病毒種类繁多,本研究中除了对CpMMV进行检测外,同时也对其他大豆常见病毒如黄瓜花叶病毒、菜豆普通花叶病毒、大豆花叶病毒等进行了检测,结果在这批样品中也检测到了菜豆普通花叶病毒等病毒,说明江苏大豆上病毒种类相对比较复杂,要摸清江苏大豆上的病毒种类还需后续更广泛的样品采集和更为系统的病毒种类调查。
参考文献:
[1]赵团结,盖钧镒. 栽培大豆起源与演化研究进展[J]. 中国农业科学,2004,37(7):954-962.
[2]智海剑. 大豆对大豆花叶病毒抗侵染和抗扩展特性的鉴定、遗传和利用研究[D]. 南京:南京农业大学,2005:3.
[3]单宇航,高维达,于 曼,等. 大豆花叶病毒沈阳分离物全基因测序及系统进化分析[J]. 中国植保导刊,2020,40(2):17-21.
[4]Hobbs H A,Domier L L,Nelson B D. First report of alfalfa mosaic virus and soybean dwarf virus on soybean in North Dakota[J]. Plant Disease,2012,96(12):1829.
[5]杨 晓,张 宇,陈 莎,等. 豇豆轻斑驳病毒海南分离物全基因组序列测定及分子特征[J]. 中国蔬菜,2019(6):35-38.
[6]Muniyappa V,Reddy D V R. Transmission of cowpea mild mottle virus by Bemisia tabaci in a non-persistent manner[J]. Plant Disease,1983,67(4):391-393.
[7]Iwaki M,Thongmeearkom P,Honda Y,et al. Cowpea mild mottle virus occurring on soybean and peanut in southeast Asian countries[J]. Technical Bulletin of the Tropical Agriculture Research Center,1986,21:106-120.
[8]Brunt A A,Kenten R H. Cowpea mild mottle,a newly recognized virus infecting cowpeas (Vigna unguiculata) in Ghana[J]. Annals of Applied Biology,1973,74(1):67-74.
[9]Zanardo L G,Silva F N,Bicalho A A C,et al. Molecular and biological characterization of cowpea mild mottle virus isolates infecting soybean in Brazil and evidence of recombination[J]. Plant Pathology,2014,63(2):456-465.
[10]Brunt A A,Phillips S. ‘Fuzzy vein’,a disease of tomato (Lycopersicon esculentum) in western Nigeria induced by cowpea mild mottle virus[J]. Tropical Agriculture,1981,58(2):177-180.
[11]Mansour A,Al-Musa A,Vetten H J,et al. Properties of a cowpea mild mottle virus (CPMMV) isolate from eggplant in Jordan and evidence for biological and serological differences between CPMMV isolates from leguminons and solanaceous hosts[J]. Journal of Phytopathology,1998,146(11/12):539-547.
[12]Iwaki M,Thongmeearkom P,Honda Y,et al. Whitefly transmission and some properties of cowpea mild mottle virus on soybean in Thailand[J]. Plant Disease,1982,66(1):365-368.
[13]Iizuka N R,Rajeshwari R,Reddy D V R,et al. Natural occurrence of a strain of cowpea mild mottle virus on groundnut (Arachis hypogaea) in India[J]. Journal of Phytopathology,1984,109(3):245-253.
[14]Mink G I,Keswani C L. First report of cowpea mild mottle virus on bean and mung bean in Tanzania[J]. Plant Disease,1987,71(6):557.
[15]Antignus Y,Cohen S. Purification and some properties of a new strain of cowpea mild mottle virus in Israel[J]. Annals of Applied Biology,1987,110(3):563-569.
[16]El-Hassan S M,Naidu R A,Ahmed A H,et al. A serious disease of groundnut caused by cowpea mild mottle virus in the Sudan[J]. Journal of Phytopathology,1997,145(7):301-304.
[17]Rodríguez Pardina P E,Arneodo J D,Truol G A,et al. First report of cowpea mild mottle virus in bean crops in Argentina[J]. Australasian Plant Pathology,2004,33(1):129-130.
[18]Tavassoli M,Shahraeen N,Ghorbani S. Detection and some properties of cowpea mild mottle virus isolated from soybean in Iran[J]. Pakistan Journal of Biological Sciences,2008,11(23):2624-2628.
[19]Brace R C,Fehr W R,Graham M A. Inheritance and molecular mapping of an allele providing resistance to a cowpea mild mottle-like virus in soybean[J]. Crop Science,2012,52(5):2109-2114.
[20]Brito M,Fernández-Rodríguez T,Garrido M J,et al. First report of cowpea mild mottle Carlavirus on yardlong bean (Vigna unguiculata subsp. sesquipedalis) in Venezuela[J]. Viruses,2012,4(12):3804-3811.
[21]Rosario K,Capobianco H,Ng T F F,et al. RNA viral metagenome of whiteflies leads to the discovery and characterization of a whitefly-transmitted Carlavirus in North America[J]. PLoS One,2014,9(1):e86748.
[22]Zinsou V A,Afouda L A C,Zoumarou-Wallis N,et al. Importance of cowpea mild mottle virus on soybean (Glycine max) in Benin and effect of planting date on soybean (G.max) virus level in northern Benin[J]. Crop Protection,2015,72:139-143.
[23]Orawu M,Obuo J,Omadi R. Distribution and detection of cowpea viruses infecting cowpea in Uganda[J]. American Journal of Plant Sciences,2015,6(5):574-581.
[24]Chiquito-Almanza E,Caballero-Pérez J,Guevara-Olvera L,et al. First report of cowpea mild mottle virus infecting cultivated and wild Phaseolus in the central-western region of Mexico[J]. Plant Disease,2018,102(5):1047.
[25]Odhiambo Patrick O,Were H,Ndonga M,et al. First report of cowpea polero virus 1 (CPPV1) infecting cowpea in Kenya[J]. International Journal of Genetics and Genomics,2019,7(4):119-123.
[26]Chang C A,Chien L Y,Tsai C F,et al. First report of cowpea mild mottle virus in cowpea and French bean in Taiwan[J]. Plant Disease,2013,97(7):1001.
[27]劉雪建. 浙江省和江西省蔬菜病毒鉴定与变异研究[D]. 杭州:浙江大学,2015:113-116.
[28]Wei Z Y,Wu G W,Ye Z X,et al. First report of cowpea mild mottle virus infecting soybean in China[J]. Plant Disease,2020,104(9):2534.
[29]King A. Virus taxonomy:ninth report of the international committee on taxonomy of viruses[M]. San Diego:Academic Press,2012:855-881.
[30]Rozanov M N,Koonin E V,Gorbalenya A E. Conservation of the putative methyltransferase domain:a hallmark of the ‘Sindbis-like’ supergroup of positive-strand RNA viruses[J]. Journal of General Virology,1992,73(8):2129-2134.
[31]Koonin E V. The phylogeny of RNA-dependent RNA polymerases of positive-strand RNA viruses[J]. Journal of General Virology,1991,72 ( Pt 9):2197-2206.
[32]Lawrence D M,Rozanov M N,Hillman B I. Autocatalytic processing of the 223-kDa protein of blueberry scorch carlavirus by a papain-like proteinase[J]. Virology,1995,207(1):127-135.
[33]Gorbalenya A E,Koonin E V. Viral proteins containing the purine NTP-binding sequence pattern[J]. Nucleic Acids Research,1989,17(21):8413-8438.
[34]Zanardo L G,Carvalho C M. Cowpea mild mottle virus (Carlavirus,Betaflexiviridae):a review[J]. Tropical Plant Pathology,2017,42(6):417-430.
[35]Wylie S J,Adams M,Chalam C,et al. ICTV virus taxonomy profile:Potyviridae[J]. Journal of General Virology,2017,98(3):352-354.
[36]Lough T J,Netzler N E,Emerson S J,et al. Cell-to-cell movement of potexviruses:evidence for a ribonucleoprotein complex involving the coat protein and first triple gene block protein[J]. Molecular Plant-Microbe Interactions,2000,13(9):962-974.
[37]Adams M J,Antoniw J F,Fauquet C M. Molecular criteria for genus and species discrimination within the family Potyviridae[J]. Archives of Virology,2005,150(3):459-479.
[38]吳淑华,赵文浩,李廷芳,等. 南京辣椒上一种斑驳类型病毒病的分子鉴定[J]. 江苏农业学报,2015,31(6):1284-1290.
[39]Nie X Z,Bai Y J,Molen T A,et al. Development of universal primers for detection of potato carlaviruses by RT-PCR[J]. Journal of Virological Methods,2008,149(2):209-216.
[40]陈 新,顾和平,张红梅,等. 江苏省大豆生产发展历史、现状与前景分析[J]. 江苏农业科学,2011,39(1):6-9.
