干旱胁迫及复水条件下2种抗旱性不同结缕草种质的生长和生理响应
2022-06-09汪毅郭海林宗俊勤陈静波李丹丹李建建刘建秀
汪毅 郭海林 宗俊勤 陈静波 李丹丹 李建建 刘建秀


摘要:结缕草(Zoysia japonica Steud.)种内在抗旱性方面存在广泛的遗传变异,其抗旱机制值得深入探讨。本试验中,将2份抗旱性差异显著的结缕草种质(Z077:抗旱型;Z119:敏旱型)栽植于装满河沙的聚氯乙烯管中,以研究其在干旱胁迫(停止浇水)及复水条件下的生长和生理响应。结果表明,干旱胁迫下,Z077的叶片过氧化氢酶(CAT)活性维持在对照水平,同时抗坏血酸过氧化物酶(APX)活性先上升后下降,基本高于对照,而Z119的CAT活性则在干旱胁迫下显著低于对照(P<0.05),同时APX活性在整个处理过程中与对照差异不显著。干旱胁迫9 d,2份种质的净光合速率(P n)、气孔导度(G s)和蒸腾速率(T r)均出现下降,与Z077相比,Z119的降幅更明显;干旱胁迫17 d,Z077的G s恢复至对照水平,而Z119的P n、G s和T r仍显著或极显著(P<0.01)低于对照;复水18 d,Z077的P n表现出超补偿效应;整个处理过程中,Z077的胞间CO 2浓度始终处于对照水平,Z119则在干旱胁迫下显著或极显著高于对照。干旱胁迫下,Z077的叶绿素浓度与对照无显著差异,Z119在干旱17 d时显著低于对照。尽管在干旱胁迫期间,2份种质的各项生物量指标并未与对照产生明显差异,但处理结束时,与对照相比,Z077的总干质量未受影响同时根冠比显著增加,而Z119的总干质量则显著下降。上述结果表明,相对于Z119,Z077通过维持CAT活性、提高APX活性、维持较为活跃的光合气体交换和较高的叶绿素含量,能够更好地抵御逆境,减轻干旱胁迫对生长的不利影响。
关键词:结缕草;干旱胁迫;渗透保护;抗氧化酶;光合作用
中图分类号:S688.401 文献标志码: A
文章编号:1002-1302(2022)09-0159-10
近年来,受到气候变化及人类活动等多种因素的影响,水资源短缺状况日趋严峻,干旱缺水影响草坪草的生长,使草坪质量下降。因此,理解干旱胁迫下草坪草的生理机制并阐明抗旱机制,有利于选育抗旱品种以及为供水受限情况下的生产管理提供指导[1]。结缕草(Zoysia japonica Steud.)为禾本科(Gramineae)画眉草亚科(Eragrostoideae)结缕草属(Zoysia Willd.)多年生草本植物,是已获得广泛应用的暖季型草坪草之一。该草种原产于东亚地区,在我国境内,其自然分布范围北起辽宁省,南达福建省,横跨多个气候带,涵盖多种土壤类型,是同属植物当中分布最广的一个种,种质资源具有丰富的遗传多样性[2-3]。研究表明,结缕草的抗旱性在种内存在广泛的遗传变异,因此可作为抗旱育种的重要基础[4-5]。为了充分挖掘结缕草丰富的遗传资源并提高其干旱适应性,无疑需要深入研究该草种的抗旱机制。然而迄今为止,对于结缕草在干旱胁迫下的生长与生理响应机制仍所知有限。结缕草的根系特性与抗旱性的关系受到一定关注[6-9],但其地上和地下部分在经历干旱胁迫后所发生的相对比重的变化趋势尚不明确;同时,在其他一些草种当中发现,地下茎在抵御干旱时可发挥重要作用[10-11],而以往的研究对结缕草地下茎的重要性并未给予充分重视;此外,尽管之前对结缕草的抗旱生理机制已有多方阐述[12-19],但过往研究或侧重于不同种属草种的比较,或侧重于单一种质的讨论,而以结缕草种内抗旱性具有明显差异的不同种质为研究对象,综合讨论干旱胁迫下结缕草的生长表现及其生理响应的研究报道仍属鲜见。
此前,笔者对来自不同地区的96份结缕草属种质资源(包含63份结缕草)开展了抗旱性评价工作[5],根据评价结果,本研究选取其中2份抗旱性差异显著的结缕草种质作为试验材料。对这2份种质在干旱与复水条件下的生长与生理响应进行较为全面的比较与分析,旨在为揭示结缕草的抗旱机制提供参考数据。本试验可为相关的分子机制研究奠定基础,也能够为通过遗传育种或栽培管理措施来改善结缕草的干旱适应性提供理论支撑。
1 材料与方法
1.1 供试材料
本研究选用2份抗旱性差异显著的结缕草种质(Z077:抗旱型;Z119:敏旱型)作为试验对象,植物材料取自江苏省植物研究所草业研究中心种质资源圃,试验地点位于本所温室大棚。2015年6月,从苗圃地中挖出草皮并洗净泥沙,统一将草层高度修剪至5 cm并剪去须根,切割成直径10 cm的圆形,种植于装满河沙的聚氯乙烯(PVC)管(直径 10 cm,高度60 cm,底盖具排水孔)中,2份种质各种植64管备用。先进行露天预培养,每周浇水2~3次,并以1/2 Hoagland营养液浇灌1次,同时每周修剪以保持草层高度为5 cm。预培养10周后,PVC管中草皮的地上和地下部分均已重新建成,将所有植物材料移至塑料大棚内并以相同措施繼续培养2周,使其适应试验环境。
1.2 试验设计
2015年9月6日开始试验处理,处理期间,大棚内平均最低温度和最高温度分别为18 ℃和 36 ℃,平均最低空气湿度和最高空气湿度分别为28%和94%,正午天气晴好时光合有效辐射约为610 μmol/(m2·s)。试验开始时,从每份种质的64管中挑选出40管长势一致的植物材料作为处理对象,分为对照组和处理组,每组各设4个重复。对照组正常浇水,处理组则进行为期21 d的干旱胁迫(停止浇水)后再恢复正常浇水。干旱胁迫前一天傍晚,对照组和处理组都进行最后一次修剪并充分浇水。干旱胁迫21 d(9月26日)傍晚,对照组和处理组都再次充分浇水,此后2组均正常浇水。复水18 d(10月14日),处理结束。
1.3 指标测定
1.3.1 取样及观测时间 生理生化指标取样和光合作用指标测定时间为干旱胁迫2、9、17 d以及复水7、18 d,生物量指标取样时间为干旱胁迫2、17 d以及复水18 d,叶片萎蔫度观测记录时间为干旱胁迫9、17、21 d以及复水1 d。5750642A-D46E-46A1-B5DD-4250FC84761C
1.3.2 抗旱性评价指标测定 基质含水量(SWC)使用TZS型土壤水分测量仪(浙江托普仪器有限公司)测定。叶片萎蔫度(LW)参照Abraham等的观测方法[20]作调整,于13:00以0~9分(分别代表萎蔫程度为无萎蔫、小于10%、10%~<25%、25%~<35%、35%~<45%、45%~<55%、55%~<65%、65%~<75%、75%~85%以及大于85%)为标准进行目测评分。叶片相对含水量(RWC)和叶片电解质外渗率(LEL)测定参照DaCosta等的方法[21]。
1.3.3 生物量指标测定 整株采收并清洗干净,分成地上部、地下茎和根系3个部分,80 ℃烘干72 h。称质量获得地上部干质量(ADW)、地下茎干质量(RHDW)和根系干质量(RDW)。地下部干质量(UDW)为RHDW与RDW之和;总干质量(TDW)为ADW与UDW之和;根冠比(R/S)为UDW与ADW之比。
1.3.4 生理生化指标测定
采收新鲜叶片以液氮速冻并于-80°C保存,用于后续测定叶绿素含量、抗氧化酶活性和丙二醛含量。叶绿素(Chl)含量采用丙酮乙醇混合液法[22]测定;采用单一提取系统[23]提取多种抗氧化酶,采用李忠光等和李合生的方法[23-24]测定超氧化物歧化酶[SOD,酶系统分类编号(EC) 1.15.1.1]、过氧化氢酶(CAT,EC 1.11.1.6)、过氧化物酶(POD,EC.1.11.1)和抗坏血酸过氧化物酶(APX,EC 1.11.1.11)的活性;丙二醛(MDA)含量采用硫代巴比妥酸法[24]测定。另外采收新鲜叶片80 ℃烘干 72 h,用于后续测定渗透调节物质含量。叶片脯氨酸(Pro)含量采用酸性茚三酮法[24]测定,叶片可溶性糖(WSC)含量采用蒽酮法[24]测定,叶片甜菜碱(GB)含量委托南京钟鼎生物技术有限公司采用比色法测定。SOD、CAT、POD、APX的活性以鲜质量计算,Chl、MDA、Pro、WSC、GB的含量以干质量计算。
1.3.5 光合作用指标测定 天气晴好的09:30—12:00,使用Li-6400XT型便携式光合仪(LI-COR Biosciences Inc.,Lincoln,NE,USA)測定净光合速率(P n)、气孔导度(G s)、蒸腾速率(T r)和胞间CO 2浓度(C i)等光合气体交换参数,开放式气路,光强设为1 200 μmol/(m2·s);14:00—15:30,使用OS1p型手持式叶绿素荧光仪(OPTI-Sciences,Inc.,Hudson,NH,USA)测定最大光化学效率(F v/F m)。
1.4 数据分析
所有试验数据使用SPSS 19.0版(IBMTM)进行方差分析(ANOVA),采用Duncans法对平均数进行多重比较(P<0.05和P<0.01);使用Office 2010版(MicrosoftTM)绘制图表。
2 结果与分析
2.1 2份种质在干旱胁迫及复水过程中抗旱性评价指标的变化
由图1可知,干旱胁迫9、17 d,Z077的基质含水量(SWC)分别下降至4.6%和3.9%,Z119分别下降至4.7%和3.2%,复水7 d,2份种质均恢复至对照水平,整个干旱胁迫及复水过程中,无论是处理组还是对照组,2份种质的SWC都没有明显差异。由图2可知,干旱胁迫9、17、21 d,Z077的叶片萎蔫度(LW)分别为0.7、2.7、2.7,Z119分别为3.5、5.5、7.3,而复水1 d,Z077即不再表现萎蔫,Z119的LW则仅恢复到1.0。由图3可知,干旱胁迫9 d,Z077的RWC仍保持在对照水平,Z119则下降至81.7%;干旱胁迫17 d,Z077和Z119的RWC分别为84.5%和77.5%,均极显著低于对照(P<0.01);复水7 d,2份种质均恢复至对照水平。由图4可知,干旱胁迫9、17 d,Z077的LEL维持稳定,与对照相比未出现变化,而Z119在干旱胁迫9 d时保持在对照水平,但在干旱胁迫17 d时上升到对照的1.5倍,直到复水7 d,Z119恢复至对照水平。
2.2 2份种质在干旱胁迫及复水过程中生物量的变化
从表1可以看出,直到干旱胁迫17 d,2份种质的总干质量、地上部干质量、地下部干质量、地下茎干质量、根系干质量和根冠比均未与各自对照产生显著差异。复水18 d,Z077的TDW仍维持在对照水平,而Z119则减少至对照的75.7%;同时,Z077和Z119的ADW分别减少至对照的88.7%和72.5%;但是2份种质的UDW仍维持在对照水平;Z077的RHDW增加至对照的117.8%同时RDW与对照没有显著差异,Z119的RHDW与对照相比差异不显著,但其RDW则减少至对照的59.8%;上述各部分的变化导致Z077的R/S上升至对照的130.0%,Z119则与对照持平。
2.3 2份种质在干旱胁迫及复水过程中叶片渗透调节物质含量的变化由图5可知,干旱胁迫9 d,2份种质的叶片Pro含量与对照相比没有变化;干旱胁迫17 d,Z077和Z119的Pro含量分别上升至对照的4.6倍和13.1倍,种质间存在极显著差异;复水7 d,2份种质的Pro含量恢复至对照水平。由图6可知,干旱胁迫 9 d,Z077和Z119的叶片可溶性糖(WSC)含量分别上升至对照的124.9%和177.6%;干旱胁迫17 d,Z077的WSC含量恢复至对照水平,而Z119仍极显著高于对照;复水7 d,2份种质的WSC含量均与各自对照无显著差异;到复水18 d时,Z077的WSC含量下降至对照的77.2%。由图7可知,在整个干旱胁迫及复水过程中,2份种质的叶片GB含量始终维持在各自对照水平。
2.4 2份种质在干旱胁迫及复水过程中叶片丙二醛含量及抗氧化酶活性的变化5750642A-D46E-46A1-B5DD-4250FC84761C
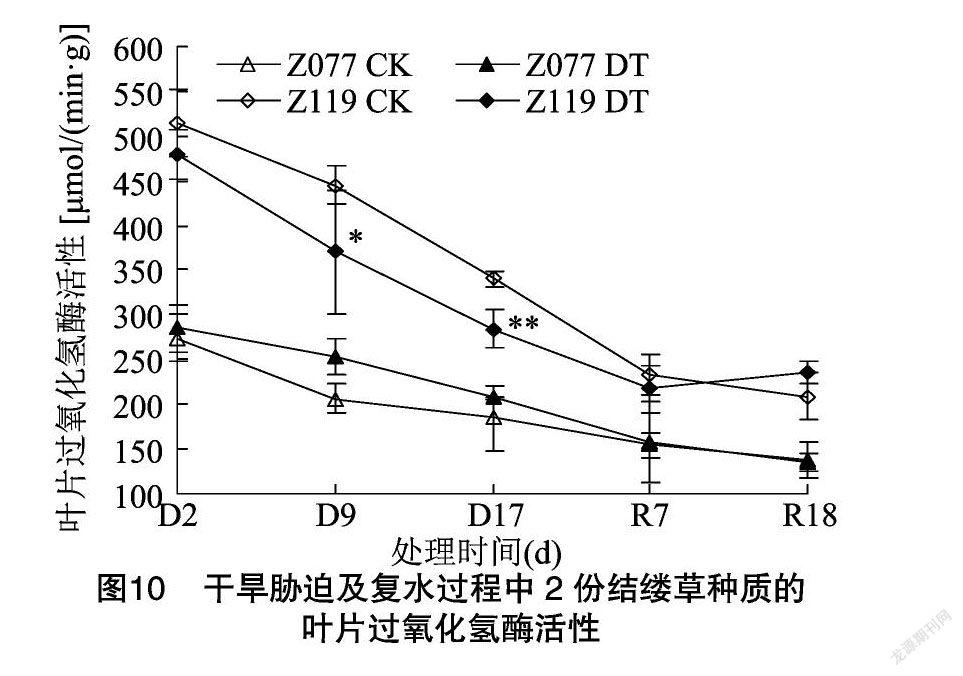
由图8可知,干旱胁迫9 d,2份种质的叶片MDA含量与各自对照没有显著差异;干旱胁迫 17 d,Z077的MDA含量仍维持在对照水平,Z119则上升至对照的126.0%;复水7 d,Z119的MDA含量恢复至对照水平。由图9可知,干旱胁迫9 d,Z077和Z119的叶片SOD活性分别上升至各自对照的105.2%和104.4%;干旱胁迫17 d,Z077恢复至对照水平,但Z119仍显著高于对照;复水7 d,2份种质的SOD活性与各自对照均无差异。由图10可知,干旱胁迫9、17 d,Z077的叶片CAT活性均维持在对照水平,Z119则分别为对照的83.2%和83.4%,显著或极显著低于对照;复水7 d,Z119恢复至对照水平。由图11可知,从干旱胁迫开始直到复水7 d,Z077和Z119的叶片POD活性始终与对照差异不显著,但是到复水18 d,2份种质的POD活性均出现了显著上升。由图12可知,干旱胁迫 9 d,Z077的叶片APX活性上升至对照的113.6%,干旱胁迫17 d时略有上升,但在复水7 d时下降并显著高于对照;整个干旱胁迫及复水过程中,Z119的APX活性始终与对照差异不显著。
2.5 2份种质在在干旱胁迫及复水过程中光合作用相关指标的变化
由图13、图14、图15可知,干旱胁迫9 d,Z077的净光合速率(P n)、气孔导度(G s)和蒸腾速率(T r)分别下降至对照的72.0%、69.6%和54.8%,Z119则分别下降至对照的46.7%、38.8%和40.5%;干旱胁迫17 d,Z077的G s恢复至对照水平,T r为对照的72.4%,而Z119的上述3项指标均显著或极显著低于对照;复水18 d,Z077的P n上升至对照的153.4%,表现出超补偿效应。由图16可知,整个干旱胁迫及复水过程中,Z077的胞间CO 2浓度(C i)一直维持在对照水平,Z119则在干旱胁迫9、17 d分别为对照的188.8%和127.0%,复水7 d恢复至对照水平。
由图17可知,干旱胁迫9、17 d,Z077的叶绿素(Chl)含量与对照无显著差异,Z119则在干旱胁迫17 d显著下降至对照的72.0%,复水7 d恢复至对照水平;复水18 d,Z077的Chl含量显著上升至对照的115.3%,也表现出超补偿效应。
由图18可知,干旱胁迫9 d,2份種质的最大光化学效率(F v/F m)与对照均无显著差异;干旱胁迫17 d,Z077和Z119均显著下降至各自对照的94.7%;复水7 d,2份种质的F v/F m恢复至对照水平。
3 讨论与结论
3.1 结缕草的外部水分状况与抗旱性评价
干旱条件下,在不同的供试材料中,同样的土壤(基质)含水量表明不同材料面临同等程度的水分亏缺,而在灌溉条件下,这种情况也表明不同材料获得同等程度的水分供应。这样,土壤(基质)含水量的一致性即保证了试验条件的一致性[10]。在本试验的整个处理过程中,2份种质基质含水量的变化始终同步且保持一致,种质之间没有显著差异(图1)。2份种质的外部水分状况相同,这一前提对于本研究非常重要,说明在干旱胁迫及复水过程中,2份种质生长和生理响应的差异来自于种质本身固有的抗旱性差异,而非来自外部干旱胁迫程度的差异。
在相同程度的干旱胁迫下,不同抗旱性的草坪草会有不同的表现,可通过叶片萎蔫度、叶片相对含水量和叶片电解质外渗率这3个指标来进行评价。LW是植株损伤和草坪质量下降的直观反映;RWC是表征草坪草保水力的一个重要指标,反映了植株内部的水分状况;LEL则反映了草坪草细胞膜损伤的程度[10,20]。本试验中,干旱胁迫下,Z077的LW低于Z119(图2),RWC下降也慢于Z119(图3)。同时,Z077的LEL在整个干旱胁迫及复水过程中与对照相比没有显著变化,而Z119则在干旱胁迫下出现显著上升(图4)。上述3个指标的变化表明Z077的抗旱性显著高于Z119,印证了之前在96份结缕草属种质资源当中的抗旱性评价结果[5],这是本研究的另一个前提。
3.2 结缕草在干旱胁迫下的生长响应
干旱胁迫抑制草坪草生长,会导致地上和地下部分的生物量减少,并使光合作用碳同化产物的分配模式出现变化[25-26]。反过来,草坪草各部分生物量以及碳分配模式的变化,也会影响其抵御干旱和旱后恢复的能力。研究表明,干旱胁迫下的茎叶生长量或者胁迫结束后茎叶的恢复生长量可反映出不同草种抗旱性的强弱,旱后恢复与胁迫过程中叶片和地下茎中碳水化合物的积累以及复水后的新根生长有关[10,20]。干旱胁迫下,如果草坪草干物质的分配趋势使地下部分生物量相对于地上部分生物量的比值出现上升,即通常所说的根冠比上升,则其抗旱性也得到增强[26]。本试验中,干旱胁迫期间,Z077和Z119的总干质量、地上部干质量、地下部干质量、地下茎干质量、根系干质量和根冠比等一系列指标均维持在各自对照水平没有明显变化,而直至复水以后,2份种质才表现出不同的变化趋势(表1)。分析其原因,很大程度上是由于本次干旱胁迫持续时间较短,同时结缕草生长较为缓慢,干旱胁迫对生物量的影响需要一定的时间积累才能显现,所以生物量指标的变化滞后于处理进程。处理结束时,与对照相比,Z077的总生物量和根系生物量没有减少,并且地下茎生物量增加,引起根冠比的上升;而Z119的生长则受到显著抑制,与对照相比,总生物量尤其是根系生物量明显减少,对水分吸收和旱后恢复产生不利影响。相对于地上部分而言,地下部分的根系和地下茎在草坪草应对干旱胁迫时发挥的作用显得更为重要。发生干旱时,草坪草的碳分配趋向于地下尤其是湿润的下层土壤,使得根系生物量增加以便更好地吸收水分[21,25]。干旱胁迫下,一些草坪草的根系生物量与草坪质量成正比,抗旱性较强的草种根系生物量下降的幅度也较小[6,26]。地下茎是一部分草坪草中重要的贮藏器官,可在恢复生长时提供物质与能量,并且能在茎叶和根系之间的营养、水分和碳水化合物的转运中起到积极作用[10,27]。有研究指出,狗牙根属(Cynodon Rich.)的抗旱性与干旱胁迫前后的地下茎干质量正相关[11]。本试验结果表明,包括地下茎和根系在内的整个地下部分,在结缕草抵御干旱和旱后恢复中能够发挥重要作用。5750642A-D46E-46A1-B5DD-4250FC84761C
3.3 结缕草在干旱胁迫下的渗透保护物质响应
植物在干旱或盐胁迫下能够主动积累一些小分子量的、无毒性的或相容性的溶质以降低细胞渗透势,从而保持水分吸收并维持膨压,使生理活动得以持续进行,这些主动积累的溶质被称为渗透调节物质,而这一过程被称为渗透调节[28]。由于这些物质在逆境下的功能并不仅限于渗透调节,还对渗透胁迫所引起的伤害具有多重保护作用,因此称它们为渗透保护物质或许更为恰当[29]。在植物抗旱性研究当中,脯氨酸、可溶性糖和甜菜碱这3类有机溶质是受到最多关注的渗透保护物质。
长久以来,有关干旱胁迫下植物体内Pro的积累与抗旱性的关系存在争议。一方面,有报道指出,水分亏缺时,一些草坪草中Pro的积累能力与其抗旱性是正相关的[26,30]。另一方面,也有证据表明,干旱胁迫下,Pro的积累是一种胁迫伤害症状,Pro含量与抗逆性或存活率负相关[12,31]。本试验中,尽管2份种质的叶片Pro含量在干旱胁迫下都出现明显上升,但抗旱型种质Z077的上升幅度明显小于敏旱型种质Z119(图5)。说明在本试验条件下,结缕草叶片中Pro的积累在相当大的程度上代表一种受损反应,该结果支持Pro含量与抗旱性呈负相关这一方面的观点。当然,上述负相关的证据并不能否定Pro在抵御渗透胁迫方面具有积极作用,而是反映了在一些植物种类当中,相对于渗透调节来讲,形态或生理方面的抗性机制可能更具主导作用[32]。
作为一类渗透保护物质,WSC在干旱胁迫下的积极作用已在草坪草中得到阐述[10,30]。然而,有证据表明,禾草类植物的抗旱性并非简单地与干旱胁迫下WSC的积累正相关。例如,Volaire等研究发现,干旱条件下WSC的积累不一定能够提高多年生黑麦草(Lolium perenne L.)的抗旱性[31]。再如,Luo等的研究表明,干旱胁迫使57份二穗短柄草[Brachypodium distachyon (L.) Beauv.]种质的WSC含量出现不同程度的增加,但是增加幅度的差异与不同种质间的抗旱性差异没有关系[33]。本试验中,干旱胁迫下敏旱型种质Z119的叶片WSC含量增幅明显大于抗旱型种质Z077(图6),这一结果说明结缕草叶片中WSC的积累与抗旱性不存在正相关关系。研究指出,作物生命活动过程中WSC的积累和转运有利于其应对干旱[34]。Yang等研究发现,干旱使草地早熟禾(Poa pratensis L.)叶片WSC含量显著升高,复水后下降至对照水平,可能是恢复生长过程中碳水化合物消耗的结果[35]。而Chai等研究发现,复水过程中草地早熟禾根状茎中的非结构性总糖含量降低,可能反映了组织恢复生长期间碳水化合物的利用及转运[10]。本试验已经证实,干旱胁迫对Z077生长的抑制作用小于Z119(表1),同时,干旱胁迫下,Z077的叶片WSC含量增幅始终小于Z119,并且复水18 d,Z077与对照相比还出现了显著下降,Z119则与对照无差异(图6)。根据上述结果可以推断,抗旱型种质Z077由于生长需求而对包括WSC在内的碳水化合物有较强的利用和转运能力,导致其在干旱胁迫下及旱后恢复阶段的叶片WSC含量低于敏旱型种质Z119。
研究表明,干旱胁迫下作物中GB的积累与其抗旱性可能具有正相关关系[36]。通过转基因手段促进內源GB的积累[37],或者施用外源GB[38],都能够明显提高作物和草坪草的抗旱性。本试验中,干旱胁迫对抗旱型种质Z077和敏旱型种质Z119的叶片GB含量的影响都不明显(图7),表明结缕草中GB的积累与其抗旱性强弱不存在明显的相关关系。
3.4 结缕草在干旱胁迫下的抗氧化酶响应
在干旱所造成的氧化胁迫下,植物体内发生脂质过氧化,其产物MDA的含量常被用来作为衡量氧化损伤程度的指标[13]。本试验中,抗旱型种质Z077的叶片MDA含量在整个干旱胁迫及复水过程中与对照相比没有明显变化,而敏旱型种质Z119则在干旱胁迫下显著升高(图8),这表明Z077应对氧化胁迫的保护机制强于Z119。各种抗氧化酶是植物抗氧化防御系统的重要成员,比如SOD、CAT、POD、APX等等[26]。在禾草类作物中,干旱条件下各种抗氧化酶活性的变化与植物种类、干旱程度、干旱持续时间和植株部位都有关系,表现出不同的变化规律[26,39]。本试验发现,干旱胁迫及复水过程中,2份种质各种抗氧化酶活性的变化趋势存在差异,尽管Z077的叶片SOD活性上升时间比Z119短,并且POD活性变化趋势与Z119类似,但是在干旱胁迫下,Z077的叶片CAT活性可维持在对照水平而Z119则明显低于对照,同时Z077的叶片APX活性显著高于对照而Z119则与对照差异不显著(图9、图10、图11、图12)。以上结果说明,干旱胁迫下较高的CAT和APX相对活性是抗旱型种质Z077比敏旱型种质Z119具备更强抗氧化防御能力的重要原因之一。
3.5 结缕草在干旱胁迫下的光合响应
干旱胁迫对草坪草的光合作用产生影響,直接导致光合速率的下降,意味着植物体的光合能力被削弱[21,25]。植物光合能力削弱的原因来自于气孔限制和非气孔限制:轻度干旱胁迫下,当RWC下降程度较小时,虽然G s、T r、C i和P n均出现下降,但此时内部水分亏缺程度并不会使光合机构受到实质损伤,P n的降低仅仅是CO 2供不应求的结果,只要胁迫解除使G s、T r和C i恢复正常,光合能力也能较快得到恢复,该阶段主要为气孔限制;当胁迫加重使RWC持续下降时,内部严重的水分亏缺造成光合机构受损,对CO 2的同化能力减弱,即使由于气孔关闭而使外界进入叶肉细胞间隙的CO 2大大减少,也会出现CO 2供过于求而导致C i不降反升的情况,此时光合能力的下降难以恢复,该阶段主要为非气孔限制[40-41]。本试验中,干旱胁迫下,虽然2份种质的G s和T r均出现下降,但抗旱型种质Z077的降幅小于敏旱型种质Z119(图14、图15),表明Z077气孔开放程度较大并且蒸腾拉力较强,有助于水分的吸收和运输而使其体内保持较高的含水量。也就是说,干旱胁迫下Z077的气孔限制小于Z119。干旱胁迫下,Z077的C i与对照无显著差异,Z119则显著或极显著高于对照(图16),说明在2份种质中,虽然气孔部分关闭引起CO 2的供应量减少,但是光合机构的损伤所产生的非气孔限制导致2份种质的CO 2同化能力也下降,损伤越严重则C i越高。气孔限制和非气孔限制的共同作用使2份种质的光合能力都出现下降,表现为P n的降低,但Z077的降幅要小于Z119(图13)。此外,本试验中还发现,干旱胁迫尚未结束时,Z077的P n即与对照差异不显著,复水以后还表现出明显的超补偿效应,这进一步证明Z077的光合机构对干旱胁迫具有较强的适应性。5750642A-D46E-46A1-B5DD-4250FC84761C
非气孔限制又称代谢限制,与光合代谢过程中的诸多因素(比如叶绿体功能)有关[40]。叶绿素含量和叶绿素荧光参数可以反映光合机构的状态,已经成为草坪草抗旱性评价中的重要指标[16,26]。本试验中,与对照相比,干旱胁迫下抗旱型种质Z077的Chl含量并未受到显著影响,并且复水之后还表现出超补偿效应,而敏旱型种质Z119则在干旱胁迫下出现下降(图17)。此外,干旱胁迫下2份种质的最大光化学效率(F v/F m)都出现下降,但两者的降幅没有差异(图18)。上述结果表明,2份种质叶绿素稳定性的差异可能是两者光合机构稳定性差异的重要原因之一,或者说叶绿素的降解是结缕草中光合代谢非气孔限制的一个重要因素。
3.6 结论
总体上来说,干旱胁迫下,有赖于生长和生理生化各方面的响应机制,与敏旱型种质相比,结缕草的抗旱型种质能够维持较为适宜的体内水分状况并有效减轻胁迫所带来的各种伤害,从而在一定程度上保障了光合作用的持续进行并缓和了逆境对生长的抑制效应。本研究采用抗旱性差异显著的2份结缕草种质,从植株整体出发,综合探讨了结缕草在干旱胁迫及复水过程中的生长和生理特性的响应变化规律,就这一点而言,这是迄今为止在结缕草中的首次报道。本研究获得如下重要发现:(1)增加地下茎生物量和提高根冠比是结缕草在生长方面的有效抗旱机制;(2)干旱胁迫下,叶片脯氨酸的积累与结缕草的抗旱性负相关,叶片可溶性糖的积累与结缕草的抗旱性非正相关,叶片甜菜碱的积累与结缕草的抗旱性没有明显的相关关系;(3)维持过氧化氢酶活性、提高抗坏血酸过氧化物酶活性是结缕草抗氧化防御系统的有效抗旱机制;(4)减小气孔限制和减少叶绿素的降解,是结缕草光合机构的有效抗旱机制。这些发现可以作为进一步研究结缕草及本属植物抗旱机制的着眼点。
参考文献:
[1]Huang B R,DaCosta M,Jiang Y W. Research advances in mechanisms of turfgrass tolerance to abiotic stresses:from physiology to molecular biology[J]. Critical Reviews in Plant Sciences,2014,33(2/3):141-189.
[2]金 洪.中国结缕草(Zoysia japonica Steud.)遗传多样性研究[D]. 北京:北京林业大学,2004.
[3]黄春琼,刘国道,白昌军,等. 结缕草属植物种质资源遗传变异研究[J]. 热带作物学报,2018,39(7):1259-1265.
[4]胡化广,张振铭,季芳芳,等. 中国主要地区结缕草属植物种质资源抗旱性变异分析[J]. 草地学报,2014,22(2):224-228.
[5]Guo H L,Wang Y,Zhang B,et al. Association of candidate genes with drought tolerance traits in zoysiagrass germplasm[J]. Journal of Plant Physiology,2019,237:61-71.
[6]Marcum K B,Engelke M C,Morton S J,et al. Rooting characteristics and associated drought resistance of zoysiagrasses[J]. Agronomy Journal,1995,87(3):534-538.
[7]Rimi F,Macolino S,Ziliotto U.Rooting characteristics and turfgrass quality of three bermudagrass cultivars and a zoysiagrass[J]. Acta Agriculturae Scandinavica(Section B-Soil & Plant Science),2012,62(Sup1):24-31.
[8]Zhang J,Poudel B,Kenworthy K,et al. Drought responses of above-ground and below-ground characteristics in warm-season turfgrass[J]. Journal of Agronomy and Crop Science,2019,205(1):1-12.
[9]施建舟,王 儲,唐 睿,等. 结缕草属植物水分利用效率与根系形态特征的关系分析[J]. 热带农业科学,2020,40(7):22-28.
[10]Chai Q,Jin F,Merewitz E,et al. Growth and physiological traits associated with drought survival and post-drought recovery in perennial turfgrass species[J]. Journal of the American Society for Horticultural Science,2010,135(2):125-133.
[11]Yi Z,Lambrides C J,Shu F K.Drought resistance and soil water extraction of a perennial C 4 grass:contributions of root and rhizome traits[J]. Functional Plant Biology,2014,41(5):505-519.5750642A-D46E-46A1-B5DD-4250FC84761C
[12]Xu C B,Li X M,Zhang L H.The effect of calcium chloride on growth,photosynthesis,and antioxidant responses of Zoysia japonica under drought conditions[J]. PLoS One,2013,8(7):e68214.
[13]俞 乐,刘拥海,周丽萍,等. 干旱胁迫下结缕草叶片抗坏血酸与相关生理指标变化的品种差异研究[J]. 草業学报,2013,22(4):106-115.
[14]Bae E J,Han J J,Choi S M,et al. Evaluating pre-silicon treatment to alleviate drought stress and increases antioxidative activity in Zoysia japonica[J]. Weed & Turfgrass Science,2015,4(4):360-367.
[15]Fuentealba M P,Zhang J,Kenworthy K,et al. Transpiration responses of warm-season turfgrass in relation to progressive soil drying[J]. Scientia Horticulturae,2016,198:249-253.
[16]胡化广,张振铭,季芳芳,等. 干旱胁迫对结缕草叶绿素荧光和光合关键酶活性的影响[J]. 草地学报,2016,24(6):1304-1308.
[17]Zhang J,Kenworthy K,Unruh J B,et al. Physiological responses to soil drying by warm-season turfgrass species [J]. Crop Science,2017,57(Sup1):1-8.
[18]彭凯悦,杨春勐,许 喆,等. 假俭草和结缕草在昆明地区的抗逆性及草坪质量比较[J]. 草学,2018(6):65-71.
[19]张博文,李富平,许永利,等. PEG-6000模拟干旱胁迫下五种草本植物的抗旱性[J]. 分子植物育种,2018,16(8):2686-2695.
[20]Abraham E M,Huang B R,Bonos S A,et al. Evaluation of drought resistance for Texas bluegrass,Kentucky bluegrass,and their hybrids[J]. Crop Science,2004,44(5):1746-1753.
[21]DaCosta M,Wang Z L,Huang B R.Physiological adaptation of Kentucky bluegrass to localized soil drying[J]. Crop Science,2004,44(4):1307-1314.
[22]张宪政.植物叶绿素含量测定:丙酮乙醇混合液法[J]. 辽宁农业科学,1986(3):26-28.
[23]李忠光,李江鸿,杜朝昆,等. 在单一提取系统中同时测定五种植物抗氧化酶[J]. 云南师范大学学报(自然科学版),2002,22(6):44-48.
[24]李合生.植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000.
[25]Huang B R,Fu J M.Photosynthesis,respiration,and carbon allocation of two cool-season perennial grasses in response to surface soil drying[J]. Plant and Soil,2000,227(1/2):17-26.
[26]Pirnajmedin F,Majidi M M,Gheysari M. Root and physiological characteristics associated with drought tolerance in Iranian tall fescue[J]. Euphytica,2015,202(1):141-155.
[27]Yi Z,Lambrides C J,Shu F K.Associations between drought resistance,regrowth and quality in a perennial C 4 grass[J]. European Journal of Agronomy,2015,65:1-9.
[28]Serraj R,Sinclair T R.Osmolyte accumulation:can it really help increase crop yield under drought conditions?[J]. Plant,Cell & Environment,2002,25(2):333-341.
[29]Kempf B,Bremer E.Stress responses of Bacillus subtilis to high osmolarity environments:Uptake and synthesis of osmoprotectants[J]. Journal of Biosciences,1998,23(4):447-455.5750642A-D46E-46A1-B5DD-4250FC84761C
[30]DaCosta M,Huang B R.Osmotic adjustment associated with variation in bentgrass tolerance to drought stress[J]. Journal of the American Society for Horticultural Science,2006,131(3):338-344.
[31]Volaire F,Thomas H,Lelièvre F.Survival and recovery of perennial forage grasses under prolonged Mediterranean drought:Ⅰ.Growth,death,water relations and solute content in herbage and stubble[J]. New Phytologist,1998,140(3):439-449.
[32]Delauney A J,Verma D P S.Proline biosynthesis and osmoregulation in plants[J]. The Plant Journal,1993,4(2):215-223.
[33]Luo N,Liu J X,Yu X Q,et al. Natural variation of drought response in Brachypodium distachyon[J]. Physiologia Plantarum,2011,141(1):19-29.
[34]Shi H R,Wang B,Yang P J,et al. Differences in sugar accumulation and mobilization between sequential and non-sequential senescence wheat cultivars under natural and drought conditions[J]. PLoS One,2016,11(11):e0166155.
[35]Yang Z M,Xu L X,Yu J J,et al. Changes in carbohydrate metabolism in two Kentucky bluegrass cultivars during drought stress and recovery[J]. Journal of the American Society for Horticultural Science,2013,138(1):24-30.
[36]景蕊蓮,昌小平,胡荣海,等. 变水处理条件下小麦幼苗的甜菜碱代谢与抗旱性的关系[J]. 作物学报,1999,25(4):494-498.
[37]Wang G P,Li F,Zhang J,et al. Overaccumulation of Glycine betaine enhances tolerance of the photosynthetic apparatus to drought and heat stress in wheat[J]. Photosynthetica,2010,48(1):30-41.
[38]刘思露,杨 鹏,尹淑霞. 外源甜菜碱对匍匐翦股颖的抗旱性调控作用分析[J]. 草业学报,2015,24(3):80-88.
[39]Bian S M,Jiang Y W. Reactive oxygen species,antioxidant enzyme activities and gene expression patterns in leaves and roots of Kentucky bluegrass in response to drought stress and recovery[J]. Scientia Horticulturae,2009,120(2):264-270.
[40]Lawlor D W. Limitation to photosynthesis in water-stressed leaves:stomata vs.metabolism and the role of ATP[J]. Annals of Botany,2002,89(7):871-885.
[41]刘金荣,杜建雄,谢晓蓉.干热胁迫和复水对草坪草光合生理生态特性的影响[J]. 生态学报,2009,29(5):2694-2700.5750642A-D46E-46A1-B5DD-4250FC84761C
