亚麻花和叶片相关性状的全基因组关联分析
2022-06-06伊六喜贾霄云高凤云斯钦巴特尔
伊六喜,贾霄云,高凤云,周 宇,斯钦巴特尔
(1.内蒙古农业大学农学院,呼和浩特 010019;2. 内蒙古农牧业科学院,呼和浩特 010031)
【研究意义】亚麻花和叶片相关性状不易受环境条件的影响,属于质量性状。花色的差异是由于其所含花色素种类和含量的不同导致,是植物适应环境的表型性状之一[1]。花色一般指花瓣的颜色,可作为虫媒植物引诱昆虫进行授粉的一个重要视觉信号[2]。亚麻花色多为蓝色、深蓝色、白色、淡蓝色、紫色或粉蓝色,也有罕见的黄花和红花;花冠形状分为漏斗形、五角星形、碟形、轮形;花药颜色多为微黄、浅灰、蓝[3]。亚麻花相关性状遗传稳定,易于观察,不仅可作为标记性状,在提高杂交种纯度和检测种间性状转移方法的可行性等生产实践方面发挥重要的作用,而且还可作为旅游资源,用于开发田园生态旅游,对地方经济发展和人民增收具有重要的意义[4-6]。亚麻种子萌发、幼苗出土时展开的是1对子叶,见到阳光后呈现为绿色,后期形成真叶,狭小细长,一般分为线形或披针形。叶色呈浅绿色、绿色或深绿色。【前人研究进展】植物花作为繁殖后代的生殖器官,其性别分化不仅影响作物产量与品质[7],而且在制种方面产生影响。例如一般白花亚麻种皮颜色为淡黄色,亚麻酸含量较高,适合保健食品开发,但易感病,抗性弱;蓝花亚麻种皮颜色通常为褐色,一般含油率较高,适合榨食用油,抗性较强。目前,作物花性状关联基因的报道研究较少,利用 BSA 和全基因组重测序技术, 甘蓝型油菜橙花性状隐性基因BrOF定位到 A09 染色体 41.5 kb 区间[8]; 桔黄花性状基因定位在 C09 染色体区域[9], 并获得了 2 个连锁的分子标记 BnaC09和 BnaC09; 白花性状基因定位在 C03 染色体 52 ~55 Mb区间[10]。 叶片是作物光合作用的主要场所,可把光能转化成化学能,为营养生长提供所需能量,其形态结构影响着光能利用效率和干物质积累,与作物产量紧密相关,而叶片颜色差异对植物捕获光能和使光合组织免受光氧化伤害等方面具有重要作用[11]。Xu等[12]对水稻的叶宽性状的基因定位研究,发现FLW7基因调控水稻剑叶宽度,可使光合叶面积增大,叶片态势得到改善。【本研究切入点】目前亚麻产量和品质相关性状的遗传多样性分析及其相关基因的挖掘研究已有较多报道[13],但有关亚麻花和叶片相关性状的研究报道仍较少,尤其是关于亚麻种质花和叶片相关性状的全基因组关联分析尚未见报道。【拟解决的关键问题】本研究利用内蒙古农业大学亚麻课题组前期开发获得到的全基因组SNP数据,通过花和叶片相关性质的全基因组关联分析,挖掘目标性状显著关联的位点和候选基因,为亚麻种质创新提供基础。
1 材料与方法
1.1 实验材料
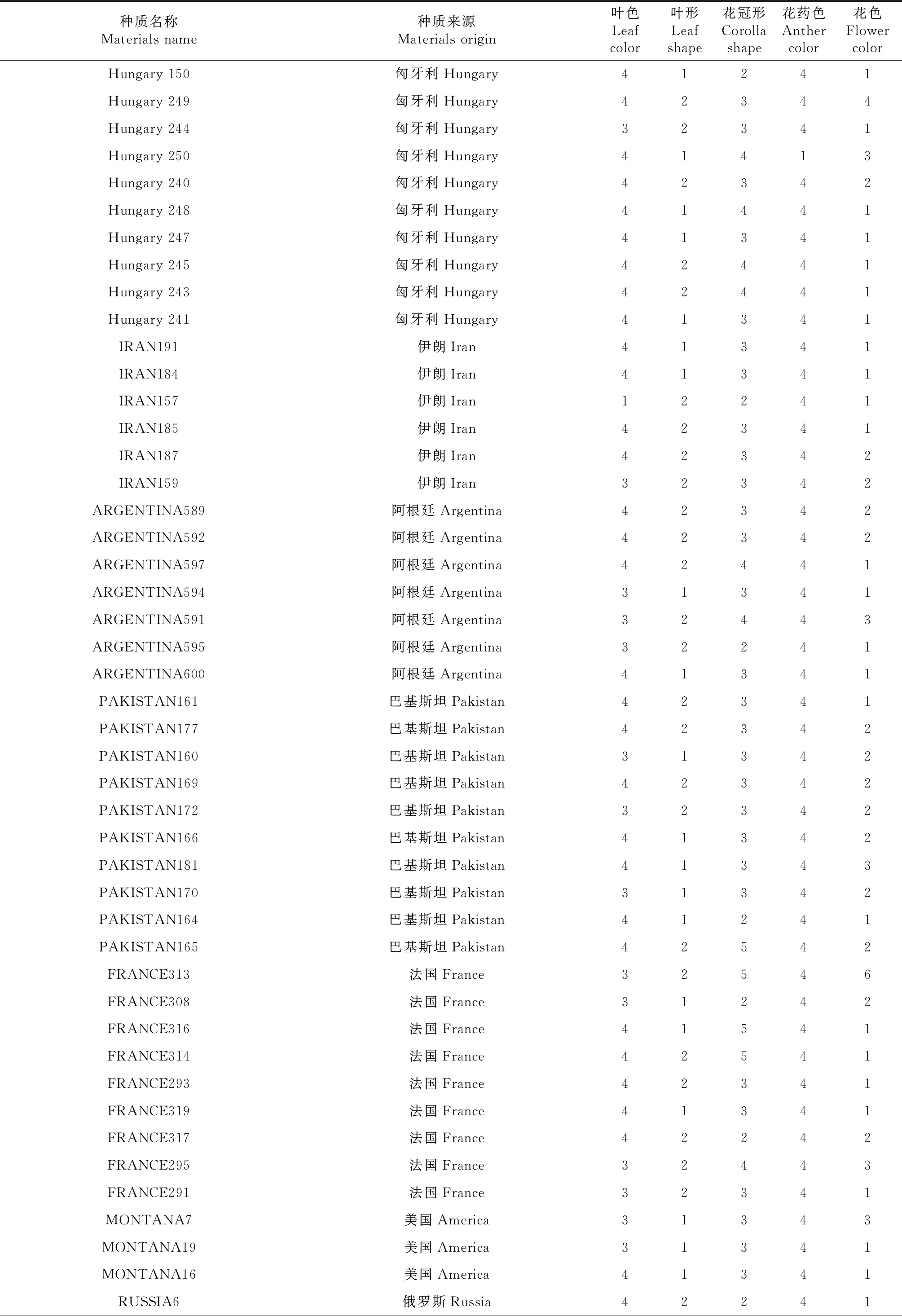
269份亚麻种质材料来自21个国家和地区,其中国内种质占46.09%,包括内蒙古33份、河北15份、山西14份、甘肃42份、新疆8份、宁夏12份。国外种质占53.91%,包括美国21份、加拿大19份、阿根廷8份、荷兰21份、匈牙利19份、法国12份、俄罗斯6份、巴基斯坦13份、伊朗6份,埃及、印度、波兰、摩洛哥、新西兰、阿富汗、土耳其、奥地利、乌拉圭、罗马尼亚、西德等11个国家种质20份。具体编号、名称、来源见表1。
1.2 材料种植与性状调查
269个亚麻种质材料种植于内蒙古农牧业科学院实验田,在开花期,按参考文献[3]调查记载花色、花形、花药色、叶色、叶形等表型,用Excel表格整理,对每个性状转换阿拉伯数字(表1)。

表1 269份亚麻品种名称及来源

续表1 Continued table 1

续表1 Continued table 1

续表1 Continued table 1

续表1 Continued table 1
续表1 Continued table 1

续表1 Continued table 1
花色:在盛花期,以实验小区全部植株为观测对象,在一致的光照条件下(一般在晴天上午7:30 —10:00),观察完全开放花朵的花瓣颜色,不同花色用阿拉伯数字替代(1:蓝色;2:深蓝色;3:白色;4:淡蓝色;5:紫色;6:粉蓝色)。
花冠形状:在盛花期,上午7:30—10:00从实验小区随机取样20株,观察每朵花的花冠形状,并参照花冠形状模式图,确定亚麻种质的花冠形状。不同花冠形状用阿拉伯数字替代(2:漏斗形;3:五角形;4:碟形;5:轮形)。
花药色:在盛花期,以实验小区的全部植株为观测对象,在一致的光照条件下(一般在晴天上午7:30—10:00),观察完全开放花朵的花药颜色。不同花药色用阿拉伯数字替代(1:微黄;3:浅灰;4:蓝)。
叶色:在现蕾期,以实验小区全部亚麻植株为观测对象,在一致的光照条件下,观察植株中部叶片正面的颜色。不同叶色用阿拉伯数字替代(1:浅绿;3:绿;4:深绿)。
叶形:在现蕾期,从实验小区中部随机取样10株,观测每株中部完全展开的10片完整叶片的形状。根据观察结果并参照叶形模式图,确定亚麻种质的叶形。不同叶形用阿拉伯数字替代(1:线形;2:披针形)。
1.3 数据分析
内蒙古农业大学亚麻课题组前期对269份亚麻品种进行Hiseq测序,得到1.37 Tb的有效序列数据(Clean data),与已公布的亚麻参考基因组(http://phytozome.jgi.doe.gov/)平均比对率为96.32%,平均测序深度为12.55,平均覆盖度为95.25%。采用SAMtools[14]软件对参考基因组进行比对,获得1069 106个有效SNPs进行花和叶片性状的全基因组关联分析。
用GEMMA(http://www.xzlab.org/software.html)软件的混合线性模型(Mixed Linear Model,MLM)对群体结构主成分分析和亲缘关系矩阵做协变量进行关联分析,显著性P的阈值-log10(0.05/标记数)确定为P=6.00。用R语言绘制曼哈顿图和QQ图。笔者前期研究发现亚麻连锁不平衡度(LD值)为15 Kb[15],因此,基因组序列上15 Kb为窗口筛选了候选基因,并进行NR[16]、Swiss-port[17]、KEGG[18]、GO[19]功能注释。
2 结果与分析
2.1 花色性状关联分析
对269份亚麻种质的花色统计分析表明,152份种质为蓝花,占56.50%;52份种质为深蓝花,占19.70%;26份种质为白花,占9.66%;30份种质为淡蓝花,占11.15%,7份种质为粉蓝花,占2.60%,1份材料为紫花(图1)。
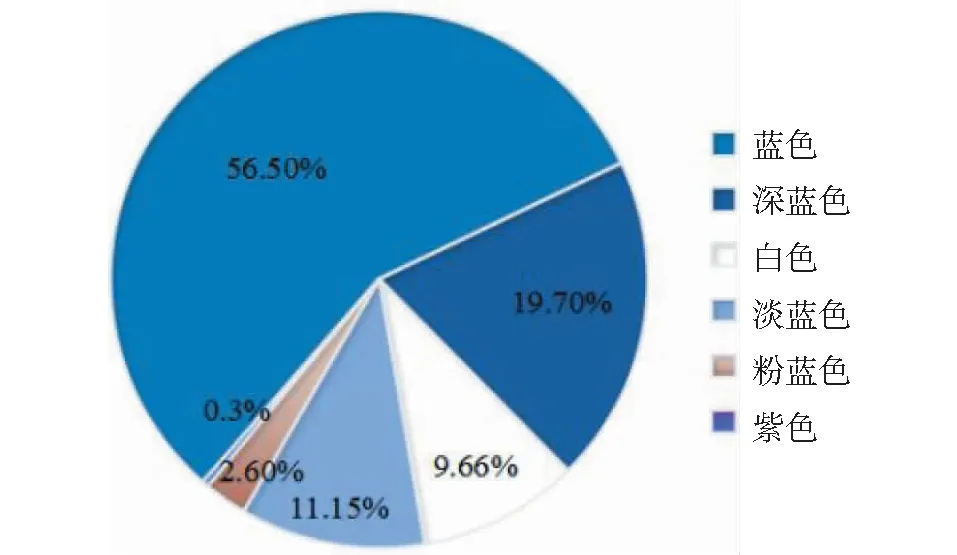
图1 花色分布比率
从图2可见,花色性状的SNP观测值与期望值前端基本重叠,仅在末端翘起,说明群体结构和亲缘关系对关联分析结果产生的假阳性较低[15],得到的SNP位点可靠。在图3中,虚线对应的阈值为-log(P)=6.00,在混合线性模型(MLM)模式下,共检测到3个显著SNP位点,分别为scaffold701:840107、scaffold736:250888、scaffold1639:8420(表2)。通过NR、Swiss-port、KEGG、GO等四大数据库注释到8个候选基因。其中Lus10033621基因功能为果胶酯酶,该酶中的纤维素酶和半乳糖苷酶可协同作用于细胞壁,从而促进花色苷等酚类物质的释放,而本研究中检测到的另外一个基因Lus10007409功能为β-半乳糖苷酶,因此,推测Lus10033621和Lus10007409基因是亚麻花颜色调控的主效基因。
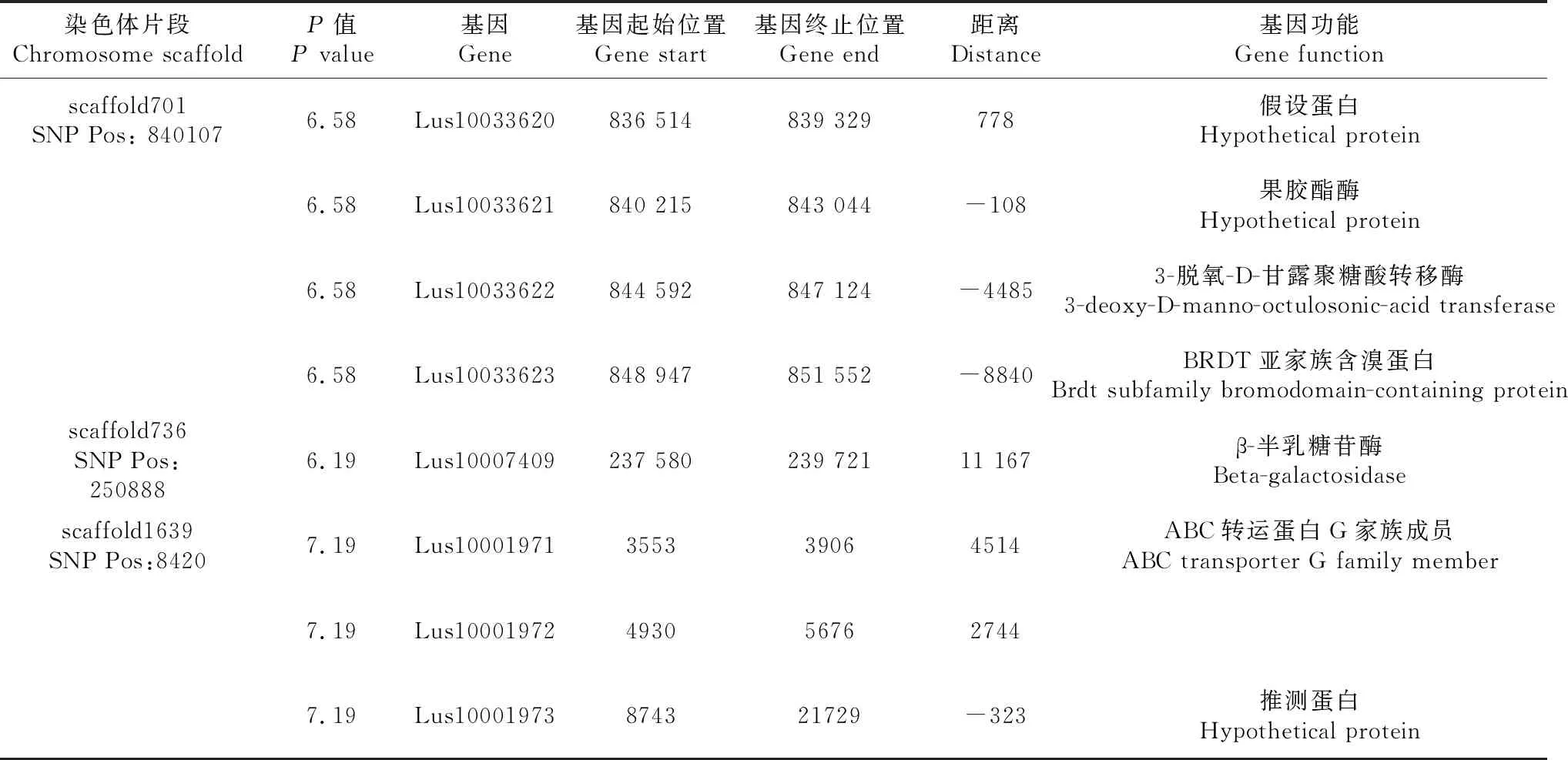
表2 花色性状关联区域候选基因信息
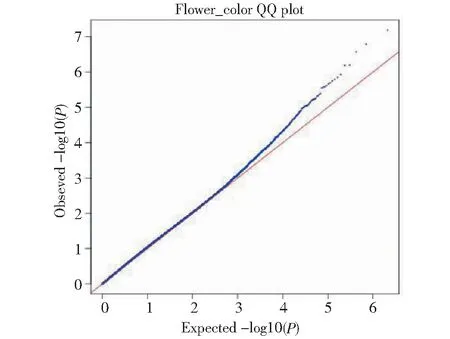
图2 花色性状的QQ分析

图3 花色性状的曼哈顿分析
2.2 花冠形状的关联分析
对269份亚麻种质的花冠形状统计分析表明,漏斗形花冠种质48份,占17.84%,五角形花冠种质115份,占42.75%,碟形花冠种质92份,占34.20%,轮形花冠种质14份,占5.20%(图4)。

图4 花色分布比率
花冠形状关联的SNP观测值与期望值前端重叠,但在末端未翘起,因此,花冠形状关联分析结果可能产生假阳性SNP位点(图5)。-log(P)=6.00时(图6),共检测到3个显著SNP位点,分别为scaffold811:44136、scaffold1370:15031、scaffold695:22509(表3)。通过NR、Swiss-port、KEGG、GO等四大数据库注释到6个基因。其中Lus10000554基因起始位置在显著SNP位点上,该基因编码为富含亮氨酸PPR基序的蛋白质,该蛋白在植物中分布广泛,是线粒体和叶绿体中转录的RNA前体,PPR基序的蛋白缺失影响植物表型性状。

图5 花冠形状QQ分析

图6 花冠形状曼哈顿分析
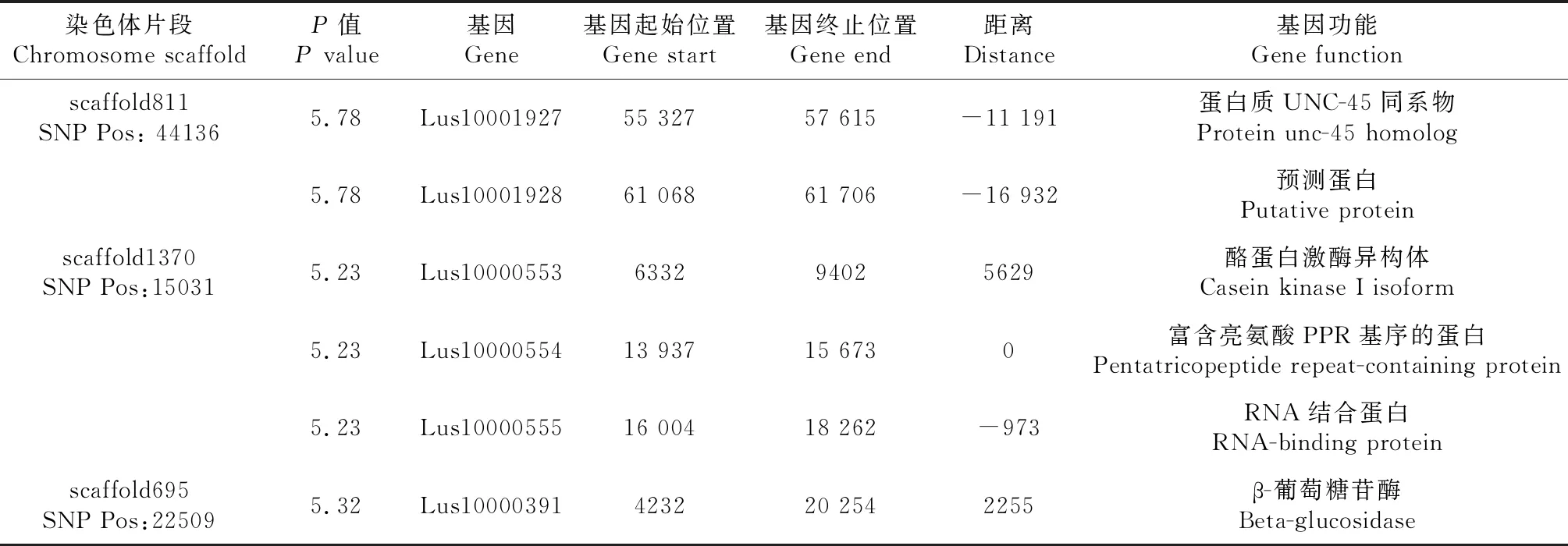
表3 花冠形状关联区域候选基因信息
2.3 花药色性状关联分析
亚麻花药色统计分析表明, 花药为微黄色的种质16份,占5.94%,浅灰色的种质20份,占7.43%;蓝色种质233份,占86.61%(图7)。从图8可见,观测值与期望值前端翘起,对关联分析结果产生的假阳性较低,得到的SNP位点可靠。-log(P)=6.00时(图9),共检测到1个显著SNP位点,为scaffold910:31728(表4),通过NR、Swiss-port、KEGG、GO等四大数据库注释到了5个基因。其中Lus10010403基因功能为花青素还原酶,该基因直接参与植物花青素的代谢途径。
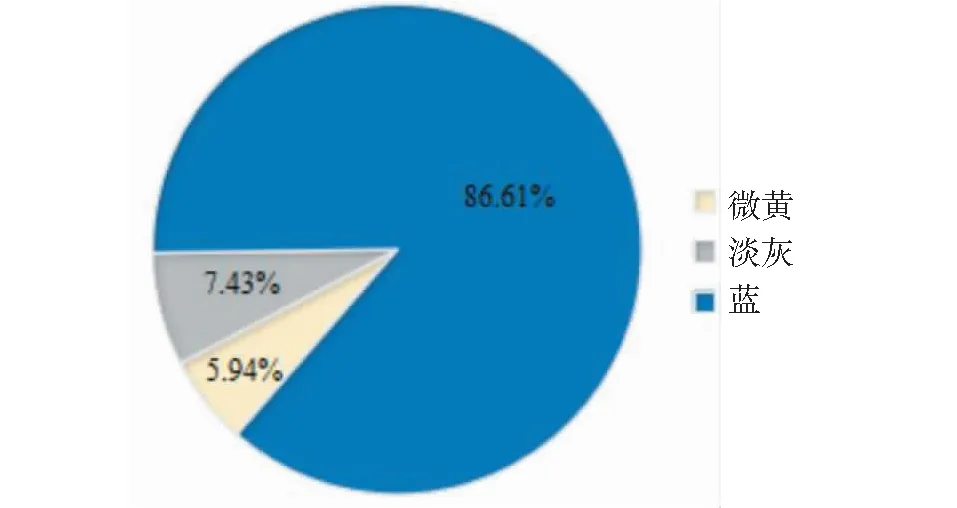
图7 花药色分布比率

图8 花药色的QQ分析

图9 花药色的曼哈顿分析
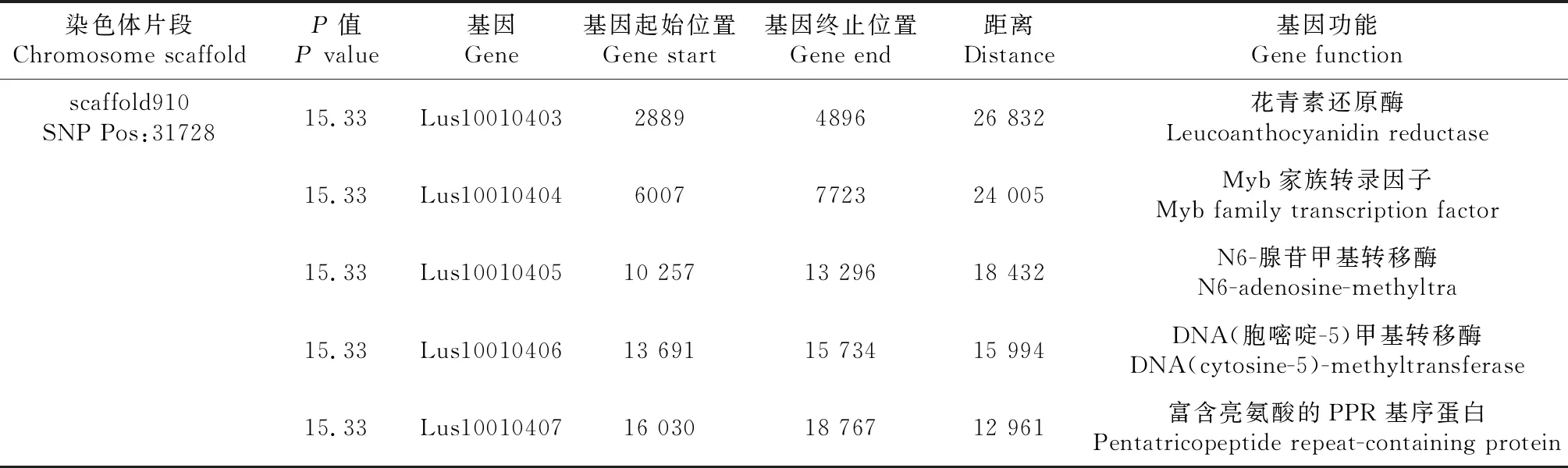
表4 花药色关联区域候选基因信息
2.4 叶色性状关联分析
对269份亚麻叶色性状的调查分析结果表明,叶片浅绿色的种质为13份,占4.83%,绿色的种质98份,占36.43%,深绿色的种质158份,占58.73%(图10)。观测值与期望值前端开始翘起(图11),对关联分析结果产生的假阳性较低,得到的SNP位点可靠。-log(P)=6.00时(图12),共检测到1个显著SNP位点,为scaffold211:69126(表5)。通过NR、Swiss-port、KEGG、GO等四大数据库分别注释到4个基因。其中Lus10005600功能为富含亮氨酸的PPR基序蛋白,与花冠形状关联的Lus10000554基因和花药色关联的Lus10010407基因功能相同。

图10 叶色分布比率

图11 叶色QQ分析

图12 叶色曼哈顿分析

表5 叶色关联区域候选基因信息
2.5 叶形性状关联分析
对269份亚麻叶形调查分析结果表明,线形叶片的种质116份,占43.12%,披针形叶片的种质153份,占56.87%(图13)。叶形性状的SNP观测值与期望值前端基本重叠(图14),仅在末端翘起,因此,假阳性低,得到的SNP位点可靠。在图15中,虚线对应的阈值-log(P)=6.00时,共检测到3个显著SNP位点,分别为scaffold67:579267、scaffold76:1474090、scaffold51:1093344(表6)。通过NR、Swiss-port、KEGG、GO等四大数据库注释到5个基因。其中Lus10033007基因功能为凯氏带膜蛋白,可以推测亚麻叶片结构中存在凯氏带,吴小琴等[20]植物凯氏带研究进展中提出了白皮松针叶内皮层细胞壁具有凯氏带结构。

表6 叶形状关联区域候选基因信息

图13 叶形状分布比率

图15 叶形状曼哈顿分析
3 讨 论
亚麻花和叶片是一个重要的表型性状,在品种鉴别和纯度检测及其杂交育种等方面具有重要意义。通过基因组学研究筛选亚麻花和叶片性状关联的候选基因,不仅有利于了解亚麻植物学特征,而且为亚麻种质创新提供丰富的遗传标记。柳丽等[21]对油菜花色基因的定位研究获得控制花色性状的2个主效基因。 Zhang等[22]对芥菜花色突变基因定位研究发现控制芥菜花色的候选基因BjuB27334,该基因编码具有植酸酯合成和二酰基甘油酰基转移酶活性。陈丽等[23]跳枝碧桃花色性状的全基因组关联分析,得到3个核酸内切酶DCL2基因。耿庆河等[24]通遗传图谱定位,将菜豆花色基因FC6定位在 6 号染色体末端 0.15 Mb 的区域内。上述研究表明,植物花色形成基因调控网络比较复杂,不同植物花色性状关联到不同基因。本研究对亚麻花色性状关联分析未发现类似功能的编码基因,但花色显著关联的SNP位点区域注释到2个关于ABC转运蛋白G家族成员编码基因,推断这2个基因可能是控制亚麻花色的候选基因。申慧敏等[25]ABC转运蛋白在植物花器官生长发育中的研究进展中提出了ABC转运蛋白对玉米、拟南芥、水稻、葡萄等植物花色形成中定位于液泡膜上负责向液泡转运花青素的转运体。亚麻花药色性状关联的Lus10010403基因编码为花青素还原酶。该酶是类黄酮物质合成途径中与原花青素相关的一个关键酶[26]。鲁丹丹等[27]在红花的根、茎、叶、花中花青素还原酶基因的定量分析表明,在花中的表达量最高。卢甜甜等[28]对124份菜豆花色全基因组关联分析,在6号染色体 322.67 kb 的区域内共鉴定到8个候选基因,其中,花青素调控的MYB 转录因子基因Phvul.006G020200在不同花色材料中差异性表达。Han等[29]将苹果的花青素酶基因克隆转入烟草中进行表达,结果显示,这2种基因能抑制烟草花冠中花色苷的积累,从而调节不同植物组织颜色的呈现。说明花青素还原酶对亚麻花色苷合成有直接的调控作用,认为Lus10010403基因是亚麻花药颜色调控关键基因。
叶子是光合作用的主要器官,它产生的同化物是作物产量形成的主要因素。作物叶片中叶绿体细胞越多,叶绿体中基粒类囊体数量多,光合作用强度最高,作物产量高。因此,植物叶子表型及其相关的关键基因挖掘研究对植物的遗传改良具有重要意义。姚俭昕等[30]利用90K小麦SNP芯片对小偃81、西农1376构建的重组自交系群体进行旗叶长QTL定位,检测到2个QTLs均位于5A染色体上。Tu等[31]利用20828/SY95-71重组自交系群体进行QTL定位,定位到控制旗叶长和宽的QTLs分别位于2B(2个)、5B和2B、2D染色体上,且位于2B染色体上的2个QTLs不重叠。曹廷杰等[32]对96分小麦品种旗叶性状全基因组关联分析,检测到59个与旗叶显著关联的SNPs位点。彭芳芳等[33]樱桃种质SCoT分子标记与叶片表型性状关联分析,筛选出了叶片表型显著关联54个SCoT标记。本研究中亚麻叶色表型关联到了1个显著SNP位点和4个候选基因,其中Lus10005600基因功能为富含亮氨酸的PPR基序蛋白,目前其他植物的叶色与该基因之间的关联性尚未报道。亚麻叶形表型的关联分析获得了3个显著SNP位点和5个候选基因,其中功能为凯氏带膜蛋白基因(Lus10033007)与叶子发育形成密切相关。
本研究中花色分为蓝色、深蓝色、淡蓝色、紫色、粉蓝色、白色6个颜色,其中蓝花种质最多(152份),占供试材料的56.5%,说明亚麻花颜色主要蓝花为主。除这些花颜色以外,据报道还有红花、淡红花和黄花的亚麻种质[1],但本研究中未见红花或黄花的亚麻。花药颜色一般以蓝色较多,本研究中233份种质花药色为蓝色,占供试材料的86.61%,说明亚麻花药色主要以蓝色为主。本研究中叶片颜色分深绿色(158份)、绿色(98份)、淡绿色(13份),叶形分为线形(116份)和披针形(153份)。说明亚麻叶子主要以深绿披针形为主,但是叶子颜色绿色和深绿色、绿色和淡绿色之间没有明确的界限,对于叶片颜色的确定因不同时间或不同研究者均会产生一定的差异。
4 结 论
亚麻花和花药主要以蓝色为主,叶子主要以深绿披针形为主。通过全基因组关联分析检测到11个SNP位点和28个候选基因。其中,亚麻花色显著关联的SNP位点3个,候选基因8个;花冠形状显著关联的SNP位点3个,候选基因6个;亚麻花药色显著关联的SNP位点1个,候选基因5个;亚麻叶色显著关联的SNP位点1个,候选基因4个;叶形显著关联SNP位点3个,候选基因5个。对28个候选基因功能的NR、Swiss-port、GO、KEGG数据进行注释,NR注释到15个基因,其中糖苷酶、转移酶、还原酶相关基因3个,假设蛋白、结合蛋白、结构域旋蛋白、凯氏带膜蛋白等12个蛋白。Swiss-port注释到22个基因,KEGG注释到20个基因,GO注释到13个基因。
