天麻通过脑肠轴对脑出血大鼠的保护机制
2022-06-06朱世杰寇云芳吴云田维毅周凌云罗亚非唐中生陈万浩段学清
朱世杰 寇云芳 吴云 田维毅 周凌云 罗亚非 唐中生 陈万浩 段学清


摘要 目的:探究黔产天麻通过调节脑-肠轴对蛛网膜下腔出血(SAH)大鼠的保护作用及机制。方法:选取成年雄性大鼠60只,采用血管内刺破法建立SAH模型,并随机分为假手术组、模型组、天麻低、中、高浓度组,5组分别给予相应处理1周后进行造模,24 h后取材,利用HE染色观察病理学变化,免疫组织化学染色、蛋白免疫印迹检测神經递质5-羟色胺转运体基因连锁多态区(5-HTTLPR)、降钙素基因相关肽(CGRP)、白细胞介素-4(IL-4)表达情况。结果:与模型组比较,天麻低、中、高浓度组大鼠脑和空肠的病理学变化较轻,但存在神经细胞不同程度的核固缩、变性的情况,空肠绒毛存在脱落、上皮下间隙扩大、毛细血管扩张等病理学变化;与模型组比较,假手术组、天麻中浓度组和高浓度组大鼠海马和空肠中5-HTTLPR、CGRP的表达显著性提高,IL-4表达降低显著,差异有统计学意义(均 P <0.01),与假手术组比较,天麻高、中浓度组大鼠海马和空肠中5-HTTLPR、CGRP的表达提高及IL-4表达降低显著(均 P <0.01)。结论:天麻通过脑-肠轴调节5-HTTLPR、CGRP、IL-4因子的表达,发挥对脑出血大鼠脑和肠道的保护作用,尤以天麻高浓度溶液的效果更为显著。
关键词 脑-肠轴;脑出血;天麻;中药;炎症;机制;损伤;大鼠
Mechanism of Gastrodiae Rhizoma in Protecting Rats with Cerebral Hemorrhage through Brain-Gut Axis
ZHU Shijie1,KOU Yunfang1,WU Yun2,TIAN Weiyi1,ZHOU Lingyun3,LUO Yafei1,TANG Zhongsheng1,CHEN Wanhao1,DUAN Xueqing1
(1 Guizhou University of Traditional Chinese Medicine,Guiyang 550025,China; 2 Zunyi Hospital of Traditional Chinese Medicine,Zunyi 563000,China; 3 The Second Affiliated Hospital of Guizhou University of Traditional Chinese Medicine,Guiyang 550002,China)
AbstractObjective: To explore the efficacy and mechanism of Gastrodiae Rhizoma produced in Guizhou Province in protecting the rats with cerebral hemorrhage by regulating brain-gut axis. Methods: Sixty adult male rats were randomly assigned into a sham operation group,a model group,and low-,medium-,and high-dose Gastrodiae Rhizoma groups.After corresponding treatments for a week,the model was established.After 24 h,the samples were collected for observation of the pathological changes by hematoxylin-eosin(HE) staining.Immunohistochemistry and Western blotting were employed to determine the expression of the neurotransmitters serotonin-transporter-linked promoter region(5-HTTLPR),calcitonin gene-related peptide(CGRP),and interleukin-4(IL-4). Results: Compared with the model group,the Gastrodiae Rhizoma groups showed slight pathological changes of brain and jejunum,karyopyknosis and degeneration of nerve cells,and shedding,subepithelial space enlargement,and capillary dilatation of jejunal villi.Compared with the model group,the medium-and higher-dose Gastrodiae Rhizoma groups and sham operation group presented up-regulated expression of 5-HTTLPR and CGRP and down-regulated expression of IL-4 in hippocampus and jejunum( P <0.01).Furthermore,the medium-and higher-dose Gastrodiae Rhizoma groups showed higher expression of 5-HTTLPR and CGRP and lower expression of IL-4 in hippocampus and jejunum than the sham operation group( P <0.01). Conclusion: Gastrodiae Rhizoma can regulate the expression of 5-HTTLPR,CGRP,and IL-4 through brain-gut axis to protect rats from cerebral hemorrhage.In particular,high-dose Gastrodiae Rhizoma demonstrated remarkable effect.60B3D286-45BD-45E0-A708-8AFC591F72C3
Keywords Brain-gut axis; Cerebral hemorrhage; Gastrodiae Rhizoma; Chinese herb medicine; Inflammation; Mechanism; Injury; Rat
中图分类号:R282;R743 文獻标识码:A doi: 10.3969/j.issn.1673-7202.2022.09.017
蛛网膜下腔出血(Subarachnoid Hemorrhage,SAH)是出血性脑血管疾病的一种,约占急性脑卒中的10%,具有发病迅速、病死率高、病情严重的特点[1]。该病不仅可以引起脑部损伤,还可以通过脑-肠轴引起胃肠道病变,如胃肠道炎症、出血、肠梗阻等症状,严重影响后期的愈后康复,也给患者带来巨大的经济及心理压力[2]。
天麻是中医用于防治脑血管疾病常用的植物药材之一,也是我国生活中常用的食材,具有息风止痉、平抑肝阳、祛风通络等功效[3-4], 其主要化学成分有天麻素、多糖类、腺苷类等,具有多靶点作用[5-6]。有实验研究表明,天麻可以通过调节多个信号通路中关键因子,改善脑出血后对脑和肠道的损伤,但机制尚待进一步研究。本团队对大鼠以不同浓度天麻溶液灌胃,探究天麻溶液对SAH大鼠的保护作用机制。
1材料与方法
1.1材料
1.1.1动物选用成年SD大鼠60只,雄性,体质量280~300 g,购于长沙市天勤生物技术有限公司,合格证号:【SCXK】2019-0014,无特定病原体(Specific Pathogen Free,SPF)级,经学校实验动物管理委员会批准,饲养于基础医学院课题组动物房,其温度在20~24 ℃,相对湿度35% ~40%,噪声控制80分贝以下,保持持续通风换气,定期投喂水和饲料。
1.1.2药物黔产天麻购于贵州中医药大学第一附属医院,用时将天麻流水洗净,干燥粉碎后加大于天麻重量10倍的纯水,煎煮1 h/次,煎煮3次,总时间不超过3 h,过滤,浓缩至约原药材1 g/mL,稀释成所需要浓度存放于4 ℃冰箱保存备用。
1.1.3试剂5-羟色胺转运体基因连锁多态区(5-hydroxytryptamine Transporter Gene-linked Polymorphic Region,5-HTTLPR)(BOSTER,批号:BA3707-1),降钙素基因相关肽(Calcitonin Gene-related Peptide,CGRP)(碧云天,批号:AF6495),白细胞介素-4(Interleukin-4,IL-4)(BOSTER,批号:BA0980-1)。
1.2方法
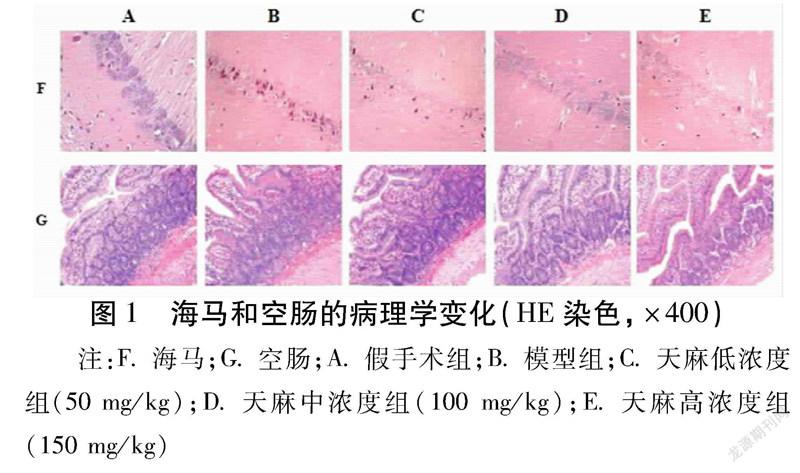
1.2.1分组与动物模型制作将动物随机分为5组,每组12只,即假手术(A)组、模型(B)组、天麻低浓度(C)组(50 mg/kg)、天麻中浓度(D)组(100 mg/kg)、天麻高浓度(E)组(150 mg/kg)[7]。采取颈内动脉穿刺法建立SAH模型。应用戊巴比妥钠,浓度1%,剂量35 mg/kg,经腹腔注射麻醉后,把SD大鼠仰卧固定,颈正中切口,逐层钝性分离出右侧颈总动脉、颈外动脉。在近心端电凝切断颈外动脉,分离并夹闭颈内动脉和颈总动脉,避免夹持迷走神经,游离并电凝颈内动脉的侧支小动脉,在颈外动脉剪V形切口,将修制的4号尼龙线从切口导入,至出现落空感后,迅速抽出并结扎颈外动脉。松开颈总动脉上的动脉夹恢复血流,逐层缝合并消毒。整个手术过程用电热毯将大鼠体温保持为(37±1)℃。假手术组在线栓遇到阻力后停止插入。
1.2.2动物给药给药各组大鼠在造模前1周,分别进行天麻低、中、高浓度提取液灌胃,2次/d,3 mL/次,假手术组和模型组给予等量的0.9%生理盐水。
1.2.3HE染色各组大鼠麻醉后,将0.9%生理盐水约400 mL,用灌注针经升主动脉注入,冲洗至心脏溢出的液体为清澈,然后将4%多聚甲醛约300 mL/只,用灌注针经升主动脉注入,滴注时间约15 min/只,待标本固定后,快速断取脑和空肠,放入4%多聚甲醛中后固定过夜。常规石蜡包埋切片,按照HE染色的步骤进行梯度染色,其中苏木精染色时间为5 min,伊红染色时间为1 min。
1.2.4免疫组织化学法将各组大鼠脑和空肠的石蜡切片梯度脱蜡后,0.3% H2O2室温孵15 min,5%牛血清白蛋白(Bovine Serum Albumin,BSA)室温孵育1 h;分别依次滴加5-HTTLPR、CGRP、IL-4抗体(1∶ 200),4 ℃过夜;次日滴加二抗工作液,37 ℃孵育1 h;二氨基联苯胺(3,3′-diaminobenzidine,DAB)显色3 s,苏木精复染,梯度乙醇脱水,二甲苯透明后中性树脂封片。每步骤间均用0.01 mol/mL磷酸盐缓冲溶液(Phosphate Buffered Saline,PBS)洗涤5 min×3。最后,每张切片在显微镜下随机观察3个视野,采用Image-Pro Plus 10.0软件统计每张图片的阳性细胞数。
1.2.5蛋白免疫印迹法各组取海马和空肠组织加入适量RIPA(细胞裂解液)提取液提取蛋白离心,收集上清液,再按细胞蛋白提取试剂盒说明进行蛋白提取,检测蛋白浓度。将制备好的蛋白样品加入凝胶中电泳,转膜,取膜。5%BSA室温封闭1 h,5-HTTLPR、CGRP、IL-4抗体(1∶ 300)和小鼠抗大鼠肌动蛋白多克隆抗体(1∶ 3 000)过夜。复温1 h后滴加相应二抗,辣根过氧化物酶(Horseradish Peroxidase,HRP)标记山羊抗兔抗体(1∶ 1 000),室温孵育2 h。 洗涤后,在聚偏氟乙烯(Polyvinylidene Fluoride,PVDF)膜上滴加ECL发光液,放于凝胶成像仪中,开始曝光,用发光凝胶成像系统软件进行图像分析。60B3D286-45BD-45E0-A708-8AFC591F72C3
1.3统计学方法采用Sigma Plot 18.0统计软件进行实验数据的统计分析,数据以均值±标准差( ±s )表示。应用单因素方差分析(ANOVA)对免疫蛋白印迹检测的条带灰度值进行组间比较,以 P <0.05为差异有统计学意义。
2结果
2.1海马和空肠组织病理学变化
假手术组大鼠海马和空肠组织细胞排列基本均匀规则,胞核呈圆形或椭圆形,核仁明显,染色均匀,正常细胞较多;模型组大鼠海马和空肠组织细胞排列杂乱松散,细胞肿胀、细胞空泡化较多,核固缩而核周体消失严重,空肠黏膜上皮下间隙扩大,肠绒毛脱落,肠组织结构破坏较重;天麻溶液不同浓度灌胃的大鼠海马区正常细胞胞核圆形或椭圆形,核仁清晰,染色质丰富,排列较密,存在相对少量因核固缩、胞质空泡化而发生变性的神经细胞,空肠黏膜上皮下间隙扩大、毛细血管扩张不明显。见图1。
2.25-HTTLPR在脑和空肠的表达情况
与模型组比较,其余4组大鼠海马和空肠中5-HTTLPR表达显著提高( P <0.01);与假手术组比较,天麻中、高剂量组大鼠海马和空肠中5-HTTLPR表达显著,差异有统计学意义(均 P <0.01);天麻低浓度组5-HTTLPR表达量虽有提高,但差异没有统计学意义( P >0.05),与天麻中剂量组比较,天麻高剂量组更能提高大鼠海马和空肠中5-HTTLPR表达( P <0.01)。见图2~3。2.3CGRP在脑和空肠的表达情况
与模型组比较,其余4组大鼠海马和空肠中CGRP表达水平显著提高,差异有统计学意义(均 P <0.01);与假手术组比较,天麻中、高剂量组大鼠海马和空肠中CGRP表达水平上调显著,且差异有统计学意义(均 P <0.01);天麻低浓度组CGRP表达水平有上升,但差 异有统计学意义( P >0.05),与天麻中剂量组比较,天麻高剂量组更能提高CGRP在大鼠海马和空肠中的表达水平( P <0.01)。见图4~5。
2.4IL-4在脑和空肠的表达情况与假手术组比较,其余4组大鼠海马和空肠中IL-4表达明显上升,差异有统计学意义(均 P <0.01);与模型组比较,IL-4在天麻中、高剂量组大鼠海马和空肠中表达水平下降明显,差异有统计学意义(均 P <0.01);天麻低浓度组海马和空肠中IL-4表达水平虽然有所下降,但差异没有统计学意义( P >0.05),与天麻中剂量组比较,天麻高剂量组大鼠海马和空肠中IL-4表达水平下调更为显著( P <0.01)。见图6~7。
3讨论
蛛网膜下腔出血是由分布于脑的血管破裂引起的一种常见急性脑损伤疾病,分为自发和继发2种类型。研究证明,蛛网膜下腔出血后的主要病理学变化以炎症、血管痉挛、水肿、细胞凋亡等为主[8-12],病理学变化之间相互交织影响发展,最终导致脑实质性损伤引起死亡或伴发其他脏器的损伤如胃肠道出血、便秘等,在此过程中,炎症起重要作用[12]。
蛛网膜下腔出血既可以引起脑损伤,还能通过脑-肠轴引起胃肠道诸多的病理学变化,目前多认为是通过神经系统、免疫系统、内分泌系统等途径[13],借助沟通脑肠信息的脑肠肽来进行。而脑肠肽是分布于胃肠和神经系统的肽类物质,如5-HT、CGRP等[14-15],具有连接和调控脑和肠道信息介质交换通畅的功能。其中5-HT是脑肠通路中重要的单胺类递质,受其编码的转运体基因启动因子5-HTTLPR和调控[16],大部分由肠道的嗜铬细胞合成,其受体多存在于嗜酸性粒细胞、嗜碱性粒细胞、肥大细胞等免疫细胞上,具有调节炎症介质表达、影响中枢神经系统对胃肠道的调节作用,如调节其他神经递质在胃肠组织的水平及肠道绒毛、隐窝的变化等作用[17-18]。CGRP是利用基因重组技术发现的由氨基酸组成的多肽物质,广泛存在于脑和肠道组织中,可以通过舒张其组织中的血管及直接作用于巨噬细胞和树突状细胞,抑制上述细胞产生炎症介质[19-20]。IL-4可由树突状细胞、肥大细胞、T/B细胞等多种免疫细胞分泌,是多功能细胞因子,在脑和胃肠道的炎症反应、免疫反应中起重要作用[21-22]。
天麻是一种产于贵州、云南、四川等地的药食两用植物,具有息风止痉,平抑肝阳,祛风通络的功效,现代药理证明其化学成分为天麻苷、多糖、维生素A、氨基酸等[23],具有镇痛抗炎、抗氧化及改善缺血等作用[24-26],有较高的临床应用价值,但具体作用机制尚未完全阐明。本实验采用不同浓度的天麻液灌胃大鼠1周,观察其对SAH大鼠引起的脑损伤和肠损伤的保护效果及其作用機制,实验结果显示,与模型组比较,给予7 d天麻中、高浓度溶液灌胃后,能显著提高5-HTTLPR、CGRP在SAH大鼠海马和空肠部位的表达,下调炎症介质IL-4的表达水平;而与假手术组比较,天麻低浓度溶液对5-HTTLPR、CGRP表达的影响差异无统计学意义,说明给予天麻中、高浓度溶液能明显提高脑和空肠组织中提高5-HTTLPR、CGRP的表达,下调IL-4表达水平,起对SAH大鼠海马和空肠组织的保护作用,降低SAH引起的大鼠脑和肠道的损伤。但该实验对SAH大鼠海马和空肠中5-HTTLPR、CGRP、IL-4指标的观察时间较短,对于长期的影响效果有待进一步研究。
总之,天麻能通过脑-肠轴抑制蛛网膜网下腔出血引起的大鼠脑和肠道的损伤,其中以天麻高浓度溶液灌胃的效果最好,作用机制可能与提高5-HTTLPR、CGRP的表达下调IL-4表达水平有关。
参考文献
[1]赵忠惠,郝广志,邹正,等.Claudin-1在蛛网膜下腔出血小鼠早期脑损伤过程中的变化[J].神经解剖学杂志,2020,36(5):507-511.
[2]梁恩,麦树荣,何嘉伟,等.绿茶多酚通过抑制TLR4通路减轻蛛网膜下腔出血大鼠早期脑损伤[J].免疫学杂志,2021,37(2):122-127.60B3D286-45BD-45E0-A708-8AFC591F72C3
[3]柳威,鄧林华,祁东利,等.天麻及其有效成分的药理作用概述[J].中药药理与临床,2021,37(4):240-244,12.
[4]李平,许金国,季德,等.天麻饮片传统性状与内在品质相关性研究[J].中国中药杂志,2019,44(20):4460-4466.
[5]郜玉钢,顾沛沛,臧埔,等.HPLC法同时检测人参、天麻及其复方中21种活性成分[J].中华中医药学刊,2021,39(12):1-5.
[6]杨沙,段灿灿,张建永.基于ADME及网络药理学的天麻治疗原发性头痛的作用机制研究[J].中药材,2018,41(8):1963-1969.
[7]周建,陶陶,徐坚,等.天麻对缺氧引起大鼠大脑皮质神经元细胞凋亡的保护作用[J].中华中医药杂志,2013,28(3):640-644.
[8]Rumalla K,Smith KA,Arnold PM,et al.Subarachnoid Hemorrhage and Readmissions:National Rates,Causes,Risk Factors,and Outcomes in 16,001 Hospitalized Patients[J].World Neurosurg,2018,110:e100-e111.
[9]Zuo G,Zhang T,Huang L,et al.Activation of TGR5 with INT-777 attenuates oxidative stress and neuronal apoptosis via cAMP/PKCε/ALDH2 pathway after subarachnoid hemorrhage in rats[J].Free Radic Biol Med,2019,143:441-453.
[10] Wang M,Cheng L,Chen ZL,et al.Hyperbaric oxygen preconditioning attenuates brain injury after intracerebral hemorrhage by regulating microglia polarization in rats[J].CNS Neurosci Ther,2019,25(10):1126-1133.
[11]Rass V,Ianosi BA,Wegmann A,et al.Delayed Resolution of Cerebral Edema Is Associated With Poor Outcome After Nontraumatic Subarachnoid Hemorrhage[J].Stroke,2019,50(4):828-836.
[12]Coulibaly AP,Provencio JJ.Aneurysmal Subarachnoid Hemorrhage:an Overview of Inflammation-Induced Cellular Changes[J].Neurotherapeutics,2020,17(2):436-445.
[13]Cryan JF,O′Riordan KJ,Cowan,CSM,et al.The Microbiota-Gut-Brain Axis[J].Physiol Rev,2019,99(4):1877-2013.
[14]Chung JY,Jeong JH,Song J.Resveratrol Modulates the Gut-Brain Axis:Focus on Glucagon-Like Peptide-1,5-HT,and Gut Microbiota[J].Front Aging Neurosci,2020,12:588044.
[15]Pendharkar SA,Walia M,Drury M,et al.Calcitonin gene-related peptide:neuroendocrine communication between the pancreas,gut,and brain in regulation of blood glucose[J].Ann Transl Med,2017,5(21):419.
[16]Chan F,Lanctt KL,Feinstein A,et al.The serotonin transporter polymorphisms and major depression following traumatic brain injury[J].Brain Inj,2008,22(6):471-479.
[17]Martins-Perles J,Zignani I,Souza S,et al.QUERCETIN SUPPLEMENTATION PREVENTS CHANGES IN THE SEROTONIN AND CASPASE-3 IMMUNOREACTIVE CELLS OF THE JEJUNUM OF DIABETIC RATS[J].Arq Gastroenterol,2019,56(4):405-411.
[18]Hao MM,Fung C,Boesmans W,et al.Development of the intrinsic innervation of the small bowel mucosa and villi[J].Am J Physiol Gastrointest Liver Physiol,2020,318(1):G53-G65.
[19]Theoharides TC,Tsilioni I,Bawazeer M.Mast Cells,Neuroinflammation and Pain in Fibromyalgia Syndrome[J].Front Cell Neurosci,2019,13:353.60B3D286-45BD-45E0-A708-8AFC591F72C3
[20]Sheng Y,Zhu L.The crosstalk between autonomic nervous system and blood vessels[J].Int J Physiol Pathophysiol Pharmacol,2018,10(1):17-28.
[21]d′Avila JC,Siqueira LD,Mazeraud A,et al.Age-related cognitive impairment is associated with long-term neuroinflammation and oxidative stress in a mouse model of episodic systemic inflammation[J].J Neuroinflammation,2018,15(1):28.
[22]Leyva-Castillo JM,Galand C,Kam C,et al.Mechanical Skin Injury Promotes Food Anaphylaxis by Driving Intestinal Mast Cell Expansion[J].Immunity,2019,50(5):1262-1275.e4.
[23]张志龙,郜玉钢,臧埔,等.天麻素、对羟基苯甲醇对中枢神经系统作用机制研究进展[J].中国中药杂志,2020,45(2):312-320.
[24]雷娜,柳丽松,韩春妮,等.云南昭通三种天麻镇痛抗炎作用的比较研究[J].时珍国医国药,2015,26(1):13-15.
[25]高玉梅,王晓玲,邓于新,等.天麻粉预防痴呆小鼠模型发病及其对抗氧化作用的影响[J].中国实验方剂学杂志,2020,26(2):52-58.
[26]蒋清伟,王威,刘姝畅,等.柱前衍生化HPLC法测定天麻提取物中18种氨基酸含量[J].中国新药杂志,2020,29(15):1785-1790.
(2021-04-11收稿本文编辑:杨觉雄)
基金项目:贵州省中医药管理局中医药、民族医药科学技术研究课题(QZYY2018112);贵州省科技厅科技合作项目(黔科合LH[2016]7121号);贵州中医药大学校内课题(贵中医科院内[2018]52号;贵州省科技创新人才团队(黔科合平台人才[2020]5010);贵州省发改委工程研究中心建设项目(黔发改高技[2020]896号)作者简介:朱世杰(1986.05—),男,硕士,讲师,研究方向:中药对脑血管及免疫系统的影响,E-mail:zhu3514@163.com通信作者:罗亚非(1965.07—),男,硕士,教授,硕士研究生导师,研究方向:脑血管疾病的形態学研究,E-mail:944943527@qq.com60B3D286-45BD-45E0-A708-8AFC591F72C3
