四倍体白掌新品种‘绿萌’的选育
2022-06-06周辉明林辉锋莫智龙陈昌铭曹奕鸯熊君
周辉明 林辉锋 莫智龙 陈昌铭 曹奕鸯 熊君






摘 要:白掌又名白鶴芋,原产于美洲和亚洲的热带地区,为天南星科白鹤芋属多年生草本植物,是重要的观花观叶盆栽植物,当前市场主栽品种基本源于国外,多为人工杂交产生的后代。利用人工诱变技术对植物体细胞染色体组进行加倍的多倍体育种方法已应用于观赏花卉新品种的选育,多倍体植株具有叶片增大、叶色加深、花朵变大、花色艳丽等优良性状,与二倍体比较,目标性状的观赏价值更高。利用化学诱变产生多倍体是目前人工多倍体育种中常用的诱导方法,其具有操作简易、突变率高、专一性强和适用性广等特点。秋水仙素是目前主要采用的多倍体化学诱变剂,其诱导的效果与诱导时间、使用的浓度、处理的植物种类和器官等因素有关。本研究以白掌‘美酒’的组培苗愈伤组织为材料,优化四倍体白掌诱导方法,经秋水仙素浸泡处理后,开展试管苗形态学初筛、田间种植优选及株系比较试验,同时进行染色体计数、气孔大小和基因组大小比较、四倍体白掌新品种选育。结果表明:最佳诱导四倍体白掌的方式为0.10%秋水仙素浸泡处理7 d,其四倍体诱导率最高;选育出的四倍体白掌新品种‘绿萌’在设施大棚种植时自然花期为4—6月,与对照‘美酒’相比,叶片长和宽、叶柄长和直径、叶鞘长、佛焰苞苞片长和宽、花梗长和直径、肉穗花序长和直径、气孔长度和宽度、气孔密度均差异极显著,根尖染色体数为2=4X=60,是对照(2=2X=30)的2倍。流式细胞仪测定DNA显示,‘绿萌’基因组大小为10.87 Gb,对照‘美酒’基因组大小为5.73 Gb,鉴定为四倍体白掌新品种。本研究利用人工化学诱变方法选育的四倍体白掌新品种‘绿萌’,具有叶片增厚、叶色加深、茎杆变粗、叶柄变粗、花梗变粗、肉穗花序变粗等特点,大大提高了白掌的观赏价值。
关键词:白掌;化学诱变;选育
中图分类号:S682 文献标识码:A
is an important ornamental foliage and flower plant and is an perennial herb native to the tropics of America and Asia. At present, most of the main varieties in China are from abroad, and the offspring of artificial hybridization. The polyploid breeding method of doubling the chromosome sets of plant somatic cells by artificial mutation technology is often applied to ornamental flowers. The variety of selected polyploid plants showed excellent traits such as leaf enlargement, leaf color deepening, flower enlargement and gorgeous flower color, which could greatly improve the ornamental value of the target traits. Using chemical mutagens to induce polyploids is a common induction method in artificial mutagenesis technology because of its simple operation, high mutation rate, strong specificity and wide applicability. Colchicine is a polyploid chemical mutagen mainly used in polyploid induction at present. The effect of colchicine on inducing polyploidy is related to induction time, concentration, plant species and organs. The callus of Meijiu was used as the material. The induction method of tetraploid was optimized. Morphological screening of seedlings , field selection and comparison of plants regeneratrd were carried out. Furthermore, the number of chromosomes, stomatal size andgenome size identification were used for breeding and identified new varieties of . The results showed that the best way to induce tetraploid was soaking with 0.10% colchicine for 7 days. The flowering duration of the newly selected ‘Lvmeng’ was from April to June when it was planted in the greenhouse. Compared with the control ‘Meijiu’, there were significant differences in leaf length, leaf width, petiole length, petiole diameter, leaf sheath length, bracts length, bracts width, bracts stalk length, bracts stalk diameter, spadix length, spadix diameter, stomatal length, stomatal width and stomatal density at the flowering stage. The number of chromosomes was 2=4X=60, which was twice that of the control 2=2X=30. Flow cytometry DNA analysis showed that the genome size of ‘Lvmeng’ was 10.87 Gb, and that of the control ‘Meijiu’ was 5.73 Gb. It was identified as a new tetraploid species of . The new polyploid variety ‘Lvmeng’ was induced by artificial chemistry, with thickened leaves, deepened leaf color, thickened stem, petiole, bracts stalk and spadix, which greatly improves the ornamental value of .
; chemical mutagenesis; breeding
: 10.3969/j.issn.1000-2561.2022.05.011
白鹤芋()又名白掌,原产于美洲和亚洲的热带地区,为天南星科(Araceae)白鹤芋属()多年生草本植物。其植株叶色翠绿,花形似鹤翘首,色泽洁白无暇,被视为“清白之花”,是重要的观花观叶盆栽植物,极具观赏价值和经济价值。当前,国内关于白掌新品种选育的研究报道较少,市场主栽品种基本源于国外,多为人工杂交产生的后代。杂交育种存在育种周期长、效率低等问题。利用人工诱变技术对植物体细胞染色体组进行加倍的多倍体育种方法已常应用于观赏花卉,选育的植株表现出叶片增大、叶色加深、花朵变大、花色艳丽等优良性状,大大提高了目标性状的观赏价值。利用化学诱变剂诱变产生多倍体是目前人工多倍体育种常用的诱导方法,具有操作简易、突变率高、专一性强和适用性广等特点。秋水仙素是目前主要采用的诱变剂,诱导试验材料通常选取种子、顶芽、侧芽以及组织培养中的愈伤组织、原球茎等分裂旺盛的器官或组织,秋水仙素诱导的效果与诱导时间、使用的浓度、培养的温度、处理的植物种类和器官等因素有关。本研究以主栽白掌‘美酒’愈伤组织为材料,通过秋水仙素化学诱变结合试管苗形态学初筛、田间种植优选及株系比较试验后,进行了染色体计数、气孔大小和基因组大小比较,选育出了四倍体白掌新品种,丰富了白掌种质资源,满足市场需求。
材料与方法
材料
供试材料为三明市农业科学研究院花卉研究所白掌‘美酒’组培苗和成品苗。
方法
1.2.1 多倍体白掌诱导方法优化 2012年4月以白掌‘美酒’健壮二代苗的茎尖诱导的愈伤组织为供试材料,设计不同浓度的秋水仙素(0、0.06%、0.08%、0.1%)、不同处理时间(7、14、21 d)来优化四倍体诱导方法。将秋水仙素处理后的愈伤组织接种于分化培养基中,45 d后统计生长状况,计算成活率,成活率=成活愈伤组织数/处理愈伤组织数×100%。将分化的种苗进行生根培养,待长出根后,采用根尖压片法进行多倍体鉴定,统计分化植株数、变异植株数和四倍体植株数,计算变异率和四倍体诱导率,变异率=变异植株数/分化植株数×100%,四倍体诱导率=四倍体植株数/变异植株数×100%。
1.2.2 选育白掌四倍体 以白掌‘美酒’健壮二代苗的茎尖诱导愈伤组织为供试材料,经添加0.1%化学诱变剂秋水仙素的液体诱导培养基7 d摇床振荡处理,然后将处理的愈伤组织接种于分化培养基,待愈伤组织分化后,从41株分化苗中发现叶片宽大肥厚、色泽加深、茎秆粗壮的变异株23株,通过根尖染色体检测,发现了其中的12株为四倍体植株,选取一个四倍体单株进行少量组培快繁和栽培。经农艺性状观察发现,其茎秆粗壮,叶片宽大肥厚、富有质感,佛焰苞厚实、白色且富有光泽,花高于叶,花梗直径较粗,符合多倍体巨大性特征,命名为‘MJ-1’。2018年,将‘MJ-1’和对照‘美酒’的形态学特征进行比较、根尖染色体、气孔大小和分子检测,综合评价判定为四倍体白掌新品种,定名为‘绿萌’。
1.2.3 形态学特征比较 分别随机抽取10盆‘绿萌’和‘美酒’,测定植株盛花时的叶片长、叶片宽、叶柄长、叶柄直径、叶鞘长、叶片数、佛焰苞苞片长、佛焰苞苞片宽、花梗长、花梗直径、肉穗花序长、肉穗花序直径、花色等形态学特征,统计重复3次,用Excel软件进行数据统计和分析。
1.2.4 叶片气孔大小测定 早上9:00—11:00,用指甲油(思姿恋环保护甲亮油)涂抹白掌植株成熟叶片的背部,2 min后,用镊子轻轻地撕取叶片的下表面组织,置于载玻片上,盖上盖玻片(注意保证组织的平整放置),在20×10倍镜下随机观察10个视野,重复3次,统计各视野的气孔数,用标准的显微镜测微尺测量气孔长度。气孔密度计算为:气孔密度(个/mm)=各视野中气孔数(个)/视野的面积(mm)。
1.2.5 根尖染色体检测 切取白掌根尖0.4~ 0.8 cm,置于2 mL试管中,加入1.5 mL已配制好的0.002 mol/L浓度的8-羟基喹啉,16℃黑暗处理6 h,期间每隔2 h换1次0.002 mol/L的8-羟基喹啉处理液。将预处理后的根尖用清水洗净,加入新鲜配制的卡诺固定液(95%乙醇∶冰醋酸= 3∶1),于4℃冰箱放置18~24 h;次日,弃除卡诺固定液,用蒸馏水漂洗根系5~10 min,用刀片切取根尖生长点,浸泡于含2%纤维素酶和1%果胶酶的液体中,37℃温浴1~2 h后缓慢加入75%乙醇,轻轻吸出液体,缓慢加入醋酸少许,之后将根尖生长点取出并置于载玻片上,用玻棒捣碎根尖使根尖紧压载玻片,蘸取已过滤的0.025%甲基紫1~2滴于根尖捣碎区,染色2~3 min,盖上盖玻片,用濾纸吸取多余的染色液,用普通光学显微镜进行镜检和拍照,每个品种选取3株作根尖取样,每株观察清晰可辨的细胞10个及以上,以确定染色体数目。
1.2.6 流式细胞仪测定基因组大小 取白掌新鲜叶片1 g,置于0.8 mL预冷的细胞核解离液(45 mmol/L MgCl·6HO,20 mmol/L MOPS,30 mmol/L柠檬酸钠,1%(/) PVP40,0.2% (/)Tritonx-100,10 mmol/L NaEDTA,20 μL/mL β-巯基乙醇,pH 7.5)中,用锋利的刀片将组织迅速切碎,冰上静置10 min,用400目滤网过滤,滤液为细胞核悬浮液。向细胞核悬液中加入预冷的含50 μg/mL RNAase的碘化丙啶(propidium iodide,PI)(50 μg/mL)染液100 μL,置于冰上避光染色0.5~1 h。以番茄为内参,利用BD FACScalibur流式细胞仪对染色后的细胞核悬浮液样品上机检测,采用488 nm蓝光激发,检测碘化丙啶的发射光荧光强度,每次检测收集10 000个颗粒。变异系数()控制在5%以内。使用Modifit 3.0分析软件作图分析,试验重复3次。
本试验所用培养基配方如下:
液体诱导多倍体培养基:MS+6-BA 1.0 mg/L+ NAA 0.1 mg/L+白糖30 ;g/L+秋水仙素,pH 5.6。
组培分化培养基:MS+6-BA 1.0 mg/L+NAA 0.1 mg/L+白糖30 g/L+琼脂4.5 g/L,pH 5.6。
组培生根培养基:1/2 MS+NAA 0.3 mg/L+ 0.5 g/L活性炭+白糖20g/L+琼脂4.5 g/L,pH 5.6。
结果与分析
不同浓度秋水仙素和不同处理时间对‘美酒’多倍体诱导的影响
从表1可见,相同浓度秋水仙素下,处理时间越长对愈伤组织毒害作用越大,愈伤组织成活率越低;0.06%~0.10%范围内,秋水仙素浓度越高,变异率和四倍体诱导率越高,对愈伤组织毒害作用也越大;0.10%秋水仙素处理7 d,变异率达60%,四倍体诱导率为50%,变异率和四倍体诱导率均比其他浓度和处理时间高。
形态学特征比较
白掌‘绿萌’与对照‘美酒’相比,具多倍体的植株变壮(图1A~图1C)、叶片变大(图1D)、肉穗花序变粗(图1E)等特征。从表2可见,‘绿萌’叶片长度、叶柄长度、叶鞘长、佛焰苞苞片长度、佛焰苞苞片宽度、花梗长度均小于对照‘美酒’,方差分析显示差异极显著;‘绿萌’叶片宽度、叶柄直径、叶片数、花梗直径、肉穗花序长度、肉穗花序直径均大于对照‘美酒’,方差分析显示,除叶片数之外,其他特征差异极显著。‘绿萌’在植株形态学上具多倍体的叶片增厚、叶色加深、茎杆变粗、叶柄变粗、苞梗变粗、肉穗花序变粗等特征。
气孔大小和密度比较
白掌新品种‘绿萌’与对照‘美酒’的气孔大小和密度比较见表3和图2,‘绿萌’的气孔长度为41.72 μm、气孔宽度为25.93 μm,大于对照‘美酒’的气孔长度和宽度,方差分析显示差异极显著;‘绿萌’的气孔密度为15.50个/mm,比对照‘美酒’的气孔密度少,方差分析显示差异极显著。
細胞学水平比较
本研究观测了10个清晰视野下的染色体状态,重复3次,结果显示对照‘美酒’的二倍体染色体数为2=2X=30(图3A),‘绿萌’的染色体数为2=4X=60(图3B)。‘绿萌’的染色体数为对照‘美酒’的2倍,是‘美酒’的四倍体白掌。
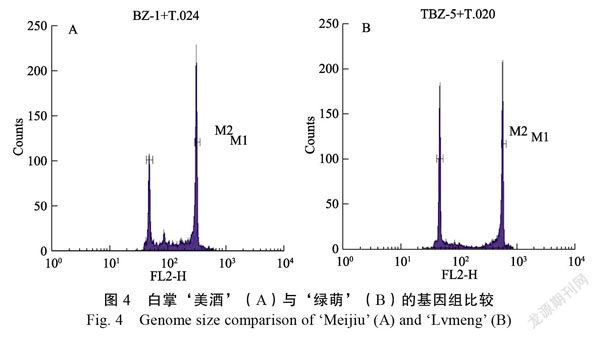
基因组大小比较
通过流式细胞仪对细胞DNA含量测定和分析(图4),‘绿萌’的DNA含量为10.87 Gb,‘美酒’的DNA含量为5.73 Gb,‘绿萌’基因组大小约为‘美酒’的2倍,表明白掌‘绿萌’为纯四倍体。
讨论
利用人工化学诱导剂秋水仙素结合组织培养诱导植物多倍体的应用已十分广泛,在红掌、大花蕙兰、非洲菊、萱草、百合、杜鹃等园艺花卉中已有成功报道,诱导材料的类型包括愈伤组织、原球茎、茎尖、芽体、种子等,不同植物种类对诱导材料的类型选择不同,且处理浓度也存在差异。在白掌的化学诱变选育上,郑云飞利用秋水仙素处理多个品种白掌的叶片、愈伤组织、组培苗的茎尖诱导多倍体,并通过流式细胞仪进行多倍体的鉴定,结果仅有以组培苗的茎尖成功诱导获得、‘Coddy color’、 ‘Bright’、‘Parrish’等4个品种的多倍体植株,这可能与叶片诱导的愈伤组织在分化过程中易褐变和秋水仙素对愈伤组织的毒害作用有关。本研究优化了多倍体白掌诱导的方法,带芽的愈伤组织(来源于健壮二代试管苗的茎尖诱导),分化能力强,试验重复性较高,是诱导四倍体的好材料;高浓度秋水仙素可提高的四倍体诱导率,但随着处理时间的延长,愈伤组织成活率越低。因此,最佳诱导四倍体白掌处理为0.10%秋水仙素浸泡处理7 d,其四倍体诱导率最高,应用于白掌四倍体新品种的选育。
利用染色体计数结合形态学和细胞学水平的差异是植物倍性鉴定的可靠方法。形态学的差异是最简单直观的鉴定方法,可通过茎秆粗度、叶片厚度、植株形态等特征的初筛提高倍性鉴定的效率。根尖染色压片的好坏直接影响染色体鉴定的结果,本研究参考了张志胜等的压片方法加以改进,通过混合纤维素酶和果胶酶进行细胞壁的溶解和应用低毒、低成本的甲基紫进行染色,建立了适合的白掌染色体分析的改良压片法。应用此方法具重复性好、分辨率高、效率高等优点,为白掌的倍性育种提供了可靠的鉴定方法。
流式细胞术作为一项高效的检测技术,广泛应用于检测植物细胞的核DNA含量及染色体倍性。本研究参考了田新民等方法,采用生长中的白掌新鲜叶片,选取PI染料为检测细胞核DNA含量的探针,以番茄为内参,利用BD FACScalibur流式细胞仪对染色后的细胞核悬浮液样品上机检测,采用488 nm蓝光激发,检测碘化丙啶的发射光荧光强度,试验结果可靠稳定。
本研究采用以白掌‘美酒’的组培愈伤组织为材料,用0.10%秋水仙素浸泡处理7 d后,经试管苗形态学、细胞学的初筛,染色体计数法及基因组大小的比较鉴定,选育出白掌四倍体新品种‘绿萌’,具多倍叶片增厚、叶色加深、茎杆变粗、叶柄变粗、花梗变粗、肉穗花序变粗等形态特征,大大提高了白掌的观赏价值,丰富了白掌种质资源。
参考文献
[1] 戴桦均, 徐维杰, 廖飞雄. 不同白鹤芋种/品种开花特性和形态的观察[C]//中国园艺学会观赏园艺专业委员会. 中国园艺学会观赏园艺专业委员会2012年学术年会论文集. 广州: 中国园艺学会, 2012: 148-153.DAI H J, XU W J, LIAO F X. An observation of flowering characteristics and spadix morphology of species/varieties[C]//Ornamental Horticulture Committee of Chinese Society for Horticultural Science. Proceedings of 2012 Academic Annual Meeting of Ornamental Horticulture Committee of Chinese Society for Horticultural Science. Guangzhou: Chinese Society for Horticultural Science, 2012: 148-153. (in Chinese)
[2] 周英彪, 彭卓伦, 蒋雄辉, 王 奎, 魏雪琴, 肖淑惠. 白掌花粉活力检测及其超低温保存研究[J]. 中国农学通报, 2013, 29(1): 113-117.ZHOU Y B, PENG Z L, JIANG X H, WANG K, WEI X Q, XIAO S H. Study on vitality and cryopreservation of 20 pollen[J]. Chinese Agricultural Science Bulletin, 2013, 29(1): 113-117. (in Chinese)
[3] 宋 平, 王学凤, 蔡 明, 任翔翔, 潘会堂, 张其翔. 秋水仙素诱导观赏植物多倍体研究进展[J]. 湖北农业科学, 2009, 48(6): 1510-1513.SONG P, WANG X F. CAI M, REN X X, PAN H T, ZHANG Q X. Research progress of polyploidy induction by colchicine in ornamental plants[J]. Hubei Agricultural Sciences, 2009, 48(6): 1510-1513. (in Chinese)
[4] 尹翠翠, 张 燕, 张景华, 陈瑶瑶, 王广东. 秋水仙素诱导杂交兰四倍体及倍性鉴定[J]. 核农学报, 2010, 24(3): 518-521.YI C C, ZHANG Y, ZHANG J H, CHEN Y Y, WANG G D. Tetraploid induction by colchicine and identification in interspecific hybrids[J]. Journal of Nuclear Agricultural Sciences, 2010, 24(3): 518-521. (in Chinese)
[5] 宋 蓮, 杨俊旭, 刘 丹, 李枝林, 王玉英. 墨兰‘绿墨素’×大花蕙兰‘世界和平’F代多倍体诱导初报[J]. 广西植物, 2018, 38(2): 188-194.SONG L, YANG J X, LIU D, LI Z L, WANG Y Y. Polyploid induction in ‘Lvmosu’× ‘Shijieheping’ F generation[J]. Guihaia, 2018, 38(2): 188-194. (in Chinese)
[6] 胡瑞阳, 段红静, 林华忠, 吴 博, 纳 静, 方禄明, 余小龙, 孙宇涵, 李 云. 杉木多倍体变异苗诱导及倍性鉴定[J]. 核农学报, 2016, 30(8): 1491-1497.HU R Y, DUAN H J, LIN H Z, WU B, NA J, FANG L M, YU X L, SUN Y H, LI Y. Polyploid mutant seedlings induction and ploidy identification of Chinese fir[J]. Journal of Nuclear Agricultural Sciences, 2016, 30(8): 1491-1497. (in Chinese)
[7] 王艳英, 邓传远, 赵晓明, 李海平. 秋水仙素处理对连翘生长的影响[J]. 蚌埠学院学报, 2014, 3(1): 20-23.WANG Y Y, DENG C Y, ZHAO X M, LI H P. The effect of colchicines on the growth of [J]. Journal of Bengbu College, 2014, 3(1): 20-23. (in Chinese)
[8] 邓 樱, 周 晔, 陈继敏. 秋水仙素诱导兰属‘素心黄’多倍体的方法研究[J]. 亚热带植物科学, 2008, 37(2): 38-40.DENG Y, ZHOU H, CHEN J M. Methods of ployplois induction of with colchicine[J]. Subtropical Plant Science, 2008, 37(2): 38-40. (in Chinese)
[9] 张志胜, 黎扬辉, 姜 蕾, 李 远, 王朱莹, 夏 晴, 易懋升. 红掌四倍体的离体诱导及其鉴定[J]. 园艺学报, 2007, 34(3): 729-734.ZHANG Z S, LI Y H, JIANG L, LI Y, WANG Z Y, XIA Q, YI M S. tetraplois induction and its identification in [J]. Acta Horticulturae Sinica, 2007, 34(3): 729-734. (in Chinese)
[10] 王木桂, 曾瑞珍, 謝 利, 黎扬辉, 曾飞燕, 杜宝贵, 张志胜. 大花蕙兰四倍体的离体诱导和鉴定[J]. 西北植物学报, 2010, 30(1): 56-62.WANG M G, ZENG R Z, XIE L, LI Y H, ZENG F Y, DU B G, ZHANG Z S. induction and its identification of tetraploid [J]. Acta Botanica Boreali-Occidentalia Sinica, 2010, 30(1): 56-62. (in Chinese)
[11] 李 涵, 鄢 波, 张 婷, 蒋亚莲, 张 颢, 于丽霞, 李绅崇. 切花非洲菊多倍体诱变初报[J]. 园艺学报, 2009, 36(4): 605-610.LI H, YAN B, ZHANG T, JIANG Y L, ZHANG H, YU L X, LI K C. Preliminary studies on polyploidy mutation of cut flower bolus[J]. Acta Horticulturae Sinica, 2009, 36(4): 605-610. (in Chinese)
[12] 武 江, 李 丽, 曹冬梅, 左力翔, 王云山. 萱草多倍体诱导及其鉴定[J]. 山西农业科学, 2018, 46(5): 687-691, 700.WU J, LI L, CAO D M, ZUO L X, WANG Y S. Polyploidy induction and identification in [J]. Journal of Shanxi Agricultural Sciences, 2018, 46(5): 687-691, 700. (in Chinese)
[13] 张运峰, 胡 芬. 红掌组培再生植株中表型突变体的ISSR分析[J]. 北方园艺, 2014, 38(21): 101-104.ZHANG Y F, HU F. ISSR analysis of phenotypic variants in tissue culturing regeneration plants of [J]. Northern Horticulture, 2014, 38(21): 101-104. (in Chinese)
[14] 彭绿春, 陶俊锋, 段修安, 宋 杰, 解玮佳, 关文灵, 李世峰. 腋花杜鹃多倍体诱导和鉴定[J]. 核农学报, 2018, 32(2): 257-265.PENG L C, TAO J F, DUAN X A, SONG J, XIE W J, GUAN W L, LI S F. Polyploidy induction and identification of franch[J]. Journal of Nuclear Agricultural Sciences, 2018, 32(2): 257-265. (in Chinese)
[15] 鄭云飞. 秋水仙素诱导白掌多倍体及其鉴定[D]. 南昌: 江西农业大学, 2015.ZHENG Y F. Study on polyloid inducement of Spathiphyllum with colchicine[D]. Nanchang: Jiangxi Agricultural University, 2015. (in Chinese)
[16] 彭 静, 魏岳荣, 熊兴华. 植物多倍体育种研究进展[J]. 中国农学通报, 2010, 26(11): 45-49.PENG J, WEI Y R, XIONG X H. Polyploid induction of plant research summary[J]. Chinese Agricultural Science Bulletin, 2010, 26(11): 45-49. (in Chinese)
[17] 田新民, 周香艳, 弓 娜. 流式细胞术在植物学研究中的应用——检测植物核DNA含量和倍性水平[J]. 中国农学通报, 2011, 27(9): 21-27.TIAN X M, ZHOU X Y, GONG N. Applications of flow cytometryin plant research-analysis of nuclear dna content and ploidy level in plant cells[J]. Chinese Agricultural Science Bulletin, 2011, 27(9): 21-27. (in Chinese)
