蛇足石杉主要活性成分及其生物合成研究进展
2022-05-31李籽杉安周捷徐志超段宝忠
李籽杉,安周捷,王 婧,田 亚,徐志超,段宝忠*
·综 述·
蛇足石杉主要活性成分及其生物合成研究进展
李籽杉1, 2,安周捷2,王 婧1,田 亚2,徐志超1, 2,段宝忠1*
1. 大理大学药学院,云南 大理 671000 2. 东北林业大学生命科学院,黑龙江 哈尔滨 150000
蛇足石杉为我国珍稀濒危药用植物,可供利用的资源极其有限,其所含石杉碱甲对治疗阿尔茨海默病、改善学习记忆等具有显著的疗效。对蛇足石杉的主要活性成分进行系统综述,基于现有研究推导了其活性成分可能的生物合成途径,为其资源开发利用和活性成分的生物合成提供科学参考。
蛇足石杉;石松生物碱;石杉型三萜;石杉碱甲;生物合成;转录组学
蛇足石杉(Thunb. ex Murray) Trevis.为石杉科石杉属多年生蕨类植物,又名千层塔、蛇交子、铁板草、矮罗汉等,为国家二级保护植物,主要分布于长江流域、云南、贵州、东北及两广地区。其药用始载于《植物名实图考》,以全草入药,用于跌打损伤、内伤出血、瘀血肿痛、烧伤烫伤、毒虫叮咬、肌肉痉挛等[1],是生产石杉碱甲片、石杉碱甲注射液和石杉碱甲胶囊等药物的重要原料。自然状态下,蛇足石杉为一种小型蕨类植物,植株矮小,生长缓慢,其孢子萌发所需时间长达15年[2-3],而长期掠夺式的采挖导致野生蛇足石杉锐减,可供利用的资源极其有限,无法满足市场需求[4]。现代研究表明,其化学成分主要为生物碱和三萜类成分,这2类成分与其他植物相比具有独特的结构特点,其中石杉碱甲是一种高效的乙酰胆碱酯酶(acetylcholinesterase,AChE)抑制剂,主要用于阿尔茨海默病、老年患者术后认知和重症肌无力等疾病的治疗,亦可用于改善学习记忆能力[5-6],已成为国际生物合成和有机合成研究的热点化合物,但由于植物体内石杉碱甲含量甚微,仅0.006%左右,随着工业需求量不断加大,由于石杉碱甲开环的吡啶酮环和六氢吡啶环结构的复杂性,其全合成路线开发工艺难度极大,合成成本远高于植物提取[7];在迄今已合成的100多种石杉碱甲类似物中,其抑酶活性大多不如天然石杉碱甲[8],导致石杉碱甲市场销售价格昂贵。随着合成生物学及代谢工程技术的飞速发展,开展生物转化或半化学合成为石杉碱甲生产提供了新的途径,但蛇足石杉三萜类和生物碱类化合物生物合成及代谢调控研究起步较晚,其生物合成信息相对有限,其综述文章多关注于化学成分、药理作用和石杉碱甲的生物合成等方面[9-11],蛇足石杉的组学研究呈现快速发展趋势,对其活性成分生物合成途径解析及合成生物学应用具有巨大推动作用。本文对蛇足石杉的主要活性成分进行了系统综述,基于现有研究推导了其活性成分可能的生物合成途径,以期为蛇足石杉科学研究和实践应用提供理论支撑。
1 活性成分
目前已从蛇足石杉中分离鉴定出包括生物碱类、三萜类、黄酮类等化学成分。其中生物碱和三萜类是其主要成分。目前已从蛇足石杉中分离到生物碱类137种、三萜类69种以及其他化合物13种。
1.1 石松生物碱类
目前,从蛇足石杉中分离鉴定的生物碱成分超过130个,主要以石松生物碱为主,多数为C16N或C16N2骨架组成的三环或四环结构,少数为C27N3或少于C16[11]。按结构类型,其所含生物碱可分为fawcettimine型、lycopodine型、lycodine型、miseelaneous型4种类型[10,12],其母核结构如图1所示。该类化合物主要具有抗AChE、细胞毒、抗炎和免疫抑制等作用。有关蛇足石杉的生物碱影响因素,已有研究表明,野生蛇足石杉引种至同一生物环境后,石杉碱甲的含量基本保持不变,提示含量高低是遗传因素与环境条件共同作用的结果,但更受遗传因素控制[13-14];此外,研究显示不同生长阶段的石杉碱甲的含量差异显著,表现为幼苗>幼株>成株,且与年降雨量呈负相关[15],叶片中石杉碱甲和石杉碱乙的含量普遍高于根和茎[16]。

图1 4种类型石松生物碱的母核
1.1.1 fawcettimine型生物碱 该类生物碱是蛇足石杉中最丰富的一类,目前已从蛇足石杉中分离到60个fawcettimine型化合物(1~60),约占蛇足石杉已分离到生物碱总数的50%以上。该类型生物碱结构变化多样,通常具有7/5/6/6四环结构,根据C13位所连官能团可分为醇胺式和酮胺式[17],包括fawcettimine和huperserine A~D等,相关化合物信息见表1。该类化合物抗AChE活性较低,huperserine A~D对AChE无抑制作用[18]。
1.1.2 lycopodine型生物碱 该类型生物碱在蛇足石杉中的数量仅次于fawcettimine型,其母核一般为6/6/6/6四环结构,其排列方式与fawcettimine型生物碱相似,根据C12位氧化态的不同可分为lycopodine型和lycodoline型[17],包括6α,11α-dihydroxy-lycopodine、lycoposerramine K、huperzine O等化合物[50],目前该类生物碱的活性研究报道较少,相关化合物信息见表2。
1.1.3 lycodine型生物碱 该类型生物碱生物碱母核一般为含吡啶的6/6/6/6四环结构,偶有C9-C10断裂的三环结构,其分子式大多为C16N2或C15N2[61]。lycodine型生物碱大多都具有抗AChE活性[62],如最具AChE抑制活性的huperzine A,以及活性较强的huperzine B、huperserine E和6β-羟基石杉碱甲均属lycodine型石松生物碱。目前从蛇足石杉中仅分离到18个该类化合物,其研究主要集中在石杉碱甲类似物的人工合成和结构改造方面,药效作用机制还有待继续深入研究。相关化合物信息见表3。
1.1.4 miseelaneous型生物碱 miseelaneous型生物碱是其他类型石松生物碱的统称,该类型生物碱在蛇足石杉中数量较少,又可分为phlegmarine型、lucidine型、氮杂十二元环型及其他4种类型,其中以phlegmarine型生物碱数量相对较多,phlegmarine型结构中的C4-C13键一般断裂形成C4位为亚甲基的三环生物碱。相关化合物信息见表4。
表1 蛇足石杉中fawcettimine型石松生物碱
Table 1 Fawcettimine-type lycopodium alkaloids from H. serrata
编号化合物名称分子式文献编号化合物名称分子式文献 12α-hydroxyphlegmariurine BC16H23NO31929千层塔碱(serratine)C16H25NO330 27α-hydroxyphlegmariurine BC16H23NO32230dihydrolycopoclavamine AC16H25NO231 37α,11α-dihydroxyphlegmariurineC16H23NO42031千层塔宁碱(serratinine)C16H25NO332 48α-羟基马尾杉碱乙(8α- C16H23NO32132千层塔尼定碱(serratinidine)C18H28N2O233 hydroxyphlegmariurine B) 33serratezomine AC16H25NO334 58β-羟基马尾杉碱乙(8β-C16H23NO32234serratezomine BC16H25NO434 hydroxyphlegmariurine B) 35石杉碱I(huperzine I)C16H23NO235 68-deoxy-13-dehydroserratinineC16H23NO22336蛇足石杉新碱(neohuperzinine)C16H23NO336 7lycoposerramine AC18H29N3O22437马尾杉碱甲(phlegmariurine A)C16H23NO219 8lycoposerramine CC16H23NO22538马尾杉碱乙(phlegmariurine B)C16H23NO219 9lycoposerramine DC17H25NO326392-oxoyphlegmariurine BC16H21NO319 10lycoposerramine EC16H23NO3254011-oxophlegmariurine BC16H21NO319 11lycoposerramine PC16H25NO32541macleanineC16H26N237 12lycoposerramine QC16H25NO25427-过氧羟基马尾杉碱乙(7- C16H23NO438 13lycoposerramine SC17H30N225 hydroperoxyphlegmariurine B) 14lycoposerramine UC17H25NO3254311α-过氧羟基马尾杉碱乙(11α- C16H23NO438 15lycoposerramine RC16H22N2O27 hydroperoxyphlegmariurine B) 16lycoposerramine TC20H29NO52744石杉碱W(huperzine W)C14H21NO239 17N-methyl-lycoposerramine TC21H31NO52745石杉碱P(huperzine P)C16H21NO318 18N-formyl-lycoposerramine TC21H29NO62746石杉碱Q(huperzine Q)C16H25NO240 19法氏石松碱(fawcettimine)C16H25NO22747石杉碱R(huperzine R)C15H21NO341 20石杉碱S(huperzine S)C16H23NO32848石杉碱H(huperzine H)C16H21NO242 21石杉碱T(huperzine T)C16H23NO328494α-hydroxy-2,13-oxidofacettimineC16H23NO343 2211α-羟基佛石松碱(11α- C16H23NO229508-去氧千层塔宁碱(8-deoxy- C16H25NO244 hydroxy-fawcettidine) serratinine) 232α,11α-二羟基佛石松碱(2α,11α- C16H23NO32951huperserratinineC25H33NO545 dihydroxy-fawcettidine) 52N-oxyhuperzine Q C16H25NO346 248α,11α-二羟基佛石松碱(8α,11α- C16H23NO32953huperserine AC16H24NO247 dihydroxy-fawcettidine) 54huperserine BC17H26NO247 252β-羟基石松丢宁碱(2β- C16H23NO32955huperserine CC16H23NO47 hydroxy-lycothunine) 56huperserine DC16H23NO247 268α-羟基石松丢宁碱(8α- C16H23NO32957huperzimineC16H22N2O48 hydroxy-lycothunine) 58huperzine Y1C16H24NO349 27石松丢宁碱(lycothunine)C16H23NO22959huperzine Y2C15H22NO449 28千层塔他尼定碱(serratanidine)C16H25NO42960huperzine Y3C16H24NO349
1.2 三萜类
蛇足石杉中所含的三萜类化合物,又称石杉型三萜、锯齿石松烷三萜,是石松目植物三萜类物质的代表成分,其化学结构属特殊五环三萜,且骨架C环为七元环结构,C环的C27化学位移一般在C56左右,C14-C15位大多形成双键结构,或形成C14β-C15β环氧结构,有些化合物的C16位为羰基,与C14和C15位的双键形成共轭体系;此外C3和C21位一般分别有1个含氧官能团,按骨架上含氧官能团的数量,可分为二醇类、三醇类、多醇类和其他结构4种类型[9,76]。目前已从蛇足石杉中分离得到千层塔尼醇、16氧千层塔三醇、千层塔萜二醇、21氧千层塔萜烯三醇和千层塔三醇等70多种[77-78]。此外,从蛇足石杉中还分离到一些有特殊药理活性的石杉型三萜,如serratenediol已被证实具有诱导人白血病细胞HL-60凋亡和抑制细胞增殖的作用[79]。相关化合物信息见表5。
表2 蛇足石杉中lycopodine型石松生物碱
Table 2 Lycopodine-type lycopodium alkaloids from H. serrata
编号化合物名称分子式文献编号化合物名称分子式文献 616α,11α-二羟基石松碱(6α,11α-dihydroxy- C16H26NO350 81lycoposerramine NC18H27NO455 lycopodine) 82lycoposerramine OC28H39NO655 625β,6β,15α-15-甲基石松碱-5,6-二醇(5β,6β, C16H27NO251 83lycodolineC16H25NO254 15α-15-methyllycopodane-5,6-diol) 846α-hydroxy-lycopodineC16H25NO254 6312β-12-羟基石杉碱G(12β-12-hydroxy- C18H26N2O451 85serratezomine CC16H25NO334 huperzine G) 864α,6α-dihydroxy-serratidineC16H23NO456 6412-脱氧石杉碱O(12-deoxyhuperzine O)C16H23NO223 874α-hydroxy-serratidineC16H23NO356 656α-羟基-5,15-氧化石松碱(6α,-hydroxy-5,15- C16H25NO223,43 886α-hydroxy-serratidineC16H23NO356 oxidelycopodane) 89serratidineC16H23NO256 662α-hydroxy-lycoflexineC17H25NO343 90石杉碱E(huperzine E)C16H21NO339 67N-氧化石杉碱E(N-oxidehuperzine E)C16H21NO352 91石杉碱F(huperzine F)C16H21NO352 68N-氧化石杉碱F(N-oxidehuperzine F)C16H21NO452 92石杉碱O(huperzine O)C16H23NO357 692-氯代石杉碱E(2-chlorohuperzine E)C16H20ClNO253 93石松洛宁(clavolonine)C16H25NO258 70石杉碱E′(huperzine E′)C16H19NO253 94石杉碱庚(huperzine G)C18H26N2O326 71石杉碱F′(huperzine F′)C16H19NO353 95石松文碱(lycoclavine)C18H29NO332 72石松碱(lycopodine)C16H25NO54 96亮石松灵(lucidioline)C16H25NO259 73lycoposerramine FC16H25NO455 974α,6α-dihydroxy-lycopodine/(6α,15R)-4,6-C16H25NO360 74lycoposerramine GC16H25NO355 dihydroxy-15-methyllycopodan-5-one 75lycoposerramine HC16H23NO255 98 7-hydroxy-lycopodine/(15S)-7-hydroxy-C16H25NO260 76lycoposerramine IC16H23NO255 15-methyllycopodan-5-one 77lycoposerramine JC16H25NO255 9912-epilycodoline N-oxide/(12α,15R)-12-C16H25NO360 78lycoposerramine KC16H23NO255 hydroxy-15-methyllycopodan-5-one N- 79lycoposerramine LC16H25NO255 oxide 80lycoposerramine MC16H25NO2551007α-hydroxy-lycopodineC16H25NO258
表3 蛇足石杉中lycodine型石松生物碱
Table 3 Lycodine-type lycopodium alkaloids from H. serrata
编号化合物名称分子式文献编号化合物名称分子式文献 101石松定碱(lycodine)C16H22N244109蛇足石杉碱(huperzinine)C17H22N2O65 102石杉碱甲(huperzine A)C15H18N2O26110异福定碱(isofordine)C15H18N2O64 103石杉碱乙(huperzine B)C16H20N2O26111N-demethylhuperzinineC16H20N2O66 104石杉碱U(huperzine U)C16H22N2O228112β-obscurineC17H24N2O66 1056β-羟基石杉碱甲(6β-hydroxy- C15H18N2O263113蛇足石杉碱丙(huperzinine C)C16h24N267 huperzine A) 114de-N-methyl-obscurineC16H22N2O54 106马尾松碱M(phlegmariurine M)C17H20N2O364115huperserine EC18H22N2O347 107N-甲基石杉碱甲(N-methyl- C16H20N2O63116N-methyl-16-hydroxy-huperzine BC17H22N2O263 huperzine A) 1171-甲基石松嵩碱(1-methyllycodine)C17H24N263 108N-甲基石杉碱乙(N-methyl- C17H22N2O651188α-hydroxy-15,16-dehydro-des-N-C16H22N2O263 huperzine B) methyl-α-obscurine
表4 蛇足石杉中miseelaneous型石松生物碱
Table 4 Miseelaneous-type lycopodium alkaloids from H. serrata
编号类型化合物名称分子式文献 119phlegmarine型serratezomine EC18H32N2O68 120石杉碱J(huperzine J)C17H30N2O69 121石杉碱K(huperzine K)C16H28N2O69 122石杉碱L(huperzine L)C17H30N2O269 123石杉碱M(huperzine M)C17H30N2O270 124石杉碱N(huperzine N)C16H28N2O70 125lycoposerramine XC16H28N2O71 126lycoposerramine YC17H30N2O71 127lycoposerramine ZC16H28N2O71 128lucidine型serratezomine DC29H49N3O68 129石杉碱V(huperzine V)C28H47N3O72 130serratanine A/lucidine BC30H49N3O73 131serratanine B/oxolucidine BC30H49N3O273 132氮杂十二元环型huperserratine AC17H28N2O312 133huperserratine BC17H28N2O312 134其他蛇足石杉碱乙(huperzinine B)C10H15NO74 135马尾杉碱N(phlegmariurine N)C11H11NO75 136(+)-huperzine ZC11H12NO249 137(−)-huperzine ZC11H12NO249
1.3 其他成分
除上述成分以外,蛇足石杉中还分离到黄酮类、甾醇类、二萜类、蒽醌类、醇类等化学成分[84,86]。其中黄酮类物质主要为黄酮类和黄酮醇类[84,86]。相关化合物信息见表6。
2 生物合成
2.1 转录组学研究
目前,蛇足石杉的转录组学研究主要以2、3代或两者结合技术手段进行。Luo等[89]基于表达序列标签(expressed sequence tag,EST)分析,从其根、茎、叶中获得140 930条ESTs,并注释了16 274个转录本,其中182个参与植物激素代谢,115个参与生物碱、三萜和黄酮类成分的生物合成调控;通过差异表达分析筛选到20个编码细胞色素P450(cytochrome P450,CYP450)的转录本,其中4个候选基因、、和与石松生物碱合成相关;何美娜[90]以蛇足石杉地上部分为样本,共获得111 251个unigenes,通过京都基因与基因组百科全书分析显示,分别有4、154个unigenes参与了赖氨酸的合成与代谢;基于Illumina HiSeq 4000对蛇足石杉根、茎、叶、孢子囊的转录组测序结果,显示共有105 516个去冗余后的转录本,N50值为2488 bp,预测了参与石杉碱甲前体生物合成和修饰的关键酶,如-赖氨酸脱羧酶(lysine decarboxylase,LDC)、酮胺氧化酶(copper amine oxidase,CAO)、聚酮合酶(polyketide synthase,PKS)和CYP450,对其编码基因进行差异表达分析,结果显示叶片中CAO、PKS、CYP450表达量较高,并通过实时荧光定量聚合酶链式反应进行了验证[91]。基于RNA测序转录组测序分析,Peng等[92]注释获得49 923个unigenes,通过差异表达分析发现,在幼叶、老叶和茎中分别有1158、1675、1326个基因特异性表达,结合转录组分析得到2个编码LDC的unigenes(和),以及3个编码CAO的unigenes(、和)。光照影响蛇足石杉的生长发育[93]。张林甦等[94]研究发现,孢子和叶中有2321(3.3%)个基因表达上调,2832(6.7%)个基因下调,进一步对二者中差异表达基因进行分析,结果显示共有294个基因参与了蛇足石杉的光周期途径。而基于超高效液相串联质谱仪的综合代谢组学研究,Wu等[95]从蛇足石杉中分离鉴定了118种生物碱,其中,有72种在不同组织中存在显著差异;进一步分析发现,生物碱huperzine A、huperzine B、lycoposerramine C和lycoposerramine D在茎和叶中的含量显著高于根,且具有相同的变化趋势。目前转录组研究多定位在石杉碱甲的生物合成过程中,催化赖氨酸和丙二酰辅酶A相关的LDC、CAO和PKS,这些转录组数据对进一步探讨蛇足石杉生长发育和次生代谢的合成机制奠定了基础。
表5 蛇足石杉中的三萜类化合物
Table 5 Triterpenoids from H. serrata
编号化合物名称化学式文献编号化合物名称化学式文献 138山芝三醇(tohogenol)C30H52O3801733α,21β-dihydroxy-serrat-14-en-24,29-diolC30H54O482 139tohogeninolC30H52O4801743α,21β-dihydroxy-serrat-14-en-16-oneC30H48O378 140山芝烯三醇(serratriol)C30H50O3811753α,21β,24-trihydroxy-serrat-14-en-16-oneC30H48O477 141serratinol AC39H58O4821763α,21β,24-trihydroxy-serrat-14-enC30H50O378 142serratinol BC39H58O5821773α,21β,24- trihydroxy-serrat-14-en-16-oneC30H48O478 143serratenediol-3-acetateC32H52O3261783α,21α-dihydroxy-serrat-14-en-24-oic acidC30H48O481 144serratenediol-21-acetateC32H52O38317921α-hydroxy-serrat-14-en-3β-yl-acetateC32H56O482 145山芝烯二醇(serratenediol)C30H50O28318021β-hydroxy-serrat-14-en-3β-yl-acetateC32H56O484 146serrat-14-en-3β,21β-diolC36H56O57718121β-hydroxy-serrat-14-en-3β-olC30H54O284 147serrat-14-en-3β,21α-diolC36H56O57718221α-hydroxy-serrat-14-en-3β-olC30H54O284 148serrat-14-en-3α,21β-diolC36H56O57718321α-hydroxy-serrat-14-en-3β-yl propanedioic acid C33H52O581 149serrat-14-en-3β,21β,29-triolC30H50O377 monoester 150serrat-14-en-3β,21β,24-triolC36H56O68418421α-hydroxy-serrat-14-en-3β-yl dihydrocaffeateC39H58O581 151serrat-14-en-3β,21α,24-triolC36H56O67718521α-hydroxy-serrat-14-en-3β-yl p-C39H58O481 152serrat-14-en-3α,21β,24-triolC36H56O677 dihydrocoumarate 153serrat-14-en-3α,21β,24,29-tetraolC30H50O47718621α-hydoxyserrat-14-en-3β-yl acetateC32H56O477 154seratenediol-3,21-diacetateC34H54O47818721-epi-serratenediolC30H50O283 155seratenediol-3-acetateC32H52O37818821-epi-serratenediol-3-acetateC32H52O378 1563β-hydroxy-serrat-14-en-21β-yl-acetateC32H56O38218916-oxo-serratriolC30H48O485 1573β-hydroxy-serrat-14-en-21α-yl-acetateC32H56O38219016-oxo-diepiserratenediolC30H48O383 1583β-hydroxy-serrat-14-en-21β-olC30H54O28219116-oxo-3β-hydroxy-serrat-14-en-21β-olC30H48O382 1593β-hydroxy-serrat-14-en-21α-olC30H54O28219216-oxo-3α-hydroxy-serrat-14-en-21β-olC30H48O382 1603β-hydroxy-serrat-14-en-21-oneC30H48O28219316-oxo-3α,21β-hydroxy-serrat-14-en-24-olC30H48O482 1613β-acetoxy-serrat-14-en-21-on-3-hydroxy-C32H50O38219416-oxo-3α,21β-hydroxy-serrat-14-en-24-oic acidC30H46O582 serratenon-acetat 19516-oxo-3α,21β-hydroxy-serrat-14-en-24-alC30H46O482 1623β,21β-dihydroxy-serrat-14-en-29-olC30H54O38219616-oxo-3α,21β-dihydroxy-serrat-14-en-24-olC30H48O482 1633β,21β-dihydroxy-serrat-14-en-24-olC30H54O38219716-oxo-3α,21β-dihydroxy-serrat-14-en-24-alC30H46O481 1643β,21β-dihydroxy-serrat-14-en-16-oneC30H48O37719816-oxo-3α,21β-dihydroxy-serrat-14-en-24-oic acidC30H46O581 1653β,21β,24-trihydroxy-serrat-14-enC30H50O37819916-oxo-21β-hydroxy-serrat-14-en-3β-olC30H48O382 1663β,21α-dihydroxy-serrat-14-en-24-olC30H50O38420016-oxo-21β-hydroxy-serrat-14-en-3α-olC30H48O382 1673β,14β-dihydroxy-serratan-21α-olC30H57O48220116-oxo-21β-hydroxy-serrat-14-en-3α-yl-acetateC32H50O484 1683β,14β,21α-trihydroxy-serratan-24-olC30H57O58220214β,15β-epoxyserratan-3β,21β,29-triolC30H50O477 1693β,21β-dihydroxy-serrat-14-en-29-olC30H50O38220314β,15β-epoxy-3β-hydroxy-serratan-21βC30H52O482 1703β-hydroxy-serrat-14-en-21β-yl-p-C39H58O47820414β,15β-epoxy-3β-hydroxy-serratan-21β-olC30H52O382 dihydrocoumarate 20514β,15β-epoxy-3β-hydroxy-serratan-21α-yl-acetateC32H54O482 1713α,21β-dihydroxy-serrat-14-en-24-olC30H50O38420614β,15β-epoxy-3β-hydroxy-serratan-21α-olC30H52O382 1723α,21β-dihydroxy-serrat-14-en-24-oic acidC30H54O482
表6 蛇足石杉中其他化学成分
Table 6 Other compounds contained in H. serrata
编号类型化合物名称分子式文献 207黄酮类5,5′-dihydroxy-2′,4′-dimethoxy-flavone-7-O-β-D-(6′′-O-Z-p-coumaroyl)-glucopyranosideC32H30O1487 2085,7,4′-trihydroxy-3′,5′-dimethoxyflavoneC17H14O784 209金圣草(黄)素(5,7,4′-trihydroxy-3′-methoxyflavone)C16H14O684 2105,7,2′,4′-tetrahydroxy-5′-methoxyflavoneC16H12O784 211芹菜素(apigenin)C15H10O584 212甾醇类β-谷甾醇(β-sitosterol)C30H52O26 213胡萝卜甾醇(daucosterol)C35H60O626 214羽扇豆醇(lupeol)C30H50O84 215二萜类3β-hydroxy-isopimaric acidC20H30O388 21615R-12,16-epoxy-11,14-dihydroxy-8,11,13-abietanoid-7-oneC20H28O488 217蒽醌类大黄素甲醚(physcion)C16H12O584 218醇类三十烷醇(triacontanol)C30H62O78 2191-dibenzofuranolC12H8O278
2.2 生物碱和萜类生物合成
2.2.1 石松型生物碱 石松型生物碱是蛇足石杉的特征活性成分,目前有关其生物合成的研究主要聚焦于石杉碱甲,其生物合成途径主要包括石松定碱骨架形成和下游后修饰阶段。目前认为石榴碱(pelletierine)和4-(2-哌啶基)乙酰乙酸[4-(2-piperidyl) acetoacetate,4PAA]是石松定碱骨架形成的关键前体[96],其中石榴碱由4PAA自发脱羧形成;4PAA由Δ1-哌啶烯和3-氧戊二酸发生亚胺酮缩合反应生成;Δ1-哌啶烯的生物合成起始物为-赖氨酸[97],其被-赖氨酸脱羧酶(lysine decarboxylase,LDC)催化形成尸胺(cadaverine),尸胺在酮胺氧化酶(copper amine oxidase,CAO)作用下生成5-氨基戊醛(5-aminopentanal),后脱水并环化为Δ1-哌啶烯(1-piperideine);3-氧戊二酸的起始物为乙酸,其活化形成乙酰辅酶A(acetyl-CoA),经系列反应生成丙二酰辅酶A(malonyl-CoA),随后2分子丙二酰辅酶A与III型聚酮合酶(polyketide synthase III,PKS III)作用生成3-氧戊二酸(3-oxoglutaric acid)。下游途径中,目前认为由3种双加氧酶(dioxygenase,2OGD)参与合成,首先石松定碱骨架与相关酶反应转化形成-甲基-α-玉柏碱(des--methyl-α-obscurine,DNMAO),但有关机制尚不清楚;随后DNMAO在2OGD-3催化下形成具吡啶环的去-甲基-β-玉柏碱(des--methyl-β-obscurine,DNMBO),DNMBO发生氧化反应后转化为石杉碱乙,石杉碱乙在2OGD-1催化下,哌啶环裂解形成中间产物石杉碱丙,在2OGD-2作用下石杉碱丙的双键异构化形成石杉碱甲[98],见图2。
2.2.2 石杉型三萜 石杉型三萜(锯齿烷型三萜)是一类特殊的五环三萜,其生物合成途径亦可分为三萜骨架形成和下游修饰阶段。石杉型三萜骨架形成阶段,之前有关学者认为芒柄花萜醇(α-onocerin)是三萜化合物合成的关键前体,其经相关酶催化后形成具有七元环的山芝烯二醇(serratenediol)[99],但最新研究发现,从东北石松L.中克隆鉴定出3种氧化鲨烯环化酶(oxido squalene cyclase,OSC)基因(、和),参与了山芝烯二醇及山芝三醇的生成;通过体外酶催化实验,进一步证明芒柄花萜醇前体(pre-α-onocerin,POC)是石杉型三萜合成的关键前体[100-101],POC的形成以乙酰辅酶A为起始底物,经甲羟戊酸(mevalonate,MVA)途径生成异戊烯二磷酸(isopentenyl pyrophosphate,IPP)和二甲基烯丙基焦磷酯(dimethylallyl pyrophosphate,DMAPP),IPP和DMAPP在法尼基焦磷酸合酶(farnesyl pyrophosphate synthase,FPS)催化下,缩合生成法尼基二磷酸(farnesyl diphosphate,FPP),随后2分子FPP在角鲨烯合成酶(squalene synthase,SQS)作用下生成角鲨烯(squalene),角鲨烯与角鲨烯环氧酶(squalene epoxidase,SE)作用催化形成2,3-氧化角鲨烯(2,3-oxidosqualene),2,3-氧化角鲨烯与OSC作用后,环化生成2,3,22,23-环氧角鲨烯(2,3,22,23-dioxidosqualene),2,3,22,23-环氧角鲨烯由LCC特异性催化形成具有A环和B环的POC[102]。下游途径中,POC与LCD催化形成芒柄花萜醇,与LCE催化形成C14阳离子的6/6/7/6/6-稠合五环中间体(intermediate,IMD),随后IMD脱质子生成山芝烯二醇,或亲核加成水生成山芝三醇[100],见图3。
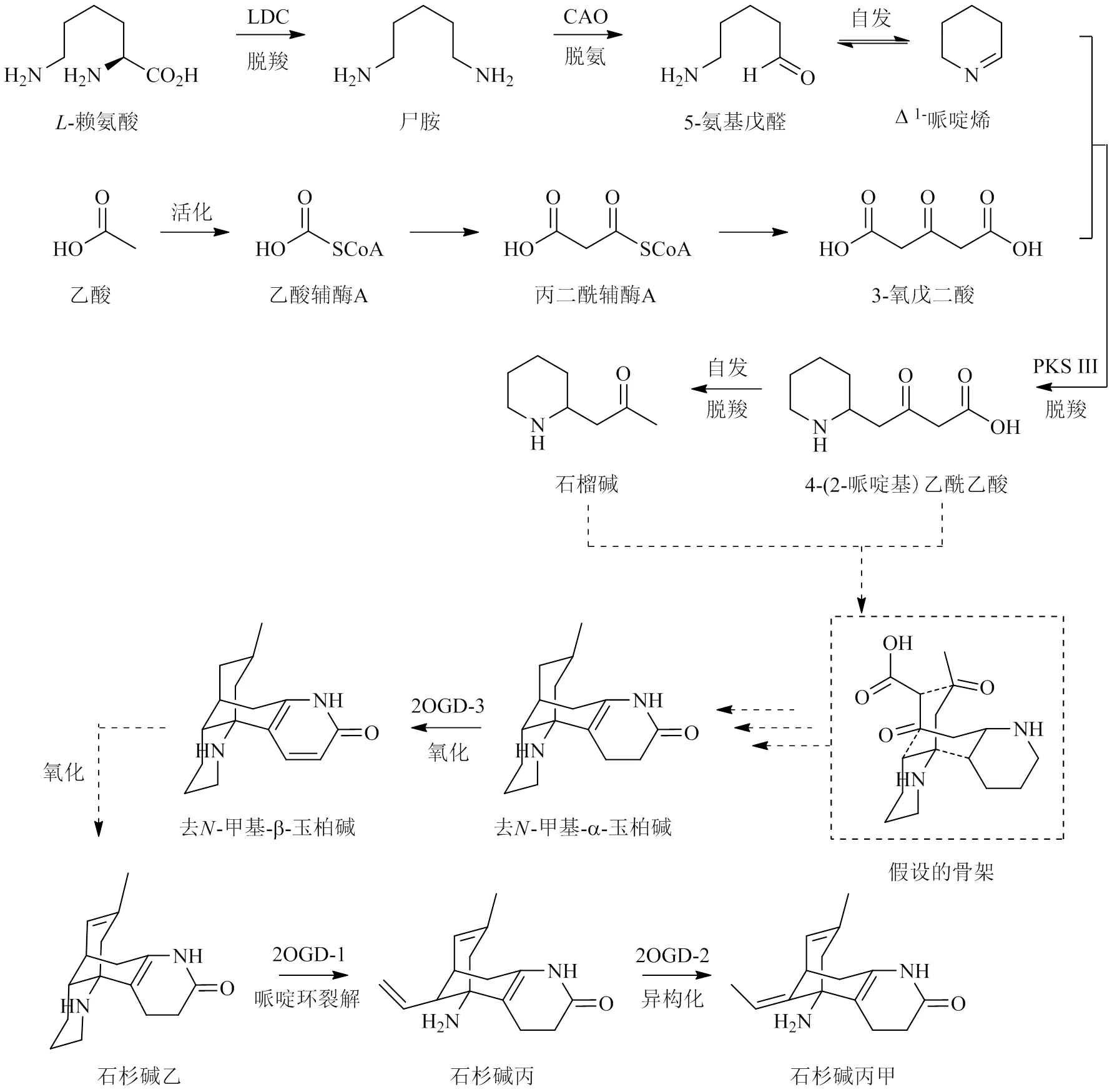
图2 石松型生物碱的生物合成途径
3 结语与展望
蛇足石杉作为一种重要的药用植物,其所含的石杉碱甲为强效AChE抑制剂,对重症肌无力症的治疗有效率高达99.2%,对老年痴呆症、单纯记忆障碍等疗效显著[103],是临床治疗上述疾病最有效的药物之一。由于蛇足石杉野生资源有限,且石杉碱甲含量甚微,开展这一珍贵植物资源研究,探讨合理开发利用途径十分必要。化学合成是解决天然产物稀缺的重要手段,然而石杉碱甲的人工合成价格高昂,获得产物纯度较低,且大多数衍生物及类似物的生物活性较低甚至丧失等问题,均限制了石杉碱甲合成的发展和应用[104]。随着分子代谢及生物技术的快速发展,有关天然产物生物合成及调控基因研究的不断深入,为石杉碱甲生物合成提供了重要参考,但当前相关研究还存在一些问题,如蛇足石杉在全球分布广泛,变种较多,关于该物种的分类和系统发育进化关系尚存较大争议[105],有必要进一步开展深入研究。通过叶绿体基因组序列或转录组编码基因的系统进化研究,有助于深入理解该物种及其近缘类群之间的演化关系;其次,目前蛇足石杉染色体的相关研究样本采集范围有限,基因组研究仍为空白,限制了其种间演变和进化关系的探索[106];关于蛇足石杉活性成分生物合成途径相关研究,国内外虽解析了蛇足石杉及其亲缘种中石杉碱甲生物合成的大致途径,并初步明确了参与上游合成途径的关键酶基因,但涉及石榴碱和4PAA骨架形成的过程和关键酶尚不明确,且参与下游途径中多个步骤的关键酶基因亦不清楚;此外,有关石杉型三萜的生物合成途径,目前仅明确了七元环骨架形成的关键酶LCD和LCE,其骨架修饰相关过程关键酶还有待进一步研究。因此,蛇足石杉的基因组、转录组及代谢组研究仍亟待深入解析并挖掘,基于多组学的蛇足石杉活性成分生物合成研究,将为成分绿色合成提供重要基础。
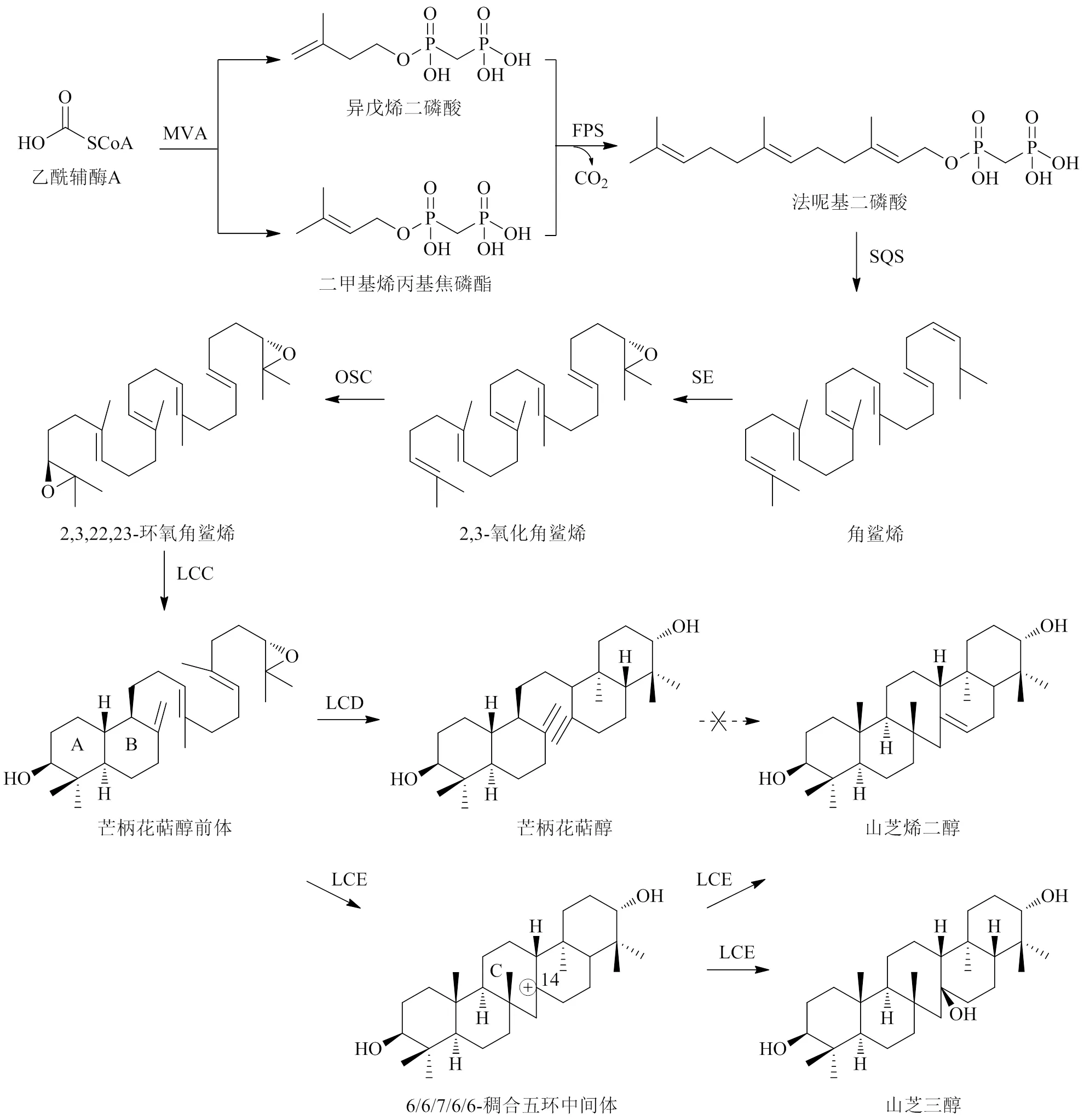
图3 石杉型三萜的生物合成途径
利益冲突 所有作者均声明不存在利益冲突
[1] 赵刚, 胡光明, 吴平华, 等. 药用蕨类植物蛇足石杉的研究进展 [J]. 上饶师范学院学报, 2018, 38(6): 67-73.
[2] 马英姿, 刘江海, 张家玲. 林下珍稀药用植物蛇足石杉繁殖的研究进展 [J]. 经济林研究, 2016, 34(2): 162-166.
[3] 齐耀东, 王德立. 蛇足石杉的种群结构和致危因素 [J]. 中国现代中药, 2017, 19(1): 96-102.
[4] 王德立, 齐耀东. 蛇足石杉不同天然居群的土壤酶活性研究 [J]. 中国现代中药, 2019, 21(10): 1407-1410.
[5] 张庭荟. 石杉碱甲提取工艺及药理功效研究进展 [J]. 西部皮革, 2016, 38(2): 10.
[6] Ghassab-Abdollahi N, Mobasseri K, Dehghani Ahmadabad A,. The effects of huperzine A on dementia and mild cognitive impairment: An overview of systematic reviews [J]., 2021, 35(9): 4971-4987.
[7] 陈业高, 刘怡君, 蒋金和, 等. 石松类生物碱成分研究的新进展 [J]. 云南师范大学学报: 自然科学版, 2010, 30(6): 12-24.
[8] 易家宝, 颜杰, 李旭明. 石杉碱甲结构改造的研究进展 [J]. 天然产物研究与开发, 2009, 21(6): 1080-1083.
[9] 周文昊, 董秋竹, 成飞, 等. 石杉型三萜类化合物及其生物活性研究进展 [J]. 中草药, 2021, 52(12): 3736-3751.
[10] 袁经权, 周小雷, 王硕, 等. 蛇足石杉化学成分和药理作用研究进展 [J]. 中草药, 2012, 43(2): 399-407.
[11] 谢峻, 张静怡, 汤宁, 等. 加兰他敏和石杉碱甲生物合成的研究进展 [J]. 中草药, 2020, 51(3): 812-820.
[12] Wu X D, Li X N, Peng L Y,. Huperserratines A and B, two macrocyclic lycopodium alkaloids with an unusual skeleton from[J]., 2020, 85(10): 6803-6807.
[13] 黄骥, 赵爱玲. 蛇足石杉中石杉碱甲含量的动态变化分析 [J]. 中国中药杂志, 2010, 35(19): 2511-2515.
[14] Yang Y, Dai L F, Wu D C,.propagation, huperzine A content and antioxidant activity of three genotypic[J]., 2021, 10(6): 1112.
[15] 王德立, 甘炳春, 齐耀东, 等. 蛇足石杉不同生长阶段植株中石杉碱甲含量的地区差异及生境影响的比较观察 [J]. 中国新药杂志, 2014, 23(3): 326-332.
[16] 鲁润龙, 周忠泽, 鲍时来, 等. 药用植物蛇足石杉的生物学特性 [J]. 中国科学技术大学学报, 1999(1): 121-124.
[17] 赵宪鹤. 生源启发的Lycodoline型和Fawcettimine型石松科生物碱合成研究 [D]. 兰州: 兰州大学, 2017.
[18] Tan C H, Jiang S H, Zhu D Y. Huperzine P, a novelalkaloid from[J]., 2000, 41(30): 5733-5736.
[19] Tan C H, Chen G F, Ma X Q,. Three new phlegmariurine B type lycopodium alkaloids from[J]., 2002, 4(3): 227-231.
[20] Tan C H, Wang B D, Jiang S H,. New lycopodium alkaloids from[J]., 2002, 68(2): 188-190.
[21] 谭小健, 王海顷, 蒋华良, 等. 8α-OH马尾杉碱B的结构鉴定: NMR谱分析及密度泛函理论研究 [J]. 化学学报, 2000, 58(11): 1386-1392.
[22] 袁珊琴, 赵毅民. 蛇足石杉中一个新的phlegmariurine型生物碱 [J]. 药学学报, 2003, 38(8): 596-598.
[23] Yang Y F, Qu S J, Xiao K,.alkaloids from[J]., 2010, 12(11): 1005-1009.
[24] Takayama H, Katakawa K, Kitajima M,. A new type of lycopodium alkaloid, lycoposerramine-A, fromThunb. [J]., 2001, 3(26): 4165-4167.
[25] Takayama H, Katakawa K, Kitajima M,. Seven new lycopodium alkaloids, lycoposerramines-C, -D, -E, -P, -Q, -S, and -U, fromThunb [J]., 2002, 43(46): 8307-8311.
[26] 蒋金和, 刘莹, 王利勤, 等. 蛇足石杉化学成分的研究 [J]. 云南师范大学学报: 自然科学版, 2010, 30(3): 59-65.
[27] Katakawa K, Kogure N, Kitajima M,. A new lycopodium alkaloid, lycoposerramine-R, with a novel skeleton and three new fawcettimine-related alkaloids from[J]., 2009, 92(3): 445-452.
[28] Tan C H, Ma X Q, Chen G F,. Huperzines S, T, and U: New lycopodium alkaloids from[J]., 2003, 81(4): 315-318.
[29] Katakawa K, Nozoe A, Kogure N,. Fawcettimine-related alkaloids from[J]., 2007, 70(6): 1024-1028.
[30] Inubushi Y, Harayama T, Akatsu M,. The structures of serratine and serratanidine [J]., 1968, 16(12): 2463-2470.
[31] Katakawa K, Mito H, Kogure N,. Ten new fawcettimine-related alkaloids from three species of[J]., 2011, 67(35): 6561-6567.
[32] 俞超美, 沈文照, 韩锦文, 等. 草药蛇足草生物碱的研究 [J]. 药学学报, 1982, 17(10): 795-797.
[33] Yasui B, Ishii H, Harayama T,. Structure of serratinidine: Correlation with serratinine [J]., 1966, 7(33): 3967-3973.
[34] Morita H, Arisaka M, Yoshida N,. Serratezomines A-C, new alkaloids fromvar.[J]., 2000, 65(19): 6241-6245.
[35] Gao W Y, Wang B D, Li Y M,. A new alkaloid and arbutin from the whole plant of[J]., 2010, 18(4): 614-616.
[36] 袁珊琴, 赵毅民, 冯锐. 蛇足石杉新碱的结构鉴定 [J]. 药学学报, 2002, 37(12): 946-949.
[37] Ayer W A, Ma Y T, Liu J S,. Macleanine, a unique type of dinitrogenous lycopodium alkaloid [J]., 1994, 72(1): 128-130.
[38] Tan C H, Ma X Q, Zhou H,. Two novel hydroperoxylated lycopodium alkaloids from[J]., 2003, 45(1): 118-121.
[39] Cao H, Chai T T, Wang X,. Phytochemicals from fern species: Potential for medicine applications [J]., 2017, 16(3): 379-440.
[40] Hong B K, Hu D C, Wu J B,. Divergent total syntheses of (–)-huperzine Q, (+)-lycopladine B, (+)-lycopladine C, and (–)-4--lycopladine D [J]., 2017, 12(13): 1557-1567.
[41] Tan C H, Chen G F, Ma X Q,. Huperzine R, a novel 15-carbon lycopodium alkaloid from[J]., 2002, 65(7): 1021-1022.
[42] Gao, W Y,Li Y M,Wang B D,. Huperzine H, a new lycopodium alkaloid from[J]., 1999, 10(6): 463-466.
[43] 王海顷. 1. 石杉生物碱成分研究; 2. 乌头生物碱成分研究[D]. 上海: 中国科学院上海生命科学研究院, 1999.
[44] 袁珊琴, 冯锐, 顾国明. 蛇足石杉生物碱成分的研究(II) [J]. 中草药, 1994, 25(9): 595-596.
[45] Zhu D Y, Jiang S H, Huang M F,. Huperserratinine from[J]., 1994, 36(4): 1069-1072.
[46] Tan C H, Ma X Q, Chen G F,. Two novel lycopodium alkaloids from[J]., 2002, 85(4): 1058-1061.
[47] Jiang W W, Liu F, Gao X,. Huperserines A-E, lycopodium alkaloids from[J]., 2014, 99: 72-77.
[48] Yu C M,Calhoun L A,Konder R M,. Huperzimine, a novel lycopodium alkaloid from[J]., 2015 92(40): 406-410.
[49] Jiang F F, Qi B W, Ding N,. Lycopodium alkaloids from[J]., 2019, 137: 104277.
[50] Shan W G, Ren F Y, Ying Y M,. A new lycopodine alkaloid from[J]., 2012, 36(1): 15-16.
[51] Jiang J H, Liu Y, Min K,. Two new lycopodine alkaloids from[J]., 2010, 93(6): 1187-1191.
[52] Wang H B, Tan C H, Tan J J,. Two new-oxide lycopodium alkaloids from[J]., 2009, 23(15): 1363-1366.
[53] Wang H B, Tan C H, Tan J J,. Lycopodium alkaloids from[J]., 2007, 90(1): 153-157.
[54] 袁珊琴, 冯锐, 顾国明. 蛇足石杉生物碱成分的研究(III) [J]. 中草药, 1995, 26(3): 595-596.
[55] Takayama H, Katakawa K, Kitajima M,. Ten new lycopodium alkaloids having the lycopodane skeleton isolated fromThunb. [J].(), 2003, 51(10): 1163-1169.
[56] Tan C H, Ma X Q, Jiang S H,. Three new hydroxylated serratidine alkaloids from[J]., 2002, 16(3): 149-153.
[57] 王保德, 滕宁宁, 朱大元. 石杉碱O的结构鉴定 [J]. 有机化学, 2000, 20(5): 812-814.
[58] Siengalewicz P, Mulzer J, Rinner U. Lycopodium alkaloids: Synthetic highlights and recent developments [J]., 2013, 72: 1-151.
[59] Lin L J, Lin L Z, Cordell G A,. NMR assignments of huperzine a, serratinine and lucidioline [J]., 1993, 34(5): 1425-1428.
[60] Tan C H, Zhu D Y. Lycopodine-type lycopodium alkaloids from[J]., 2004, 87(8): 1963-1967.
[61] Patil S P. Recently isolated lycodine-type lycopodium alkaloids and their total synthesis: A review [J]., 2020, 6: 99.
[62] 张青. 石松科Lycopodine型生物碱多样性合成研究 [D]. 兰州: 兰州大学, 2021.
[63] Liu Y C, Zhang Z J, Su J,. Lycodine-type lycopodium alkaloids from the whole plants of[J]., 2017, 7(5): 405-411.
[64] 袁珊琴, 赵毅民. 蛇足石杉生物碱成分的研究(VI) [J]. 中草药, 2003, 34(7): 595-596.
[65] 袁珊琴, 魏同泰. 蛇足石杉生物碱成分的研究 [J]. 药学学报, 1988, 23(7): 516-520.
[66] Shan S M, Luo J G, Pan K,. Rapid screening and identification of lycodine-type alkaloids in Lycopodiaceae and Huperziaceae plants by ultra-performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry [J]., 2016, 30(11): 1861-1872.
[67] 袁珊琴, 赵毅民, 冯锐. 蛇足石杉碱丙的结构鉴定 [J]. 药学学报, 2004, 39(2): 116-118.
[68] Kubota T, Yahata H, Yamamoto S,. Serratezomines D and E, new lycopodium alkaloids fromvar.[J]., 2009, 19(13): 3577-3580.
[69] Gao W, Li Y, Jiang S,. Three lycopodium alkaloid-oxides from[J]., 2000, 66(7): 664-667.
[70] Bosch C, Bradshaw B, Bonjoch J. Decahydroquinoline ring13C-NMR spectroscopic patterns for the stereochemical elucidation of phlegmarine-type lycopodium alkaloids: Synthesis of (−)-serralongamine A and structural reassignment and synthesis of (−)-huperzine K and (−)-huperzine M (lycoposerramine Y) [J]., 2019, 82(6): 1576-1586.
[71] Katakawa K, Kitajima M, Yamaguchi K,. Three new phlegmarine-type lycopodium alkaloids, lycoposerramines-X, -Y and-Z, having a nitrone residue, from[J]., 2007, 38(19): 177.
[72] Liu H Q,Tan C H,Jiang S H,. Huperzine V, a new lycopodium alkaloid from[J]., 2004, 15(3): 303-304.
[73] Siengalewicz P, Mulzer J, Rinner U.[M]. New York: Academic Press, 2013: 72.
[74] 袁珊琴, 赵毅民, 冯锐. 蛇足石杉生物碱成分的研究(V) [J]. 军事医学科学院院刊, 2001, 25(1): 57-58.
[75] 袁珊琴, 赵毅民. 蛇足石杉生物碱成分的研究(IV) [J]. 中草药, 2000, 31(7): 20-21.
[76] 杨舜伊, 袁纯红, 蒋金和, 等. 石松类锯齿烷型三萜成分及其生物活性研究进展 [J]. 浙江农业科学, 2020, 61(4): 708-714.
[77] Zhou H, Li Y S, Tong X T,. Serratane-type triterpenoids from[J]., 2004, 18(5): 453-459.
[78] 郑凯凯, 赵圆圆, 袁谱龙, 等. 蛇足石杉中非生物碱类化学成分研究 [J]. 中草药, 2016, 47(1): 15-20.
[79] Ham Y M, Yoon W J, Park S Y,. Investigation of the component ofextract that inhibits proliferation and mediates apoptosis of human HL-60 leukemia cells [J]., 2012, 50(8): 2629-2634.
[80] Sano T, Tsuda Y, Inubushi Y. Structures of tohogenol and tohogeninol: Triterpenoids of[J]., 1970, 26(12): 2981-2986.
[81] Zhou H, Tan C H, Jiang S H,. Serratene-type triterpenoids from[J]., 2003, 66(10): 1328-1332.
[82] 罗超. 蛇足石杉化学成分研究 [D]. 苏州: 苏州大学, 2011.
[83] 李军, 韩燕艺, 刘嘉森. 千层塔中三萜成分的研究 [J]. 药学学报, 1988, 23(7): 549-552.
[84] 罗超, 陈重, 张文芳, 等. 蛇足石杉化学成分研究 [J]. 中草药, 2011, 42(12): 2407-2409.
[85] Tsuda Y, Fujimoto T, Kimpara K. 16-Oxoserratriol and 16-oxolycoclavanol:triterpenoids [J]., 1970(5): 261.
[86] 鲁翠涛, 梅兴国, 钟凡. 千层塔植物茎叶中黄酮类物质的研究 [J]. 天然产物研究与开发, 2002, 14(3): 27-29.
[87] 杨亚滨, 杨雪琼, 徐艳群, 等. 千层塔中的一个新黄酮苷 [J]. 中国天然药物, 2008, 6(6): 408-410.
[88] 杨亚滨, 杨雪琼, 徐艳群, 等. 千层塔中的两个二萜化合物[A] // 第七届全国天然有机化学学术研讨会论文集[C]. 成都: 中国化学会, 2008: 52.
[89] Luo H M, Li Y, Sun C,. Comparison of 454-ESTs fromandreveals putative genes involved in lycopodium alkaloid biosynthesis and developmental regulation [J]., 2010, 10: 209.
[90] 何美娜. 蛇足石杉转录组测序及基于SSR标记的遗传多样性分析 [D]. 西安: 西北大学, 2017.
[91] Yang M Q, You W J, Wu S W,. Global transcriptome analysis ofand identification of critical genes involved in the biosynthesis of huperzine A [J]., 2017, 18(1): 245.
[92] Peng Q Z, Long H, Du C,. RNA-seq of aboveground sporophyte’s transcriptome ofand transcriptional understanding of early steps associated with huperzine biosynthesis in forest [J]., 2020, 24: 100159.
[93] 骆冰洁, 姚茂君, 曹德华. 蛇足石杉芽胞萌发及生长发育的影响因素 [J]. 吉首大学学报: 自然科学版, 2016, 37(1): 64-68.
[94] 张林甦, 许义红, 陆廷祥, 等. 基于蛇足石杉转录组测序筛选及分析光周期相关基因 [J]. 基因组学与应用生物学, 2020, 39(12): 5736-5743.
[95] Wu S W, Fan Z, Xiao Y L. Comprehensive relative quantitative metabolomics analysis of lycopodium alkaloids in different tissues of[J]., 2017, 3(1): 44-55.
[96] 陈作毅, 张君诚. 石杉碱生物合成与代谢途径研究进展 [J]. 中华中医药杂志, 2013, 28(6): 1815-1818.
[97] Hemscheidt T.[M]. Berlin: Biosynthesis, 2000: 175-206.
[98] Nett R S, Dho Y, Low Y Y,. A metabolic regulon reveals early and late acting enzymes in neuroactivealkaloid biosynthesis [J]., 2021, 118(24): e2102949118.
[99] 张宇. 石松三萜成分的研究 [D]. 武汉: 中南民族大学, 2014.
[100] Saga Y, Araki T, Araya H,. Identification of serratane synthase gene from the fern[J]., 2017, 19(3): 496-499.
[101] Araki T, Saga Y, Marugami M,. Onocerin biosynthesis requires two highly dedicated triterpene cyclases in a fern[J]., 2016, 17(4): 288-290.
[102] 田荣, 谷巍, 韦陈彬, 等. 植物三萜类成分生物合成中氧鲨烯环化酶与细胞色素P450的研究进展 [J]. 南京中医药大学学报, 2021, 37(2): 303-310.
[103] Callizot N, Campanari M L, Rouvière L,.extract ‘NSP01’ with neuroprotective effects-potential synergies of huperzine A and polyphenols [J]., 2021, 12: 681532.
[104] Thu Ha T T, Khanh T D, Trung K H. Evaluation of genetic diversity and identification ofspecies collected in some different areas in Vietnam by molecular markers [J]., 2020, 80: 13-23.
[105] Yang Y H, Wang H, Yu H X,. Simultaneous separation and determination of three huperzine alkaloids inand its preparations by cyclodextrin-modified mixed micellar electrokinetic capillary chromatography [J]., 2021, 623: 114207.
[106] 陈思思, 张梦华, 王锦秀, 等. 药用植物千层塔的基原物种及研究进展 [J]. 广西植物, 2021, 41(11): 1794-1809.
Active compounds and their biosynthesis of
LI Zi-shan1, 2, AN Zhou-jie2, WANG Jing1, TIAN Ya2, XU Zhi-chao1, 2, DUAN Bao-zhong1
1. College of Pharmacy, Dali University, Dali 671000, China 2. College of Life Science, Northeast Forestry University, Harbin 150000, China
Due to theextremely limited resources available,is a rare and endangered medicinal plant in China. Moreover, clinical studies have shown that huperzine A fromis highly effective in treatment of Alzheimer’s disease and improving learning and memory abilities. Active compounds fromwere reviewed in this paper, and the possible biosynthetic pathway of active compounds ofwere concluded, in order to provide scientific reference for exploitation and utilization of its resources and biosynthesis of its active ingredients.
(Thunb. ex Murray) Trevis.; lycopodium alkaloids; serratene triterpenoids; huperzine A; biosynthesis; transcriptomics
R282.710.5
A
0253 - 2670(2022)11 - 3505 - 13
10.7501/j.issn.0253-2670.2022.11.029
2022-02-25
云南省院士专家工作站(202105AF150053);云南省重大科技专项(202002AA100007);云南省兴滇英才支持计划项目(YNWR-QNBJ-2020251)
李籽杉(1996—),女,硕士研究生,研究方向为中药资源与鉴定。E-mail: lzs6623@163.com
段宝忠,教授,研究方向为中药资源与种质创新。Tel: (0872)2257411 E-mail: bzduan@126.com
[责任编辑 崔艳丽]
