痛舒胶囊临床最大耐受剂量实验中4种成分药物浓度测定方法建立
2022-05-30赵高琼刘红斌崔佳丽梅晶周艺佳王京昆
赵高琼 刘红斌 崔佳丽 梅晶 周艺佳 王京昆

【摘 要】 目的:建立痛舒胶囊中指标性成分栀子苷、人参皂苷Rg1、三七皂苷R1、人参皂苷Rb1在人血浆中的LC-MS/MS浓度检测方法,并对该方法进行验证,以经过验证的方法,对来自痛舒胶囊临床MTD(最大耐受量)实验的血浆样本进行药物浓度检测,获得志愿者口服给予痛舒胶囊后体内的药物浓度水平。方法:色谱柱:Waters SunFire C18(4.6mm×150mm,5μm);流动相:A 为0.01%甲酸水,B 为甲醇;梯度洗脱:0~1min,90% A;1~8min,90%~10% A;8~10min,10% A;10~10.5min,10%~90% A;10.5~15min,90% A。流速:1mL/min。柱溫:20℃;进样量:10μL。离子源:ESI 源,正离子模式,MRM 扫描。结果:栀子苷、人参皂苷Rg1、三七皂苷R1、人参皂苷Rb1及内标盐酸普萘洛尔提取离子色谱图与血浆中内源性杂质互不干扰。以盐酸普萘洛尔为内标,栀子苷、人参皂苷Rg1、三七皂苷R1、人参皂苷Rb1的检测范围分别为252~8100ng/mL、26.8~858ng/mL、32.8~1050ng/mL、11.2~361ng/mL。各成分日内精密度与日间精密度RSD≤15%,准确度分别在85%~115%之间,提取回收率在61.05%~96.54%之间。基质对4个成分各浓度间的影响基本一致。结论:该方法快速、灵敏、重复性好,可用于痛舒胶囊中4 种有效成分在人体内的MTD试验样本药物浓度检测。
【关键词】 痛舒胶囊;栀子苷;人参皂苷Rg1;三七皂苷R1;人参皂苷Rb1
【中图分类号】R284.1 【文献标志码】 A【文章编号】1007-8517(2022)13-0021-05
The Method of Determination of the concentration of 4 ingredients in the clinical MTD experiment of Tongshu capsule
ZHAO Gaoqiong1,2 LIU Hongbin1,2 CUI Jiali1,2 MEI Jing1,2 ZHOU Yijia1,2 WANG Jingkun1,2*
1.Yunnan Institute of Materia Medica,Kunming 650111,China;2.Yunnan Province Company Key Laboratory for TCM and Ethnic Drug of New Drug Creation,Kunming 650111,China
Abstract:
Objective To establish a method that detect the concentration of major components:geniposide, ginsenoside Rg1, notoginsenoside R1 and ginsenoside Rb1 of Tongshu capsule in human plasma utilizing LC-MS/MS, then validate this methodology. With proven methods, detecting drug concentration in plasma samples form volunteers that experienced clinical MTD(Maximum Tolerance Dose) experiment, Tongshu capsule dosed orally.Methods The chromatographic column: Waters Sun Fire C18(4.6mm×150mm, 5μm). Mobile phase: A is 0.01% formic water, B is methanol. Gradient elution: 0-1min, 90%A; 8-10min,10% A;10-10.5min, 10%-90% A; 10.5-15min, 90% A. Flow rate:1mL·min-1.Column temperature: 20℃. Injection volume: 10μL. Ion source: ESI, positive ion mode, MRM scan.Results The ion chromatograms of geniposide, ginsenoside Rg1, notoginsenoside R1, ginsenoside Rb1 and internal standard of Propranolol hydrochloride were not interfered with the endogenous impurities in the plasma. The detection ranges of Geniposide, ginsenoside Rg1, notoginsenoside R1 and ginsenoside Rb1 were 252-8100ng/mL, 26.8-858ng/mL, 32.8-1050ng/mL and 11.2-361ng/mL. Respectively, The inday precision and day precision RSD of each component was ≤15%, the accuracy ranged from 85% to 115%, and the extraction recovery ranged from 61.05% to 96.54%. The effects of substrate on the concentrations of the four components were basically consistent.Conclusion This method is rapid, sensitive and reproducible, and can be used to detect the concentration of 4 active ingredients in tongshu capsule in human MTD test samples.
Key words:Tongshu Capsule; Gardenin; Ginsenoside Rg1; Notoginsenoside R1; Ginsenoside Rb1
痛舒胶囊是根据云南彝族经验方开发的民族药,其主要由七叶莲、三七、栀子、灯盏细辛、玉葡萄根、珠子参等八味中药组方而成,具有活血化瘀,舒筋活络,化痞散结,消肿止痛的功效。临床常用于治疗关节炎[1] 、肩周炎[2]、颈源性头痛[3-4]、乳腺增生[5]等。由于制剂中三七具有活血作用,且在制剂中占比最大,含量最高,故选择三七中的三七皂苷R1、人参皂苷Rg1和人参皂苷Rb1为指标性成分,同时再选择具有消肿作用的栀子中的特征性成分栀子苷为指标性成分,建立这4种成分在人体内药物浓度测定方法,开展痛舒胶囊在人体内的特征性多指标成分体内药代研究。
1 仪器与材料
1.1 仪器 美国Agilent-ABI三重四级杆液质联用仪(安捷伦公司)、Allegra 64R高速冷冻台式离心机(Beckman公司)、SK8200LHC超声波清洗器(上海科导超声仪器有限公司)、XW-80涡旋混合器(上海精科实业有限公司)、MD200氮气吹扫仪(杭州奥盛仪器有限公司)、DV215CD电子天平(OHAUS)。96孔板固相萃取装置、96孔固相萃取板(Oasis HLB μElution Plate 30μm)均购买自美国waters公司。
1.2 材料 对照品栀子苷(简称Gen,中国食品药品检定研究院,批号:110749-201316)、人参皂苷Rg1(简称Rg1,中国食品药品检定研究院,批号:110703-201529)、三七皂苷R1(简称R1,中国食品药品检定研究院,批号:110745-201318)、人参皂苷Rb1(简称Rb1,中国食品药品检定研究院,批号:110704-201424)均购于中国药品生物制品检定所。盐酸普萘洛尔(简称Pro,Sigma公司,美国,批号:BCBJ2807V)。甲醇(Merck公司,美国,色谱纯)、甲酸(上海阿拉丁生化科技有限公司,色谱纯)。水为超纯水(Millipore纯水,超纯水系统制备)。
1.3 药品 痛舒胶囊(规格为0.3g/粒,批号:SMA1501,云南白药集团股份有限公司)。
2 方法
2.1 对照品溶液及内标溶液配制
2.1.1 标准曲线对照品溶液的配制 精密称取Gen、Rg1、R1、Rb1对照品,配制成浓度分别为0.243、0.231、0.253、0.260mg/mL的标准曲线对照品储备液,2~8℃保存,备用。取Gen、Rg1、R1、Rb1标准曲线用对照品储备液适量,配制得到浓度分别为81.0、8.57、10.5、3.60μg/mL的混合标准曲线工作液,并用甲醇逐级稀释(每级稀释倍数为2倍,共稀释5次)得到6级不同浓度的混合标准曲线工作液。
2.1.2 质控对照品溶液的配制 精密称取Gen、Rg1、R1、Rb1对照品,配制成浓度分别为0.217、0.194、0.207、0.205mg/mL的质控用对照品储备液,2~8℃保存,备用。取Gen、Rg1、R1、Rb1质控用对照品储备液适量,配制得到浓度分别为72.3、7.20、8.40、2.85μg/mL的高浓度混合质控工作液,并用甲醇逐级稀释得到浓度分别为18.1、1.80、2.10、0.712μg/mL的中浓度混合质控工作液及浓度分别为4.52、0.450、0.525、0.178μg/mL的低浓度混合质控工作液。
2.1.3 内标溶液的配制 精密称取Pro对照品6.59mg,置于适量容量瓶中,甲醇溶解并定容至刻度,得到浓度0.659mg/mL的内标对照品储备液,2~8℃保存,备用。取适量Pro内标储备液,加入适量甲醇,稀释得到浓度为110ng/mL的内标工作液。
2.2 血浆样品处理方法 固相萃取板分别以300μL甲醇、300μL超纯水活化,备用。取不同浓度的混合对照品溶液及内标工作液各10μL于离心管中,氮气吹干。加入100μL空白人血浆,涡旋混匀,加入100μL 20%的甲酸,漩涡混匀2min后转移至固相萃取板中,分别以200μL超纯水淋洗,200μL甲醇洗脱,甲醇洗脱液10μL进样。
2.3 LC-MS/MS检测方法
2.3.1 液相色谱条件 Waters SunFire C18色谱柱(5μm,150mm×4.6mm);流动相:0.01%甲酸水A-甲醇B,梯度洗脱,0~1min,90% A;1~8min,90%~10% A;8~10min,10% A;10~10.5min,10%~90% A;10.5~15min,90% A,流速:1mL/min。柱温:20℃;进样量:10μL。
2.3.2 质谱条件 电喷雾离子化(ESI),正离子模式。多反应监测(MRM)定量:Gen,[M+Na]+,m/z:411.10/217.00;Rg1,[M+Na]+,m/z:823.40/203.20;R1,[M+Na]+,m/z:955.60/775.50;Rb1,[M+Na]+,m/z:1131.50 /365.10;Pro,[M+H]+,m/z:260.20/183.10。质谱参数CUR:20.00;IS:5500.00;TEM:500.0℃;GS1:50.00;GS2:50.00;CAD:Mediμm;Interface Heater(ihe):on。
3 结果
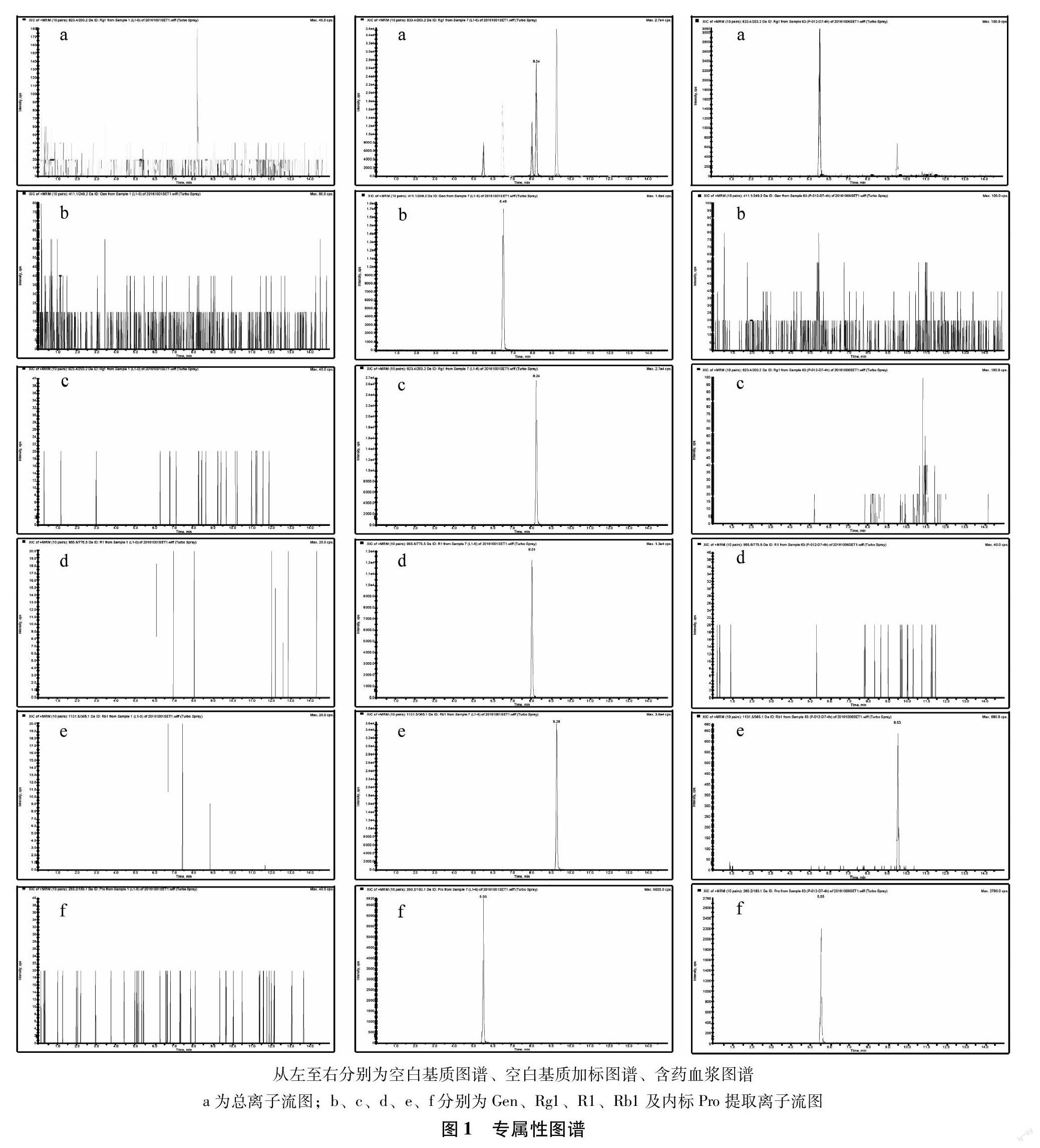
3.1 专属性 按照“2.2”项下方法处理,分别得到空白离子色谱图、含标准品和内标的离子色谱图及未知浓度血浆样品离子色谱图。结果表明,Gen、Rg1、R1、Rb1及Pro提取离子色谱图与血浆中内源性杂质互不干扰。结果如图1所示。
3.2 标准曲线与定量范围 按照“2.2”项下方法处理,得到不同浓度系列的进样溶液,测定得到待测成分与内标的峰面积。以各待测成分的浓度为横坐标,待测成分与内标峰面积的比值为纵坐标,绘制标准曲线。结果表明,所有待测成分的线性关系良好(r>0.95),定量范围较宽,定量限低,所有定量下限均满足S/N≥10。其中,Gen、Rg1、R1、Rb1 3個批次所测定标准曲线的相关系数(r)平均值分别为为0.9954、0.9978、0.9965、0.9928,相对标准偏差分别为0.12%、0.05%、0.48%、0.48%;斜率的平均值分别为4.40×10-2、5.72×10-3、2.06×10-3、13.1×10-3,相对标准偏差分别为17.38%、12.77%、14.43%、4.64%;标准曲线上各点的准确度均符合要求;线性范围分别为252~8100ng/mL、26.8~857ng/mL、32.8~1050ng/mL、11.2 ~360ng/mL。
3.3 残留率 按照“2.2”项下方法处理,得到标准曲线最高浓度点的进样溶液及空白血浆溶液,平行处理6份,按“最高浓度点样品-空白血浆样品”次序交叉测定所有制备的样品,各空白血浆中待测成分Gen、Rg1、R1、Rb1及内标Pro的峰面积与定量下限样品測定峰面积的比值,其中待测成分残留率均小于20%,内标残留率小于5%,满足试验要求。
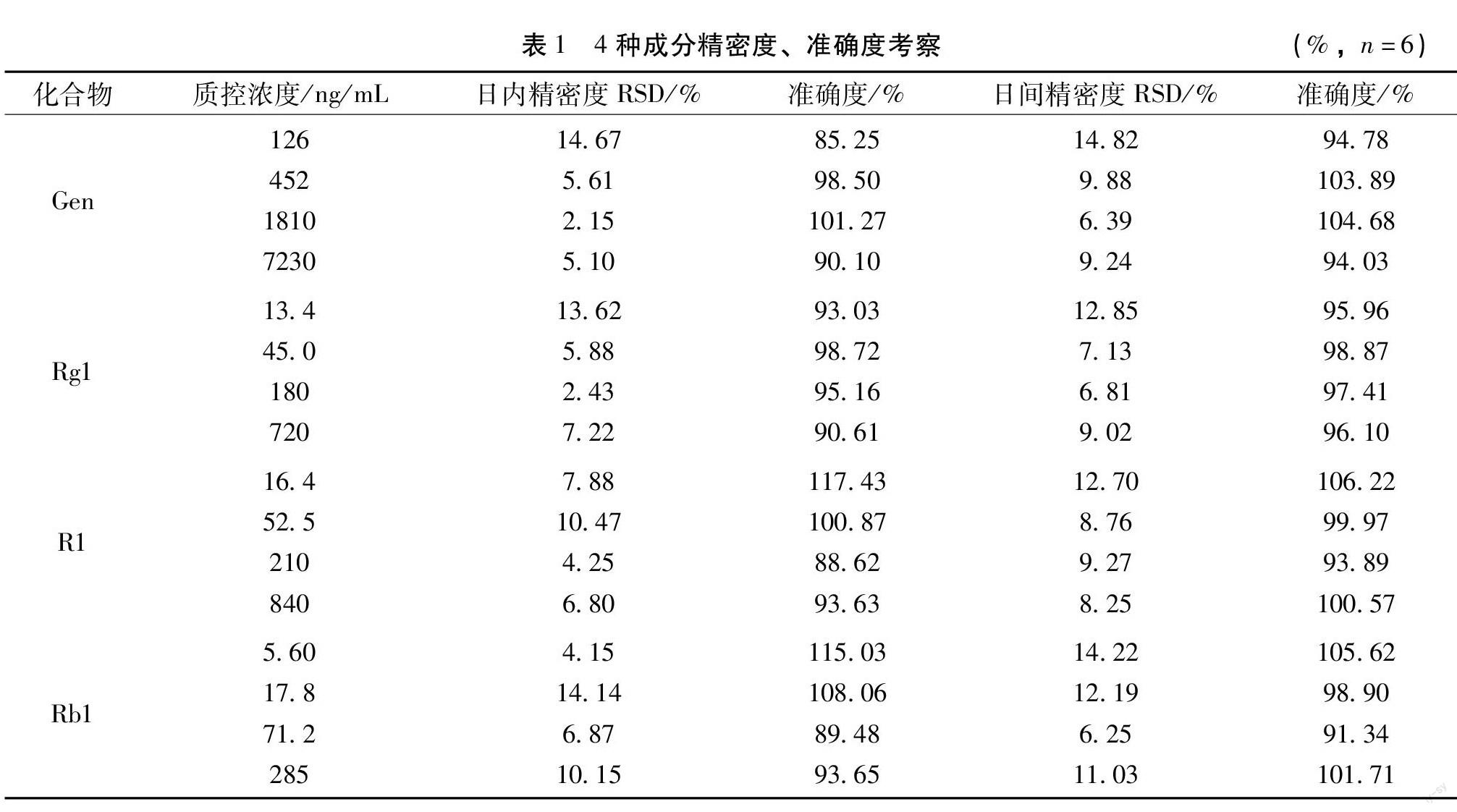
3.4 精密度、准确度 取定量下限、低、中、高4个浓度的的加标血浆,按照“2.2”项下方法分别处理得到4个浓度的进样溶液,每个浓度处理3批次,每批次每个浓度平行处理6份,计算日内精密度、日间精密度及准确度。结果表明,痛舒胶囊中4种入血成分的日内精密度、日间精密度RSD≤15%,定量下限准确度均在80%~120%之间,质控样品准确度均在85%~115%之间,符合试验要求。见表1。
3.5 回收率 按照“2.2”项下方法平行处理6份低、中、高3个浓度的加标血浆,得提取后的进样溶液。再取相同浓度的混标溶液,平行6份,得未提取的标准进样溶液。分别测定12个进样溶液。计算提取后进样溶液与未提取进样溶液测定浓度的比值,得到提取回收率。结果痛舒胶囊中4个入血成分Gen、Rg1、R1、Rb1不同浓度间的平均回收率分别为91.65%、64.39%、84.72%、86.11%,回收率在61.05%~96.54%之间,各入血成分各浓度间回收率RSD均≤15%,符合试验要求。
3.6 基质效应 按照“2.2”项下方法,平行6个不同个体的人空白血浆,每个个体平行处理3份,得到18份空白基质样品。离心管中分别加入低、中、高浓度混合标准溶液及内标溶液,氮气吹干,加入空白基质复溶,得到含基质的进样溶液,每个浓度平行处理6份。再取相同浓度的混标溶液,平行6份,得不含基质的标准进样溶液。计算归一化基质效应因子。结果显示人血浆对Gen、Rg1、R1、Rb1各浓度间的基质影响均较小,且影响程度均基本一致,基质效应RSD均≤15%,满足试验要求。
3.7 血浆样品及进样溶液稳定性 按照“2.2”项下方法,处理低、高两个浓度的质控样品,每个浓度平行6份,室温放置5d后进样。制备低、高两个浓度的加标血浆样品,分别于室温放置6h、-80℃放置164d、-80℃放置164d且反复冻融3次后按照“2.3”项下方法处理进样,每个浓度平行6份。结果表明含药血浆可在室温稳定放置6h、-80℃放置164d、可反复冻融3次,进样溶液可室温稳定放置5d,稳定性考察条件满足试验需求。见表3。
综上,本试验条件下,所建立的HPLC-MS/MS法能用于对来自于临床MTD的所有人血浆样本中栀子苷、人参皂苷Rg1、三七皂苷R1、人参皂苷Rb1的检测,该方法灵敏度高、重现性好、稳定性高。
4 讨论
由于人血浆中基质比较复杂,基质可随目标成分共提出或共流出,对前期摸索阶段建立的分析方法造成干扰,基质效应对不同浓度间目标成分影响差异较大。为排除基质对分析检测的影响,首先优化含药血浆样品处理方法。通过对不同提取方法的考察后筛选出对不同浓度间目标成分影响较小的固相萃取法为样品前处理方法。然后又对固相萃取法洗脱溶剂、溶剂洗脱比例、溶剂洗脱体积等因素进行考察,结果发现有基质能随洗脱溶剂甲醇共流出,无法通过样品前处理方法完全排除基质对分析检测的干扰。因此,为彻底排除基质对分析检测的影响,本实验同步优化分析检测方法,选择柱长为150mm的色谱柱对随目标成分共流出的基质进行分离,通过调整流动相比例、流动相梯度、流动相种类等方式实现对基质的分离,从而保证基质效应对样品分析检测影响的一致性。
在试验过程中,血浆样品及进样溶液稳定性仅对低浓度及高浓度质控进行验证,验证浓度能覆盖痛舒胶囊临床MTD血浆样本中的浓度。根据样品存放条件及时间,设置血浆样品长期稳定性考察,考察周期为164d,考察周期可覆盖血浆样品的存放周期。
本次实验所选择的检测目标物,均为原型化合物,由于中药复方的复杂性,这一阶段并未对其可能的代谢产物进行检测,这些化合物有可能在进入人体后发生代谢转化,导致原型化合物难以被跟踪到[6-8],后续试验将提高仪器灵敏度,或对原型化合物及代谢产物进行研究分析,以揭示痛舒胶囊的体内吸收过程。
参考文献
[1]
张海存. 综合治疗膝骨关节炎185例疗效观察[J].云南中医中药杂志,2012,33(10):56.
[2]窦蓉芳. 推拿配合痛舒胶囊治疗肩周炎36例[J].云南中医中药杂志, 2012, 6(6): 82.
[3]杨茂林, 邓程叶. 痛舒胶囊结合盐酸乙哌立松治疗颈源性头痛临床疗效及安全性研究[J]. 中华中医药学刊,2021,39(2):177-180.
[4]甘国强,彭雪花,廖丽彬,等.痛舒胶囊配合针刀治疗颈源性头痛的疗效观察[J].现代中西医结合杂志,2012,21(9):944.
[5]陈继红.维生素E联合痛舒胶囊治疗乳腺增生病疗效观察[J].河北医药,2011,33(4):623-624.
[6]杨柳,许舜军,曾星,等.人参皂苷Rb1在大鼠体内的药物代谢研究[J].高等学校化学学报,2006,27(6):1042-1044.
[7] 赵欣,强光辉,郭毅,等.复方丹参滴丸人含药血浆中三七相关代谢物的研究[J].质谱学报,2007,28(1):23-26,30.
[8]陈建. 栀子苷在佐剂性关节炎大鼠体内生物利用度、血浆蛋白结合率及其代谢产物的研究[D].合肥:安徽中医药大学,2015.
[9]SFDA.药物非临床药代动力学研究技术指导原则[Z]. 2014-05-01.
[10]SFDA.化学药物制剂人体生物利用度和生物等效性研究技术指导原则[Z].2000-09-01.
(收稿日期:2011-11-08 编辑:陶希睿)
