高中化学中配合物的教学与研究
2022-05-30刘利锋
刘利锋
摘要:化学作为三大基础学科的中心学科,与生命、能源、材料及环境领域息息相关,承载着人类的文明与希望.每时每刻都在创造着新的物质,探索着自然界的奥秘,为人类命运共同体的美好未来发挥着巨大的引领作用.而配合物的研究作为无机化学的重要分支,广泛应用于物质的分析、分离、提纯,并应用到电镀、医药、照相、印刷等方面,打破了无机化学与有机化学的界限,极大的丰富了化学的内涵与外延,也是高中教学的一个难点,更是近年来高考命题的一个热点与趋势,据此对高中化学配合物知识进行了探究.
关键词:教学合一;知行合一;配合物、螯合物;高中化学
中图分类号:G632文献标识码:A文章编号:1008-0333(2022)21-0118-03
1配合物、螯合物的联系与区别
配合物的定义:中心离子(或原子)和一定数目的配位体(中心分子或阴离子)以配位共价键结合而形成的复杂结构单元称配合单元,凡是由配合单元组成的化合物称为配位化合物,简称配合物.例如:
CuSO4+4NH3[Cu(NH3)4]SO4
硫酸化四氨合铜(Ⅱ)
AgCl+2NH3[Ag(NH3)2]Cl氯化二氨合银(Ⅰ)
PtCl4+2KClK2[PtCl6]六氯合铂(Ⅳ)酸钾
3NaF+AlF3Na3[AlF6]六氟合铝(Ⅲ)酸钠
中心原子或中心离子:配合物形成体,它位于配离子(或分子)的中心.绝大多数配合物的形成体是带正电荷的金属离子.过渡金属的离子,由于具有空轨道,是较强的配合物形成体.当然,中性的原子也可以作为形成体,如:Ni(CO)4、Fe(CO)5中的Fe与Ni等.
配位体:指与中心离子结合的分子或离子.在配位体中直接与中心原子相连的原子叫配位原子,具有孤对电子对,一般包含N、O、S、C和卤素等,分为单齿与双齿配位体.
配位数:是指中心离子(或原子)所接受的配位原子的数目,若配位数是单齿的就是该中心离子或原子的配位数,Cu(H2O)2+4、Co(NH3)3+6的配位数分别是4和6;Pt(en)2+2中的乙二胺(en)是双齿配位体,每个en中有两个氮原子与中心离子Pt2+配位,所以配位数不是2而是4.常见的单齿配位体有H2O、CO、NO、CH3、NH2、F-
、Cl-、Br-、I-、OH-、CN-,双齿有乙二胺四乙酸根(EDTA)等.那么螯合物与配合物的有什么关系呢?其实螯合物属于配合物,是一种特殊的配合物,两者沒本质的区别.主要的区别在于形成配合物时配位体是否为双齿,若为双齿,形成配合物时的形状如同螃蟹的双螯钳住中心离子,而使中心离子与配位体结合成环状结构,从而形象地称之为螯合物.
纵观近几年的高考题不难发现,多数情况下是考查学生对于配合物的概念、配位数的计算层面,相对来说还是比较简单,但是对于学生今后在大学的学习具有重要的意义.
2高中阶段涉及的三个配合物实例教学研究
(1)银氨溶液的配制
AgNO3+NH3·H2OAgOH↓+NH4NO3
2AgOHAg2O+H2O
Ag2O+4NH3+H2O2[Ag(NH3)2]OH
(2)人教版选修3课全P42页[Cu(NH3)4]SO4和Fe3+的检验
Cu2++2NH3·H2OCu(OH)2↓+2NH+4
Cu(OH)2+4NH3[Cu(NH3)4]2++2OH-
(3)Fe3++3SCN-Fe(SCN)3
在高中阶段这三个有限的实例教学中,在教学时尽可能地让学生自已动手去探究,并认真思考为什么已经形成沉淀,最终沉淀会溶解?沉淀溶解生成的物质与以前熟知的物质有什么不同?你能结合课本知识解释它们形成的原因吗?尤其是结合化学第二课堂,让学生通过网络了解配合物形成的基本理论和在实践中的应用,既增加学生的学习兴趣,又开阔学生的视野,形成良好的探究氛围,教学效果非常理想.
3高中阶段配合物研究的价值和意义
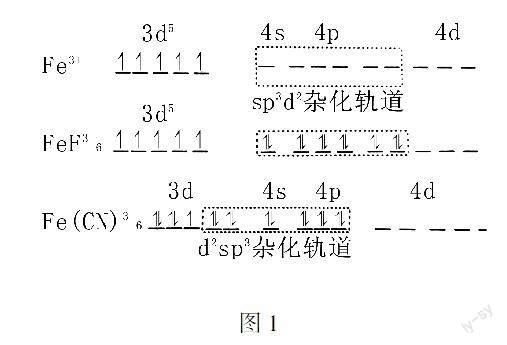
(1)熟知配合物成因,了解配合物的价键理论,培养学生宏观识与微观探析方面的核心素养.自从Sidgwick和Pauling提出配位共价键模型后,逐渐产生中心离子(原子)提供轨道而配位体提供孤电子对的配合物价键理论.例如:Fe3+形成FeF63-,
进入大学学习后,这些知识将作为专业来进行学习,但高中阶段的学生由于认识的局限性,未对价键知识和杂化轨道理论进行系统的学习,但通过外轨形和内轨形配合物的简单介绍,学生能更好的理解全满半满全空的意义,从而对分子是否具有磁性有一个初步的了理,利用轨道图(如图1所示)来讲授对学生的理性思维、发散思维的培养事半功倍.
(2)引导学生能从结构的角度解释物质的性质,培养学生的科学探究与创新意识素养.配合物价键理论的部分大学内容空降到了高中,对学生的综合素质要求相当高,但是有好多老师,对这一部分知识本身就是盲区,对外轨形和内轨形的配合物分不清,更不要说从磁学理论来解释.例如:在刚刚进行的本市第三次检测中,关于Fe(CN)3-6的考查,题目中问到,为什么CN-的配体以C配位,而不是以N配位?同时为什么-NO-2配体以N配位,而不是以O配位?这就考查到了内轨形低自旋配合物的知识,但是站在高中阶段,能给出的答案只能是电负性低的容易给出孤对电而已,但对于一些基础好的学生要问到FeF3-6和Fe(CN)3-6的杂化轨道有什么不同?为什么前者具有磁性而后者磁性降低,甚至为反磁性时老师则很难解释清楚,对教学效果造成影响.陶行知先生曾说过:“先生的责任不在教,而在教学,而在教学生学;教的法子必须在于学的法子;先生不但要拿他教的法子和学生学的法子联络,并须和他自己的学问联络起来”.所以必须践行教与学的辩证关系,在教书的过程中树立终身学习的理念,不断提升自已的教育理念,提高教学的水平.
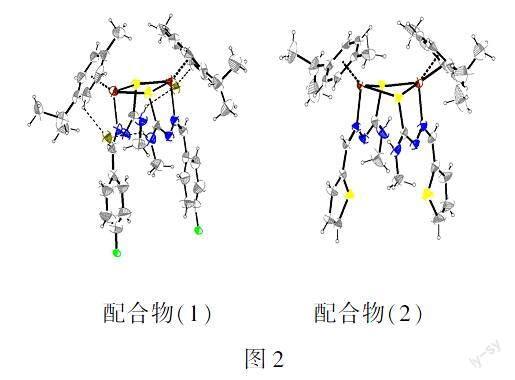
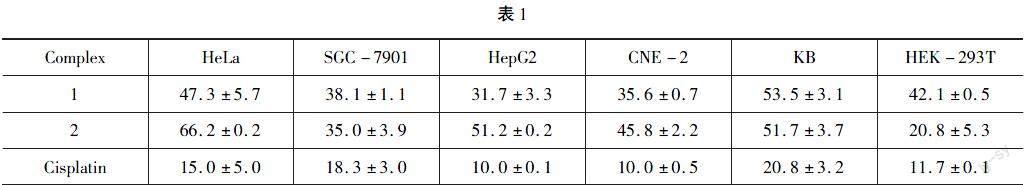
(3)培养学生的科学态度及社会责任,提高学生学习化学的兴趣,帮助学生树立正确的人生观及价值观.例如:在笔者研究的配合物中,钌配合物具有较好的抗肿瘤活性,其给药方式不同于临床应用的铂类药物,提供了代替铂类药物用于治疗癌症的可能性.目前正在进行二期临床试验的钌配合物为:NAMI-A,KP1019和NKP-1339.此外,具有钢琴凳几何形状的有机金属芳烃钌半三明治配合物,如Dyson课题组开发的RAPTA-C;Sadler课题组开发的RM175,因其具有较好的抗癌活性而引起越来越多的关注.对于笔者研究的双核芳烃钌配合物[(η6-arene)Ru(TSC)Cl]2Cl2,(TSC=氨基硫脲)是一类具有特殊结构的钌配合物,其往往具有良好的康复肿瘤活性(如图2所示).
作为一名化学老师,无论你在高中段还是大学段,树立终身学习的意识是必备的素质.高中的学生正值青春期,对新生的事物非常的感兴趣,只要引导好会使学生终身受益,也会使社会受益.当笔者介绍完自已研究的配合物时,教室里非常安静,孩子们的眼睛亮晶晶的,对未来的大学生活充满期待,一颗探索未来世界的种子已深深的埋入他们的内心,学好化学造福社会的责任感由然而生,连一直以来不怎么学生学生,下课后都主动来找笔者谈心,那一刻的教学真美,笔者和学生都收获到知识带来的幸福.
(4)助力学生在高考中取得优异成绩,同时也为高等教育输送优质的生源,为化学人才的培养奠定基础.十年磨一剑,霜刃未曾试,对于距高考只有一个多月的学生来说,教师对高考的引导与纠错至关重要,关系到学生的未来与发展,也是体现高中化学教学价值的关键所在,下面就高考原题和大家共享一下.
例1(1)在配合物[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是,画出配合物
[Ag(NH3)2]+中的配位键:.
(2)H3O+的空间构型为,BCl3的空间构型为.
(3)FeCl3中的化学键具有明显的共价性,蒸气状态下以双聚分子存在的FeCl3的结构式为,其中Fe的配位数为.
(4)五羰基合铁Fe(CO)5的配体是,已知配原子是C而不是O,其可能的原因是.
(5)已知
Fe3++K++[Fe(CN)6]4-KFe[Fe(CN)6]
利用该离子方程式可以检验溶液中的Fe3+,
[Fe(CN)6]4-中σ和π数目之比.
通过以上例题的展示与配合物基本知识的分析,不难看出,配合物的重心展现在成键特征、空间构型、杂化类型、等电子体方面,但是由于所有的题型均是以配合物做為骨架,给人一种难以逾越的感觉,但是只要在授课过程中理清线索,注重基础,使学生对配合物有一个不正确了解,一定会对孩子的今后发展起到积极的作用.
参考文献:
[1]惠海涛.从两则“配合物”的教学设计谈核心素养的培养[J].中学化学教学参考,2018(19):65-66.
[2]陈晟.高中化学竞赛配合物构型问题的解题思路[J].广西教育,2014(26):115-116+118.
[3]张晓红,张海滨.实例分析价键理论在配合物构型判断中的应用[J].数理化解题研究,2019(19):96-97.
[责任编辑:季春阳]
