雪茄烟叶(BESNO H382)不同组织器官及盐胁迫条件下内参基因的筛选
2022-05-30金静静徐国云郑庆霞刘萍萍陈千思金立锋周会娜
张 慧,金静静,徐国云,翟 妞,郑庆霞,刘萍萍,陈千思,金立锋,周会娜
中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2 号 450001
雪茄烟叶按照其用途可以分为三类:茄衣、茄套和茄芯[1]。优良品种的缺乏和现有品种的退化已成为我国茄衣烟叶生产上的主要问题[2]。目前在茄衣烟叶的栽培和调制方面研究较多[3-5],但对于茄衣烟叶的分子生物学及遗传育种方面的研究则十分匮乏。随着测序技术的不断发展,利用二代测序和三代测序相结合的方法获取雪茄烟叶(茄衣)基因组的序列及表达数据,进而挖掘基因功能,创制出雪茄烟叶优良性状的育种材料成为可能[6-8]。
基因表达分析是分子遗传学的基础研究内容,实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)是基因表达分析的重要技术手段[9-10],常用来检测不同组织、不同试验条件下特定基因的表达情况或者验证转录组测序数据的准确性。选择合适的内参基因是保证qRT-PCR分析结果准确性的前提[11]。常用的内参基因包括ACTIN(肌动蛋白家族基因)、RPL(Ribosomal protein L,核糖体蛋白基因)、UBQ(ubiquitin,多 聚 泛 素 酶 基 因)、EF-1 α(Elongation factors 1 alpha,转录延伸因子基因)、GAPDH(glyceraldehyde-3-phosphate dehydrogenase,甘油醛-3-磷酸脱氢酶基因)、TUB(tubulin,β微管蛋白基因)[12-14]等。尽管这些基因高度保守,但在不同植物及组织中、不同生理状态条件下的表达量并不稳定,因此研究者需要根据具体的物种和不同的处理条件选择合适的内参基因[15-16],如藜麦中选择肌动蛋白(ACT-1)和微管蛋白(TUB-6)作为盐胁迫下的内参基因等。
关于普通栽培烟草的内参基因,最早Schmidt等[17]研究挑选了L25 和EF-1α两个基因。王燃等[13]基于烟草芯片数据筛选获得了HSC70-1基因作为内参。由于烤烟与晾晒烟的遗传相似性差异较大[18],因此普通栽培烟草(烤烟)的内参基因是否适用于雪茄烟叶(晾晒烟)尚不明确。基于前期对雪茄烟叶的三代测序和转录组测序数据分析,已经得到了较为完整的雪茄烟叶基因信息[19]。通过序列比对发现,雪茄烟叶中未找到完整的L25 基因序列,这可能与测序及拼接有关;而EF-1α基因根据转录组测序数据判断在根茎叶中的表达量较低且并不一致。此外,目前已报道的栽培烟草L25 和EF-1α的qPCR 引物在雪茄烟叶里特异性差,因此不适合作为雪茄烟叶的内参基因。结合雪茄烟叶的三代测序和转录组测序数据,从中筛选各组织较高表达且表达量一致的10 个基因作为候选内参基因。利用qRT-PCR 获得这10个基因在雪茄烟叶不同组织器官以及盐处理前后雪茄烟叶叶片中的表达量,并使用geNorm[20]、NormFinder[21]和BestKeeper[22-23]等3 个软件对候选基因的表达稳定性进行分析评价,旨在筛选出适合用于雪茄烟叶不同组织器官和盐胁迫条件下基因表达研究的内参基因。
1 材料与方法
1.1 植物材料
雪茄烟叶(品种BESNO H382)种植在国家烟草基因研究中心的植物生长室中(培养条件:温度28 ℃,相对湿度70%~75%,光照16 h,黑暗8 h)。雪茄烟叶不同组织器官(旺长期根、茎、叶,盛花期花萼、花冠、柱头、子房、雄蕊、雌蕊及种子)取样后,于液氮中迅速冷冻后保存在-80 ℃超低温冰箱中。盐胁迫试验:待烟苗长至6片真叶时,移至1/2 MS液体培养基中继续培养,1周后向培养液中加入300 mmol/L的NaCl溶液处理0 h、3 h、1 d、3 d和7 d,选取同一叶位的叶片进行取样,经液氮速冻后置于-80 ℃冰箱保存备用。所有样品均设置3次生物学重复。
1.2 总RNA提取及cDNA的合成
总RNA的提取及反转录cDNA的合成方法具体为:将采集的样品在液氮中充分研磨,根据植物RNA提取试剂盒[天根生化科技(北京)有限公司]说明书提取总RNA。通过Nano Drop 2000[赛默飞世尔科技(中国)有限公司]检测RNA的浓度和纯度(A260/A280=1.8~2.1,A260/A230>1.8),并通过1.0%的琼脂糖凝胶电泳检测总RNA 的质量和完整性。检测合格的总RNA 用于cDNA 第一链的合成,具体步骤参照Roche 第一链cDNA 合成试剂盒Transcriptor First Strand cDNA Synthesis Kit说明书。合成的cDNA按1∶5稀释后于-20 ℃保存备用。
1.3 候选内参基因的筛选及qRT-PCR引物设计
根据前期已完成的雪茄烟叶三代测序及根茎叶转录组测序数据[19],筛选在不同组织表达量接近且高表达的持家基因,从中选取10个文献报道的常用内参基因作为本研究中的候选内参基因,设计特异性引物(表1),并将设计好的引物提交至北京六合华大基因科技股份有限公司合成。
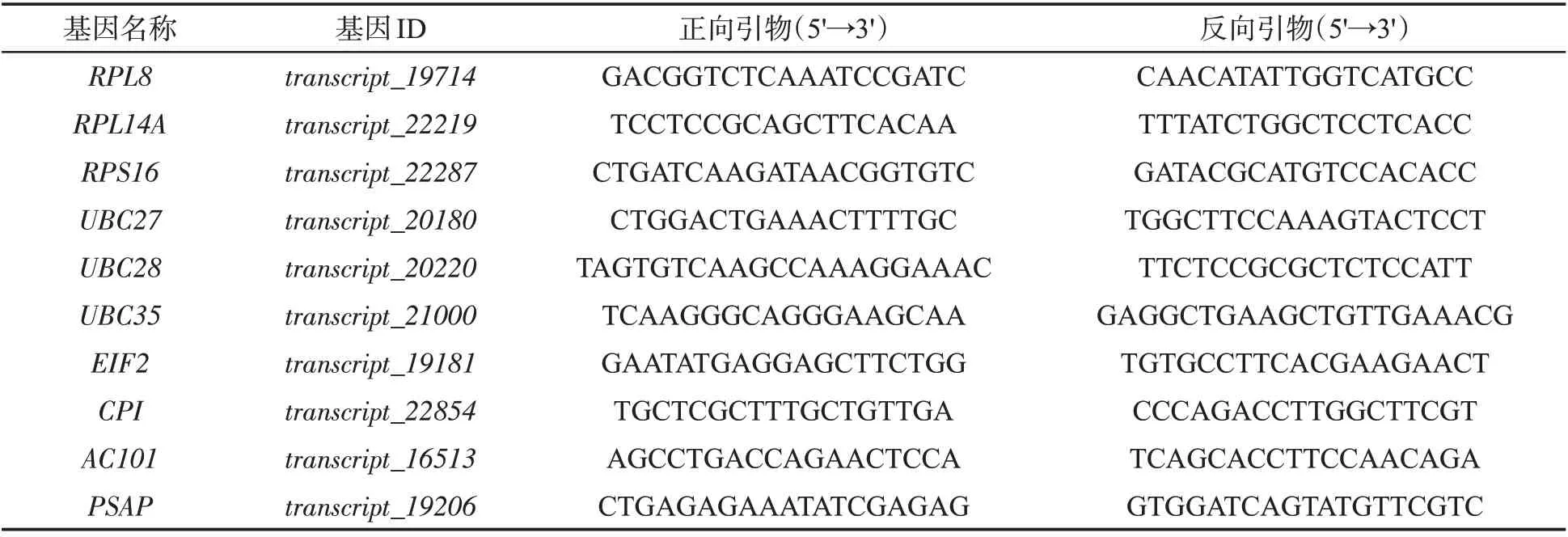
表1 候选内参基因qRT-PCR引物Tab.1 qRT-PCR primers for candidate reference genes
1.4 实时荧光定量PCR扩增及引物扩增效率的计算
用Roche Light Cycler 96 实时荧光定量PCR 仪进行qRT-PCR 扩增反应。反应体系20 μL:10 μL 2×SYBR I Master,上下游引物各0.5 μL,cDNA 模板1 μL,加ddH2O 至20 μL。PCR 反应程序:94 ℃预变性30 s;94 ℃变性5 s,60 ℃退火10 s,72 ℃延伸10 s,45 个循环;60 ℃~95 ℃持续15 s 作为熔解曲线分析程序。脯氨酸合成酶基因(P5CS)的相对表达量采用2-ΔΔCT方法计算,其中P5CS 基因的定量引物为:上游5′-CTGCAAGAGAATGCGCCAG-3′ ,下游5′-GCCAGGATTTCCTCTTCATT-3′ 。参考文献[24]计算引物扩增效率。
1.5 数据分析
利用Prism6 软件绘制10 个候选基因在所有样品中CT值的分布箱线图。利用geNorm、NormFinder和Bestkeeper 软件对候选内参基因的稳定性进行评价。
2 结果与分析
2.1 RNA质量检测
琼脂糖凝胶电泳检测结果(图1)表明,RNA 条带清晰,无弥散现象;经过Nano drop 2000 的检测,所 有 样 本A260/A280介 于1.8~2.1 之 间,A260/A230介 于1.8~2.2 之间。说明RNA 完整性好,纯度高,且没有降解。证明RNA样品纯度较高,满足后续实验要求。

图1 雪茄烟叶不同组织器官中提取的总RNA的琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis of total RNA from different tissues and organs of cigar tobacco
2.2 候选内参基因扩增特异性分析及扩增效率
将雪茄烟叶不同组织的总RNA 分别反转录成cDNA 进行qRT-PCR 反应,结果(图2)表明,10 个候选内参基因的熔解曲线均呈现显著的单一峰,没有引物二聚体及非特异扩增的情况出现,可用于内参基因表达稳定性分析。同时,10 个候选基因的扩增效率介于91.74%~107.1%之间(表2),R2较高(均在0.980 0 以上),满足qRT-PCR 对引物扩增效率的要求,可用于进一步分析。

表2 雪茄烟叶候选内参基因扩增效率比较Tab.2 Amplification efficiency of candidate reference genes of cigar tobacco

图2 候选内参基因的熔解曲线Fig.2 Melting curves of candidate reference genes
2.3 候选内参基因表达丰度分析
内参基因的表达水平通常用CT值来表示[21]。对10 个候选基因在10 个样品中的CT值分布情况进行了分析。结果(图3)表明,10个候选内参基因的平均CT值介于21.39(RPL8)~29.93(PSAP)之间,表达丰度分布范围较广。在10 个候选内参基因中,UBC28、UBC35和AC101基因的表达水平在不同样本中的波动较小,所有样本的平均CT值分别是24.66、24.00和25.21;RPL8 基因的表达水平在不同样本中最为分散,最大是27.51,最小是21.39,平均CT值是24.4。因此,从不同组织表达量的一致性来看,UBC28、UBC35和AC101基因适合作为分析不同组织间表达变化的内参基因。
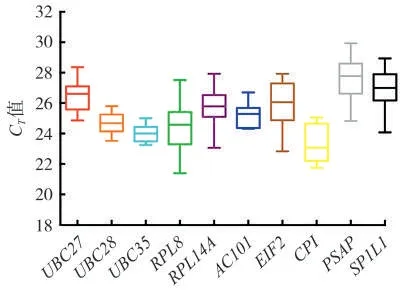
图3 雪茄烟叶10个候选内参基因在不同组织器官中CT值的分布Fig.3 Distributions of CT values for 10 candidate reference genes in different tissues and organs
2.4 候选内参基因在雪茄烟不同组织表达的稳定性分析
由于不同样本之间固有的差异,以及qRT-PCR反应的操作过程中多步实验导致的误差,直接比较原始的CT值无法准确评估候选内参基因的稳定性,因此采用3 种常见的内参基因测试软件geNorm、NormFinder 和BestKeeper 进行比较分析,筛选出雪茄烟叶不同组织器官中适合的内参基因。
2.4.1 geNorm软件分析
geNorm软件用M值来判断其表达稳定性[23]。具体算法为:先找到该基因在所有样品中最小的CT值,再用其他样品CT值减去最低CT值,得到ΔCT值后,计算2-ΔCT值,然后通过geNorm软件计算M值。通常适合作为内参基因的M 值都小于等于1.5。geNorm 软件分析结果(图4)表明,10个候选内参基因的M值均小于1.5,其中最小0.37(RPL14A和SP1L1),最大1.09(PSAP),说明这些基因都可作为候选内参基因,按照M 值由低到高排序依次为RPL14A=RPS16<UBC27<UBC28<UBC35<EIF2<AC101<RPL8<CPI<PSAP。 即在这10个候选基因中,RPL14A和RPS16基因表达最为稳定,PSAP 基因表达最不稳定。此外,通过geNorm 软件计算出配对变异值Vn/n+1,当Vn/n+1<0.150时,n 个基因即可满足校正目的基因表达量的要求。从图4 中可以看出,V4/5=0.143<0.150,表明适合候选内参基因数目最少为4。

图4 geNorm分析候选内参基因表达稳定性(A)和最佳候选内参基因个数(B)Fig.4 Expression stabilities(A)and optimal numbers(B)of candidate reference genes analyzed by geNorm
2.4.2 NormFinder软件分析
NormFinder软件计算原理与geNorm类似,所得稳定值越小的越适合作为内参基因[23]。分析结果如图5 所示,10 个候选内参基因的表达稳定值从低到高排列为:UBC27<RPL14A<UBC28<RPS16<UBC35<AC101<EIF2<RPL8<CPI<PSAP。其中UBC27 最低,为0.336 1;PSAP 最高,为0.779 2。表明最适合作为候选内参基因的是UBC27,其次是RPL14A 和UBC28。

图5 NormFinder分析10个候选内参基因的表达稳定性Fig.5 Expression stabilities of 10 candidate reference genes analyzed by NormFinder
2.4.3 Bestkeeper软件分析
Bestkeeper 软件可以根据不同候选内参基因在样品中的平均CT值计算两两基因之间产生配对的标准偏差(SD)、相关系数(r)和变异系数(CV),通过比较各个值的大小,最终选择稳定性好的内参基因。相关系数越大,标准偏差和变异系数越小,内参基因的稳定性就越好。除了能够分析内参基因的稳定性,该软件还可分析目的基因的表达水平[21]。
从Bestkeeper的分析结果(表3)可以看出,在10个候选内参基因中有5 个(RPS16、CPI、PSAP、EIF2和RPL8)SD 大于1,剩余的5 个(RPL14A、UBC27、UBC28、AC101和UBC35)SD值均小于1,说明这5个基因适合作为内参基因。对这5个基因按照相关系数进行排序,从高到低依次为:RPL14A、UBC27、UBC28、UBC35 和AC101,其中RPL14A 和UBC27 也是geNorm 软件和NormFinder 软件筛选出的适合雪茄烟叶不同组织基因定量分析的内参基因。

表3 BestKeeper分析10个候选内参基因表达稳定性Tab.3 Expression stabilities of 10 candidate reference genes analyzed by BestKeeper
2.5 候选内参基因在盐胁迫下表达的稳定性分析
对10个候选内参基因进行了盐胁迫下表达稳定性分析,结果如表4所示。3种软件的评价结果基本一致,最适合的盐胁迫条件下的内参基因是UBC28,其次是UBC27和RPL14A等。
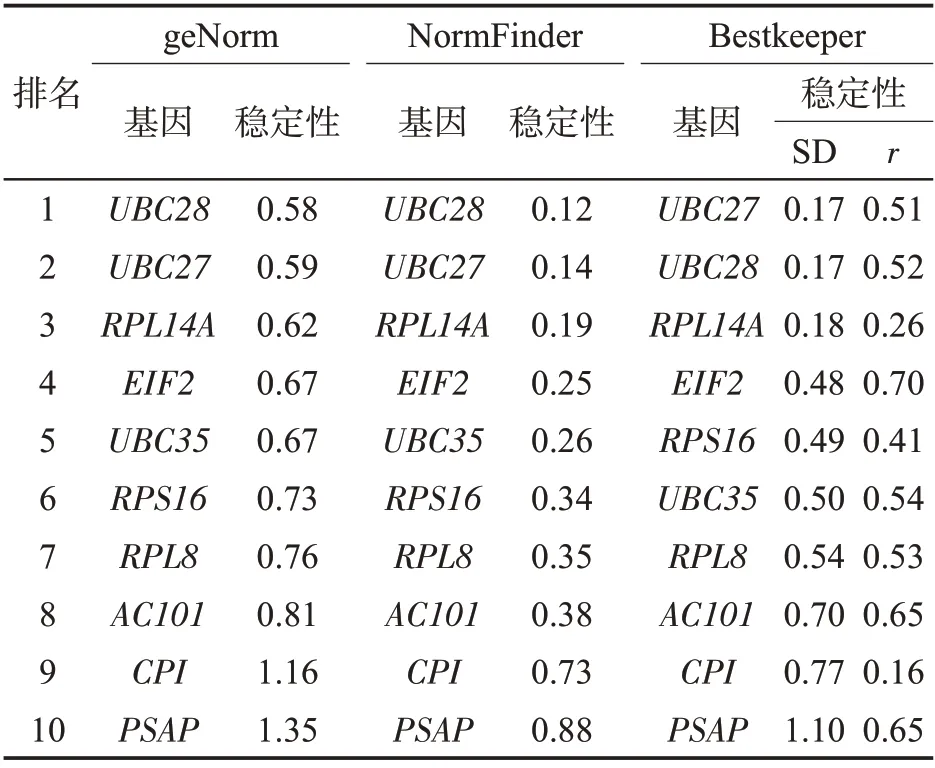
表4 盐处理条件下雪茄烟叶候选内参基因的稳定性分析Tab.4 Stability analysis of candidate reference genes under salt stress
2.6 盐胁迫下脯氨酸合成相关基因P5CS的时间表达模式分析
脯氨酸在植物抗逆中起着重要作用,其表达变化通常被用来衡量植物对逆境的响应情况[25-27]。分别使用RPL14A、UBC27和UBC28通过qRT-PCR对脯氨酸合成相关基因P5CS的相对表达量进行分析,结果如图6 所示。分别以RPL14A、UBC27 和UBC28 作为内参基因时P5CS的相对表达量基本一致,尤其是在盐胁迫3 h、1 d 和7 d 时,但在盐胁迫3 d 时以RPL14A 为内参时的相对表达量更高;3 种内参基因分析得到的时间表达模式非常一致,P5CS的表达在盐胁迫的前三天逐渐升高,第7天又略有下降,各取样时间点的表达由高至低依次为:3 d>7 d>1 d>3 h>0 h(CK)。可见,RPL14A、UBC27和UBC28作为内参基因用于雪茄烟叶盐胁迫时的基因表达定量分析都是适合的。

图6 雪茄烟叶盐处理后叶片中P5CS基因相对RPL14A、UBC27和UBC28的表达量Fig.6 Expression levels of P5CS gene relative to RPL14A,UBC27 or UBC28 in cigar tobacco leaves under salt stress
3 讨论
本研究中利用geNorm、NormFinder和BestKeeper等软件对候选内参基因的表达稳定性进行了分析,结果显示3种软件中候选内参基因的稳定性排序并不完全一致,这种情况在异色瓢虫(Harmonia axyridis)[10]和火龙果(Hylocereus)等[12]物种内参基因的筛选研究中也得到相似结果。其原因可能是由于3种分析软件处理数据的原理不同造成的。同时,本研究中选取的10个候选基因中有3个核糖体蛋白基因(RPL8、RPL14A 和RPS16)和3 个泛素结合酶基因(UBC27、UBC28 和UBC35)。从分析结果来看,3 个核糖体蛋白基因中RPL14A的稳定性明显高于RPL8和RPS16,3个泛素结合酶基因中UBC27和UBC28的稳定性明显高于UBC35,这说明功能相似的内参基因其表达稳定性不一定相同。这种情况在柑橘(Citrus)[28]和碱蓬(Suaeda glauca)[29]等植物中也有相关报道。此外,根据雪茄烟叶三代测序结合转录组测序的数据筛选出UBC27、RPL14A和UBC28等内参基因,但可能由于数据组装及拼接问题未能获得普通栽培烟草(烤烟)常用的L25等基因,因此如果想要更为全面地获得并验证雪茄烟叶的内参基因,可能需要对雪茄烟叶进行全基因组测序方面的研究。
4 结论
①筛选出10 个适合于温室中雪茄烟叶(BESNO H382)基因相对定量分析的候选内参基因,分别是RPL8、RPL14A、RPS16、UBC27、UBC28、UBC35、EIF2、CPI、AC101和PSAP。②利用geNorm、NormFinder 和Bestkeeper 等3 个软件分析了10 个候选内参基因在雪茄烟叶不同组织器官及盐胁迫下叶片中的表达稳定性,表明RPL14A 和UBC27 最适合作为雪茄烟叶不同组织器官的内参基因;UBC28 最适合作为雪茄烟叶不同盐胁迫条件下的内参基因。③应用UBC27、UBC28和RPL14A作为内参基因分析P5CS 基因在盐胁迫下的表达情况,发现3 个内参基因的定量结果趋势一致。
