猫疱疹病毒1型RPA-Cas12a-LFD检测方法的建立及初步应用
2022-05-30刘韵佳杨晓农
黄 坚,刘韵佳,杨晓农,李 妍*
(1.西南民族大学畜牧兽医学院,成都 610041;2.西南民族大学教学动物医院,成都 610041)
猫疱疹病毒1型(feline herpesvirus-1,FHV-1)为水痘病毒属的双链DNA包膜病毒,是引起猫上呼吸道感染(如鼻炎和结膜炎)的主要病原之一。多个血清学的调查结果表明,已免疫和未免疫猫只的FHV-1 抗体阳性率为10.0%~40.9%,提示部分饲养或流浪猫群仍存在FHV-1传播和持续流行的风险。在不同的调查报告中,FHV-1的检出率(8.0%~28.3%)存在地区和群体差异性,这可能与检测方法、样本中病毒分布和载量以及病毒变异等因素有关,对现有病原检测方法的即时性和灵敏度提出了挑战。现有的商品化FHV-1检测方法主要基于实时荧光PCR原理,可靶向胸苷激酶(TK)、糖蛋白B(gB)或糖蛋白D(gD)等基因进行特异性检测,但需要配备特殊的检测设备,且较为耗时,不便于现场快速检测。因此,建立快速灵敏的可视化检测方法十分必要。
2018年,Doudna的研究团队首次将CRISPR-Cas12a核酸酶的切割反应与重组酶聚合酶扩增(recombinase polymerase amplification,RPA)技术相结合,建立了DNA核酸快速检测的方法,并命名为DNA内切酶靶向的CRISPR反式报告检测系统(DNA endonuclease targeted CRISPR trans reporter,DETECTR)。其工作原理为通过体外合成的crRNA引导CRISPR-Cas12a特异性识别经RPA扩增的目标DNA序列,并利用Cas12a核酸酶的附带切割活性(反式切割)降解反应体系中的ssDNA报告探针,从而产生可在侧流层析试纸条(lateral flow dipstick,LFD)上显示的标记信号,增强了结果的可视化。目前,尚无针对FHV-1的RPA-Cas12a-LFD检测方法,因此本研究将结合RPA扩增、Cas12a反式切割反应和LFD显示技术建立针对FHV-1基因的快速可视化分子检测方法。
1 材料与方法
1.1 样本收集
从西南民族大学教学动物医院采集患有典型上呼吸道临床症状的猫眼鼻拭子20份,于-80 ℃保存。另外,猫疱疹病毒1型(FHV-1)、猫杯状病毒(FCV)、猫冠状病毒(FCoV)、猫诺如病毒(FNoV)、猫星状病毒(FAstV)、猫细小病毒(FPV)以及猫大肠杆菌()和肺炎克雷伯杆菌()和猫支原体(FM)的阳性样本分别采集自1家动物医院和2家猫舍,所有核酸样本均由西南民族大学动物医学实验室制备、鉴定和保存。
1.2 主要试剂及仪器
RNAiso Plus、PrimeScriptTM RT reagent Kit with gDNA Eraser、TB Green Premix Ex TaqII、DH5α感受态细胞、pMD19-T克隆载体和反转录试剂盒(大连宝生物有限公司)、2×Mastermix(蓉为基因生物科技有限公司);EnGenLbaCas12a核酸酶、HiScribe T7高效RNA合成试剂盒、DNase Ⅰ(无RNase)、NEBuffer2.1(10×)、Monarch RNA 纯化试剂盒(NEB公司,美国)、Annealing Buffer for DNA Oligos(5×)(碧云天公司);Gel Extraction Kit(Omega公司,美国);TIANamp DNA Extraction kit、pGM-T Fast Ligation Kit、TIANpure Midi Plasmid Kit[天根生化科技(北京)有限生物公司]、TwistAmpBasic Kit(TwistDx公司,英国)、Milenia HybriDetect 侧流层析试纸条、Milenia GenLine Universalmodul Assay Buffer(Milenia-biotec公司,德国);凝胶成像系统ChemiDoc MP System(Bio-Rad公司,美国);超微量核酸蛋白测定仪和荧光定量基因扩增仪(ThermoFisher Scientiifc公司,美国);电热恒温水浴锅(Bluepard)。
1.3 样本核酸提取、FHV-1质粒构建和TB Green qPCR方法的建立
使用试剂盒分别提取临床样本及保存的猫病原阳性样本中的DNA或RNA,并使用试剂盒对RNA进行反转录,将所有DNA和cDNA置于-20 ℃保存备用。对疫苗样本中扩增得到的FHV-1基因片段进行胶回收,纯化产物与pMD19-T载体进行连接,并转入DH5α感受态细胞中进行克隆和质粒提取,将测序正确的质粒于-20 ℃保存。建立并优化FHV-1基因的TB Green qPCR的反应体系,对质粒模板进行梯度稀释后扩增,构建熔解曲线、扩增曲线和标准曲线。
1.4 引物设计和合成
针对FHV-1基因的crRNA寡核苷酸(forward:5′-GAAATTAATACGACTCACTATAGGG-3′;reverse:5′-TGTTATTGTGGATAGTCTGGAATGATCTACAACAGTAGAAATTCCCTATAGT-GAGTCGTATTAATTTC-3′,68 bp)、RPA引物(forward:5′-CCTATATCACCGCCCACTATCAAGCAAGATTTGCC-3′;reverse:5′-CTATCTATGATTAGGGTCACGTCGGGGTGTTCC-3′,133 bp)、TB Green qPCR(forward:5′-TCTCGCCTCTCTGGTCTGTTTCC-3′,reverse:5′-CAGGAGGTTCTCGTGGAAGTGTTG-3′,104 bp)引物均由本实验室设计。另外合成ssDNA报告探针(5′-6-FAM/TTATT/Biotin-3′)和扩增FHV-1基因目标片段的PCR引物序列,(forward:5′-GACGTGGTGAATTATCAGC-3′,reverse:5′-CAACTAGATTTCCACCAGGA-3′,片段大小289 bp),所有引物均由生工生物工程(上海)股份有限公司合成。
1.5 crRNA 制备
使用DNA寡核苷酸退火缓冲液将crRNA-F和crRNA-R融合成双链DNA,反应体系配置与条件参照说明书进行。然后使用 HiScribe T7 RNA合成试剂盒将双链DNA于37 ℃过夜反应体外转录成crRNA,随后加入DNase I去除核苷酸模板,并用RNA纯化试剂盒进行纯化,测定浓度后,于-80 ℃保存备用。
1.6 RPA 反应
配置反应预混液体系:Primer Free Rehydration buffer 29.5 μL、Primer A(10 μmol·L)2.4 μL、Primer B(10 μmol·L)2.4 μL和无酶ddHO 12.2 μL。预混液混匀后分装至含酶干粉的反应管中,分别加入1 μL DNA质粒模板,在管盖上加入2.5 μL 280 mmol·L醋酸镁,盖管后,离心混匀,于39 ℃水浴锅中反应20 min。反应结束后,用DNA纯化试剂盒纯化RPA反应产物并进行电泳检测。
1.7 Cas12a的切割反应体系
配制酶切割的预反应体系:EnGenLbaCas12a 核酸酶(150 nmol·L)1 μL、crRNA(300 nmol·L)3 μL、10×NEBuffer 2.1 3 μL和无酶 ddHO 18 μL。将混匀的预反应液于25 ℃静置10 min后加入3 μL RPA产物(30 nmol·L)和2 μL ssDNA报告探针(0.5 μmol·L),混匀后于37 ℃孵育30 min进行切割反应。取10 μL切割产物与80 μL 配套缓冲液混匀后滴加至侧流层析试纸条,观察并记录结果。结果判读:仅清晰显示检测线(T)的为阳性结果,仅清晰显示质控线(C)的为阴性结果。
1.8 特异性试验
用所建的RPA-Cas12a-LFD方法对阳性样本中的FHV-1和其他8种猫相关病原(FCV、FAstV、FCoV、FNoV、FPV、、K.P、FM)进行检测,并记录结果。
1.9 灵敏性试验
经qPCR方法测定制作出标准曲线,并根据转换公式计算FHV-1质粒的初始拷贝数,然后对目标质粒进行梯度稀释,分别用qPCR法以及FHV-1 RPA-Cas12a-LFD方法进行检测,对比两种方法的灵敏度和符合率。
1.10 临床样本检测
对采集的20份临床样本分别用qPCR和FHV-1 RPA-Cas12a-LFD方法进行检测,对比两种方法的检出率和符合率。
2 结 果
2.1 FHV-1 RPA-Cas12a-LFD 反应体系验证
为了确认该方法的有效性,比较反应体系中组分变化对检测结果的影响。结果显示,仅完整的反应体系可以获得阳性结果(图1),确证该检测方法在预制条件下有效。
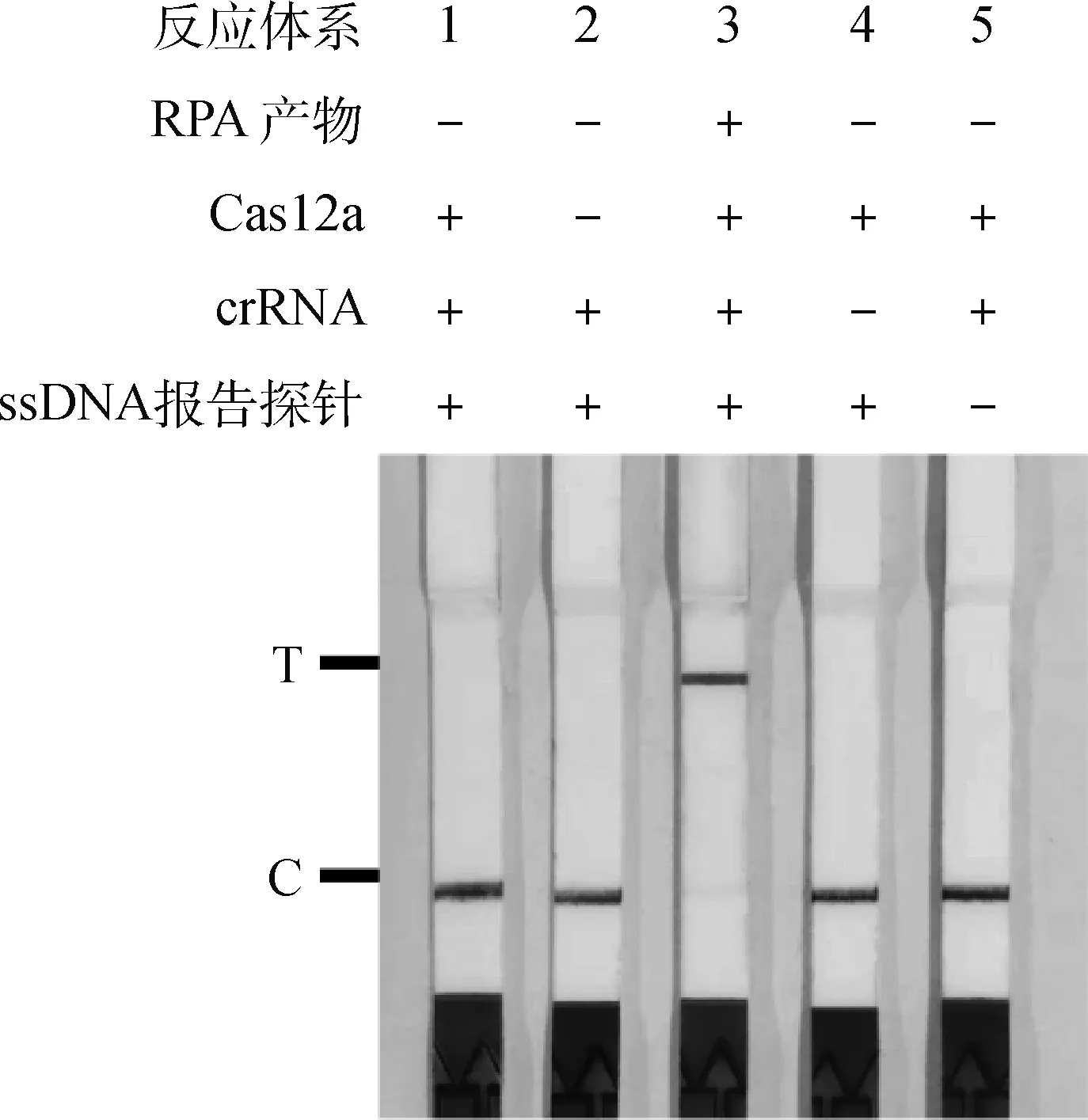
图1 FHV-1 RPA-Cas12a-LFD反应体系验证
2.2 特异性试验
对FHV-1及8种猫相关病原DNA或cDNA的RPA反应产物进行凝胶电泳分析和RPA-Cas12a-LFD检测,除FHV-1外的其他病原均未检出(图2),表明该检测方法的特异性好。
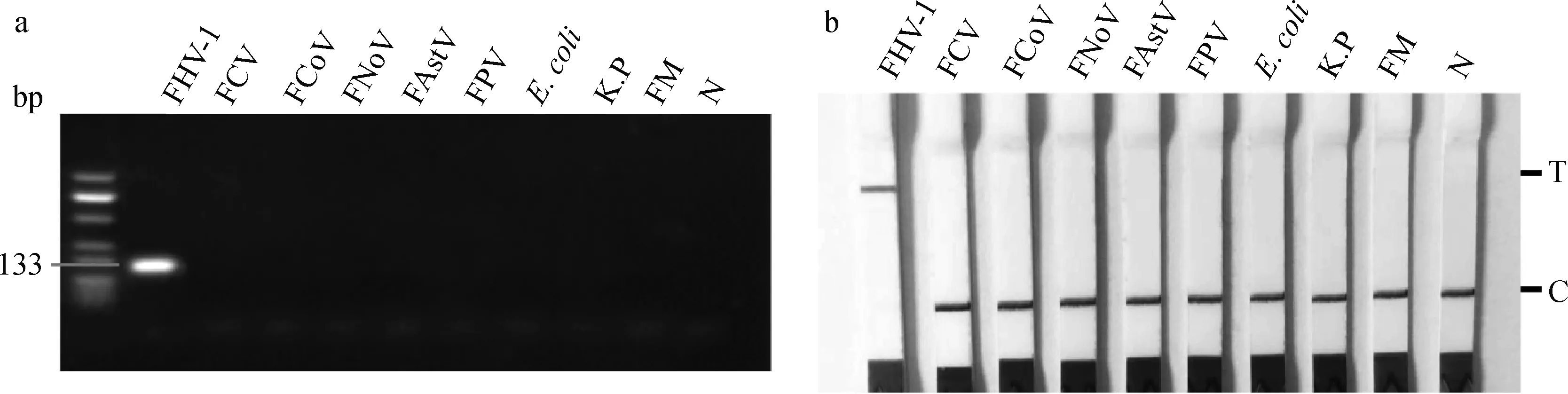
a.FHV-1和猫相关病原的RPA产物凝胶电泳分析;b.FHV-1 RPA-Cas12a-LFD检测结果
2.3 灵敏度试验
构建的FHV-1质粒浓度为74.1 ng·μL,对应的拷贝数为2.35×10copies·μL。将检测的质粒浓度从10梯度稀释至10,qPCR检测限为2.35×10copies·μL(图3a),FHV-1 RPA-Cas12a-LFD检测限为2.35×10copies·μL(图3b)。
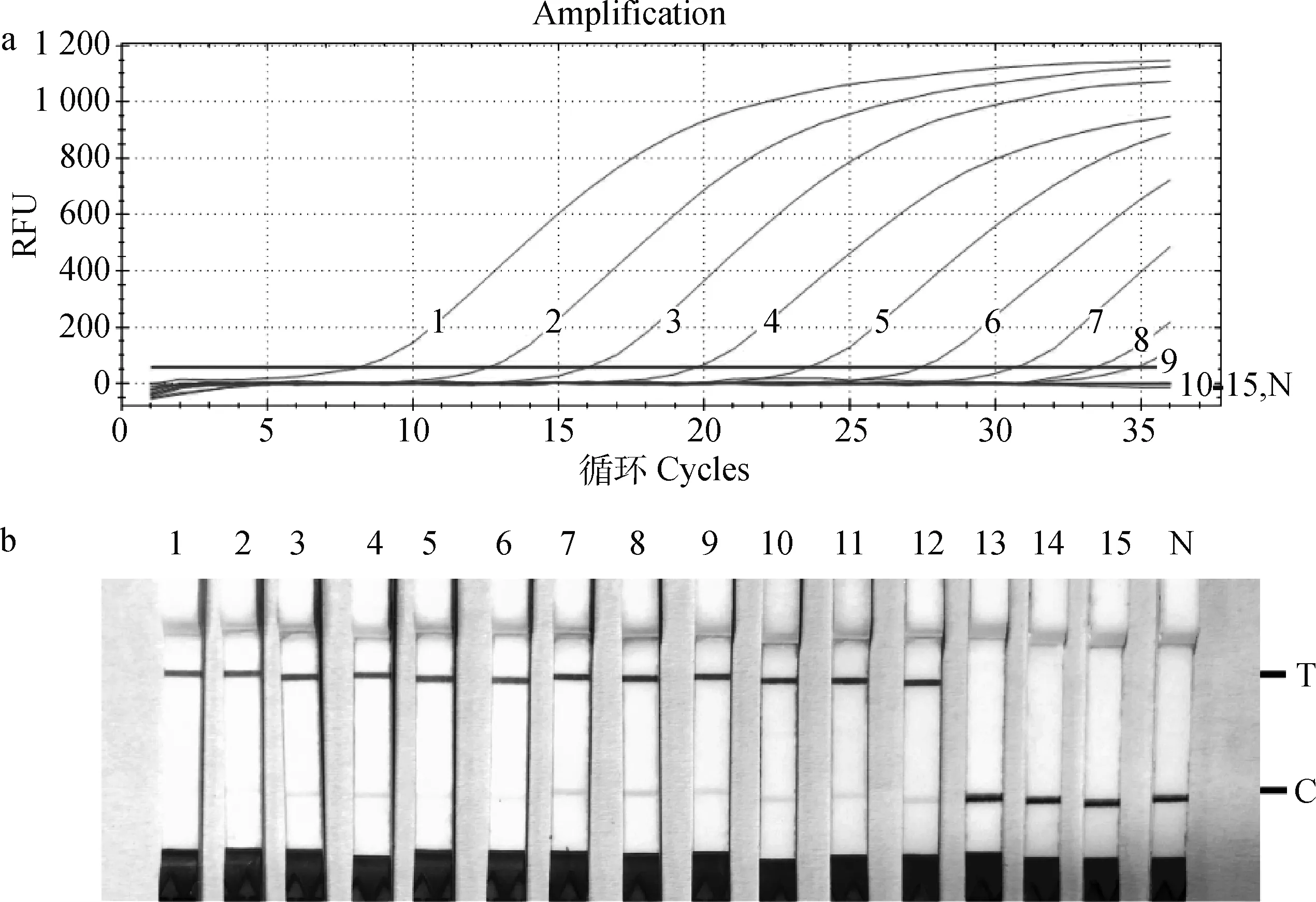
a.qPCR扩增曲线;b.FHV-1 RPA-Cas12a-LFD检测结果。N为阴性对照,1~15质粒稀释浓度为2.35×1010~2.35×10-4 copies·μL-1
2.3 临床样本检测
在20份临床样本中,qPCR方法检出5份阳性(值≤35)和2份疑似样本(值>35),检出率为25%(5/20)。FHV-1 RPA-Cas12a-LFD方法对上述5份阳性样本的检测结果与qPCR相符(符合率100%),同时对2份疑似样本的检测也得到了阳性结果,实际检出率为35%(7/20)(图4)。
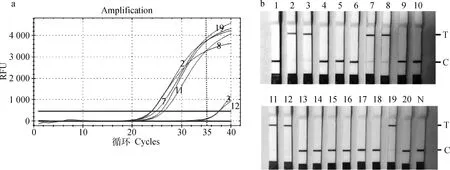
a.临床样本的qPCR检测结果,其中,3号和12号为疑似样本; b.临床样本的RPA-Cas12a-LFD检测结果,其中,3号和12号样本复核为阳性结果
3 讨 论
FHV-1在多个国家和地区的猫群中广泛流行,其引起的反复性上呼吸道症状会严重影响猫的健康和生活质量。潜伏感染期的FHV-1病毒会向周围组织(如三叉神经和睫状神经节)分布,而鼻黏膜和结膜的病原含量显著降低,可能导致黏膜拭子病原检测出现阴性结果。因此,需要寻找灵敏度更高的方法。虽然实时荧光PCR被认为是检测FHV-1的金标准,但需要在诊断性实验室和使用梯度温度循环仪来完成检测,故不适合于现场快速检测。
为了实现病原的快速检测,Liu等建立了靶向FHV-1 gD基因的RPA-LFD检测方法,其检测限为10copies·μL,高于传统PCR的检测灵敏度(10copies·μL)。而Wang等则建立了靶向FHV-1基因的exo-RPA荧光检测方法,检测限降至10copies·μL,与qPCR检测结果相当。此外,Tan等靶向FHV-1基因建立的交联引物恒温扩增(CPA)检测法,以SYBR green I作为显色染料,也同样获得10copies·μL的检测限,但需要分别在梯度热循环仪和干湿浴中完成。以上结果表明,单一基于RPA技术建立的FHV-1分子检测方法虽然提升了检测的灵敏度,但是尚未达到单拷贝的检测限。为此,本研究建立了靶向FHV-1基因的RPA-Cas12a-LFD检测法,并进一步提高了病原检测的灵敏度(2.35×10copies·μL),低于靶向FHV-1基因的TB green qPCR检测法(最低检测限为2.35×10copies·μL)和Hussein等建立的TaqMan qPCR检测法(最低检测限为2 copies·μL),而这一优势可以实现对极微量病原核酸的实时检测,提高临床样本中FHV-1的实际检出率。
与qPCR变温梯度扩增相比,RPA可在较低温度(37~43 ℃)和短时间(10~20 min)内完成基因扩增和检测信号的放大,且不需要特殊设备。另外,crRNA引导Cas12a识别特定的基因靶序列并激活其附带切割活性,也进一步提高了FHV-1检测的特异性。检测结果通过侧流层析试纸条实现了可视化,操作友好便捷,非常适合于现场快速检测,具有临床推广价值。
4 结 论
RPA-Cas12a-LFD检测法可以特异性地检测FHV-1基因,最低检测限为2.35×10copies·μL,可作为FHV-1现场快速检测的有力工具。
