纳豆大蒜酱工艺研究与分析
2022-05-26杨传慧何晓雯徐林通赵清涟侯进慧
杨传慧,何晓雯,徐林通,赵清涟,侯进慧,李 勇
(徐州工程学院食品与生物工程学院,江苏徐州 221018)
大蒜(Allium sativum) 是一种浅根性多年生草本植物,在我国栽培面积广、产量高,是主要的出口农产品之一。明朝医药学家李时珍在《本草纲目》中详细记述到,“大蒜其气熏烈,能通五脏;达窍、祛湿、消痛食此其功也”[1]。大蒜营养成分多样,有多种酶类、氨基酸、酯类和多肽,其中主要有效成分是大蒜素,这种硫化物具有抗氧化、抗肿瘤和抗感染等功效[2-4]。大蒜可以改善人体免疫机能,促进新陈代谢,消除疲劳。长期食用大蒜还有预防心脑血管疾病、糖尿病和高血压等老年性疾病的作用,大蒜是一种不可多得的绿色保健食品,有许多保健功效[5-6]。云南大理、山东金乡和江苏邳州等地是我国大蒜的主要产区,农产品加工技术应用于大蒜产业,可以带动大蒜产地经济发展,促进精准扶贫和乡村振兴[7]。
纳豆是在煮熟的大豆中加入纳豆菌,经发酵而成的一种日本传统食品,是日本发酵食品的代表之一,对于人体健康非常有益。有研究显示,日本人长寿原因和他们经常食用纳豆等发酵食品有一定的关系[8]。纳豆激酶是纳豆中特有的活性物质,是一种碱性丝氨酸蛋白酶,具有显著的溶栓活性,目前关于发酵产纳豆激酶及其生理特性研究较多[9-11]。纳豆菌是发酵纳豆食品必需的菌种。纳豆菌是一类好氧、有芽孢的革兰氏阳性杆状细菌,没有致病性,分类上属于芽孢杆菌属,枯草芽孢杆菌纳豆菌亚种[12]。其芽孢呈现椭圆形或柱状,中生或偏中生,耐热性强。纳豆菌极强的抗逆性使其在胃中失活极少,消化道中的胃酸不会对它造成影响,因此纳豆菌可以安全到达小肠,并定植在小肠内,一方面可以抑制肠道内的有害菌生长;另一方面,纳豆菌分解肠道中未被完全消化的食物,可以产生纳豆激酶(natto kinase) 等营养物。纳豆菌产生的生物活性物质很好地平衡了肠道内的生理环境,在一定程度上还能治疗肠炎和便秘等问题[13]。由此可见,纳豆菌对人体肠道的益生作用显著。
大蒜酱作为一种大蒜加工产品,增加纳豆作为原料,保留了大蒜和纳豆中各自特色的营养成分,有利于人体更好地吸收。利用大蒜和纳豆制作纳豆大蒜酱,开发蒜酱制作工艺,对蒜酱进行了检测,希望为新型大蒜酱产品开发提供基础资料。
1 材料与方法
1.1 试验材料
大蒜,江苏邳州出产的多头大蒜;纳豆,本实验室保藏菌种。
尿激酶、凝血酶、没食子酸等,上海源叶生物科技有限公司提供;纤维蛋白原,北京博奥拓达科技有限公司提供;其他分析化学试剂,国药集团化学试剂有限公司提供。
1.2 纳豆的发酵
(1) 大豆预处理。选取成熟饱满、无病虫害的大豆,反复冲洗,去除杂质。
(2) 泡豆。用干净自来水浸泡,水面没过大豆,浸泡18 h 左右(夏季),冬季可适当延长至24 h。
(3) 蒸煮。泡发好的大豆盛至干净玻璃器皿中,放蒸锅隔水蒸煮2 h。
(4) 冷却。蒸煮好的大豆取至室温冷却,自然冷却至40 ℃左右,即手摸器皿有温热感。
(5) 配菌液。将纳豆菌粉溶于无菌水,配置成纳豆菌水溶液,以大豆和纳豆菌粉质量比为50∶1适量配置。
(6) 大豆接种。配置好的纳豆菌溶液均匀喷洒在冷却完毕的大豆中,适当搅拌,使大豆和纳豆菌水溶液充分混匀。
(7) 发酵。按以上操作步骤完成后,将接种后的大豆放至纳豆机中进行发酵,设置纳豆机发酵时间为18 h。
(8) 纳豆。发酵完成即可得到纳豆产品。
1.3 纳豆大蒜酱制作
1.3.1 主要原料配方
大蒜1 kg,食用油600 g,纳豆300 g,辣椒粉40 g,花椒粉20 g,食盐40 g,白砂糖40 g,鸡精20 g,耗油15 g。
1.3.2 工艺流程
大蒜剥皮洗净→蒜瓣破碎→原辅料预备→加热炒制→密封保存。
1.3.3 操作要点
(1) 原料选择及预处理。选用无病害新鲜大蒜,剥皮洗净,碎蒜机搅碎至蒜末颗粒直径不超过0.5 cm,取上述蒜末1 kg 备用。发酵的纳豆300 g,备用。
(2) 辅料与配比。称取食盐40 g,白砂糖40 g,辣椒粉40 g,花椒粉20 g,鸡精20 g,蚝油15 g 等辅料,备用。
(3) 炒制。锅中倒入600 g 食用油,160 ℃加热30 s,取辣椒粉40 g 和花椒粉20 g 放入锅中,爆香10 s;取半份蒜末(500 g) 放锅中不断翻炒,160 ℃翻炒2 min,随后加入剩下半份蒜末(500 g),混合翻炒30 s 后,依次加入预先备好的食盐、鸡精、白砂糖160 ℃翻炒90 s,最后加入蚝油15 g 完成炒制;加入纳豆300 g 混合炒制好的大蒜酱搅拌均匀即可得纳豆大蒜酱。
(4) 保存。纳豆大蒜酱炒制完成,无菌条件下自然冷却,待纳豆大蒜酱温度降至50 ℃左右,用食品级玻璃瓶密封保存。
1.4 纳豆大蒜酱理化性质分析
1.4.1 水分的检测
参考GB/T 5009.3—2003 进行大蒜酱中水分的测定[14]。用分析天平精确称取纳豆大蒜酱样品5~10 g放入已知质量的平板中,称质量记录后,放入到70 ℃的烘箱中烘干。每隔4 h 取出称质量记录质量数据,如此反复操作,直至前后2 次称量误差不超过±0.005 0 g 时即为恒质量。做3 组平行试验,取其平均值。
计算式如下:
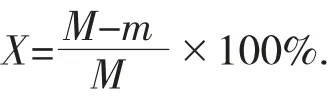
式中:X——样品水分含量,%;
M——干燥前样品质量,g;
m——干燥后样品质量,g。
1.4.2 食盐的检测
参考GB 5009.42—2016 对大蒜酱的食盐含量进行测定[15]。准确称取纳豆大蒜酱样品10 g 左右,精确至0.001 g,于研钵中磨碎,转移至250 mL 锥形瓶中并加入80 mL 蒸馏水,在水浴锅中90 ℃加热20 min 取出冷却至室温。用脱脂棉过滤后,收集滤液在100 mL 容量瓶定容至刻度,制成大蒜酱待测液。移取100 mL 大蒜酱待测液于250 mL 锥形瓶中,加入0.2 mL 铬酸钾指示剂,用浓度为0.1 mol/L 的AgNO3标准溶液滴定,在溶液出现砖红色时停止滴定,记录此时消耗的AgNO3标准溶液的体积V。试验平行做3 次,取其平均值。相同条件下做一空白对照组,记录消耗的AgNO3标准溶液体积V0。
计算式如下:
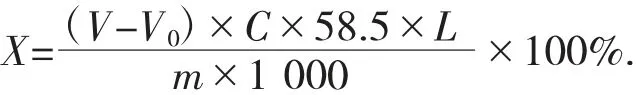
式中:X——样品中NaCl 百分含量,%;
V——样品耗用AgNO3的体积,mL;
V0——空白对照组耗用AgNO3的体积,mL;
C——使用的AgNO3标准溶液的浓度,mol/L;
58.5——与1.00 mol AgNO3相当的NaCl 的质量,g;
L——稀释倍数;
m——试验用样品质量,g;
1 000——单位换算系数。
1.4.3 总酸的检测
参考GB/T 12456—2008 进行大蒜酱总酸含量的测定[16]。准确称取纳豆大蒜酱样品10 g 左右,精确至0.001 g,于研钵中研磨碎,转移至250 mL 锥形瓶中加入80 mL 蒸馏水,在水浴锅中90 ℃加热20 min取出冷却至室温。脱脂棉过滤后,收集滤液在100 mL容量瓶定容至刻度,制成大蒜酱待测液。移取100 mL大蒜酱待测液于250 mL 锥形瓶中,加入0.5 mL 1%酚酞指示剂,用0.100 0 mol/L NaOH 标准溶液(如样品酸度较低,可用0.01 mol/L 或0.05 mol/L 氢氧化钠标准滴定溶液) 进行滴定,缓慢滴定至微红色30 s不褪色。记录消耗的NaOH 标准溶液体积(V)。试验平行做3 次,取其平均值。相同条件下做一空白对照组,记录消耗的NaOH 标准溶液体积(V0)。
计算公式如下:
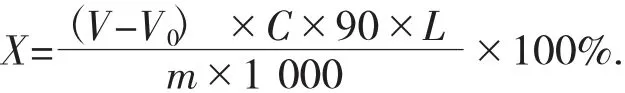
式中:X——样品中总酸的百分含量(以乳酸计),%;
V——样品消耗NaOH 标准溶液体积,mL;
V0——空白组消耗NaOH 标准溶液体积,mL;
C——滴定用NaOH 标准溶液的浓度,mol/L;
90——与1 mol NaOH 相当的乳酸的质量,g;
L——稀释倍数;
m——试验用样品质量,g;
1 000——单位换算系数。
1.4.4 总糖的检测
(1) 制备样品待测液。准确称取纳豆大蒜酱样品10 g 左右,精确至0.001 g,于研钵中磨碎,转移至250 mL 锥形瓶中加入80 mL 蒸馏水,在水浴锅中90 ℃加热20 min 取出冷却至室温。脱脂棉或滤纸过滤后,收集滤液在100 mL 容量瓶定容至刻度,制成大蒜酱待测液。
(2) 葡萄糖标准曲线的制作。取6 支干净的10 mL刻度试管,按表1 的反应体系进行操作,滴加试剂结束后用蒸馏水定容至刻度。用1 号试管作为参比进行调零,分别测定2~6 号管490 nm 的吸光度。绘制的葡萄糖标准曲线的横坐标是测试样试管中葡萄糖样品液质量浓度(μg/mL),吸光度为纵坐标。
总糖检测反应体系见表1。
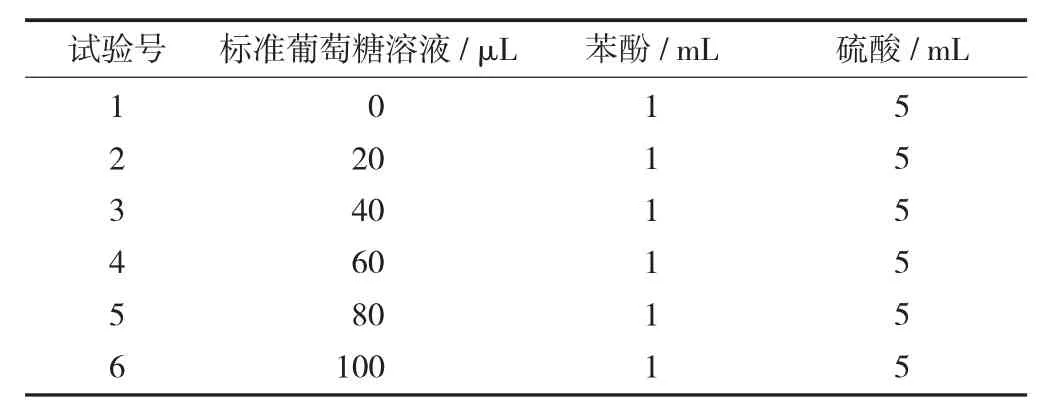
表1 总糖检测反应体系
(3) 样品总糖含量测定。10 mL 刻度试管中加入样品待测液0.5 mL,加入1 mL 80%苯酚溶液和5 mL硫酸,加水定容至刻度。按照葡萄糖标准溶液制作的条件测定吸光度。
计算式如下:
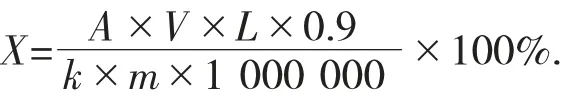
式中:X——样品中总糖百分含量,%;
V——测样液体积,10 mL;
L——稀释倍数,200;
0.9——扣除水解时消耗的水量;
k——标准曲线斜率;
m——所取样品质量,g;
1 000 000——单位换算系数。
1.4.5 多酚的检测
参考GB/T 8313—2008 对大蒜酱多酚含量进行测定[17]。
(1) 样品处理。准确称取3.0 g(精确到0.001 g)纳豆大蒜酱样品于研钵中研磨均匀转移至250 mL 烧杯中,加入70 mL 水浴锅中预热的70%甲醇溶液,用玻璃棒充分搅拌,并立即移入70 ℃水浴中浸提10 min。浸提结束冷却至室温,将其转移至50 mL 离心管中,以转速3 500 r/min 离心10 min。取上清液转移至100 mL 容量瓶,70%甲醇溶液定容至100 mL 制备成待测液。
(2) 制作没食子酸标准曲线。取10 mL 刻度试管,按表2 加入试剂后用蒸馏水定容至刻度,充分振荡混匀。25 ℃下静置60 min。
多酚检测反应体系见表2。
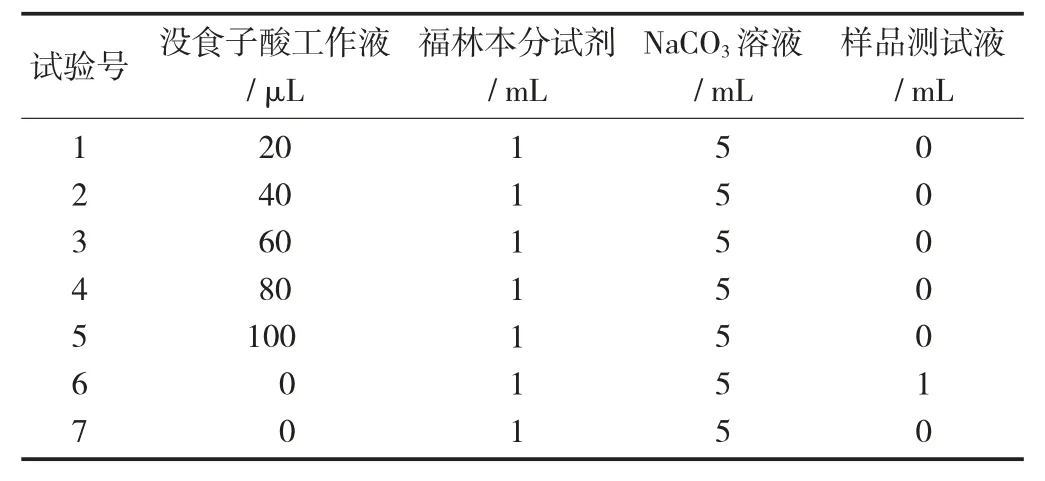
表2 多酚检测反应体系
用分光光度计测定7 支试管样液于波长760 nm条件下的吸光度。通过绘制没食子酸标准曲线来推算样品中总酚的含量。
计算公式如下:
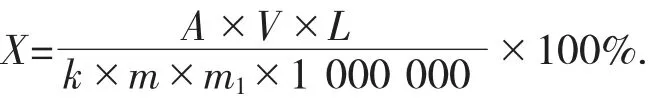
式中:X——样品中总酚的含量,%;
A——样品测试液吸光度;
V——样品提取液体积,100 mL;
L——稀释倍数;
k——没食子酸标准曲线的斜率;
m——样品质量,g;
m1——样品干物质含量,g。
1 000 000——单位换算系数。
1.4.6 纳豆激酶活性的检测
(1) 试验试剂及配制方法。①0.01 mol/L 磷酸缓冲液(PBS)。取十二水合磷酸氢二钠(Na2HPO4·12H2O) 3.58 g,加水溶解并定容至1 000 mL 为A液;取二水合磷酸二氢钠(NaH2PO4·2H2O) 0.78 g,加水溶解并定容至500 mL 为B 液;将A、B 两液混合,调节溶液pH 值为7.8。②0.9%生理盐水。称取9 g NaCl 加蒸馏水定容至1 000 mL。③工作液。磷酸缓冲液与生理盐水体积比1∶17 混合。④2%的琼脂糖溶液。天平称取琼脂糖2.0 g,加工作溶液100 mL搅拌均匀使琼脂糖充分混匀,置微波炉加热1 min 呈透明溶液。⑤纤维蛋白原溶液。分析天平精确称取纤维蛋白原,加入工作液配成质量浓度1.5 mg/mL 的纤维蛋白溶液。配制溶液时称取完时要快速加工作液搅拌溶解,否则会产生白色絮状物沉淀。⑥凝血酶溶液。称取凝血酶,加0.9%氯化钠溶液制成2 000 U/mL 的凝血酶溶液。
(2) 琼脂糖-纤维蛋白平板的制作。取配置好的纤维蛋白原溶液39 mL 置于烧杯55 ℃水浴锅中,边搅拌边加入55 ℃琼脂糖溶液39 mL、凝血酶溶液3.0 mL,三者于55 ℃条件下混合均匀,再倒入直径10 cm 干净的平板中,室温条件下静置45~60 min。平板现用现配,为防止污染[18]。待平板凝固,对平板打孔,以每个平板3 个孔为宜,打孔直径约2 mm。
(3) 尿激酶标准曲线的制作。取5 万U/g 的尿激酶标准品,用0.01 mol/L 的PBS(pH 值7.8) 将尿激酶标准品配制为20,40,60,80,100 U/mL 5 个浓度梯度,移液枪分别取10 μL 注入平板孔内,37 ℃孵育18 h,用游标卡尺测量透明圈的垂直直径,计算乘积,根据Asrtup Tage 等人[18]的报道,透明圈2 个直径乘积(A) 与尿激酶浓度(C) 存在LgA=a+bLgC的关系。以尿激酶浓度的对数为横坐标,透明圈垂直直径乘积为纵坐标,绘制标准曲线。
(4) 样品纳豆激酶活性测定。取适量纳豆大蒜酱样品于研钵中磨碎,并按质量体积比1∶10 混于0.9%生理盐水中,摇晃均匀,置于冰箱中于4 ℃下静置4 h 使纳豆激酶被充分浸提至生理盐水中。待测样品以转速5 000 r/min 离心10 min 后取上清液,得纳豆激酶提取供试液。移液枪取10 uL 样品供试液注入平板孔内,37 ℃下孵育18 h,用游标卡尺测量样品透明圈的垂直直径,计算乘积。根据标准曲线计算出纳豆激酶提取液相当于尿激酶标准液浓度,并代入公式测得纳豆大蒜酱中纳豆激酶酶活。
计算公式如下:
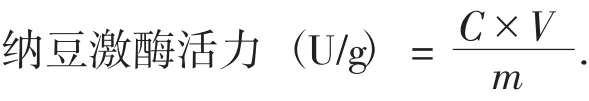
式中:C——纳豆激酶提取液相当于尿激酶标准液浓度;
V——纳豆激酶提取液体积,mL;
m——称取的样品质量,g。
1.5 微生物指标检测
参考GB 4789.3—2016 利用结晶紫中性红胆盐琼脂(VRBA) 平板计数培养基进行大肠菌群数的测定;参考GB 4789.15—2016 利用孟加拉红琼脂平板计数培养基进行霉菌和酵母菌落的测定。
2 结果与分析
2.1 水分含量检测结果
大蒜酱水分含量测定做3 组平行试验。
水分测定见表3。
由表3 可知,纳豆大蒜酱水分含量为37.64%。
2.2 食盐检测结果
大蒜酱食盐含量测定做3 组平行试验。
食盐测定见表4。

表4 食盐测定
由表4 可知,纳豆大蒜酱食盐含量为5.97%。
2.3 总酸检测结果
大蒜酱总酸含量测定做3 组平行试验.
总酸测定见表5。

表5 总酸测定
由表5 可知,纳豆大蒜酱总酸含量为1.64%。
2.4 总糖检测结果
以葡萄糖质量浓度为横坐标,以波长470 nm 下吸光度为纵坐标,绘制葡萄糖标准曲线[19]。同时,利用分光光度计测定同一参比溶液下的样品液吸光度,根据标准曲线代入公式求得样品总糖含量。
葡萄糖标准曲线见图1。
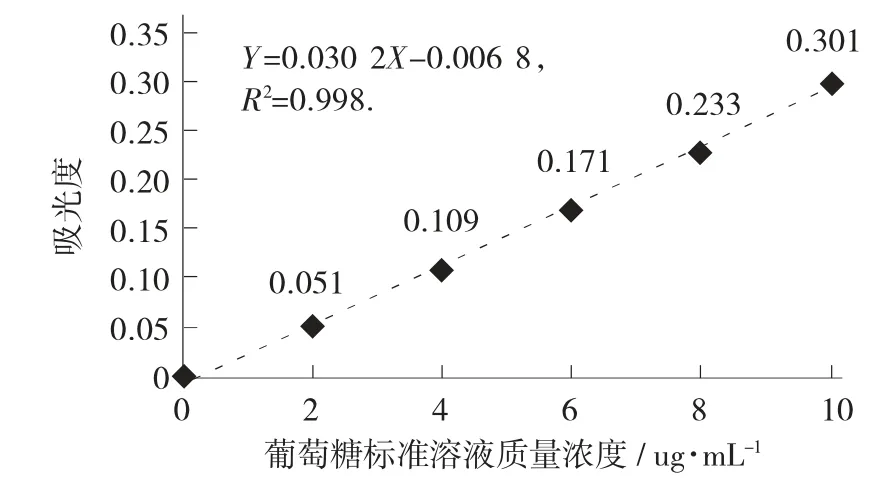
图1 葡萄糖标准曲线
由图6 得,标准曲线回归方程:Y=0.030 2X-0.006 8,R2=0.998。
称取大蒜酱样品2.99 g,配制多糖提取液100 mL,吸取提取液0.5 mL 测定吸光度,测定样品液吸光度A=2.062,根据计算公式计算出总糖含量为4.11%。
2.5 多酚检测结果
以没食子酸质量浓度为横坐标,以波长760 nm下吸光度值为纵坐标,绘制没食子酸标准曲线。同时,利用分光光度计测定同一参比溶液下的样品液吸光度,根据标准曲线代入公式求得样品多酚含量。
没食子酸标准曲线见图2。
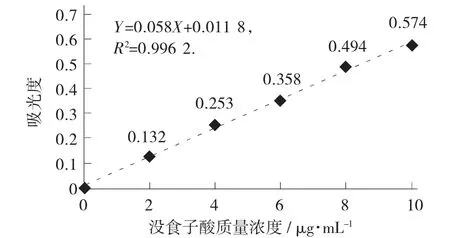
图2 没食子酸标准曲线
由图2 可得,标准曲线回归方程为Y=0.058X+0.011 8,R2=0.996 2。
试验中,称取大蒜酱样品2.99 g,配制多酚提取液100 mL,吸取样品0.8 mL 待测,测定样品液吸光度A=0.502,根据计算公式计算出多酚含量为0.58%。
2.6 纳豆激酶检测结果
纳豆大蒜酱的纳豆激酶提取液在琼脂糖-纤维蛋白平板上产生的透明圈。结果显示,纳豆激酶活性明显。
纳豆激酶提取液产生的透明圈见图3。
图3 纳豆激酶提取液产生的透明圈
以尿激酶标准溶液浓度的对数为横坐标,水解圈垂直直径乘积的对数为纵坐标,绘制尿激酶标准曲线。标准曲线回归方程为Y=0.327X+1.822 5,R2=0.992 4。
尿激酶标准曲线见图4。
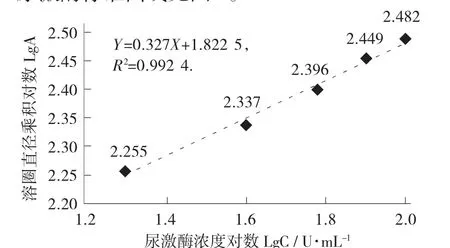
图4 尿激酶标准曲线
样品提取液溶圈直径乘积对数代入回归方程去对数后得相当于尿激酶浓度为54.83 U/mL。纳豆大蒜酱样品3.120 6 g,制得30mL 纳豆激酶提取液。代入公式求得,纳豆大蒜酱中纳豆激酶酶活为527.11 U/g(相当于尿激酶活力单位)。
2.7 微生物指标检测结果
VRBA 培养基计数平板(10-5) 见图5,孟加拉红培养基计数平板(10-5) 见图6。

图5 VRBA 培养基计数平板(10-5)

图6 孟加拉红培养基计数平板(10-5)
VRBA 培养基计数平板显示(图5),平板中没有大肠杆菌菌落出现,大蒜酱中不含大肠杆菌。孟加拉红培养基计数平板显示(图6),平板中没有霉菌或酵母菌菌落出现,大蒜酱中不含霉菌及酵母。试验结果显示,大肠杆菌、霉菌等有害菌在培养基上没有菌落存在,说明经过炒制的纳豆大蒜酱将绝大部分的致病菌杀死,并且高油脂和盐分造就的高渗透压环境也在一定程度上抑制菌的生长,通过严格的密封保存杜绝了再次染菌的可能。
2.8 感官标准
纳豆大蒜酱样品及产品包装见图7,纳豆大蒜酱感官指标见表6。

图7 纳豆大蒜酱

表6 纳豆大蒜酱感官标准
3 结论
大蒜和纳豆都有着各自不同的生理活性物质,将2 个进行融合开发新型大蒜酱,可以发挥出两者的各自优势。研究对纳豆大蒜酱进行了分析,根据感官鉴评试验,以100 g 大蒜为基准,食盐用量4 g,白砂糖用量4 g,辣椒用量4 g,食用油用量60 g 炒制大蒜酱。优化的加工工艺为炒制温度160 ℃,炒制时间5 min。对纳豆大蒜酱进行理化性质的测定,水分含量为37.64%,多糖含量为4.11%,总酸含量(乳酸计) 为1.64%,食盐含量为5.97%,多酚含量为0.58%,测得纳豆大蒜酱中纳豆激酶活性为527.11 U/g。微生物测定结果符合国标安全标准。
