适用于微创消融治疗研究的小鼠胰腺癌原位模型建立方法及比较
2022-05-24毛璐婧张娜娜史爱华朱子语
毛璐婧, 张娜娜, 刘 昊, 史爱华, 朱子语, 吕 毅,5
(1.西安交通大学第一附属医院Med-X研究院再生与重建医学研究所,西安 712000; 2.西安交通大学第一附属医院精准外科与再生医学国家地方联合工程研究中心,西安 710061; 3.西安交通大学第一附属医院陕西省再生医学与外科工程研究中心,西安 710061; 4.西安交通大学医学部,西安 710061; 5.西安交通大学第一附属医院肝胆外科,西安 710061)
胰腺癌因恶性程度高,患者生存期短,被称为“癌症之王”。全球最新癌症数据统计分析显示,胰腺癌发病率占恶性肿瘤的2.6%,而死亡率高达4.7%[1],且绝大部分患者在诊断为胰腺癌后半年内死亡,5年生存率约为10%[2]。胰腺癌因具有高度纤维化的肿瘤间质,放化疗、分子靶向药物和免疫疗法均对其治疗效果欠佳[3]。近年来,随着CT、超声等影像技术的进步,局部选择性破坏肿瘤组织的物理消融疗法为胰腺癌患者带来了良好的治疗前景[4]。研究表明,微创消融疗法可显著延长进展期胰腺癌患者的总生存期[5]。而各种物理消融方法在用于胰腺癌治疗的过程中仍存有一些问题,如热消融引起的热沉效应,消融效果不彻底,以及如何联合其他治疗方案等,均需要进一步的实验探究。
建立小鼠胰腺癌移植瘤模型是胰腺癌研究的重要基础。目前主要的造模方法有皮下移植瘤模型及原位移植瘤模型等。皮下移植瘤生长时易被纤维包绕,肿瘤血管生成易受干扰,不能很好地模拟人胰腺癌真实情况,有一定的局限性[6]。而原位胰腺癌模型是胰腺癌研究中较为理想的一种,为探究胰腺癌原位消融治疗方案等提供了合理的动物模型。因物理消融是肿瘤局部消融,对原位胰腺癌模型的要求较高,如肿瘤模型同质性差(肿瘤体积差异大)、腹腔脏器粘连严重、腹腔转移等均会影响肿瘤消融效果。目前,关于小鼠原位胰腺癌模型建立的研究报告较少。因此,如何高效准确地建立具有较高同质性的小鼠原位胰腺癌模型对于探究胰腺癌治疗方案具有重要意义。本研究对比分析了应用肿瘤细胞原位注射法以及肿瘤组织块移植法建立小鼠原位胰腺癌模型的优缺点,并总结建模过程中遇到的相关问题和解决方案,以期为小鼠胰腺癌原位模型的建立提供技术参考。
1 材料与方法
1.1 细胞及其培养
小鼠胰腺癌细胞系Panc02 购自河北北纳生物科技有限公司,用含10%胎牛血清、100 μg/mL青链霉素的DMEM培养液,置于37 ℃含5%CO2的细胞培养箱中培养,每2 d换液1次。细胞单层贴壁生长,约80%融合时使用胰蛋白酶消化传代。
1.2 实验试剂及其配制
DMEM 高糖培养液、胎牛血清购自以色列Biological Industries 公司;体积分数为0.25%的胰蛋白酶、青链霉素购自上海碧云天生物技术有限公司;Matrigel 基质胶购自美国BD 公司;兔抗Ki67 一抗购自武汉爱博泰克生物科技有限公司;鼠抗α 平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)一抗购自武汉博士德生物工程有限公司;辣根过氧化物酶标记的羊抗鼠和羊抗兔二抗购自北京兰杰柯科技有限公司(Biosharp 品牌)。DAB 显色试剂盒(20×) 和改良Harris苏木精染色液购自北京索莱宝科技有限公司。
水凝胶为本实验室制备的双网络强韧水凝胶,由丙烯酰胺单体(3.6 g)、海藻酸钠(0.6 g)和去离子水(30 g)按照原料配比6∶1∶50制备所得。壳聚糖溶液的制备:首先将0.976 g 吗啉乙磺酸加入50 g 去离子水中,并通过逐滴加入质量比为1∶10的NaOH溶液调节pH值约为4.5,然后加入1 g壳聚糖并搅拌至完全溶解。粘接肿瘤组织前,将12 g/L 1-乙基-3-(3-二甲基氨丙基)-碳化二亚胺(EDC)和12 g/L的N-羟基硫代琥珀酰亚胺(Sulfo-NHS)加入之前配制好的壳聚糖溶液中,作为胶水用来粘接肿瘤组织与水凝胶。待粘接组织和强韧水凝胶中的羧基与壳聚糖链中带正电的氨基反应生成酰胺键,同时分子链之间还存在着氢键和静电相互作用,从而形成牢固粘接。该水凝胶已被证实具有良好的生物安全性,在起到物理粘接作用的同时还可以减轻炎性反应[7]。壳聚糖则能有效防止肿瘤组织与周围组织粘连的发生,促进创面的修复与愈合[8]。
1.3 实验动物
SPF 级C57BL/6 小鼠20 只,雄性,6~8 周龄,体质量为(20±3)g,由西安交通大学医学部实验动物中心[SCXK(陕)2018-001]提供,质量合格证号为1439。实验小鼠在西安交通大学医学部实验动物中心[SYXK(陕)2020-005]屏障环境中饲养管理,环境温度维持在(25±2)℃,相对湿度控制在50%~80%,光照时间12 h,动物可自由进食、饮水。动物饲养、管理和实验操作严格按照国家和学校有关实验动物管理方面的规定进行,实验方案经西安交通大学动物伦理委员会批准[2018伦审科字第G-196号]。
1.4 小鼠原位胰腺癌模型建立
1.4.1 细胞悬液直接注射法
该方法定义为实验A组,随机取5只小鼠。将培养好的小鼠胰腺癌Panc02细胞系消化并吹打,制备成单细胞悬液,PBS 洗涤1 次,生理盐水(即0.9%NaCl 溶液)洗涤2 次,细胞计数板计数,生理盐水稀释细胞至1×107/100 μL。用异氟烷麻醉小鼠后,在小鼠左侧肋下部位用脱毛膏脱毛,消毒腹部备皮,逐层打开小鼠腹腔,首先寻找脾脏位置,在胃与脾脏之间连接紧密的类似脂肪组织的部分即为小鼠胰腺。用无菌胰岛素注射器将制备好的细胞悬液20 μL/只(2×106个/只)接种于小鼠胰腺原位,棉签轻按注射部位约30 s 后,将小鼠腹部器官归位,逐层缝合腹部。每隔2 d观察小鼠肿瘤生长情况,记录小鼠体质量。
1.4.2 含基质胶的细胞悬液注射法
该方法定义为实验B组,随机取5只小鼠。采用含50%Matrigel基质胶的生理盐水混悬小鼠胰腺癌Panc02细胞,采用与1.4.1节中同样的方法进行接种及观察。
1.4.3 肿瘤组织块移植法
该方法定义为实验C组,随机取5只小鼠。根据预实验的结果可知,按1.4.1节肿瘤细胞悬液直接注射到小鼠胰腺原位后第10天时,即可在小鼠左上腹部(即胰腺在体表的投影部位)触及质硬的包块;于第14天时开腹剥离肿瘤的长径约5~7 mm,第21 天时肿瘤长径约7~10 mm,此时肿瘤组织活力好,内部无坏死,因此取接种后第21天的肿瘤组织作为肿瘤组织块移植建立胰腺癌模型的“瘤组织源”。将采用细胞悬液直接注射法形成的任意一只荷瘤小鼠脱颈处死,浸泡在75%乙醇溶液中约20 min,逐层打开小鼠腹腔将小鼠胰腺及肿瘤组织均取出,将肿瘤组织剥离,用组织剪剪成1 mm3的肿瘤组织块,无菌PBS冲洗2次,放在DMEM 培养液中待用。异氟烷麻醉新的待接种小鼠后取右卧位,用组织剪在小鼠左侧肋下做一切口,找到脾脏后顺着脾门找到胰腺,将胰腺充分暴露并摊平,使用7-0 可吸收缝线将1 mm3肿瘤小块缝入胰腺组织上,将小鼠腹部器官归位,逐层缝合腹部。每隔2 d观察小鼠肿瘤生长情况,记录小鼠体质量。
1.4.4 肿瘤组织块水凝胶粘接法
该方法定义为实验D 组,随机取5 只小鼠。同1.4.3 节方法,用手术剪将由细胞悬液直接注射法获得的小鼠肿瘤组织剪成1 mm3的肿瘤组织块待用。接种时,剪开胰腺包膜约1 mm,将水凝胶浸入壳聚糖溶液中,将肿瘤组织块置于水凝胶上,将负载肿瘤组织块的水凝胶粘附于胰腺组织上,按压约60 s。将小鼠腹部器官归位,逐层缝合腹部。每隔2 d观察小鼠肿瘤生长情况,记录小鼠体质量。
1.5 观察指标及方法
1.5.1 手术时长及术后小鼠一般情况
计算从开腹手术开始计时至完全完成关腹的时间,即手术时长。然后在建模后前2 d,每天观察小鼠的饮水、进食及活动情况;之后每2 d观察一次,并称量小鼠体质量。
1.5.2 肿瘤生长和大小测定
于接种后肿瘤生长16 d 时,脱颈处死小鼠,观察成瘤情况。从各组小鼠胰腺组织中均可找到肉眼可辨认的肿瘤组织,其质韧,呈灰白色,凸出于胰腺组织生长。统计各组小鼠的成瘤率。然后剥离移植瘤,用游标卡尺测量并记录肿瘤最长径(a)和最短径(b)。肿瘤大小以肿瘤体积(V/mm3)表示,按公式V=a×b2/2计算。
1.5.3 腹腔脏器粘连程度的分级判定
在文献[9]的基础上改进,设立等级分级法。0级:完全无粘连。Ⅰ级:胰腺肿瘤组织与内脏组织有点状或膜状粘连,或肿瘤组织与腹壁或内脏之间有一条粘连带,分离钳容易分离且无出血。Ⅱ级:胰腺肿瘤组织与内脏或腹壁间有两条粘连带,可分离且出血少,内脏器官无损伤。Ⅲ级:胰腺肿瘤组织与内脏或腹壁间有多于两条的粘连带,分离困难且出血多,内脏器官外膜及包膜层可出现损伤。Ⅳ级:胰腺肿瘤组织与其他内脏器官纠集成团,与腹壁粘连紧密,分离很困难,强行分离可致内脏器官撕裂。0~Ⅱ级为轻度粘连;Ⅱ~Ⅳ级为重度粘连。
1.5.4 肿瘤转移情况判断
将各组小鼠中除胰腺外的其他脏器(肝、肠、胃、肾与脾)均分离取出,仔细观察有无转移灶的形成。
1.5.5 HE染色法观察肿瘤组织形态学变化
将取出的肿瘤组织经脱水、包埋、切片后进行HE染色,然后光学显微镜下观察肿瘤组织病理学形态特点。具体染色方法参见改良Harris 苏木精染色液说明书,显微镜观察的放大倍数为400倍。
1.5.6 免疫组织化学法检测Ki67和α-SMA表达
将取出的肿瘤组织经常规脱水、包埋、切片后,采用免疫组织化学法检测Ki67表达水平,以此评估肿瘤细胞的增殖情况;检测α-SMA表达水平,以此了解肿瘤间质中肿瘤相关成纤维细胞所占比例。具体按照免疫组化SP 三步法[10]进行检测;一抗的工作液体积稀释比例为1∶150,4 ℃孵育过夜;二抗的工作液体积稀释比例为1∶150,37 ℃孵育30 min;DAB显色15 min。选择10 个高倍视野进行半定量结果判定。细胞不着色记0分,染淡黄色记1分,棕黄色记2分,棕褐色记3 分。采用Image J 软件评估着色细胞百分率,并据此判定蛋白表达结果:≤5%为阴性,记0分;5%~25%为弱阳性,记1 分;26%~50%为中等阳性,记2 分;51%~75%为阳性,记3 分;≥75%为强阳性,记4分。
1.6 统计学分析
采用SPSS 22.0 软件对所有实验数据进行统计分析。计量结果用-x±s显示,计数结果用n(%)表示。率的比较采用卡方检验。多组间均数比较采用方差分析,组内两两比较采用LSD-t检验。以P<0.05(双侧检验)认为差异具有统计学意义。
2 结果
2.1 原位胰腺癌模型小鼠的手术时长和一般情况
4种手术方法的手术时长记录为表1,其中肿瘤组织块水凝胶粘接法的手术时间最短(P=0.009)。在建模手术后第2 天直至第16 天,4 组20 只小鼠均可正常饮水、进食,活动力良好,而且各组小鼠的体质量呈现逐渐增加的趋势(图1A)。
2.2 小鼠成瘤率、肿瘤大小
用细胞悬液直接注射(A 组)或含基质胶的细胞悬液注射(B 组)后小鼠原位胰腺癌成瘤率分别为60%与80%,而用肿瘤组织块移植(C组)及肿瘤组织块水凝胶粘接移植(D 组)后小鼠原位胰腺癌成瘤率均为100%(表1)。各组小鼠的剥离肿瘤见图1B,可见A 组小鼠肿瘤体积大小不一,均质性差;B、C 与D组小鼠肿瘤体积大小接近,均质性较好。另外,A、B组小鼠肿瘤组织因与周围组织粘连严重,肿瘤组织表面粗糙;C、D组肿瘤组织表面较光滑。而且D组的肿瘤组织体积较大(P=0.001),剖开肿瘤切面,可见水凝胶未完全降解(图1C)。4 组小鼠的肿瘤平均体积见表1。

表1 4组小鼠胰腺原位癌成瘤率比较Table 1 Comparison of tumor formation rate of pancreatic carcinoma in situ among the four groups of mice

图1 各组胰腺癌原位模型小鼠的生长情况及剥离肿瘤情况Figure 1 Growth and tumor dissection of pancreatic cancer orthotopic model mice in each group
2.3 小鼠腹腔脏器粘连程度和肿瘤转移情况
各组小鼠腹腔粘连程度统计见表2。A组小鼠腹腔重度粘连率为100%,B组小鼠腹腔重度粘连率为80%,C 组与D 组均未出现重度腹腔粘连。各组小鼠肿瘤腹腔转移情况见表3。A 组小鼠转移率最高为100%,其中2例为肠系膜转移(图1D),2例为肝转移(图1E),1例为胃转移;B组小鼠转移率为60%,2例为肝转移,1例为肠系膜转移;C、D组小鼠未发现转移瘤。

表2 各组小鼠肿瘤腹腔粘连等级比较Table 2 Comparison of abdominal adhesion grade among the four groups[n(%)]
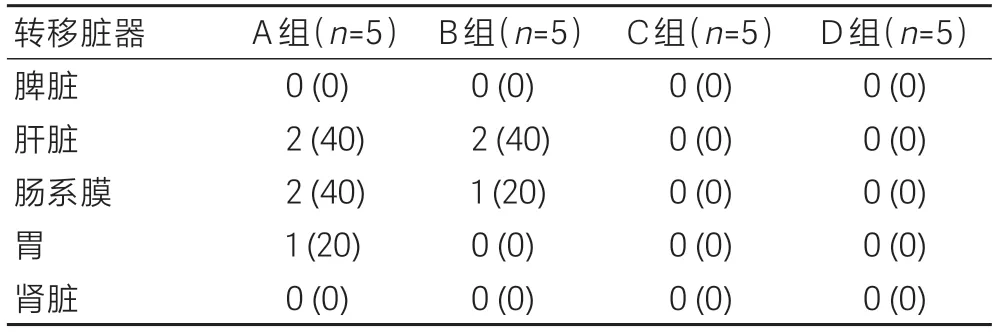
表3 各组小鼠腹腔转移情况比较Table 3 Comparison of intraperitoneal metastasis among the four groups[n(%)]
2.4 肿瘤组织形态学特点
HE 染色(图2A)显示4 组小鼠原位胰腺癌的病理组织形态学特点,发现移植瘤在组织学上无显著差异。肿瘤细胞均呈现低分化,细胞核不规则且缺乏极性,核仁多呈分叶状,肿瘤细胞对周围正常胰腺组织有显著的侵袭性,肿瘤间质具有大量肿瘤相关成纤维细胞。
免疫组织化学染色(图2A)显示,Ki67与α-SMA在4 组小鼠肿瘤组织中均呈现阳性表达,提示胰腺癌细胞增殖活跃、肿瘤间质高度纤维化、侵袭性强等生物学特点。图2B统计显示Ki67和α-SMA在4组小鼠肿瘤组织中的相对表达水平无明显差异(PKi67=0.619,Pα-SMA=0.946),表明上述4种原位胰腺癌建模法所形成的肿瘤组织均具有胰腺癌生物学特性。
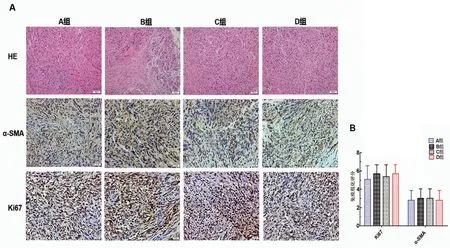
图2 HE染色法和免疫组织化学法(DAB染色)分别检测各组小鼠原位胰腺癌形态组织特点及Ki67和α-SMA表达情况Figure 2 Tumor histomorphology and the expressions of Ki67 and α-SMA proteins were detected by HE staining and immunohistochemistry,resp(DAB staining)
此外,C与D组肿瘤组织中可吸收缝合线及水凝胶均未被完全降解,在水凝胶局部有轻度的炎性反应。
3 讨论
局部物理消融对胰腺癌的治疗具有很好的应用前景,但由于消融后肿瘤复发率偏高,限制了其在临床肿瘤治疗领域的广泛应用[11-12]。肿瘤原位消融对胰腺癌模型的要求较高,因其为局部消融,肿瘤应具有良好的均质性;此外,模型建立过程中所致的种植性转移可显著影响预后。小鼠原位胰腺癌模型能够为探究胰腺癌消融治疗效果以及其他治疗方案提供很好的研究基础。Tan 等[13]首先将人胰腺癌细胞株AsPC-1 注射于裸鼠胰腺十二指肠叶,以此建立胰腺癌细胞悬液的裸鼠原位种植模型。Liu等[14]将人胰腺癌手术标本剪为成小瘤块,直接种植于BALB/c-nu/nu 裸小鼠的胰腺被膜下。Huynh等[15]利用超声将胰腺癌细胞注入主胰管建立模型,避免了种植性转移。Tsuji 等[16]利用荧光蛋白标记胰腺癌细胞并注入小鼠胆总管,成功建立肿瘤模型。前两种方法是目前建立小鼠胰腺癌原位模型的主要方法,但存在诸多缺陷,如前者易造成人为的种植性转移,后者则操作复杂、对胰腺损伤较大。
据此,本研究分别探究了肿瘤细胞原位注射法和肿瘤组织块移植法建立小鼠原位胰腺癌模型的优缺点,并分析了各种方法在建立过程中遇到的相关问题,提出了解决方案。肿瘤细胞原位注射法建立模型快速,操作简单,但由于胰腺包膜极薄,单纯的细胞悬液在注射及回纳脏器的过程中,细胞悬液容易渗出而影响建模效果,导致小鼠胰腺癌成瘤率低且易发生转移。值得注意的是,此处的腹腔转移并非传统意义上的肿瘤转移,而是由于肿瘤细胞悬液直接注射法易致细胞外渗引起的种植性转移。因此,在A 组小鼠模型中,腹腔转移率可高达100%,而成瘤率仅为60%;此外,肿瘤大小不均,肿瘤组织与周围组织粘连严重。高发的腹腔转移严重影响荷瘤小鼠的生存预后。肿瘤大小不均导致胰腺癌消融治疗效果存在显著差异。肿瘤组织与周围组织粘连严重,导致消融损伤正常组织,引起荷瘤小鼠的预后差异,影响胰腺癌消融治疗效果的可靠性。总之,低成瘤率和高发的腹腔转移主要是因为胰腺组织包膜极薄,且周围有许多实质性器官和血管,关腹时发生的挤压导致Panc02细胞混悬液流入腹腔,容易形成种植性的播散转移。
本研究对单纯细胞悬液注射方法进行了改进,即把基质胶加入Panc02 细胞混悬液后注射入小鼠胰腺,建立原位胰腺癌模型。采用此方法后,胰腺癌成瘤率提升至80%,转移率减少至60%,形成的肿瘤均质性较好,但仍与周围组织粘连严重,重度粘连率高达80%。由于胰腺位置深、周围有许多重要器官和大血管等解剖特点,手术后易发生腹腔内组织器官粘连。而常见的热消融、非热消融(纳米刀)在局部肿瘤消融过程中释放热辐射以及高压脉冲电场,均会对正常组织器官造成严重损伤,因此在实验过程中,常需将负荷肿瘤组织的胰腺分离迁出腹腔进行消融治疗。所以,以探究肿瘤原位消融疗效为目的建立原位胰腺癌模型时,避免腹腔内组织器官粘连就显得极为重要。
肿瘤组织块移植法是先建立小鼠胰腺癌原位移植瘤,小鼠成瘤后剥离出肿瘤组织,剪成1 mm3大小的组织块,然后缝合于胰尾被膜上。本研究中,采用此方法的成瘤率高,且短时间内无转移,肿瘤均质性良好,粘连较轻,但仍存在一定程度的粘连,II 级粘连可达60%。整体而言,肿瘤组织块移植法是建立小鼠胰腺癌原位模型较好的方案。
生物水凝胶材料是近年来极具潜力的医用生物材料,被广泛应用于生物医学领域[17-18]。本研究采用强韧的聚丙烯酰胺-海藻酸钙双网络水凝胶将肿瘤组织粘接于胰腺上,此方法不需缝合,手术时间短,腹腔暴露时间短,且壳聚糖具有一定的防粘连作用,腹腔粘连显著减轻。因此,这种建模方法具有成瘤率高、粘连少、无转移及肿瘤大小均一的优点,是建立原位胰腺癌模型较理想的方案。但是本研究中水凝胶在16 d内不能完全降解,导致肿瘤组织局部发生慢性炎性反应。因此,在开展肿瘤微环境的相关研究时应慎用该方法,或需严格做好对照。未来研发具有降解速度快、防粘连、可减轻炎性反应的新型生物水凝胶材料有望为高效建立原位胰腺癌模型提供有效辅助。
综上所述,肿瘤细胞悬液直接注射法、含基质胶的肿瘤细胞悬液注射法、肿瘤组织块移植法和肿瘤组织块水凝胶粘接法建立的小鼠原位胰腺癌在病理组织学上均无显著差异,肿瘤细胞具有相似的生物学行为,且符合人类胰腺癌的生物学特性。其中肿瘤组织块移植法及水凝胶粘接法所形成的移植瘤并未改变肿瘤细胞的生物学特性,且其成瘤率高,转移少,粘连程度轻,易于操作和普及,为探究胰腺癌物理消融效果提供了较理想的建模方案,也可广泛应用于胰腺癌其他治疗方案的相关研究。
