安石榴苷改善小鼠细菌性肠炎及调节肠道菌群的实验研究
2022-05-24黄淑芸洪宗元钟树志
黄淑芸,许 萍,洪宗元,钟树志
安石榴苷改善小鼠细菌性肠炎及调节肠道菌群的实验研究
黄淑芸,许 萍,洪宗元,钟树志*
皖南医学院组织胚胎学教研室,安徽 芜湖 241002
研究安石榴苷对细菌性肠炎的改善作用及对肠道菌群的影响。45只BALB/c小鼠采用致病性大肠杆菌O101建立细菌性肠炎模型,给予安石榴苷或头孢克肟干预7 d,给药过程中观察各组小鼠的体征并计算每天的疾病活动指数(disease activity index,DAI)与体质量变化率;给药结束后取肠组织及肠道内容物,苏木素-伊红(HE)染色法观察小鼠肠组织的病理改变;免疫组化法检测小鼠小肠组织黏膜中闭锁连接蛋白-1(zonula occludens-1,ZO-1)和紧密连接蛋白(Occludin)的表达;测定小鼠肠组织髓过氧化物酶(myeloperoxidase,MPO)活性;qRT-PCR法检测小鼠肠壁炎症相关因子核苷酸结合寡聚化结构域蛋白2(nucleotide binding oligomerization domain 2,)、核因子-κB p65(nuclear factor-κB p65,)、肿瘤坏死因子-α(tumor necrosis factor-α,)和白细胞介素-6(interleukin-6,)mRNA的表达;ELISA法检测小鼠血清中脂多糖(lipopolysaccharide,LPS)、TNF-α和IL-6水平;16S rDNA高通量测序法检测小鼠肠道菌群多样性和丰度。与模型组比较,安石榴苷组小鼠DAI评分显著降低(<0.01);小肠黏膜充血、水肿明显减轻;小肠上皮中ZO-1和Occludin蛋白表达显著增多(<0.01);肠壁MPO活性显著降低(<0.01);肠壁、、和mRNA表达水平显著降低(<0.01);血清LPS、TNF-α和IL-6水平显著减少(<0.01);肠道厚壁菌门(Firmicutes)、毛螺菌科(Lachnospiraceae)和Clostridiales-unclassified相对丰度显著升高(<0.01),变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、Muribaculaceae和脱硫弧菌科(Desulfovibrionaceae)菌群相对丰度显著降低(<0.05、0.01)。安石榴苷能够改善致病性大肠杆菌O101诱导的肠炎,减轻小鼠肠壁的炎症反应,保护肠黏膜屏障,其机制可能与调节肠道菌群有关。
安石榴苷;细菌性肠炎;肠道菌群;肠黏膜屏障;炎症反应
细菌性肠炎是消化系统常见病,是由金黄色葡萄球菌、大肠杆菌等细菌感染引起的急性肠道炎症,主要表现为呕吐、发热、腹痛腹泻等症状,该病在各类人群中均会发生,但在小儿中发病率最高。久治不愈可导致小儿营养成分失衡,严重可威胁到患儿生命健康[1-3]。临床上多以抗菌治疗为主,抗生素常用于治疗由病原感染引起的腹泻,然而由于耐药菌株的出现,常需更换敏感的抗生素,由此会引起肠道菌群的失调从而导致腹泻加重[4-5]。因此,开发和寻找抗腹泻的新药成为必然。
中药是我国传统医学的瑰宝,有些中药具有毒性小、抗腹泻效果较好的特点,对于肠炎腹泻类疾病的治疗,我国古籍典藏也多有记载[6-7]。石榴,亦名安石榴。《本草纲目》记载:“石榴皮,涩肠止痢之药也。能治久痢虚滑不禁,并妇人血崩,带下诸疾,又安蛔虫”,在临床上主要用于胃脘寒痛、消化不良[8-9]。安石榴苷作为石榴皮中最主要的活性成分,具有抗菌、抗炎、抗氧化等多种活性[10-11],临床研究表明,安石榴苷可通过调节肠道菌群,降低肠道癌症、腹泻和胃部疾病发生率[12]。研究表明,安石榴苷能够显著影响金黄色葡萄球菌的细胞壁完整性及细胞膜通透性,且对菌体蛋白具有一定抑制作用[13];安石榴苷在C57BL/6小鼠烟曲霉菌性角膜炎中可以降低真菌数量,抑制巨噬细胞的数量和分泌炎症因子的功能,从而降低真菌性角膜炎的炎症评分以及抑制炎症相关因子的表达[14]。这些研究证实,安石榴苷对致病菌具有选择性毒性,从而调节微生物失衡。然而,安石榴苷能否通过对致病菌的选择毒性调节肠道菌群,从而减轻细菌性肠炎尚未见文献报道。本研究对致病性大肠杆菌诱导肠炎小鼠予以安石榴苷治疗,探究安石榴苷对细菌性肠炎的作用以及对肠道菌群的影响,为阐明中药治疗肠炎的作用机制提供初步的实验依据,并且为肠炎的中药开发打开新的思路。
1 材料
1.1 动物
SPF级BALB/c小鼠60只,雌雄各半,8周龄,体质量(22±3)g,由南京青龙山动物养殖基地提供,动物许可证号SCXK(苏)2021-0001。动物常规饲养于皖南医学院实验动物中心,相对湿度40%~70%,室温(23±2)℃,昼夜交替照明,自由进食饮水,适应性喂养1周后开始实验。动物实验通过皖南医学院实验动物伦理委员会的批准,批准文号为LLSC-2021-141。
1.2 药品与试剂
安石榴苷冻干粉(批号P0349,质量分数≥98%)购自纯优生物有限公司;致病性大肠杆菌O101(批号BNCC186732C)购自北纳生物科技有限公司;头孢克肟颗粒(批号H10940128,50 mg/粒)购自广州白云山医药集团股份有限公司;反转录反应试剂盒(批号10071325)购自美国赛默飞公司;髓过氧化物酶(myeloperoxidase,MPO)试剂盒(批号A044-1-1)购自南京建成生物工程研究所;闭锁连接蛋白-1(zonula occludens-1,ZO-1)兔抗小鼠一抗(批号ab190085)、紧密连接蛋白(Occludin)兔抗小鼠一抗(批号ab216327)、HRP标记的山羊抗兔IgG二抗(批号ab150077)购自英国Abcam公司;DAB显色试剂盒购自天根生化科技有限公司;脂多糖(lipopolysaccharide,LPS)、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒均购自杭州联科生物技术有限公司,批号分别为EK201/2、EK206/3、EK282/3;核苷酸结合寡聚化结构域蛋白2(nucleotide binding oligomerization domain 2,)、核因子-κB p65(nuclear factor-κB p65,)、、、引物由华大基因有限公司合成。
1.3 仪器
JW-318HR型高速运转的台式冷冻离心机(美国赛默飞公司);Lepgen-96型PCR扩增仪(南京贝登医疗股份有限公司);qRT-PCR仪(哲罗姆生物科技有限公司);电泳仪(美国Bio-Rad公司);RT-6000型酶标仪(深圳雷杜生命科学股份有限公司)。
2 方法
2.1 腹泻模型的建立、分组及给药
致病性大肠杆菌O101在液体肉汤培养基中以180 r/min、37 ℃在摇动培养箱中培养24 h,收集的细菌5000 r/min离心5 min,并在PBS中洗涤3次,然后将细菌沉淀物重新悬浮到PBS中,调整到2.6×108CFU/mL的终浓度,备用。取BALB/c小鼠45只,雌雄各半,将备好的致病性大肠杆菌O101悬液(10 mL/kg)建立肠炎模型,并将肠炎模型小鼠随机分为模型组、安石榴苷(25 mg/kg)组和头孢克肟(3 mg/kg)组,另取15只正常小鼠作为对照组。给药组于造模当天开始ig以PBS溶解的相应药物,每日10: 00给药1次,连续7 d。
2.2 疾病活动指数(disease activity index,DAI)评分
整个实验期间,每日观察并记录小鼠的一般情况,包括精神状况、活动、小鼠的粪便性状及便血情况,按表1标准,计算DAI评分。
DAI=(体质量下降分值+粪便性状分值+便血情况分值)/3

表1 DAI评分标准
粪便性状分值的评分依据为黏着于肛门的水样便为稀便,不黏着于肛门的糊状水样便为半稀便,成型大便为正常便
Score of fecal character score is based on watery stool that adheres to anus as loose stool, mushy watery stool that does not adhere to anus is semi-loose stool, and formed stool is normal stool
2.3 标本采集
给药结束后,小鼠摘眼球取血,离心分离血清,备用。小鼠颈椎脱臼处死,打开腹腔,剪开肠管,取肠道内容物置无菌EP管冻存待测肠道菌群,另取距胃10 cm小肠6 cm,前1/3段提取RNA检测炎症因子mRNA表达,中1/3段制作匀浆检测炎症因子,后1/3段置4%甲醛充分固定。
2.4 苏木素-伊红(HE)与免疫组化染色
取固定好的小肠管,石蜡包埋,切5 μm厚切片,常规HE染色。另取切成厚度为5 μm的肠组织切片,加入H2O2,常温孵育10 min,漂洗后加入5%牛血清白蛋白,常温孵育60 min,滴加兔抗小鼠一抗ZO-1(1∶150)、Occludin(1∶150),4 ℃孵育过夜;漂洗后,加入HRP标记的化羊抗兔IgG二抗(1∶100),室温孵育60 min后冲洗,加入DAB显色液,显色完毕后用中性树胶封片。于显微镜下观察并采集图像,采用Image-Pro Plus 6.0软件测定阳性染色的平均吸光度()值。
2.5 MPO活性检测
取新鲜肠组织,研磨充分后,PBS洗涤收集,离心取上清,按照MPO试剂盒说明书测定各组样品MPO活性。
2.6 qRT-PCR检测炎性因子mRNA表达
取冻存的小肠50 mg,加入1 mL TRNzol,按说明书提取总RNA,Nanodrop 2000测定RNA的浓度和纯度,根据试剂盒说明书反转录cDNA和扩增。反应体系为25 µL,反应参数:94 ℃预热3 min,45个循环(94 ℃变性15 s,57 ℃退火20 s,荧光采集,72 ℃延伸30 s)。引物序列见表2。

表2 引物序列
2.7 ELISA法检测血清中LPS、IL-6和TNF-α水平
取分离的血清,按ELISA试剂盒说明书检测血清中LPS、IL-6和TNF-α水平。
2.8 肠道菌群的分析测定
对收集的各组小鼠粪便进行16S rDNA高通量测序。提取粪便中细菌的总DNA,取用10 ng的DNA模板,依据16S rDNA V3~4区序列,用带Barcode的特异引物进行PCR扩增。用TruSeq DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,将构建好的文库经Qubit和qRT-PCR定量,文库合格后,运用HiSeq2500 PE250进行上机测序。得到有效数据后,选取可操作分类单元(operational taxonomic units,OTUs)代表性序列,利用每个样本的相对丰度对特征丰度进行归一化。
2.9 统计学处理
3 结果
3.1 安石榴苷对细菌性肠炎小鼠体质量变化率的影响
小鼠ig致病性大肠杆菌O101悬液后12 h左右出现腹泻症状,小鼠精神倦怠,饮食量减少,毛发无光泽,排黄色稀便,有分泌物流出。与对照组相比,模型组小鼠饮食减少,活动能力下降,毛色无光泽,体质量下降;自给药第4天,体质量下降较对照组有统计学意义(<0.05、0.01,图1-A);与模型组比较,自给药第5天,各给药组小鼠体质量显著增加(<0.05、0.01)。
3.2 安石榴苷对细菌性肠炎小鼠DAI评分的影响
各组小鼠从造模开始后每天固定时间进行DAI评分,如图1-B所示,与对照组相比,从第2天起,模型组小鼠DAI评分显著升高(<0.05、0.01);与模型组比较,各给药组DAI评分显著降低(<0.05、0.01)。
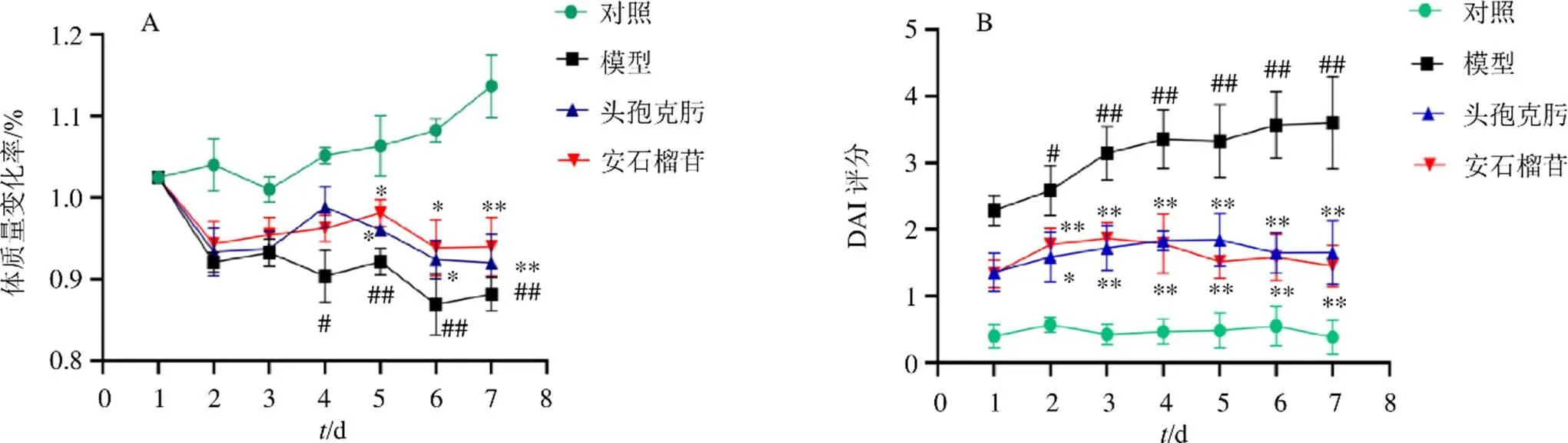
与对照组比较:#P<0.05 ##P<0.01;与模型组比较:*P<0.05 **P<0.01,下图同
3.3 安石榴苷对细菌性肠炎小鼠肠壁MPO活性的影响
MPO是评价组织中中性粒细胞浸润程度的重要指标,能够有效反映炎症状况。如图2所示,与对照组相比,模型组小鼠肠壁MPO活性明显升高(<0.01);与模型组相比,各给药组小鼠肠壁MPO活性明显降低(<0.01)。
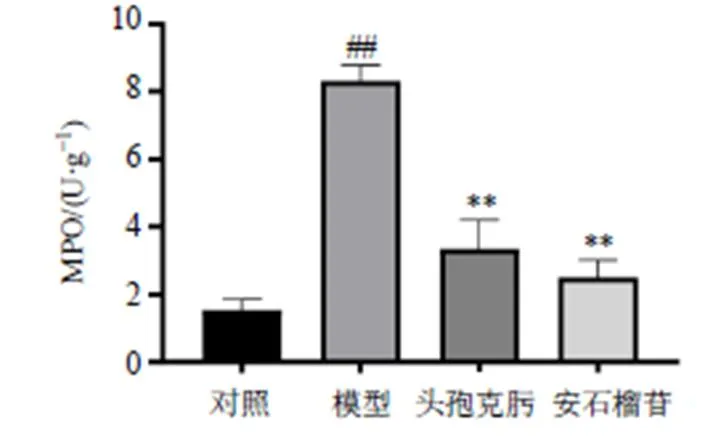
图2 安石榴苷对细菌性肠炎小鼠小鼠肠壁MPO活性的影响(, n = 15)
3.4 安石榴苷对细菌性肠炎小鼠肠壁炎性因子mRNA表达的影响
如图3所示,与对照组相比,模型组小鼠肠壁、、和mRNA表达水平明显升高(<0.05、0.01);与模型组相比,各给药组小鼠肠壁、、和mRNA表达水平明显降低(<0.05、0.01)。
3.5 安石榴苷对细菌性肠炎小鼠血清LPS、IL-6和TNF-α水平的影响
如表3所示,与对照组比较,模型组小鼠血清中LPS、IL-6和TNF-α水平显著升高(<0.01);与模型组比较,各给药组小鼠血清中LPS、IL-6和TNF-α水平显著降低(<0.01)。
3.6 安石榴苷对细菌性肠炎小鼠小肠肠壁屏障的影响
如图4所示,对照组小鼠肠黏膜结构完整无溃疡,小肠绒毛排列紧密有规则,上皮细胞形态正常;与对照组比较,模型组小鼠肠壁可见明显溃疡,绒毛密度稀疏,排列紊乱,且有不同程度的脱落;黏膜层肠腺及上皮完全丧失,并伴有大量炎性细胞浸润,炎症侵及黏膜下层及肌层;各给药组小鼠肠壁上皮细胞脱落现象较轻,绒毛排列较为整齐,炎性细胞浸润减少,感染症状明显减轻。
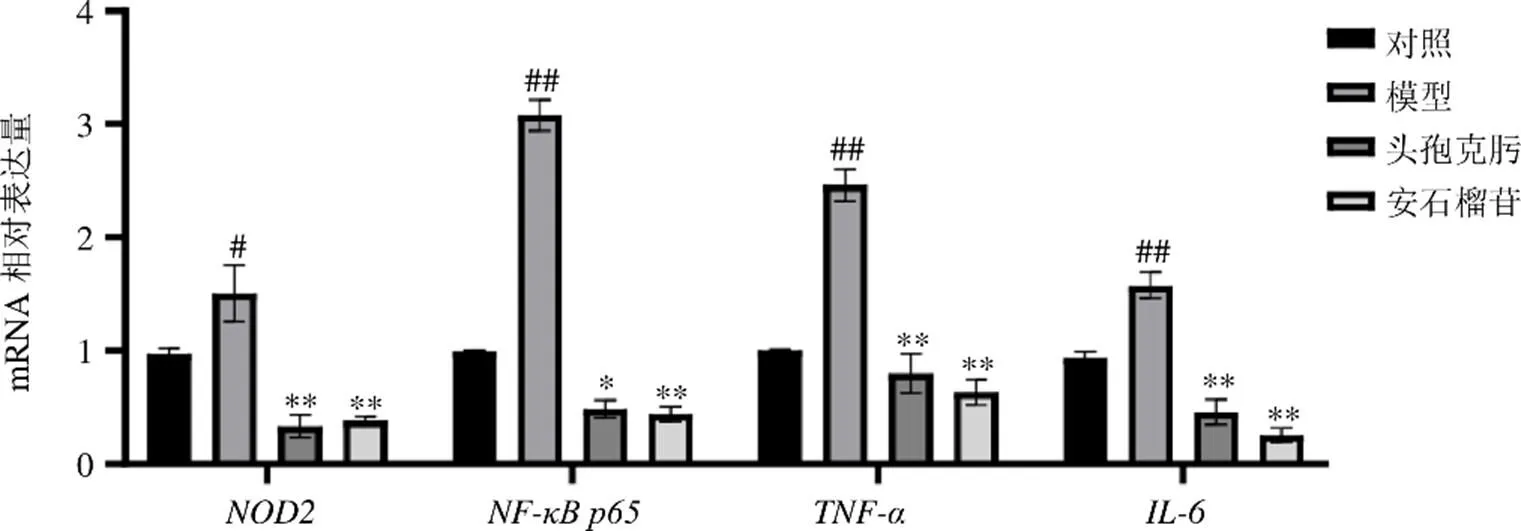
图3 安石榴苷对细菌性肠炎小鼠肠壁炎性因子mRNA表达的影响(, n = 15)
Table 3 Effect of punicalagin on inflammatory factor mRNA expressions in intestinal wall of mice with bacterial enteritis (, n = 15)
表3 安石榴苷对细菌性肠炎小鼠血清LPS、IL-6和TNF-α水平的影响(, n = 15)
Table 3 Effect of punicalagin on LPS, IL-6 and TNF-α levels in serum of mice with bacterial enteritis (, n = 15)
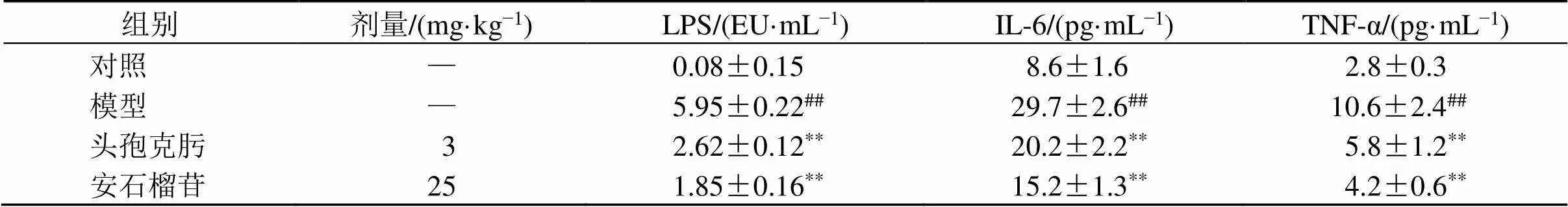
Table 3 Effect of punicalagin on inflammatory factor mRNA expressions in intestinal wall of mice with bacterial enteritis (, n = 15)
组别剂量/(mg·kg−1)LPS/(EU·mL−1)IL-6/(pg·mL−1)TNF-α/(pg·mL−1) 对照—0.08±0.158.6±1.62.8±0.3 模型—5.95±0.22##29.7±2.6##10.6±2.4## 头孢克肟32.62±0.12**20.2±2.2**5.8±1.2** 安石榴苷251.85±0.16**15.2±1.3**4.2±0.6**
与对照组比较:#<0.05##<0.01;与模型组比较:*<0.05**<0.01,表4同
#< 0.05##< 0.01control group;*< 0.05**< 0.01model group, same as table 4
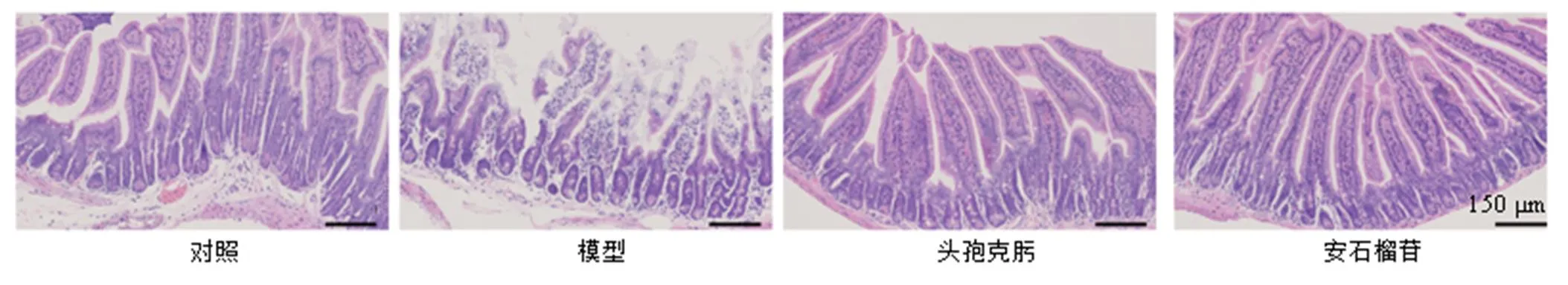
图4 安石榴苷对细菌性肠炎小鼠小肠肠壁病理变化的影响(HE, ×150)
紧密连接蛋白Occludin、ZO-1是形成肠上皮细胞之间紧密连接的重要成分,主要表达在上皮细胞侧面顶端胞质中,对维持肠壁的完整性发挥重要作用。免疫组化染色图(图5)中,棕褐色为Occludin、ZO-1阳性表达。对照组肠上皮中Occludin、ZO-1蛋白表达较多;与对照组相比,模型组小鼠肠壁蛋白表达显著减少(<0.01);与模型组相比,各给药组小鼠肠壁蛋白表达显著增多(<0.01)。
3.7 安石榴苷对细菌性肠炎小鼠肠道菌群的影响
3.7.1 对小鼠肠道菌群多样性的影响 从4个样本中共得到5813个OTUs。Venn图结果表明358个OTUs为4组共同拥有,其中对照组与模型组之间共同拥有571个OTUs,模型组与安石榴苷组之间共同拥有632个OTUs,模型组和头孢克肟组共同拥有667个OTUs,见图6-A。Shannon指数结果表明,与对照组相比,模型组小鼠肠菌多样性显著降低(<0.05);与模型组相比,各给药组小鼠肠菌多样性显著升高(<0.05),见图6-B。主坐标分析(principal coordinate analysis,PCoA)结果表明,4组间肠道菌群结构均存在显著差异,见图6-C。
3.7.2 对小鼠肠道菌群丰度的影响 由门、科水平热图(图7-A、B)、构成比堆积图(图7-C、D)和表4可知,各组小鼠的肠道菌群有明显不同。与对照组相比,模型组小鼠变形菌门(Proteobacteria)、Muribaculaceae和脱硫弧菌科(Desulfovibrionaceae)菌群相对丰度显著升高(<0.05、0.01),厚壁菌门(Firmicutes)、毛螺菌科(Lachnospiraceae)、Clostridiales_unclassified菌群相对丰度明显下降(<0.05、0.01);与模型组相比,各给药组小鼠肠道厚壁菌门、毛螺菌科、Clostridiales_unclassified菌群相对丰度显著升高(<0.05、0.01),拟杆菌门(Bacteroidetes)、变形菌门、Muribaculaceae和脱硫弧菌科菌群相对丰度显著降低(<0.05、0.01)。
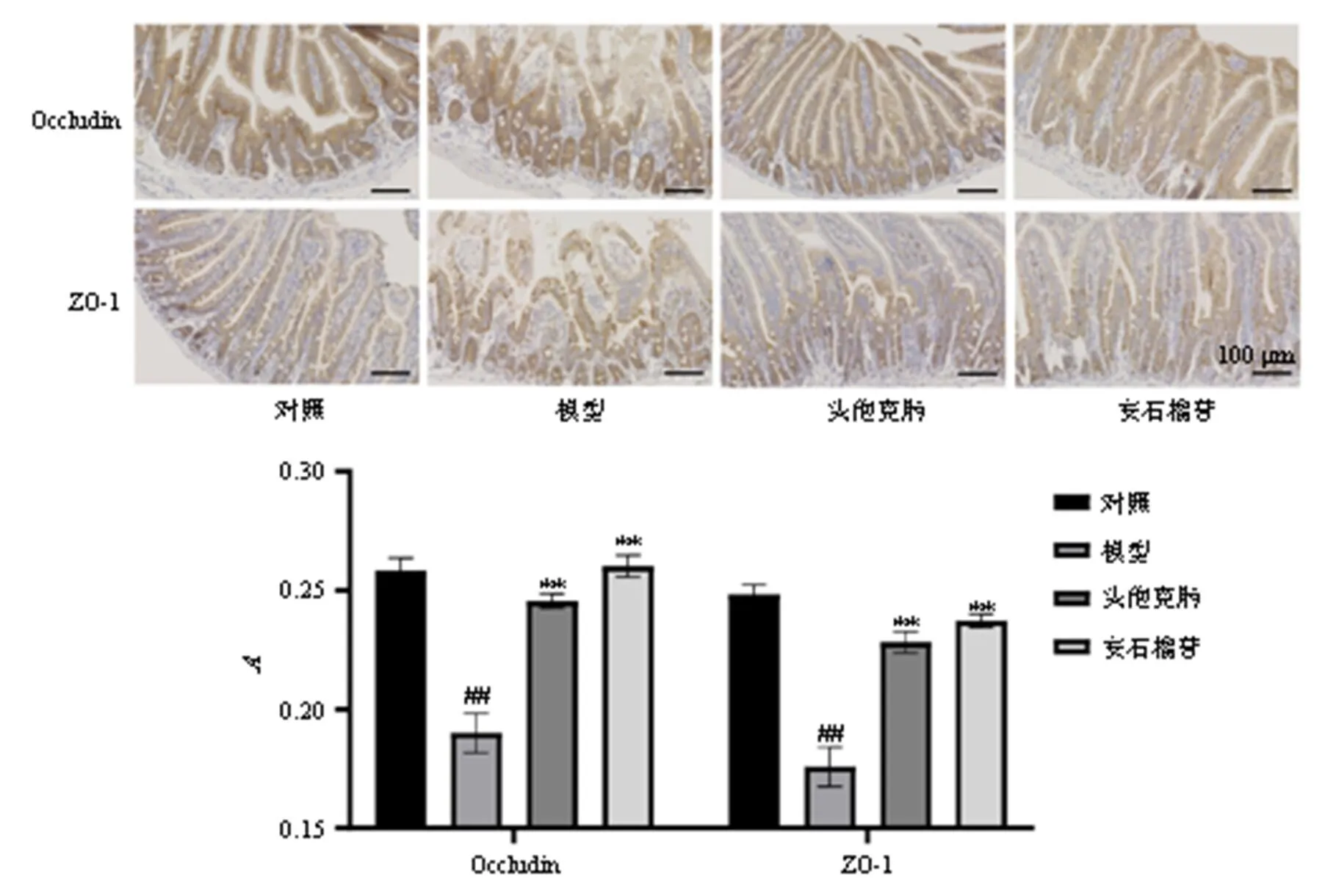
图5 安石榴苷对细菌性肠炎小鼠小肠肠壁紧密连接蛋白表达的影响小鼠(免疫组化, ×200)
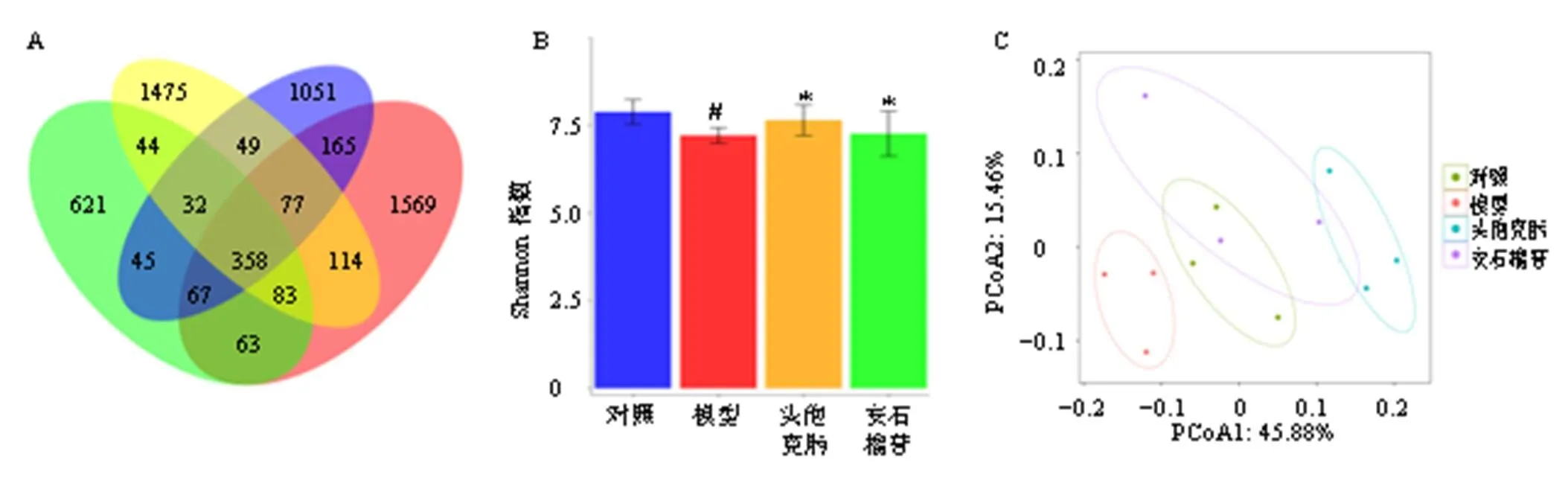
图6 各组OTUs韦恩图(A)、Shannon指数(B) 和PCoA分析(C)
4 讨论
急性细菌性腹泻是临床上最常见的消化道感染性疾病之一,引起该病的常见致病菌有大肠埃希菌、变形杆菌、金黄色葡萄球菌等,多为革兰阴性杆菌[15]。研究表明,革兰阴性杆菌感染机体后,其产生的内毒素将激活炎症信号转导通路,诱导机体合成并释放TNF-α、IL-8等炎症因子[16]。头孢克肟属于临床上常用的广谱抗生素之一,为头孢菌素类抗生素,有广泛的抗菌作用,可抑制DNA合成和复制,从而起到杀菌的功效,是治疗细菌性肠炎的首选抗生素,但头孢克肟不适于长期应用,会使患者体内出现严重的菌群紊乱症状,诱发其他并发症[17]。因此,深入研究细菌性肠炎发病的分子机制,积极寻找有效的抗肠炎药物具有重要的意义。本研究通过小鼠ig致病性大肠杆菌O101制备急性细菌性肠炎模型,记录小鼠体质量、粪便性状及便血情况,计算评分DAI。结果显示,模型组小鼠DAI评分显著升高,表明肠炎模型成功建立;安石榴苷和头孢克肟治疗后,小鼠DAI评分明显降低,表明安石榴苷能改善致病菌引起的小鼠肠炎。
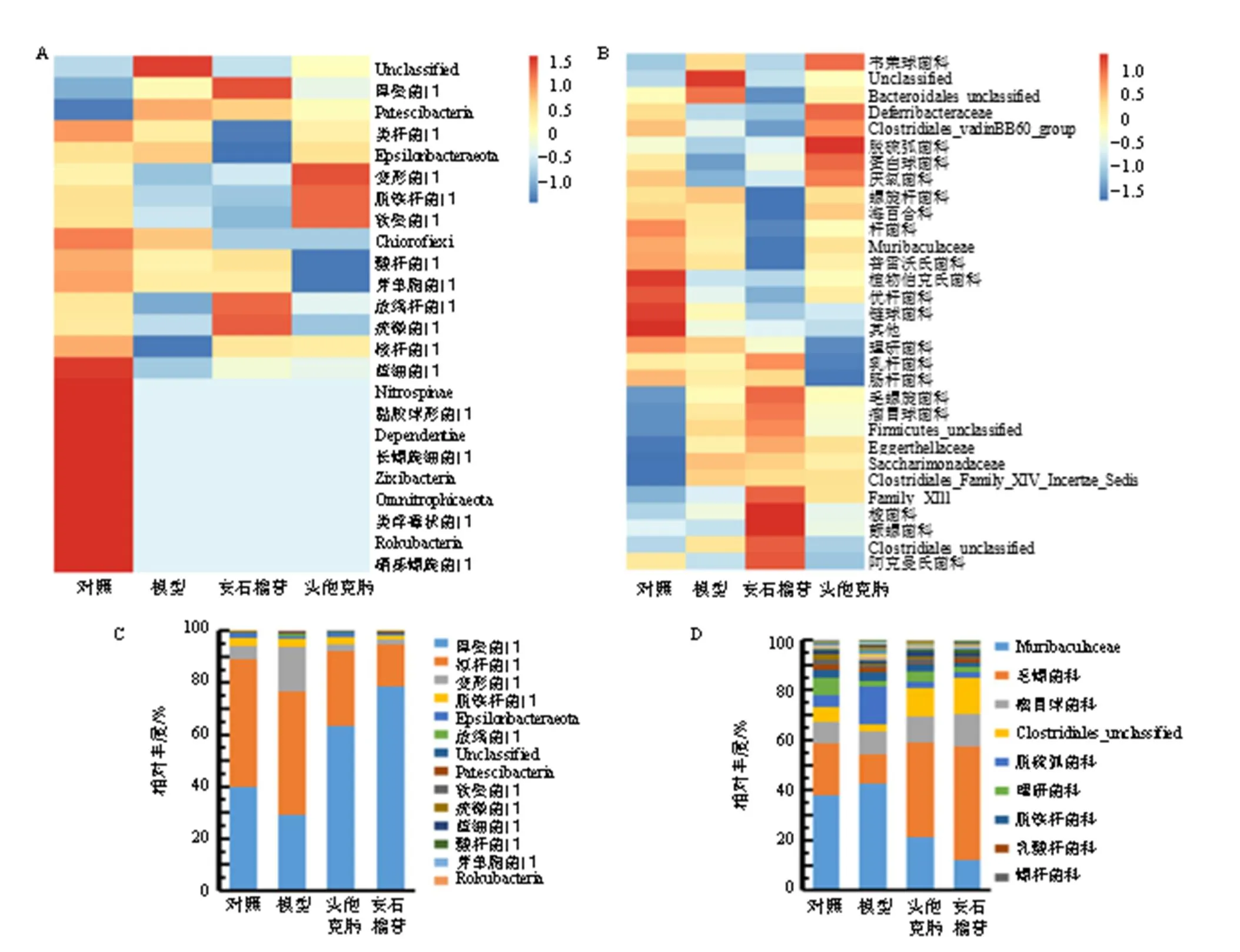
图7 小鼠肠道内容物菌群在门、科水平上物种组成热图 (A、B) 和柱状堆叠图 (C、D)
表4 安石榴苷对细菌性肠炎小鼠肠道菌群相对丰度的影响(, n = 3)
Table 4 Effect of punicalagin on relative abundance of intestinal flora of mice with bacterial enteritis (, n = 3)
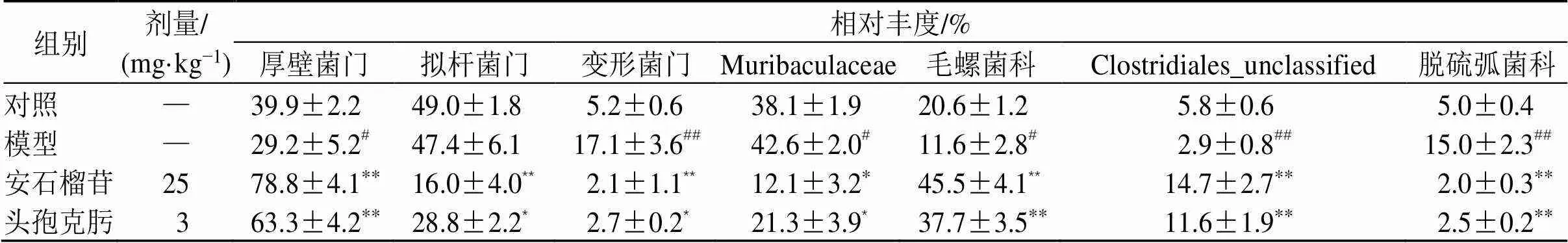
表4 安石榴苷对细菌性肠炎小鼠肠道菌群相对丰度的影响(, n = 3)
组别剂量/(mg·kg−1)相对丰度/% 厚壁菌门拟杆菌门变形菌门Muribaculaceae毛螺菌科Clostridiales_unclassified脱硫弧菌科 对照—39.9±2.249.0±1.85.2±0.638.1±1.920.6±1.25.8±0.65.0±0.4 模型—29.2±5.2#47.4±6.117.1±3.6##42.6±2.0#11.6±2.8#2.9±0.8##15.0±2.3## 安石榴苷2578.8±4.1**16.0±4.0**2.1±1.1**12.1±3.2*45.5±4.1**14.7±2.7**2.0±0.3** 头孢克肟363.3±4.2**28.8±2.2*2.7±0.2*21.3±3.9*37.7±3.5**11.6±1.9**2.5±0.2**
MPO是中性粒细胞的标志分子[18]。小鼠ig致病性大肠杆菌O101后,肠壁组织MPO活性显著升高,可见造模后小鼠肠道菌群失衡,肠壁产生炎症,免疫系统激活。肠壁病理切片也表明,肠绒毛中轴和肠腺周边固有层粒细胞浸润,小肠上皮局部脱落,绒毛排列紊乱,肠壁炎症反应明显。安石榴苷和头孢克肟治疗后可显著减轻肠壁炎症反应。
通常情况下,肠道微生物群共生并相互作用,形成稳定的微生态系统;同时,它们参与肠道食物的消化与吸收,以及直接或间接参与肠黏膜固有或获得性免疫应答。肠道微生物种群平衡的破坏,不仅影响食物的消化和吸收,而且可能破坏肠道免疫功能,引起强烈的炎症反应,导致肠壁病变[19-22]。本研究中,小鼠ig致病性大肠杆菌O101后,肠道原有的微生态平衡被打破,肠道厚壁菌门、毛螺菌科和Clostridiales_unclassified菌群丰度显著降低,变形菌门、Muribaculaceae和脱硫弧菌科菌群丰度显著升高。厚壁菌门、毛螺菌科、Clostridiales_ unclassified都是化能营养型细菌,有利营养物质的消化和吸收,该类型细菌丰度降低,常导致消化不良;变形菌门、拟杆菌门、Muribaculaceae和脱硫弧菌科细菌是条件致病菌,与炎症性肠病的发生高度相关。安石榴苷与头孢克肟可显著改善肠道微生态平衡,增加厚壁菌门、毛螺菌科、Clostridiales_ unclassified细菌丰度,降低变形菌门、拟杆菌门、Muribaculaceae和脱硫弧菌科菌群丰度。
肠黏膜屏障包括生物屏障、免疫屏障与机械屏障。生物屏障也就是肠道菌群,其构成了一个对抗病原体的保护屏障;免疫屏障即肠相关淋巴组织、肠道内浆细胞分泌型免疫球蛋白A(secretory immunoglobulin A,sIgA)在内的免疫系统;机械屏障由肠黏膜上皮细胞以及细胞间的紧密连接构成。肠壁屏障蛋白(ZO-1和Occludin)是紧密连接的重要组成部分,紧密连接能够调节和维持细胞极性,起到连接与封闭细胞的作用,与肠屏障通透性直接相关。多种病原体通过破坏ZO-1或Occludin蛋白结构改变屏障通透性与肠道完整性以穿过细胞旁连接进入机体[23-25]。肠上皮屏障若被破坏,可导致肠道菌群不受调节的移动进入固有层,病原微生物(如致病性大肠杆菌)释放的表面抗原(如LPS)被肠壁抗原提呈细胞Toll样受体(Toll-like receptor,TLR)和NOD2受体识别,活化NF-κB抑制蛋白(inhibitor of NF-κB,IκB)等促炎因子,启动包括NF-κB在内的炎症通路,促进IL-1β、IL-6和TNF-α的表达,激活肠道相关的淋巴组织,产生局部组织的炎性反应[26-28]。同时IL-1β、IL-6和TNF-α等促炎因子与机会致病菌协同损伤肠壁屏障蛋白(ZO-1和Occludin),使得细胞间的紧密连接松动,肠屏障通透性增高。LPS通过损伤的肠上皮进入肠壁和血液,诱导肠壁炎症因子相关基因表达上调,导致血液内的LPS、IL-1β、IL-6、TNF-α等炎性因子增多,影响整个机体系统[29-30]。本研究结果显示,安石榴苷改变了肠道菌群结构,显著下调肠炎小鼠肠壁、和mRNA表达水平,减轻炎症因子对肠壁屏障蛋白的破坏,导致进入血液的LPS、IL-6和TNF-α显著减少。
综上所述,安石榴苷能够改善致病性大肠杆菌O101诱导的细菌性肠炎,减轻小鼠肠壁的炎症反应,保护肠壁屏障,其机制可能与调节肠道菌群有关。本研究为阐明安石榴苷治疗肠炎的作用机制提供了一定的实验依据,也为开发治疗肠炎的中药提供了有益的启示。
利益冲突 所有作者均声明不存在利益冲突
[1] Darwish A A, Fawzy M, Osman W A L,.Clinicopathological and bacteriological studies on lamb bacterial enteritis and monitoring the oregano oil and vitamins A, D3, E effect on its treatment [J]., 2021, 8(2): 291-299.
[2] 谢政, 李志清.双歧杆菌四联活菌片辅助头孢克肟对小儿细菌性肠炎患者的疗效及其对肠道菌群平衡的影响 [J].抗感染药学, 2019, 16(4): 719-721.
[3] Chen R Y, Kung V L, Das S,.Duodenal microbiota in stunted undernourished children with enteropathy [J]., 2020, 383(4): 321-333.
[4] Vilkman K, Lääveri T, Pakkanen S H,.Stand-by antibiotics encourage unwarranted use of antibiotics for travelers’ diarrhea: A prospective study [J]., 2019, 27: 64-71.
[5] Bi C R, Jing W, Xie X F,.Efficacy and mechanism of traditional Chinese medicine in relieving antibiotic-resistant bacterial diarrhea in children: Study protocol for a randomized controlled trial [J]., 2021, 22(1): 426.
[6] 刁俊杰.肠易激综合征中医证治的现代文献系统评价研究 [D].广州: 广州中医药大学, 2016.
[7] Kou F S, Shi L, Li J X,.Clinical evaluation of traditional Chinese medicine on mild active ulcerative colitis: A multi-center, randomized, double-blind, controlled trial [J]., 2020, 99(35): e21903.
[8] 明·倪朱谟编著, 戴慎, 陈仁寿, 虞舜点校.本草汇言 [M].上海: 上海科学技术出版社, 2005: 387.
[9] Li G H, Feng Y Q, Xu Y F,.The anti-infective activity of punicalagin againstsubsp.enterica serovar typhimurium in mice [J]., 2015, 6(7): 2357-2364.
[10] Bialonska D, Kasimsetty S G, Schrader K K,.The effect of pomegranate (L.) byproducts and ellagitannins on the growth of human gut bacteria [J]., 2009, 57(18): 8344-8349.
[11] Berdowska I, Matusiewicz M, Fecka I.Punicalagin in cancer prevention-via signaling pathways targeting [J]., 2021, 13(8): 2733.
[12] Sharma M, Li L Y, Celver J,.Effects of fruit ellagitannin extracts, ellagic acid, and their colonic metabolite, urolithin A, on Wnt signaling [J]., 2010, 58(7): 3965-3969.
[13] 徐云凤.安石榴苷对金黄色葡萄球菌的抑菌作用及机制研究 [D].杨凌: 西北农林科技大学, 2017.
[14] 林浩.安石榴苷在小鼠真菌性角膜炎中的作用 [D].青岛: 青岛大学, 2020.
[15] Bandsma R H J, Sadiq K, Bhutta Z A.Persistent diarrhoea: Current knowledge and novel concepts [J]., 2019, 39(1): 41-47.
[16] Sanjeewa K K A, Nagahawatta D P, Yang H W,.Octominin inhibits LPS-induced chemokine and pro-inflammatory cytokine secretion from RAW264.7 macrophages via blocking TLRs/NF-κB signaltransduction [J]., 2020, 10(4): 511.
[17] Rogawski E T, Westreich D J, Becker-Dreps S,.Antibiotic treatment of diarrhoea is associated with decreased time to the next diarrhoea episode among young children in Vellore, India [J]., 2015, 44(3): 978-987.
[18] Chen S, Chen H S, Du Q H,.Targeting myeloperoxidase (MPO) mediated oxidative stress and inflammation for reducing brain ischemia injury: Potential application of natural compounds [J]., 2020, 11: 433.
[19] Zhang W, Xu J H, Yu T,.Effects of berberine and metformin on intestinal inflammation and gut microbiome composition in db/db mice [J]., 2019, 118: 109131.
[20] Wisniewski P J, Dowden R A, Campbell S C.Role of dietary lipids in modulating inflammation through the gut microbiota [J]., 2019, 11(1): 117.
[21] Song C M, Zhang Y S, Cheng L,.Tea polyphenols ameliorates memory decline in aging model rats by inhibiting brain TLR4/NF-κB inflammatory signaling pathway caused by intestinal flora dysbiosis [J]., 2021, 153: 111476.
[22] Li X, Wu D, Niu J J,.Intestinal flora: A pivotal role in investigation of traditional Chinese medicine [J]., 2021, 49(2): 237-268.
[23] Akdis C A.Does the epithelial barrier hypothesis explain the increase in allergy, autoimmunity and other chronic conditions? [J]., 2021, 21(11): 739-751.
[24] Wang Y G, Gao Y, Feng J,.Effect of modified Xijiao Dihuang Decoction (加味犀角地黄汤) on intestinal flora and Th17/Treg in rats with radiation enteritis [J]., 2021, 27(3): 198-205.
[25] 王庆谚, 郑洪新.中医“肾阴肾阳失常”与肠屏障功能损伤的机制 [J].中华中医药学刊, 2019, 37(3): 635-637.
[26] Wu Y R, Kuang G Y, Lu F G,.Pathological relationship between intestinal flora and osteoarthritis and intervention mechanism of Chinese medicine [J]., 2019, 25(9): 716-720.
[27] 赵赫, 匡重伸, 李芳, 等.脓毒症模型小鼠的肠道菌群组成与变化[J].中华危重病急救医学, 2021, 33(1): 10-16.
[28] Cui Y, Qu Y Y, Yin K,.Selenomethionine ameliorates LPS-induced intestinal immune dysfunction in chicken jejunum [J]., 2021, 13(3): mfab003.
[29] Stevens B R, Goel R, Seungbum K,.Increased human intestinal barrier permeability plasma biomarkers zonulin and FABP2correlated with plasma LPS and altered gut microbiome in anxiety or depression [J]., 2018, 67(8): 1555-1557.
[30] Bian M, Wang J, Wang Y, et al.Chicory ameliorates hyperuricemia via modulating gut microbiota and alleviating LPS/TLR4 axis in quail [J]., 2020, 131: 110719.
Experimental study on improvement of bacterial enteritis and regulation of intestinal flora in mice by punicalagin
HUANG Shu-yun, XU Ping, HONG Zong-yuan, ZHONG Shu-zhi
Department of Histology and Embryology, Wannan Medical College, Wuhu 241002, China
To study the improvement effect of punicalagin on bacterial enteritis and its influence on intestinal flora.Forty-five BALB/c mice were ig pathogenicO101to establish a bacterial enteritis model, and were given punicalagin or cefixime for 7 d of intervention.During the administration, signs of mice in each group were observed, daily disease activity index (DAI) and body weight change rate were calculated; Intestinal tissue and intestinal contents were collected after administration, and hematoxylin-eosin (HE) staining was used to observe the pathological changes of intestinal tissue in mice; Expressions of tight junction protein zonula occludens-1 (ZO-1) and Occludin in small intestine were detected by immunohistochemistry; Activity of myeloperoxidase (MPO) in intestinal tissue of mice was measured; Inflammation related factors nucleotide binding oligomerization domain 2 (), nuclear factor-κB p65 (), tumor necrosis factor-α () and interleukin-6 () mRNA expressions in intestinal were detected by qRT-PCR; Lipopolysaccharide (LPS), TNF-α, IL-6 levels in serum were determined by ELISA; Diversity and abundance of intestinal flora in mice were detected by 16S rDNA high throughput sequencing.Compared with model group, DAI score of mice in punicalagin group was significantly decreased (< 0.01); Congestion and edema of small intestinal mucosa were significantly alleviated; Expressions of small intestinal epithelial tight junction associated proteins ZO-1 and Occludin were significantly increased (< 0.01); MPO activity in intestinal wall was significantly reduced (< 0.01);,,andmRNA expressions in intestinal wall were decreased significantly (< 0.01); LPS, TNF-α and IL-6 levels in serum were significantly decreased (< 0.01); Relative abundances of Firmicutes, Lachnospiraceae and Clostridiales-unclassified were significantly increased (< 0.01), relative abundances of Proteobacteria, Bacteroidetes, Muribaculaceae and Desulfovibrionaceae were significantly decreased (< 0.05, 0.01).Punicalagin can improve enteritis induced by pathogenicO101, reduce the inflammatory response of mouse intestinal wall, and protect the intestinal mucosal barrier, and its mechanism may be related to the regulation of intestinal flora.
punicalagin; bacterial enteritis; intestinal flora; intestinal mucosal barrier; inflammatory response
R285.5
A
0253 - 2670(2022)10 - 3044 - 09
10.7501/j.issn.0253-2670.2022.10.014
2022-01-25
安徽省高校自然科学重大项目(KJ2020ZD56);大学生科研资助金项目(WK2020S59,WK2021XS61)
黄淑芸(1997—),女,硕士研究生,研究方向为肠道菌群与中药研究。Tel: 13770658183 E-mail: 2418481384@qq.com
通信作者:钟树志,硕士生导师,教授,主要从事中枢神经退行性变与中药调节研究。E-mail: zhongshuzhi2006@163.com
[责任编辑 李亚楠]
