基于实时荧光定量PCR筛选巨菌草内参基因
2022-05-23李苏涛陈思齐韩雪林苏德伟罗海凌
李苏涛,李 妍,张 磊,陈思齐,韩雪林,张 娟,苏德伟,罗海凌,周 晶
(1. 福建农林大学动物科学学院(蜂学学院), 福建 福州 350002;2. 福建农林大学国家菌草工程技术研究中心, 福建 福州 350002)
实时荧光定量PCR (real-time fluorescent quantitative polymerase chain reaction, qRT-PCR)技术因其特异识别性强、高灵敏度、高通量等特点[1],在分子生物学领域中常被用于检测基因表达与转录分析等研究[2]。使用合适的内参基因对目的基因的相对表达量进行校正和标准化,是获得准确试验数据的前提[3]。目前,在动物、植物内参基因的研究中常用的内参基因评估方法都是基于qRT-PCR的Ct值进行软件分析,常用的软件有geNorm、NormFinder和BestKeeper[4-5]。
内参基因是指在理想状态下,其表达量不会因不同试验条件、组织器官、物种等而改变的稳定基因。然而,不断有研究表明,不可能存在一种基因,其表达量不随试验条件变化而变化[6]。更不存在一种在所有物种中均能稳定表达的基因。如GAPDH和Actin在草地早熟禾(Poa pratensis)中表达稳定性较好,但在小麦(Triticum aestivum)中GAPDH和Actin表达稳定性较差[7-8]。因此使用未筛选的内参基因进行目的基因相对表达量的校正会影响数据的可靠性。目前,在植物领域中已有如小麦[9-10]、大麦(Hordeum vulgare)[11]、黑麦草(Lolium perenne)[12]、水稻(Oryza sativa)[13-14]、玉米(Zea mays)[15-16]、甘蔗(Saccharum officinarum)[17]、拟南芥 (Arabidopsis thaliana)[18-19]、草地早熟禾[7]、羊草(Leymus chinensis)[20]、大针茅(Stipa grandis)[21]等内参基因筛选的研究报道。
巨菌草(Pennisetum giganteum)为禾本科多年生狼尾草属植物,其根部发达,可用于修复生态环境。因其在生态、经济方面的潜力,巨菌草成为菌草的主要推广品种[22]。目前,已有揭示巨菌草基因调控机理的研究报道。有研究通过对巨菌草幼苗的叶片和根进行转录组功能测序,揭示了叶片和根的主要转录因子家族。对不同土培干旱和复水条件下巨菌草进行了高通量测序,报道了巨菌草干旱、复水相关基因的转录组数据[23-24]。但目前暂未看到关于巨菌草内参基因筛选的报道研究。因此,本试验以正常生长、不同干旱胁迫和盐碱胁迫下巨菌草的叶片、茎、根为试验材料,分别用geNorm、NormFinder和BestKeeper对18s rRNA、Actin、GAPDH、ACTB、EF-1α、UBQ、TUB、CYP共8个传统内参基因进行表达稳定性排序,最后根据赋值法进行排序,以期得到巨菌草基因表达中稳定的内参基因。
1 材料与方法
1.1 试验材料
巨菌草原产于北非,由国家菌草工程技术研究中心首席科学家林占熺引进国内并命名,种植于国家菌草工程技术研究中心菌草培育基地。试验选用带有饱满侧芽、茎粗一致的植株,于2020年12月,将巨菌草种植在以草炭土和蛭石1 : 1混匀填充的花盆中。每个花盆装约1.5 kg草炭土和蛭石混合物,将花盆置于温度为(25 ± 1) ℃的温室进行培养,每天每盆浇水250 mL。1个月后,选取21盆长出7片叶子、长势一致的巨菌草进行后续试验。
1.2 方法
1.2.1试验材料处理
将上述21盆巨菌草按每个处理组3盆,随机分成7组。分别进行正常生长、干旱胁迫和盐碱胁迫处理。正常处理组以蒸馏水进行浇灌,使其土壤含水量保持在80%左右;干旱胁迫处理组在其土壤含水量为80%左右时,分别进行连续7、14和21 d的不浇水处理;盐碱胁迫处理组参考潘羿壅[25]的研究,用蒸馏水将NaCl、Na2SO4、NaHCO3和Na2CO3以1 : 1 : 1 : 1比例混合,配置成浓度为60、120、180 mmol·L-1的混合盐碱溶液,以上述混合盐碱溶液对巨菌草进行浇灌,每个花盆每天浇灌250 mL,连续浇灌7 d。最后,快速采取每个处理组的叶片、茎和根置于液氮中,后将样品放入-80 ℃冰箱中保存。
1.2.2巨菌草组织RNA提取和cDNA合成
不同处理组均取约100 mg的叶片、茎和根组织,置于研钵中,加入液氮充分研磨,按RNAprep Pure Plant Kit (TIANGEN BIOTECH,Beijing,China)试剂盒进行总RNA提取;然后每个组织部位以1 μg的RNA作为模板,按照Fasting gDNA Dispelling RT SuperMix(TIANGEN BIOTECH,Beijing,China)试剂盒进行反转录操作,反转录获得cDNA。反转录程序为42 ℃反应15 min,后95 ℃反应3 min。反转录得到的cDNA置于-20 ℃冰箱中暂时保存。
1.2.3引物的设计与合成
根据荧光定量引物设计原则,使用Primer Premier 5软件进行内参基因的引物设计。引物交由福州尚亚生物技术公司合成(引物序列如表1所列)。

表1 内参基因信息及其引物序列Table 1 Information of reference genes and their primer sequences
1.2.4内参基因的普通PCR和qRT-PCR扩增
不同处理组均以1 μL叶片、茎和根的cDNA作为模板,按照Golden Easy PCR System (TIANGEN BIOTECH,Beijing,China)试剂盒进行普通PCR扩增。扩增程序:94 ℃反应3 min;94 ℃反应30 s,55 ℃反应20 s,72 ℃反应1 min,30个循环;最后于72 ℃反应5 min。分别以1 μL叶片、茎和根的cDNA作为模板,使用RealUniversal Color PreMix (SYBR Green)(TIANGEN BIOTECH,Beijing,China)试 剂 盒进行qRT-PCR扩增操作。qRT-PCR试验使用CFX Manager(Bio-Rad,USA)仪器。扩增程序:首先在95 ℃预变性反应15 min;然后95 ℃变性反应10 s;接着60 ℃退火反应20 s;最后72 ℃延伸反应30 s,其中变性、退火、延伸反应重复40个循环。不同处理组下每个组织均选用3个生物学重复。
1.3 数据分析
通过CFX Manager (Bio-Rad,USA)分析软件直接获得内参基因qRT-PCR的Ct值。geNorm软件由Ct值计算出每个内参基因的平均表达稳定值(M)和配对变异值(Vn/n+1)。其中,M值越小,基因越稳定。Vn/n+1用来确定最适基因的数量,当Vn/n+1< 0.15时,最适基因数为n个;NormFinder软件也是由Ct值计算内参基因稳定值;BestKeeper软件由Ct值计算标准偏差值(SD),SD值越小,基因越稳定。最后通过赋值法综合排序,稳定性从高到低依次记为1~8,数值最小的基因最稳定。
2 结果分析
2.1 样品RNA质量检测、引物扩增特异性及内参基因qRT-PCR分析
通过NanoDrop 2000C分光光度计检测总RNA的浓度和纯度。本研究中OD260/OD280值均在1.8~2.1,表明RNA的纯度高。将巨菌草叶片、茎和根的cDNA等量混合后扩增内参基因片段,并用1.5%琼脂糖凝胶电泳进行检测。在100~250 bp存在较亮的特异性条带,条带的大小与预期相符合,说明引物可用于接下来的qRT-PCR试验(图1)。将巨菌草叶片、茎、根的cDNA等量混合后,以此为模板进行qRT-PCR。由溶解曲线可知(图2),所有曲线均为单一峰,未出现其他峰段,表明试验过程中没有出现非特异扩增。此外,内参基因Tm值均80~90 ℃,引物特异性表达强,符合qRT-PCR分析的要求。
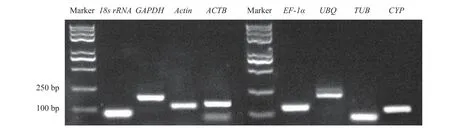
图1 内参基因的PCR扩增产物Figure 1 PCR amplification products of 8 reference genes
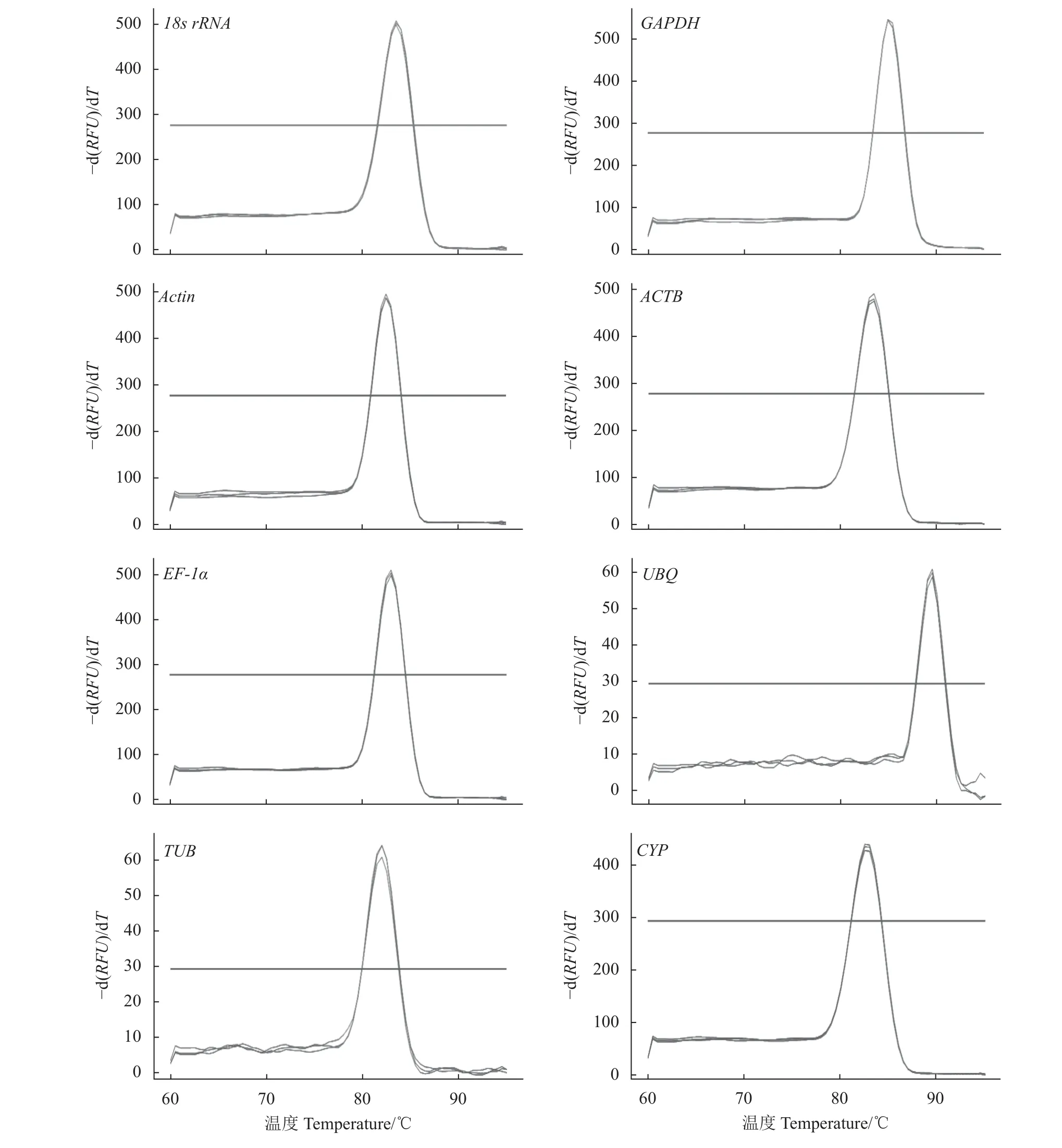
图2 内参基因溶解曲线图Figure 2 Melting curves of 8 reference genes
2.2 正常生长下巨菌草内参基因的稳定性分析
2.2.1正常生长下巨菌草内参基因稳定性geNorm分析
geNorm算法不受基因表达丰度的影响,通过一个基因与其他基因对比,计算M值。M < 1.5的基因表达相对稳定[7]。正常生长下的巨菌草叶片、茎和根中所有内参基因的M值均小于1.5,表明所选内参基因都稳定表达。其中,叶片中ACTB(0.050)和Actin(0.050)表达最稳定;茎中ACTB(0.015)和UBQ(0.015)表达最稳定;根中ACTB(0.034)和GAPDH(0.034)表达最稳定(图3)。此外,通过geNorm软件计算Vn/n+1,当Vn/n+1< 0.15时,最适基因数为n。叶片、茎和根中的V2/3依次为0.035、0.019和0.028 (图4),均小于0.15。所以正常生长下巨菌草叶片、茎、根所需的最适内参基因数均为2。

图3 正常生长下不同组织中内参基因geNorm分析稳定值Figure 3 Expression stability value of the reference genes in different tissues under normal growth by geNorm

图4 正常生长下不同组织中配对差异分析(Vn/n+1)最佳组合的内参基因数Figure 4 Paired difference analysis (Vn/n+1), the best combination of reference genes number in different tissues under normal growth
2.2.2正常生长下巨菌草内参基因稳定性NormFinder分析
虽然原理与geNorm软件相似,但NormFinder软件不能确定最适基因数,其在分析数据前需将基因的Ct值转化成相对表达量,然后基于方差分析计算M值。正常生长下,ACTB(0.017)和Actin(0.017)在叶片中表达最稳定;ACTB(0.006)在茎中表达最稳定;ACTB(0.010)在根中表达最稳定(表2)。
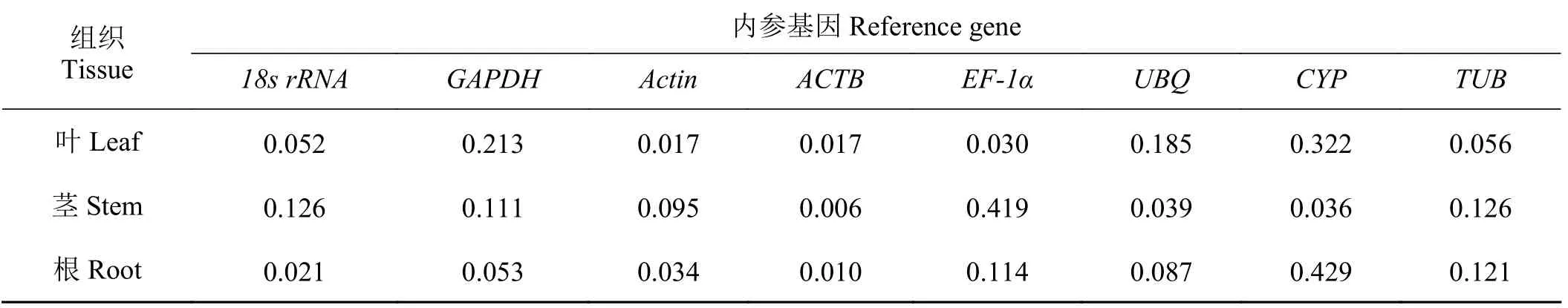
表2 正常生长下不同组织中内参基因NormFinder分析稳定值Table 2 Analysis of the stabilities of reference genes in different tissues under normal growth by NormFinder
2.2.3正常生长下巨菌草内参基因稳定性BestKeeper分析
BestKeeper通过比较内参基因的Ct值,计算得到标准偏差值SD(standard deviation,SD),从而评价内参基因的稳定性,当SD> 1,表明该基因不适合作为内参基因,反之SD越小,基因越稳定。所以,正常生长的巨菌草叶片中最稳定基因为Actin(0.04)和EF-1α(0.04);茎中为ACTB(0.04);根中为Actin(0.04)和18srRNA(0.04) (表3)。
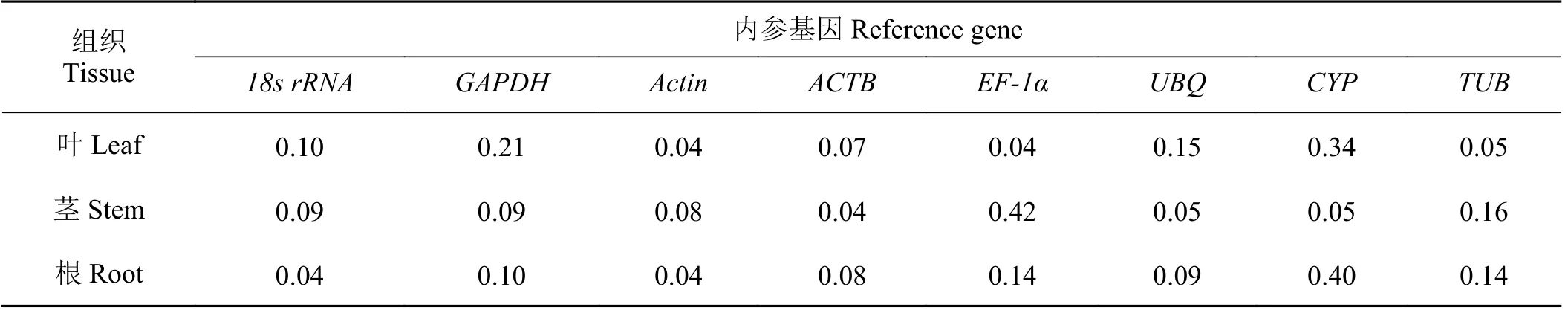
表3 正常生长下不同组织中内参基因BestKeeper分析标准差Table 3 Standard deviation of reference genes in different tissues under normal growth by BestKeeper analysis
2.3 不同干旱胁迫下巨菌草内参基因稳定性分析
2.3.1不同干旱胁迫下巨菌草内参基因稳定性geNorm分析
干旱胁迫7 d,叶片中geNorm表达稳定性最好的基因为UBQ(0.024)和18s rRNA(0.024);茎中为GAPDH(0.057)和ACTB(0.057);根中为GAPDH(0.037)和UBQ(0.037) (图5)。干旱胁迫14 d,Actin(0.044)和GAPDH(0.044)在叶片中稳定性最好;18s rRNA(0.068)和UBQ(0.068)在茎中稳定性最好;ACTB(0.038)和18s rRNA(0.038)在根中稳定性最好。干旱胁迫21 d,叶片中UBQ(0.025)和ACTB(0.025)表达最稳定;茎中18s rRNA(0.031)和TUB(0.031)表达最稳定;根中GAPDH(0.053)和18s rRNA(0.053)表达最稳定。对干旱胁迫7、14和21 d基因geNorm表达稳定性进行综合排序。其中叶片中内参基因表达稳定性由低到高依次为CYP<EF-1α<TUB<18s rRNA<ACTB=UBQ<GAPDH<Actin;茎中为CYP<EF-1α<Actin<UBQ<GAPDH<TUB<ACTB<18s rRNA;根中 为TUB<EF-1α<CYP<UBQ<Actin<ACTB<GAPDH<18s rRNA。即geNorm分析干旱胁迫处理下巨菌草叶片的最稳定基因为Actin;茎和根均为18s rRNA。
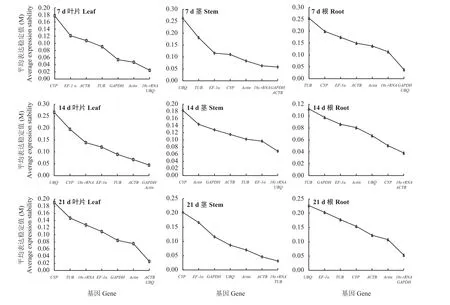
图5 不同干旱胁迫、不同组织中内参基因geNorm分析稳定值Figure 5 Analysis of the stabilities of reference genes in different tissues under different drought stress by geNorm
干旱胁迫7 d处理下,叶片、茎、根的V2/3值依次为0.019、0.020和0.05 (图6 );干旱胁迫14 d,叶片、茎、根的V2/3值依次为0.026、0.036和0.019;干旱胁迫21 d,叶片、茎、根的V2/3值依次为0.033、0.017和0.045。上述V2/3值均小于0.15。表明干旱胁迫处理下巨菌草叶片、茎、根所需的最适内参基因数均为2。
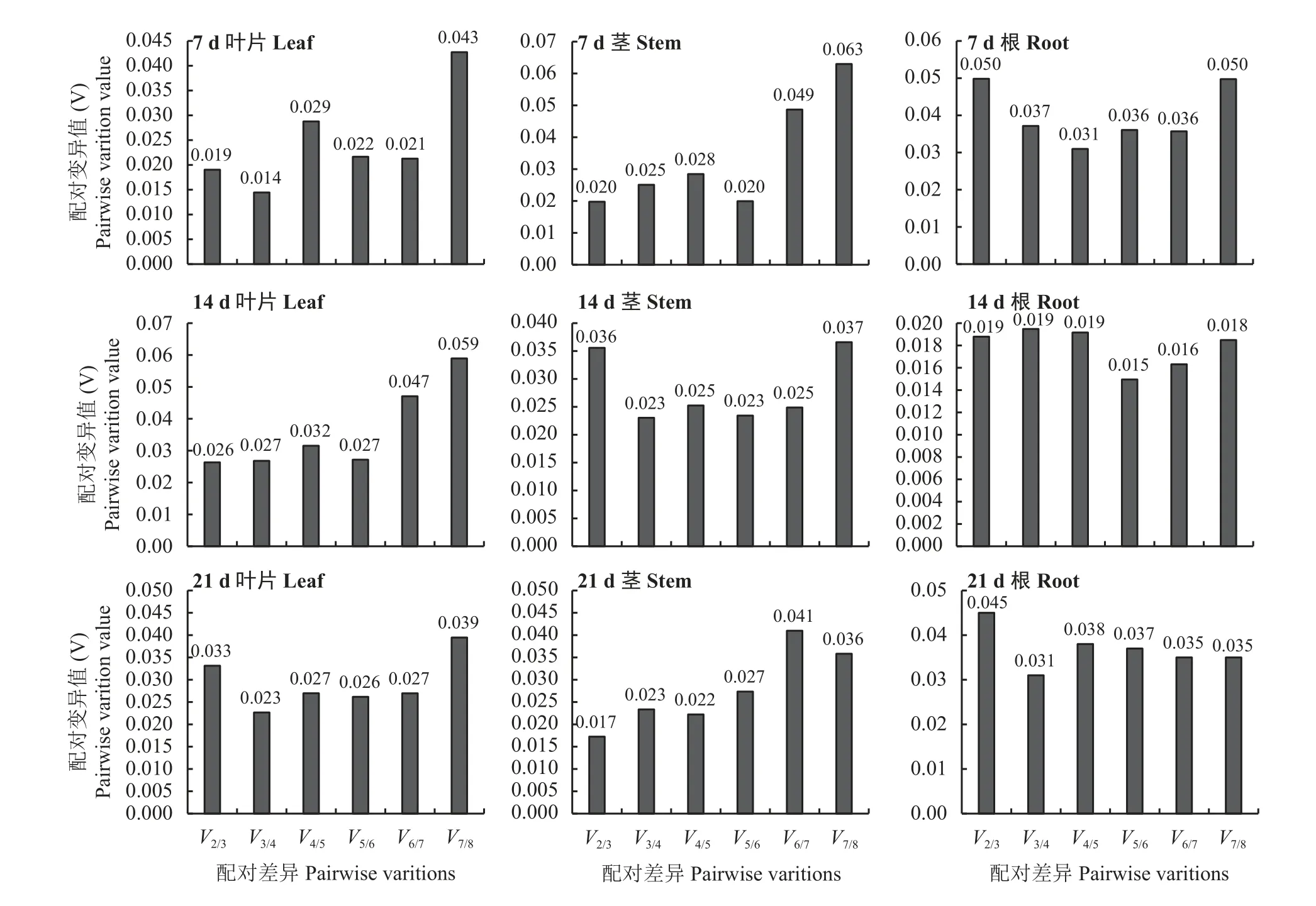
图6 不同干旱胁迫、不同组织中配对差异分析(Vn/n+1)最佳组合的内参基因数Figure 6 Paired difference analysis (Vn/n+1), the best combination of reference genes number in different tissues under different drought stress
2.3.2不同干旱胁迫下巨菌草内参基因稳定性NormFinder分析
干旱胁迫处理下内参基因NormFinder分析的稳定值(表4)中,干旱胁迫7 d,叶片中最稳定基因为ACTB(0.006);茎中为GAPDH(0.015);根中为18s rRNA(0.029)和ACTB(0.029)。干旱胁迫14 d,Actin(0.015)和GAPDH(0.015)在叶片中表达最稳定;18s rRNA(0.024)在茎中表达最稳定;UBQ(0.016)在根中表达最稳定。干旱胁迫21 d,叶片中GAPDH(0.009)表达最稳定;茎中ACTB(0.009)表达最稳定;根中18s rRNA(0.018)和GAPDH(0.018)表达最稳定。对干旱胁迫7、14和21 d NormFinder表达稳定性进行综合排序,其中叶片中内参基因表达稳定性由低到高依次为TUB<UBQ<CYP<EF-1α<ACTB=18s rRNA<GAPDH=Actin;茎中为CYP<Actin=EF-1α=UBQ<TUB<ACTB<GAPDH<18s rRNA;根中为TUB<UBQ=EF-1α<CYP<GAPDH<Actin=ACTB<18s rRNA。即NormFinder分析干旱胁迫处理下巨菌草叶片的最稳定基因为Actin和GAPDH;茎和根均为18s rRNA。

表4 不同干旱胁迫、不同组织中内参基因NormFinder分析稳定值Table 4 Analysis of the stabilities of reference genes in different tissues under different drought stress by NormFinder
2.3.3不同干旱胁迫下巨菌草内参基因稳定性BestKeeper分析
干旱胁迫7 d,BestKeeper分析叶片中最稳定基因为TUB(0.03);茎中为ACTB(0.02);根中为Actin(0.03)。干旱胁迫14 d,GAPDH(0.04)和ACTB(0.04)在叶片中表达最稳定;18s rRNA(0.02)在茎中表达最稳定;ACTB(0.01)在根中表达最稳定。干旱胁迫21 d,叶片中UBQ(0.02)和ACTB(0.02)表达最稳定;茎中TUB(0.06)、GAPDH(0.06)和ACTB(0.06)表达最稳定;根中18s rRNA(0.02)表达最稳定(表5)。对干旱胁迫7、14和21 dBestKeeper表达稳定性进行综合排序,其中叶片中内参基因表达稳定性由低到高依次为CYP<TUB<18s rRNA<Actin=UBQ<GAPDH=EF-1α<ACTB;茎中为CYP<Actin<UBQ<EF-1α<TUB<18s rRNA=GAPDH=ACTB;根中为TUB<UBQ<EF-1α<GAPDH<CYP<Actin<ACTB<18s rRNA。即BestKeeper分析干旱胁迫处理下巨菌草叶片的最稳定基因为ACTB;茎为18s rRNA、GAPDH和ACTB;根为18s rRNA。

表5 不同干旱胁迫、不同组织中内参基因BestKeeper分析稳定值Table 5 Analysis of the stabilities of reference genes in different tissues under different drought stress by BestKeeper
2.4 不同盐碱胁迫下巨菌草内参基因稳定性分析
2.4.1不同盐碱胁迫下巨菌草内参基因稳定性geNorm分析
60 mmol·L-1混合盐碱胁迫,geNorm分析叶片中最稳定基因为UBQ(0.079)和EF-1α(0.079);茎中为TUB(0.039)和GAPDH(0.039);根中为UBQ(0.066)和TUB(0.066) (图7)。120 mmol·L-1混合盐碱胁迫,Actin(0.031)和GAPDH(0.031)在叶片中表达最稳定;ACTB(0.054)和Actin(0.054)在茎中表达最稳定;TUB(0.069)和CYP(0.069)在根中表达最稳定。180 mmol·L-1混合盐碱胁迫,叶片中UBQ(0.078)和GAPDH(0.078)表达最稳定;茎中TUB(0.037)和GAPDH(0.037)表达最稳定;根中UBQ(0.050)和EF-1α(0.050)表达最稳定。对60、120和180 mmol·L-1混合盐碱胁迫geNorm表达稳定性进行综合排序,其中叶片中内参基因表达稳定性由低到高依次为CYP<ACTB<18s rRNA<EF-1α<Actin<TUB<UBQ<GAPDH;茎中 为CYP<UBQ=18s rRNA<Actin<ACTB=EF-1α<GAPDH<TUB;根中为Actin<18s rRNA<EF-1α=CYP=GAPDH<ACTB<TUB<UBQ。即geNorm分析盐碱胁迫处理下巨菌草叶片的最稳定基因为GAPDH;茎为TUB;根为UBQ。
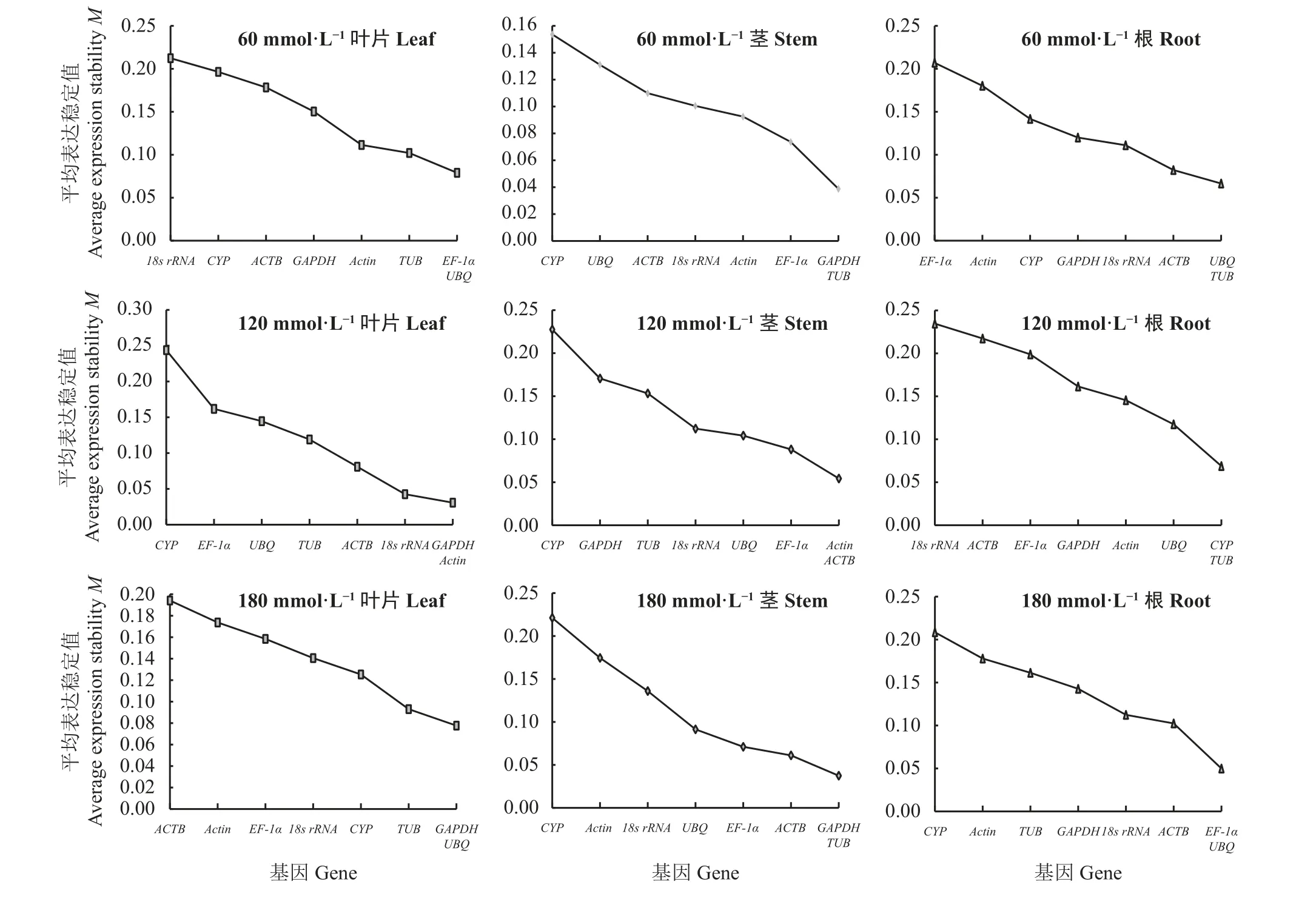
图7 不同盐碱胁迫、不同组织中内参基因geNorm分析稳定值Figure 7 Analysis of the stabilities of reference genes in different tissues under different salt-alkali stress by geNorm
60 mmol·L-1混合盐碱胁迫处理下,叶片、茎、根的V2/3值依次为0.036、0.030和0.029 (图8);120 mmol·L-1混合盐碱胁迫,叶片、茎、根的V2/3值依次为0.016、0.035和0.046;180 mmol·L-1混合盐碱胁迫,叶片、茎、根的V2/3值依次为0.031、0.024和0.043。上述V2/3值均小于0.15,表明盐碱胁迫处理下巨菌草叶片、茎、根所需的最适内参基因数均为2。
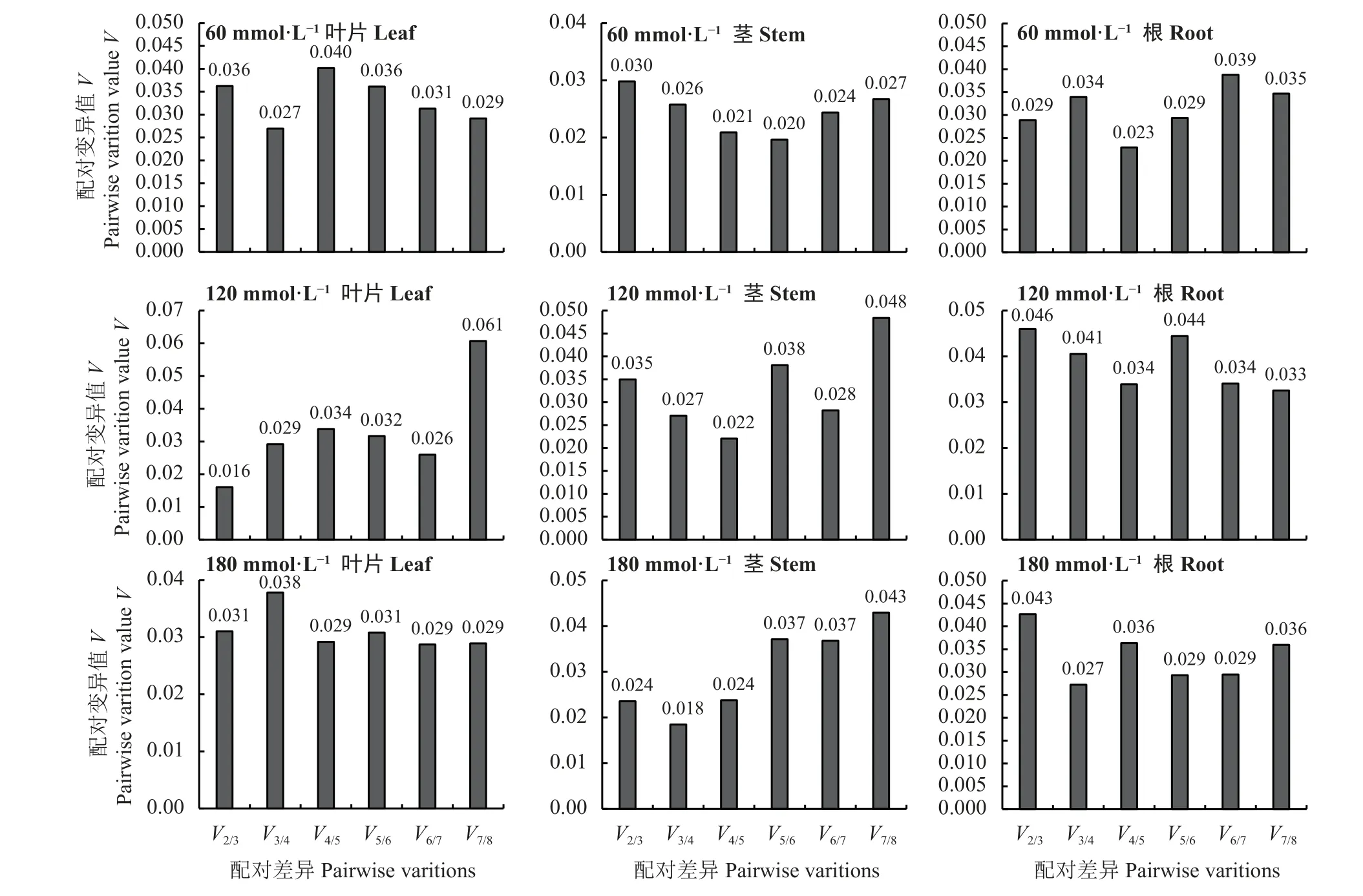
图8 不同盐碱胁迫、不同组织中配对差异分析(Vn/n+1)最佳组合的内参基因数Figure 8 Paired difference analysis (Vn/n+1), the best combination of reference genes number in different tissues under different salt-alkali stress
2.4.2不同盐碱胁迫下巨菌草内参基因稳定性NormFinder分析
60 mmol·L-1混合盐碱胁迫,NormFinder分析叶片中最稳定基因为EF-1α(0.027);茎中为TUB(0.034);根中为GAPDH(0.029)。120 mmol·L-1混合盐碱胁迫,Actin(0.011)和GAPDH(0.011)在叶片中表达最稳定;UBQ(0.027)在茎中表达最稳定;GAPDH(0.032)在根中表达最稳定。180 mmol·L-1混合盐碱胁迫,叶片中GAPDH(0.013)表达最稳定;茎中TUB(0.013)表达最稳定;根中UBQ(0.017)表达最稳定(表6)。对60、120和180 mmol·L-1混合盐碱胁迫NormFinder表达稳定性进行综合排序,其中内参基因在叶片中表达稳定性由低到高依次为CYP<ACTB<Actin=EF-1α<TUB=18s rRNA<UBQ<GAPDH;茎中为CYP<Actin<UBQ<18s rRNA=EF-1α<GAPDH<ACTB<TUB;根中为TUB<EF-1α<Actin=18s rRNA<CYP<ACTB<GAPDH=UBQ。即NormFinder分析盐碱胁迫处理下巨菌草叶片的最稳定基因为GAPDH;茎为TUB;根为UBQ和GAPDH。
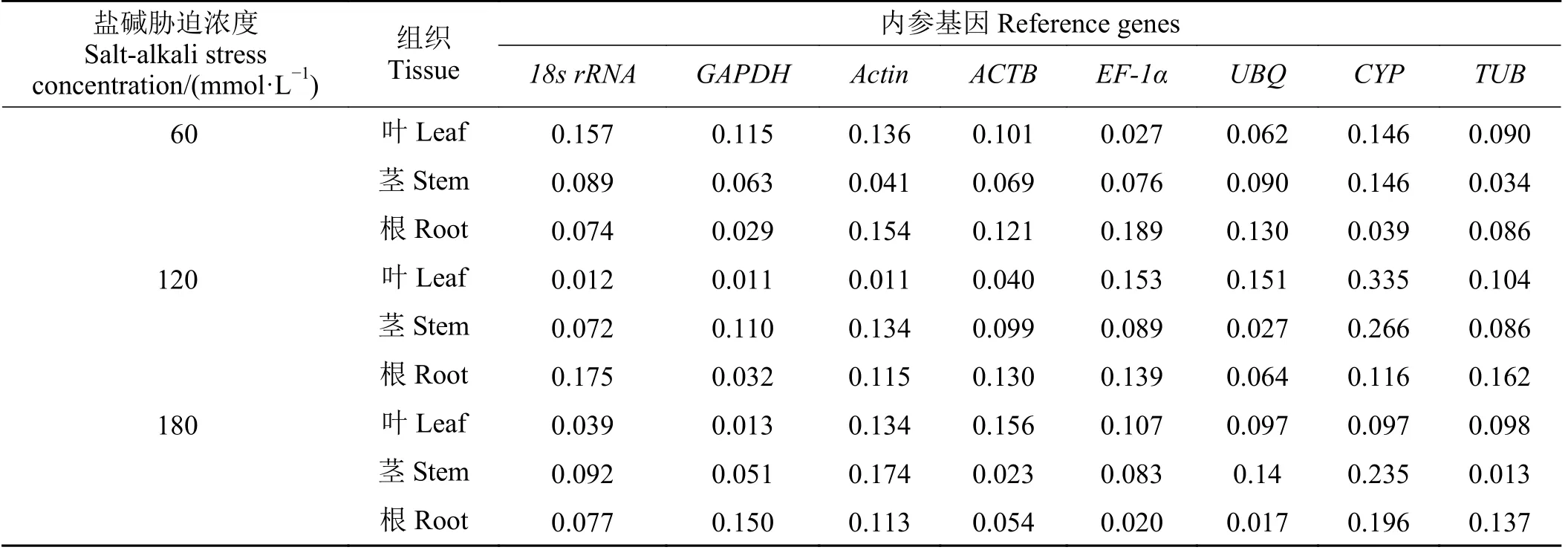
表6 不同盐碱胁迫、不同组织中内参基因NormFinder分析稳定值Table 6 Analysis of the stabilities of reference genes in different tissues under different salt-alkali stress by NormFinder
2.4.3不同盐碱胁迫下巨菌草内参基因稳定性BestKeeper分析
60 mmol·L-1混合盐碱胁迫, BestKeeper分析叶片中最稳定基因为EF-1α(0.03);茎中为GAPDH(0.04)、TUB(0.04)和EF-1α(0.04);根中为18s rRNA(0.03)。120 mmol·L-1混合盐碱胁迫,GAPDH(0.04)在叶中表达最稳定;UBQ(0.04)在茎中表达最稳定;GAPDH(0.04)在根中表达最稳定。180 mmol·L-1混合盐碱胁迫,叶片中GAPDH(0.04)表达最稳定;茎中TUB(0.06)表达最稳定;根中TUB(0.04)表达最稳定(表7)。对60、120和180 mmol·L-1混合盐碱胁迫BestKeeper表达稳定性进行综合排序,其中内参基因在叶片中表达稳定性由低到高依次为CYP<ACTB<18s rRNA=Actin<EF-1α=UBQ<TUB<GAPDH;茎中为CYP<Actin<UBQ<ACTB=GAPDH=18s rRNA<EF-1α<TUB;根中为CYP=Actin<EF-1α<18s rRNA<TUB<GAPDH<UBQ<ACTB。即BestKeeper分析盐碱胁迫处理下巨菌草叶片的最稳定基因为GAPDH;茎为TUB;根为ACTB。
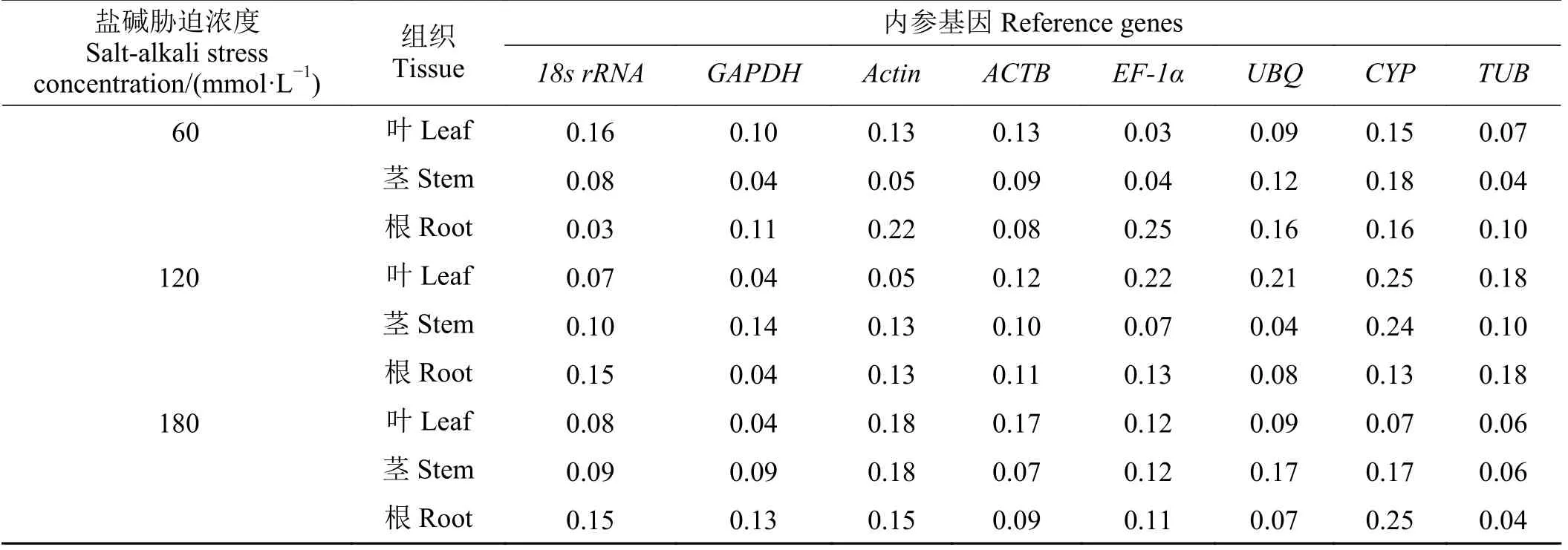
表7 不同盐碱胁迫、不同组织中内参基因BestKeeper分析标准差Table 7 Standard deviation of reference genes in different tissues under different salt-alkali stress by BestKeeper analysis
2.5 不同处理下巨菌草内参基因稳定性赋值法综合排序分析
由于各个算法得到的基因稳定性表达结果存在差异,所以使用赋值法对3种算法的排序结果进行综合分析。每个算法下各个内参基因的稳定性由高到低依次记为1~8,最终数值最小的基因最稳定。赋值法综合排序分析正常生长下,叶片中Actin基因稳定性最好,CYP最差;茎中ACTB基因稳定性最好,EF-1α最差;根中ACTB基因稳定性最好,CYP最差。干旱胁迫处理下,GAPDH在叶片中稳定性最好,CYP最差;18s rRNA在茎中稳定性最好,CYP最差;18s rRNA在根中稳定性最好,TUB最差。盐碱胁迫处理下,叶片中最稳定基因为GAPDH,最不稳定基因为CYP;茎中最稳定基因为TUB,最不稳定基因为CYP;根中最稳定基因为UBQ,最不稳定基因为Actin(表8)。
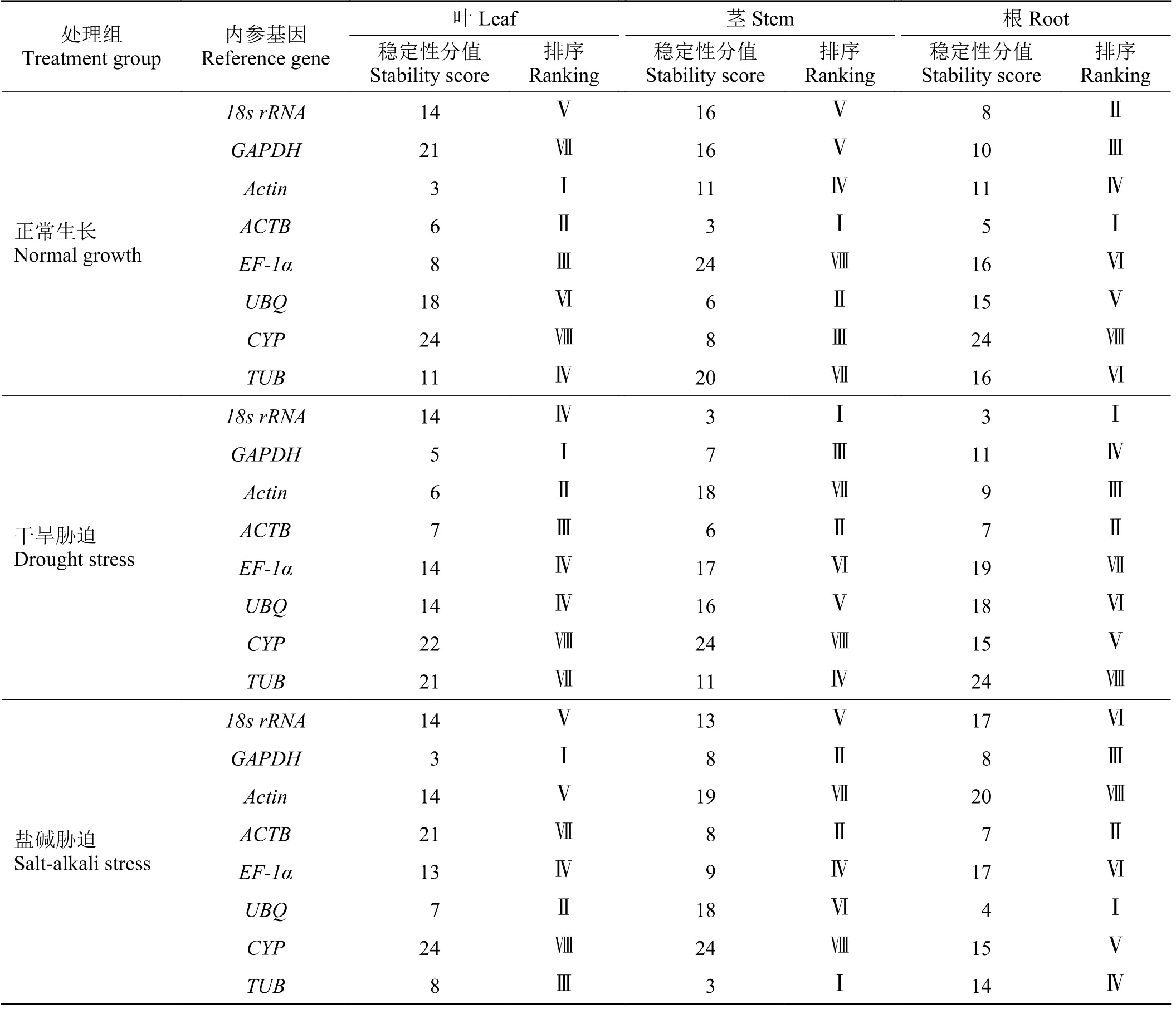
表8 不同处理、不同组织中内参基因稳定性综合排序Table 8 Comprehensive ranking of the stability of reference genes in different tissues under different treatments
3 讨论与分析
现代分子生物学常以qRT-PCR技术进行目的基因表达情况的分析,而选择合适的内参基因是获得准确表达结果的前提。但由于发现新的内参基因对技术的要求高且试验步骤繁琐,因此现常用传统内参基因来校正目的基因的表达量。本研究选用8个传统内参基因(18s rRNA、Actin、GAPDH、ACTB、EF-1α、UBQ、CYP、TUB)作为候选内参基因。其中,18s rRNA为真核核糖体RNA,作为细胞中的保守基因,常参与编码核糖体基因和核糖体循环[26-27];Actin是细胞骨架的基本构成单位,参与细胞分裂等生理活动[28];GAPDH参与糖酵解、糖异生等过程[29];EF-1α在蛋白质合成延伸过程中起作用;UBQ为多聚泛素酶,常作用于修饰蛋白质;TUB参与细胞生长过程;CYP参与调节肽基脯氨酸顺反异构酶活性[3]。
本研究对巨菌草进行正常生长、干旱胁迫以及盐碱胁迫处理后,通过geNorm、NormFinder和BestKeeper计算8个内参基因在叶片、茎和根中的表达稳定值。但各个软件的算法原理不同,得出的最稳定基因也不一致。这在如羊草[20]、二穗短柄草(Brachypodium distachyon)[30]、大豆(Glycine max)[31]等内参基因研究中也存在。geNorm通过计算基因稳定性M值和配对变异V值来确定基因的稳定性和最适基因的数量。M值低于阈值1.5,说明该基因适合作内参,反之则不适合,且M值越小稳定性越好。而当Vn/n+1< 0.15时,最适基因数为n个[4]。NormFinder与 geNorm计算原理大致上相同,都是基于计算内参基因的稳定性数值来确定基因是否稳定。其中geNorm是在不考虑其他基因的情况下,以该基因的组内表达情况进行排序,而NormFinder则是根据样品组内变异和组间变异进行排序[4,32]。BestKeeper以原始Ct值进行配对相关性分析计算得到标准差(SD),若SD低于阈值1,则表明基因稳定表达,适合作为内参基因,反之则不适合,且SD越小越稳定[4]。本试验处理下的内参基因的M值均小于1.5,SD值均小于1,表明各内参基因符合要求。因此,最后通过赋值法综合筛选出最佳的内参基因。
Actin基因的基因序列具有高度保守性,使其几乎在所有真核细胞中都有表达,被认为是qRTPCR分析中内参基因的合适选择[33-34]。有研究表明在羊草叶片中Actin稳定性较高[20];在草地早熟禾叶片的不同发育期Actin表达也最为稳定[7];在不同处理条件下的大麦中Actin表达均稳定[11],与本研究结果相符,即本研究正常生长下的叶、茎和根中Actin类基因均稳定表达。18s RNA在本研究所有处理下表达丰度均较高,且在干旱胁迫下茎和根中表达最稳定。但有研究[35-36]表明,虽然18s RNA表达丰度较高,但其稳定性差,因此不适合作为虫害处理下水稻和铝处理下绣球(Hydrangea macrophylla)的内参基因。考虑到样本RNA量、目标基因表达丰度等均会影响18s rRNA的表达稳定性[7]。因此,可根据试验需要选择另一个稳定的内参基因与18s rRNA组合,而不是单独以18s rRNA作为内参基因进行目的基因表达分析。但若目标基因表达丰度高,则可用18s rRNA单独作为内参基因。本研究的多数条件下CYP表达都不稳定,但在Mallona等[37]对矮牵牛(Petunia hybrida)叶与花组织的研究下,CYP和EF-1α可作为稳定的内参基因组合来进行目的基因表达量的校正。丁苏芹等[38]的研究表明,在小苍兰(Freesia hybrida)不同发育时期的球茎中CYP表达最不稳定,而在不同外源激素诱导下的小苍兰种球中CYP稳定性较好。进一步说明不同条件下同一个基因的稳定性也不相同。后续研究可在确定具体的试验条件后再进行内参基因的筛选,从而提高试验数据的准确性。正因如此,有些研究选择两个或以上基因组合来校正数据,从而更好的提高数据的准确性。如武志娟等[21]通过ΔCt、geNorm和NormFinder方法对干旱胁迫下的大针茅叶和根部组织进行分析后,再从每个分析中选择稳定表达的前3个基因,最终确定叶中稳定基因组合为18s rRNA和TLF;根中为18s rRNA和EF-1α。
本研究中,正常生长下,Actin在叶中表达最为稳定;ACTB在茎和根中表达最为稳定。干旱胁迫下,GAPDH在叶中表达最为稳定;18s rRNA在茎和根中表达最为稳定。盐碱胁迫下,GAPDH在叶中表达最为稳定;TUB在茎中表达最为稳定;UBQ在根中表达最为稳定。未发现在不同条件下均稳定表达的基因,这与前人关于植物内参基因的报道相同,但上述结论可以作为日后巨菌草在胁迫处理下的合适候选内参。此外,在实际研究中不太可能因不同组织选用不同内参,在兼顾稳定性和准确性的基础上,通过赋值法将内参基因在不同处理下的稳定性前三者进行统计,发现ACTB除在盐碱胁迫处理下的叶片外,其他处理下的各个组织中稳定性均在前三。表明ACTB在不同处理下的较稳定,受外界因素变化的影响相比其余基因较小,因此本研究中筛选的巨菌草内参基因为ACTB。
4 结论
本研究基于qRT-PCR对正常生长、干旱胁迫和盐碱胁迫处理下巨菌草的叶片、茎和根的内参基因进行了筛选,发现ACTB表达较稳定,为巨菌草的内参基因。由于目前暂无巨菌草内参基因稳定性的研究,因而本研究结果为后续巨菌草功能基因表达分析奠定了基础。
