黑叶猴肠道纤维素降解菌筛选鉴定及对鸡饲料粗纤维降解效率的影响
2022-05-22庞美玲周心意陆祖军
庞美玲 周心意 陆祖军
摘 要 利用选择性培养基筛选获得目标菌株,并鉴定其分类属性;采用单因素试验设计,筛选最适产酶条件;再将该菌株作为饲料添加剂饲养鸡群,探明其对鸡饲料粗纤维降解效率及鸡群体重的影响,旨在筛选黑叶猴(Trachypithecus francoisi)肠道高效纤维素降解菌,为人体肠道益生菌群或畜牧业饲料添加剂扩大菌谱。结果:鉴定出黑叶猴肠道的纤维素降解菌株为芽孢杆菌属的一种(Bacillus sp.),并命名为GXNQ-1;其最适产酶条件为:温度40 ℃,pH值6,培养时间为24 h,底物浓度(CMC-Na)为0.94%,此时该菌株酶活力值达48 U;在40日龄前每隔10日给鸡群灌服500 μL(OD540=0.86)的试验菌液取得明显的增重效果。
关键词 黑叶猴;纤维素降解菌;酶学特征;粗纤维消化率;鸡群体重
中图分类号:S816.3 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2022.07.001
纤维素是地球上最丰富的可再生资源之一,但动物肠道内很少有相应的降解酶能将其降解为单体葡萄糖,只有少部分真菌和细菌能产生相应降解酶将其降解利用[1]。
酶解和微生物降解使纤维素转变为葡萄糖分子,是纤维素开发利用的基础和前提[1]。王安以纤维素复合酶作为青贮添加剂,提高了玉米秸秆饲用价值,为纤维素复合酶在饲料中合理利用提供依据[2]。施力光等揭示了纤维分解菌在反刍动物营养代谢中的重要作用[3]。刘幼强以甘蔗渣为唯一碳源,筛选出可高效分解甘蔗渣的复合菌群并应用于固态发酵,实现了以甘蔗渣为原料生产燃料酒精的目标[4]。李旺等在雞饲料中添加可产生纤维素降解酶的菌株,显示其有助于粗纤维的消化、转化[5]。
黑叶猴(Trachypithecus francoisi)属于国家一级保护动物,主要分布于广西、云南、贵州部分喀斯特地区,以叶食性为主[7]。根据适应进化学说,黑叶猴体内(肠道)微生物应该存在适应其生存环境(食物)的相应菌群,且有可能进化成具有特异功能的菌群,如高效降解利用纤维素的菌株,但目前尚无相关研究报道。灵长类动物与人类亲缘关系近,遗传背景相似,挖掘并开发利用该猴肠道内具有降解纤维素的微生物,是对人体肠道纤维素降解菌筛选、畜牧业饲料添加剂菌谱扩大、珍稀濒危动物保护与利用的一种有益尝试。
1 材料与方法
1.1 试验材料
1.1.1 菌株
2019年11月于广西梧州黑叶猴保护基地随机采集黑叶猴新鲜粪便。利用已灭菌采样棒采集排放到地面上不足5 min的新鲜黑叶猴粪便内里部分,并迅速放入已备好的灭菌采样管中,放入实验室-4 ℃冰箱内储藏,12 h内分离纯化目标菌株。
1.1.2 培养基
1.1.2.1 富集培养基
牛肉膏蛋白胨培养基:蛋白胨8 g,牛肉膏4 g,可溶性淀粉1.6 g,NaCl 4 g,琼脂16 g,蒸馏水800 mL,pH值为7。
1.1.2.2 分离筛选培养基
1)CMC-Na固体培养基:K2HPO4 0.25 g,MgSO4 0.125 g,琼脂10 g,羧甲基纤维素钠0.94 g,NH4NO3 0.3 g,刚果红0.1 g,蒸馏水500 mL,pH值为7。
2)CMC-Na液体培养基:在CMC-Na固体培养基基础上减除10 g琼脂,其余同。
1.1.3 试剂
1 mol·L-1的盐酸溶液(AR,上海尚宝生物科技有限公司,下同),1%氢氧化钠溶液,DNS试剂,1 mg·mL-1葡萄糖溶液,1%羧甲基纤维素钠(CMC-Na)溶液,1 g·L-1刚果红溶液,30%甘油溶液。
1.1.4 饲料
饲养鸡的饲料购自南宁漓江源粮油饲料有限公司,生产厂家标注的主要成分如表1所示;委托青岛正信检测公司对该饲料进行粗纤维素含量测定,得到其粗纤维素含量为6.7%。
1.2 试验方法
1.2.1 纤维素降解菌株的分离、筛选
1.2.1.1 粪便悬液和梯度稀释液制备、涂布和富集
称取相当于1.0 g干燥粪便的新鲜粪便(120 ℃加热至恒重时含水量为84.8%)样品1.17 g溶于99 mL生理盐水中,充分振荡20 min,使粪便样品中的细菌分散,制成粪便悬液。参照文献[8]制成0、10-1、10-2、10-3、10-4、10-5、10-6不同稀释度的粪便溶液。取各梯度稀释菌悬液0.2 mL,用无菌涂布器均匀涂布牛肉膏蛋白胨培养基平板,36 ℃倒置培养48 h分离单菌落。每个梯度设置3个重复,共21个平板。
1.2.1.2 目标菌株分离、培养和保存
将牛肉膏蛋白胨培养基平板形成的所有单菌落用牙签点接于CMC-Na固体培养基平板上,设置3个重复。培养皿封口后37 ℃倒置培养96 h,将有透明圈的菌落同时分别移接2套CMC-Na固体培养基平板(网格化点接标记),培养皿封口后再37 ℃倒置培养96 h。以每皿 1 mL刚果红溶液(1 g·L-1)对其中1套CMC-Na固体培养基平板染色,20 min后,缓慢倾弃刚果红溶液。从另一套CMC-Na固体培养基平板上选取刚果红溶液染色后透明圈最大的菌落为目标菌株。挑取目标菌株于液体培养基内37 ℃培养8 h,以30%甘油和菌液等体积混合并参照文献[8]进行菌种保藏。
1.2.2 目标菌株的鉴定
在观察菌落形态、颜色、质地基础上,以革兰氏染色法初步确定菌株的微生物类别[8];以16S rDNA扩增子测序方法进行菌株的分子鉴定[9]。CTAB抽提法提取目标菌种基因组后,以引物(7F:5′-CAGAGTTT GATCCTGGCT-3′;1540R:5′-AGGAGGTGATCCAG CCGCA-3′)PCR扩增(退火温度:55 ℃)及电泳检定扩增片段的单一性及长度(1 500 bp左右)。将PCR单一片段产物直接送上海生工公司测序。测序结果于NCBI网站(https://www.ncbi.nlm.nih.gov/)上进行BLASTN比对,同时利用软件(MEGA7)构建系统发育进化树,确定目标菌株的分类属性。3B36E9D2-FCB4-4A94-84CC-AB2374FBC5B7
1.2.3 胞外纤维素酶活性测定
参照文献[10]进行酶活性测定。酶活力单位(U)规定为每分钟水解CMC-Na产生1 μg葡萄糖所需酶量。
1.2.3.1 温度对酶活性的影响
将37 ℃培养24 h的目标菌株菌液置于不同溫度中进行培养,探究不同温度对产生的胞外纤维素酶酶活性的影响[9]。具体为4 ℃、转速6 000 r·min-1条件下离心3 min后,取0.5 mL上清液(粗酶液)与1.5 mL CMC-Na溶液混合(冰上),另取0.5 mL无菌水与1.5 mL CMC-Na溶液混合作为对照(冰上)。分别在20 ℃、30 ℃、40 ℃、50 ℃、60 ℃下水浴加热30 min,随后立即加1.5 mL DNS试剂(显示剂),并在100 ℃下水浴加热10 min,取出后立即冰上冷却,用无菌蒸馏水定容至25 mL,测定OD540吸光值并记录。
1.2.3.2 pH值对酶活性的影响
将37 ℃培养24 h的目标菌株菌液置于不同pH的培养基中进行培养,探究不同pH对产生的胞外纤维素酶酶活性的影响[11]。具体为用1 mol·L-1盐酸溶液、1%氢氧化钠溶液将CMC-Na溶液的pH值分别调至2、4、6、8、10、12、14。取各pH值的CMC-Na溶液1.5 mL与0.5 mL粗酶液(目标菌液在4 ℃、转速6 000 r·min-1条件下离心3 min后取上清液)混合(冰上),另取1.5 mL CMC-Na溶液与0.5 mL无菌水混合作为对照组(冰上)[9]。在最适温度(通过1.2.3.1确定)下水浴加热30 min,随后立即加1.5 mL DNS试剂(显示剂),并在100 ℃下水浴加热10 min,取出后立即冷却,用无菌蒸馏水定容至25 mL,测定OD540吸光值并记录。
1.2.3.3 CMC-Na浓度对酶活性的影响
将CMC-Na作为唯一碳源制备成CMC-Na含量不同的液体培养基(CMC-Na含量不同,其余成分含量相同),CMC-Na含量分别是0.07%、0.13%、0.19%、0.25%、0.31%。分别加入1 mL的目标菌液(OD540=0.86),在最适温度(通过1.2.3.1确定)、最适pH值(通过1.2.3.2确定)下摇床培养10 h,以粗酶液进行CMC-Na糖化力测定,明确CMC-Na底物浓度对胞外纤维素酶酶活性的影响[13]。
1.2.3.4 目标菌株培养时间对酶活性的影响
目标菌株在最佳CMC-Na浓度(通过1.2.3.3确定)、最适温度(通过1.2.3.1确定)、最适pH值(通过1.2.3.2确定)培养基中培养不同时间,探究目标菌株培养时间对胞外纤维素酶酶活性的影响。将目标菌株接种于培养基中,共2瓶,编号为1、2。摇床培养条件下(37 ℃,120 r·min-1),每隔12 h随机取出1瓶,在超净工作台上取1 mL菌液于已灭菌的离心管中(取完菌液后立即将已接菌的培养基放回摇床中继续摇床培养),并测定胞外纤维素酶酶活性[14]。以培养时间(h)为横坐标,酶活力(U)为纵坐标,确定菌株产出的胞外纤维素酶酶活性最高的培养时间。
1.2.4 市售肉鸡饲料粗纤维制取
采用滤袋技术分离饲料中的粗纤维[12]。先将1 g肉鸡饲料装入滤袋(盐城晨星环保科技有限公司生产的2号袋,规格180 mm×810 mm)并进行酸碱消煮(先加入150 mol·L-1硫酸并煮沸20 min,脱水并用蒸馏水处理至中性,再脱水3 min;后加入150 mol·L-1 KOH并煮沸20 min,使用相同方法恢复中性并脱水),再用丙酮脱脂,120 ℃烘干至恒重、称量。
1.2.5 应用试验
试验选用20日龄的黄羽肉鸡,随机分为4组,即1个对照组和3个处理组,每组10只。不同处理组每隔10日灌服不同剂量(灌服量分别为300、400、500 μL·只-1)的目标菌液(OD540=0.86),试验周期为40 d;规定前20 d为前期,后20 d为后期。每饲养20 d,以全收粪法收集鸡粪,测定各组鸡粪中粗纤维含量,同时检定饲养时段各组鸡群的存活、体重增长情况(体重取每组鸡群平均值)。通过比较灌服目标菌液前后鸡粪中纤维素含量差别,确定前、后期最适灌服菌液剂量[12]。
1.3 数据处理
采用Excel 2017软件对试验数据进行处理分析,结果以“平均值±标准差”表示;P值<0.05表示差异显著,P值<0.01表示差异极显著。
粗纤维消化率参照文献[15]计算。
粗纤维消化率=(采食量×饲料粗纤维含量-粪重×粪样粗纤维含量)/(采食量×饲料粗纤维含量)×100%。
2 结果与分析
2.1 目标菌株的分离与鉴定
2.1.1 目标菌株的筛选与分离
在CMC-Na固体培养基上筛选到呈最大透明圈的菌落1个,其长势较好,正面为淡黄色,中心隆起,边缘整齐,命名为GXNQ-1;经革兰氏染色后,呈紫色,可判定为革兰氏阳性细菌。
2.1.2 GXNQ-1的16S rDNA扩增子测序鉴定
2.1.2.1 GXNQ-1的16S rDNA的PCR扩增
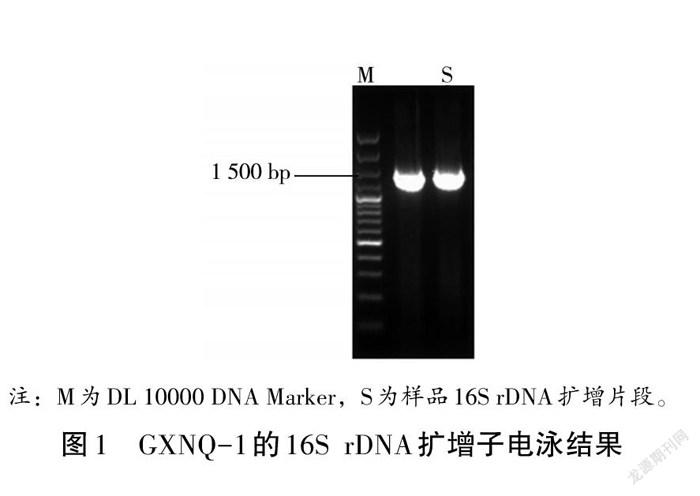
以提取的GXNQ-1基因组DNA为模板,利用细菌通用引物(7F、1540R)进行PCR扩增,取5 μL PCR产物进行1%琼脂糖凝胶电泳,结果见图1,单一扩增子长度约为1 500 bp的核苷酸片段,与预期相符。
2.1.2.2 GXNQ-1的16S rDNA扩增子序列及系统发育进化树3B36E9D2-FCB4-4A94-84CC-AB2374FBC5B7
将GXNQ-1的16S rDNA扩增片段送上海生工生物工程技术服务有限公司测序,显示扩增子序列长度为1 490 bp(核苷酸序列登录号为SUB10687086 GXNQ-1OL545364)。将该核苷酸序列与NCBI网站上的GenBank基因序列进行在线BLAST,发现其与Bacillus sp.同源性达100%。同時利用软件(MEGA7)对GXNQ-1的16S rDNA扩增子序列和相近物种者在线构建系统发育进化树,结果如图2。结合该菌的形态特征与培养特性,鉴定该菌为芽孢杆菌属的一种(Bacillus sp.)。
2.2 胞外纤维素酶酶活性测定结果
GXNQ-1胞外纤维素酶酶活性测定所用曲线的回归方程为y=0.987 5x-0.015 1(R2=0.999 1),说明曲线拟合程度较好,具有可信度。
2.2.1 GXNQ-1胞外纤维素酶酶活性最适温度
由图3可知,GXNQ-1菌所产的胞外纤维素酶酶活性最适反应温度为40 ℃,此时酶活力高达97.42 U;在20~40 ℃时,其酶活力随温度升高而升高,但高于40 ℃时,酶活力随温度升高而降低。
2.2.2 GXNQ-1胞外纤维素酶酶活性最适pH值
由图4可知,GXNQ-1胞外纤维素酶酶活性最适pH值为6,此时酶活力高达184.51 U;在pH值2~6时,其酶活力随pH升高而升高,但pH值超过6以后,其酶活力随pH升高而降低。
2.2.3 CMC-Na浓度对GXNQ-1胞外纤维素酶酶活性的影响
从图5可以看出,GXNQ-1菌在CMC-Na质量分数为0.19%的培养基中产生的胞外纤维素酶酶活力最高,达46.79 U。
2.2.4 培养时间对GXNQ-1菌株胞外纤维素酶酶活性的影响
由图6可知,培养时间为24 h时的GXNQ-1菌所产胞外纤维素酶酶活力最高,达48.81 U;培养时间超过24 h后,其所产胞外纤维素酶酶活力下降。
2.3 鸡群灌服GXNQ-1菌液对其所食用饲料粗纤维降解效果的影响
2.3.1 饲养前期鸡群灌服GXNQ-1菌液对粗纤维素降
解效果的影响
饲养前期雏鸡群灌服GXNQ-1菌液对粗纤维素降解效果的影响如表2所示。灌服GXNQ-1菌液的3个处理组(灌服量分别为300、400、500 μL·只-1)对粗纤维的消化率都显著高于对照组(提高10%以上)(P<0.05),但是3个处理组之间差异不显著(P>0.05)。
2.3.2 饲养后期鸡群灌服GXNQ-1菌液对粗纤维降解的影响
饲养后期鸡群灌服GXNQ-1菌液对粗纤维降解的影响如表3所示。灌服GXNQ-1菌液的3个处理组对粗纤维的消化率与对照组之间差异不显著(P>0.05),表明饲养后期鸡群灌服GXNQ-1菌液对粗纤维降解无显著影响。
2.3.3 灌服GXNQ-1菌液对鸡群体重的影响
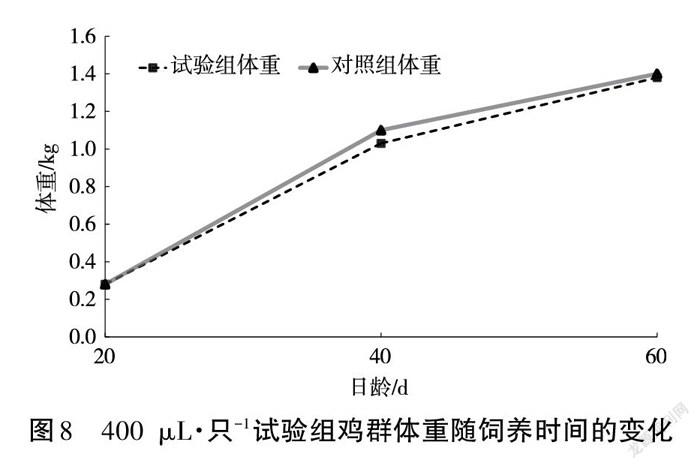
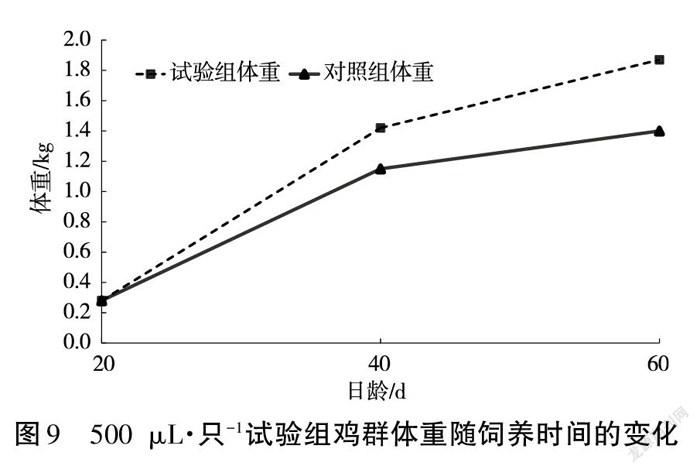
试验鸡群只有对照组中有1只鸡于饲养第10日死亡。饲养至20 d、40 d时(40日龄、60日龄),记录鸡群体重变化,结果如图7~图9所示。
结果表明,当每只鸡灌服GXNQ-1菌液为300 μL、400 μL时,无论是饲养前期还是后期,处理组和对照组无显著差异;当灌服量为500 μL·只-1时,饲养40 d(60日龄)的鸡群体重较对照增加了33.4%。
3 小结与讨论
3.1 纤维素降解菌的筛选
纤维素降解菌的筛选方法主要有纤维素刚果红培养基法、纤维素选择培养基法、半固体纤维素天青试管法、滤纸底物法等,其中纤维素刚果红培养基法应用得较多[5]。纤维素降解菌在纤维素刚果红培养基上培养一段时间后可产生透明圈,以透明圈直径大小判定菌株纤维素降解能力的强弱。透明圈出现的主要原因在于纤维素降解菌将菌株周围的纤维素分解成葡萄糖,葡萄糖不与刚果红形成红色复合物,但纤维素与刚果红可形成红色复合物,故出现以纤维素降解菌为中心的透明圈。由于纤维素刚果红培养基法呈现的结果明显,且易操作,目前普遍认为这是初步筛选纤维素分解菌的较好方法[5]。基于此,本试验采用纤维素刚果红培养基法检定黑叶猴肠道高效降解纤维素的GXNQ-1菌株。
经过菌株形态判定、革兰氏染色鉴定,初步鉴定GXNQ-1菌为革兰氏阳性细菌。通过目前常用的16S rDNA扩增子测序后进行序列同源性比对、构建系统进化树,从而确定细菌种属。周新萍等从朽木中筛选、分离到1株高产纤维素酶的NC-7菌株,经形态观察和生理生化试验,再以16S rDNA扩增子测序后序列同源性比对,确定该菌株为放线菌链霉菌属生二素链霉菌(Streptomyces ambofaciens)[16]。本试验采用16S rDNA扩增子测序方法鉴定出黑叶猴肠道的纤维素降解菌株为芽孢杆菌属的一种(Bacillus sp.),并命名为GXNQ-1。
3.2 纤维素降解菌GXNQ-1的产酶条件优化
菌株不同,其最适产酶条件也有所差异。如何优化产酶条件,是菌株应用于生产实践的关键环节。钱文佳等优化了纤维素降解菌的产酶条件,进一步提高了该菌株纤维素酶的活性[17]。GXNQ-1分解利用纤维素的最佳条件为:温度40 ℃,pH值为6,培养时间24 h,培养基中的CMC-Na含量为0.19%,此条件下的酶活性达48 U。此条件温和,生产实践中易实现,说明本研究筛选到的菌株具有一定的应用价值。
3.3 纤维素降解菌GXNQ-1的应用试验
李旺等在鸡饲料中添加可产生纤维素降解酶的菌株,显示其有助于粗纤维的消化、转化[5]。孙元烽等从不同畜粪及三种商品微生物堆肥剂中筛选高效纤维素降解菌并在羊粪堆肥中初步应用,发现该菌能够有效提升纤维素降解效果[6]。王安等在蛋鸡日粮中加入纤维素酶,结果较大地提高了日粮纤维素消化率,说明鸡日粮中添加纤维素酶可有效提升纤维素降解效果,从而提高饲料粗纤维的消化率[3]。3B36E9D2-FCB4-4A94-84CC-AB2374FBC5B7
有学者以20日龄雏鸡为试验对象,发现其肝脏和消化道远未发育完全,肠道内微生物形成的微生态系统未达到稳定阶段[18]。房兴堂等通过对1~7周龄肉鸡的消化器官重量及消化道各部分长度进行测量,结果表明消化器官的变化随体重同步变化[19]。程郁昕等以AA肉鸡商品为试验材料,测量不同肉鸡的消化道各部分长度,得出消化道的生长势在28日龄以前最强[20]。
将GXNQ-1菌液作为饲料添加剂饲养鸡群的试验表明,饲养前期(前20 d,日龄20~40 d)灌服试验菌液使鸡群对纤维素的分解效率显著增加,但不同的灌服剂量(300 μL·只-1、 400 μL·只-1、500 μL·只-1)对纤维素的消化率并无显著差异;饲养后期(后20 d,日龄40~60 d),灌服GXNQ-1菌液对鸡的粗纤维素消化率无显著影响,仅有灌服菌液(500 μL·只-1)饲养40 d(日龄60 d)的鸡群体重较对照增加了33.4%;这显然是菌液改善了饲养前期雏鸡的营养供给(纤维素降解效率提高15.48%左右)所致,因为4周龄前是雏鸡消化器官(肝脏和消化道等)生长旺盛阶段[19]。
本试验通过给鸡群灌服GXNQ-1菌液,能较快地在饲养前期的鸡群肠道内建立以GXNQ-1为优势菌群的新微生态平衡,提高纤维素的降解效率,改善试验条件下的养分供给,提高试验组鸡群的代谢效率,使其体重快速增加。饲养后期的鸡群肝脏和消化道发育较完全,肠道内微生物形成的微生态系统接近稳定状态,使GXNQ-1难以成为优势菌群从而提高饲料中粗纤维的降解效率,使试验组鸡群体重没法快速增加,但由于有饲养前期的代谢效率优势作基础,处理组鸡群在试验时间结束时仍有体重较对照组增加33.4%的明显效果。因此,以GXNQ-1菌株作为饲料添加剂饲养肉鸡时,40日龄前每隔10日灌服500 μL(OD540=0.86)的目标菌液将取得明显的增重效果。
参考文献:
[1] 李琼芳,刘明学,徐志鹏.纤维素分解菌的分离及产酶条件研究[J].安徽农业科学,2008(18):7518-7520.
[2] 王安.纤维素复合酶在饲料中的作用及其应用的研究[J].东北农业大学学报,1998(3):29-44.
[3] 施力光,荀文娟,岳文斌.纤维素分解菌在反刍动物营养代谢中的研究进展[J].饲料广角,2008(21):23-24,27.
[4] 刘幼强.降解纤维素复合菌群的研究[D].厦门:厦门大学,2009.
[5] 李旺,孙二刚,刘永磊,等.添加纤维素酶产生菌对鸡饲料养分消化率的影响[J].饲料博览,2013(5):1-4.
[6] 孙元烽,钟杰,郑娟,等.高效纤维素降解菌筛选鉴定及在羊粪堆肥中的初步应用[J].黑龙江畜牧兽医,2019(24):57-61,174.
[7] 刘秀菊,吴茜,黄中豪,等.弄岗黑叶猴旱季食物营养组分及其对食物选择的影响[J].兽类学报,2016,36(2):241-247.
[8] 张龙翔.生化实验方法和技术(第2版)[M].北京:高等教育出版社,1997.
[9] 邢力,王经伟,沙俊男.一株纤维素降解真菌的筛选与鉴定[J].饲料研究,2019,42(9):83-86.
[10] 李兰晓,杜金华,李军训,等.CMC糖化力法测定纤维素酶活性条件的研究[J].饲料工业,2006(24):49-52.
[11] 李兰晓,杜金华,李军训,等.CMC糖化力法测定纤维素酶活性条件的研究[J].饲料工业,2006(24):49-52.
[12] 刘胜男,孙燕.滤袋法测定饲料粗纤维的操作流程及注意要点[J].饲料与畜牧,2017(15):55-56.
[13] 魏微,刘兆普,王琳,等.青霉菌B01产菊粉酶特性的研究及菊粉酶系分析[J].食品科学,2009,30(5):179-183.
[14] 何仁春,熊建明,杨家晃,等.粗纖维及纤维素酶对1~2月龄肉兔能量消化率和生长性能的影响[J].粮食与饲料工业,2011(12):58-61.
[15] 刘记强,曹向阳,亢娟娟,等.全收粪和指示剂法测定固始鸡粗纤维消化率的差异性比较[J].广东农业科学,2010,37(6):173-175.
[16] 周新萍,徐尔尼,汪金萍.高产纤维素酶生二素链霉菌的鉴定与选育研究[J].中国酿造,2007 (168):20-24.
[17] 钱文佳,阚光锋,徐仲.产低温纤维素酶南极细菌的筛选、生长特性及酶学性质的初步研究[J].食品科技,2010,35(1):15-18.
[18] 吴敏峰.产纤维素酶兼性厌氧芽孢杆菌的分离筛选及在动物生产上的初步应用[D].雅安:四川农业大学,2007.
[19] 房兴堂,王景明,雷丛,等.肉鸡消化器官生长规律的研究[J].四川动物,1999(1):37-39.
[20] 程郁昕,马昭文,陈浩,等.AA肉鸡生长期消化道各部分长度变化规律的探讨[J].当代畜牧,2006(5):3-4.
(责任编辑:易 婧)
收稿日期:2021-12-15
基金项目:2020年广西壮族自治区大学生创新创业训练计划项目“黑叶猴高效纤维降解菌的饲料降解效率研究”(202010602055)。
作者简介:庞美玲(1997—),女,广西玉林人,广西大学林学专业2021级在读硕士研究生,主要研究方向为森林保护学。E-mail: 2919341698@qq.com。
*为通信作者,E-mail: luzujun2002@aliyun.com。3B36E9D2-FCB4-4A94-84CC-AB2374FBC5B7
