非经典Hippo信号通路调控免疫稳态
2022-05-20史一然章津嘉陈兰芬
赵 昊,史一然,章津嘉,陈兰芬
(厦门大学生命科学学院,细胞应激生物学国家重点实验室,福建 厦门 361102)
生物体需要持续维持其内环境的稳态才能完成正常的生命活动.Hippo信号通路最早在果蝇(Drosophilamelanogaster)中发现,在进化上保守,是在控制器官大小和维持组织稳态中发挥重要作用的信号通路[1-3].哺乳动物中,Hippo信号通路的核心成员包括激酶Mst1/2(Ste20-like kinases 1/2,果蝇中Hippo的同源分子)、支架蛋白WW45(Salvador 同源物 SAV1)、激酶Lats1/2(large tumor suppressor 1/2)、支架蛋白MOB1(MOB kinase activator 1)和2个下游转录共激活因子YAP(Yes-associated protein)和TAZ(transcriptional coactivator with PDZ-binding motif).经典的Hippo信号通路是通过活化Mst1/2-WW45复合物后,进一步磷酸化和活化Lats1/2-MOB1A/B复合物,最终磷酸化YAP或TAZ,而磷酸化的YAP和TAZ会被降解或滞留在细胞浆中,无法进入细胞核与转录因子TEAD(transcriptional enhanced associate domain)结合,启动下游基因转录(图1(a)).很多研究表明Hippo信号通路在组织稳态、再生和肿瘤发生发展中起重要作用[4-11],如:在肝脏组织中,Hippo通路失活(敲除Mst1/2基因或过表达Yap基因)会导致肝脏增大和最终肝癌发生,而敲除Yap基因则会造成肝细胞死亡和肝脏衰竭.简而言之,经典Hippo信号通路主要通过抑制YAP的功能来调控细胞增殖和死亡,维持组织器官的稳态平衡.最近,越来越多研究表明Hippo信号通路在维持免疫稳态平衡中也发挥重要作用.

FAT4.非典型钙黏蛋白4;GPCR.G蛋白偶联受体;FGFR4.成纤维细胞生长因子受体4;TLR.Toll样受体;TCR.T细胞受体;BCR.B细胞受体;CaMKⅡ.钙调蛋白依赖的蛋白激酶Ⅱ;IRAK1/4.白介素1受体相关激酶1/4;NFκB.核因子κB;PKC.蛋白激酶C;RAP1.Ras相关蛋白1;RAPL.Rassf5b,Ras相关结构域家族5b;LFA-1.淋巴细胞功能相关抗原1;DOCK8.胞质分裂作用因子8;Rac1.Rac家族小三磷酸鸟苷酶(GTPase)1;Keap1.Kelch类ECH相关蛋白l;AKT.蛋白激酶B;Sirt1.Sirtuin1;Stat5.信号转换和转录激活蛋白5;ROS.活性氧;Nrf2.核红细胞样相关因子2;IRF3.干扰素调节因子3;Foxo1/3.叉头框蛋白O1/3;Foxp3.叉头框蛋白P3;RORγt.视黄酸相关孤儿受体γt.
1 Hippo信号通路与免疫稳态调控
免疫系统是机体识别和清除异己的重要防御系统,对于维持机体内环境稳态至关重要;在正常生理条件下,免疫系统本身的稳态维持对于其发挥正常免疫应答和免疫功能是必需的.免疫系统通过各种免疫细胞,包括天然免疫细胞和获得性免疫细胞来持续性感受外环境,区分自己和异己,保护机体免受感染、自身免疫性疾病和肿瘤的侵扰[12-13].在外来抗原或自身细胞发生突变等刺激下,机体发生免疫应答,通过一系列合适的免疫反应使得机体尽快恢复内环境稳态平衡[13-14].当免疫应答过强或过弱时,都会造成机体稳态失衡,导致疾病的发生.免疫细胞可以通过相关受体感应外界环境、启动相应信号转导通路、产生下游效应分子,以及通过可能的反馈调节机制来进行免疫应答和维持机体的免疫稳态平衡.探究机体在生理和病理条件下维持免疫稳态平衡的分子机制,将有助于人们更好地理解自身免疫性疾病、感染、代谢失常和肿瘤等疾病的发病机制,为防治这些疾病提供新的思路和分子靶标.
最近研究发现,Hippo信号通路在维持免疫稳态平衡中也发挥重要作用,但与调控器官大小和组织稳态的经典Hippo信号通路不同,调控免疫系统功能的是以激酶Mst1/2为核心的非经典Hippo信号通路(图1(b))[15].早期研究发现,Hippo信号通路中Mst1-Nore1b(又称RAPL或Rassf5b)复合物是TCR或趋化因子激活后,LFA-1介导的T细胞黏附和迁移运动所必需的[16-17].激酶Mst1/2和其结合分子Nore1b以及底物MOB1在免疫组织和细胞中高表达[9].有意思的是,Mst1和Mst2双基因敲除小鼠为胚胎致死表型,Mst1单基因敲除小鼠主要表现为免疫缺陷综合征,而Mst2单基因敲除小鼠无明显的免疫缺陷表型,表明Mst1在免疫系统中发挥着更为主导的功能,且Mst1和Mst2在功能上有一定互补性[9,18].临床研究发现,激酶MST1功能缺失突变的病人表现为免疫缺陷综合征,极易发生细菌、病毒和真菌感染,易得自身免疫性疾病等,且存在体内T细胞和B细胞减少、天然免疫细胞功能异常等临床症状[19-20].在小鼠和病人中观察到的表型和症状都暗示Hippo信号通路在天然免疫和获得性免疫功能调节中发挥重要作用,而Mst1缺失导致的抗感染免疫缺陷,同时又有打破免疫耐受发生自身免疫性疾病的表型,也暗示Hippo信号通路在不同免疫细胞和不同免疫应激条件下可能发挥截然不同的调控作用.进一步研究发现,在免疫系统中,激酶Mst1/2主要通过与其他一些调控免疫功能的信号通路互作来调控机体的免疫应答,包括整合素(integrin)信号[16-17,21-22]、TCR和BCR信号[18,23-25]、细胞因子受体信号[26-27]、TLR信号[28-32]、有丝分裂原活化蛋白激酶(MAPK)信号[33-34]和抗病毒信号[35-37]通路等,统称为非经典Hippo信号通路.
本研究团队近年围绕Hippo信号通路在免疫系统功能调控和稳态维持方面取得了一些进展.早期研究发现Mst1缺失会导致淋巴细胞减少,进一步研究发现在抗原或anti-CD3抗体刺激下,Mst1是调控T细胞增殖的内在抑制分子,对于维持机体T细胞数目非常重要[18,25].最近研究还发现在T细胞中,Mst1/2和其下游的TAZ分子能够抑制辅助性T细胞17(Th17)和增强调节性T细胞(Treg)的分化,因此在T细胞中,恰当的Hippo信号通路调控对于防止自身免疫性疾病、维持免疫耐受至关重要[38].此外,在天然免疫细胞中,本研究团队发现机械力受体Piezo1与TLR信号互作活化激酶Mst1/2,通过调控下游小G蛋白Rac1促进ROS产生,调控吞噬细胞对于细菌的吞噬和杀伤作用[29-30];同时激酶Mst1/2还可以感应细胞内的ROS水平,通过Mst1/2-Keap1-Nrf2信号转导途径来调控细胞的抗氧化活性,从而维持细胞的氧化还原稳态[39].
2 Hippo信号通路在T细胞中的功能
骨髓中的淋巴样祖细胞在迁移到胸腺后,经过系列选择过程,经历CD4-CD8-双阴性(DN)胸腺细胞、CD4+CD8+双阳性(DP)胸腺细胞、CD4+或CD8+单阳性(SP)胸腺细胞阶段,最终发育为成熟T细胞.成熟T细胞随后进入血液循环,迁移到次级淋巴组织,接受抗原的刺激和活化.没有接触过抗原的T细胞称为初始T细胞(naïve T cell),在淋巴管、外周血和组织液中反复循环迁移,这有助于其广泛接触到可能的抗原,该过程对于加强免疫应答反应和维持长期的免疫记忆至关重要.大量研究表明Mst1在T细胞的迁移、归巢、分化和活化中都发挥重要作用[16-18,21-22,25,27,38,40-42].
2.1 激酶Mst1/2调控T细胞的活化和迁移
在胸腺中,Mst1和Mst2蛋白在DP阶段表达极低,而随着发育进程表达量逐渐升高,最终在CD4+和CD8+的SP胸腺细胞中高表达;Mst1和Mst2的底物MOB1蛋白在DP和SP胸腺细胞中的表达量相当,但是磷酸化的MOB1只在SP胸腺细胞中被检测到,该结果表明Mst1和Mst2在早期胸腺细胞发育中(DP胸腺细胞阶段之前)的作用不大[25].在外周血中,刚从胸腺中成熟迁出的初始T细胞高表达Mst1和Mst2;而与CD4+CD62Lhigh初始T细胞相比,在CD4+CD62Llow效应/记忆T细胞中,Mst1和Mst2的蛋白和mRNA水平约下降90%[25].结合本研究团队在Mst1敲除小鼠中观察到的T细胞高度活化和CD4+CD62Llow效应/记忆T细胞比例增加的表型,可以推断Mst1和Mst2蛋白水平的下降是初始T细胞转变为活化效应/记忆T细胞所必需的,T细胞中Mst1的活性水平决定了初始T细胞活化的阈值;与Mst1单基因敲除的表型不同,Mst2单基因敲除小鼠并不影响各组织中的T细胞数目;然而在Mst1敲除小鼠中,进一步在造血细胞系中条件性敲除Mst2则会加重T细胞减少的表型,该结果表明激酶Mst2在Mst1敲除小鼠的淋巴组织中发挥代偿性功能;其中,激酶Mst1活性对于T细胞数目和功能稳态是必需的,因为只有野生型Mst1蛋白而非激酶缺陷型的Mst1蛋白的转基因小鼠,才可以恢复Mst1缺失导致的T细胞缺陷表型[18].
与野生型小鼠相比,Mst1-/-Mst2fl/flVav-Cre小鼠(全身敲除Mst1,在造血系统中条件性敲除Mst2)的CD4+和CD8+SP胸腺细胞比例增多,这些SP胸腺细胞发生大量的凋亡事件,虽已成熟却无法迁移出胸腺[18].Qa淋巴细胞抗原2(Qa-2)分子在胸腺细胞发育晚期高表达,在成熟胸腺细胞离开胸腺和成为外周成熟T细胞时表达量继续升高;而CD24分子则相反,在胸腺细胞发育期高表达,而在成熟胸腺细胞离开胸腺时表达量下降,在外周成熟T细胞中不表达[43].因此Qa-2和CD24可以用来指示胸腺细胞和外周循环T细胞的表面标记.Mst1-/-Mst2fl/flVav-Cre小鼠的CD4+和CD8+SP胸腺细胞主要表现为Qa-2highCD24low表型,同时高表达S1P(sphingosine 1-phosphate)受体(主要表达于胸腺细胞发育晚期),说明这些细胞都是被滞留于胸腺中的成熟T细胞[18].这些Mst1/2缺失的SP胸腺细胞表面的趋化因子受体(如CCR7、CXCR3、CXCR4和CCR5)和整合素(CD11b和LFA-1)的表达水平与野生型细胞相当,但如果将这些细胞放于外周循环中,同样无法迁移进入二级淋巴组织,表明Mst1/2缺失的胸腺细胞可以发育成熟为初始T细胞,但这些细胞无法迁出胸腺组织;进一步研究发现,在成熟的胸腺细胞中,趋化因子CCL19或S1P刺激下,Mst1/2通过磷酸化MOB1,促进MOB1与DOCK8的相互作用,增强其鸟苷转换因子(GEF)活性,促进小G蛋白Rho家族成员(如Rac1)的活化,从而促进胸腺细胞迁出胸腺[18].
在Mst1-/-Mst2fl/flVav-Cre小鼠和Mst1-/-Mst2fl/flLck-Cre小鼠(全身敲除Mst1,在胸腺发育期条件性敲除Mst2)都出现成熟胸腺细胞迁出胸腺缺陷、外周T细胞减少和高度活化的表型[18].为了进一步研究Mst1/2在外周T细胞中的功能,构建了仅在成熟和活化的T细胞中敲除Mst1和Mst2的Mst1fl/flMst2fl/flOx40-Cre小鼠,结果显示这些小鼠的胸腺细胞发育正常,外周组织中T细胞数目也正常,但与野生型小鼠相比,在脾脏中效应/记忆T细胞比例增加,说明Mst1/2缺失促进了T细胞活化[38].在TCR刺激下,Mst1缺失的初始T细胞的增殖水平和细胞因子白介素-2(IL-2)、IL-4和干扰素γ(IFNγ)的表达水平都明显比野生型细胞的高,但TCR下游的CD3、ZAP70(zeta chain of TCR associated protein kinase 70)、Lck(lymphocyte-specific protein tyrosine kinase)和PLCγ1(phospholipase C-γ1)的磷酸化水平却与野生型细胞的相当[25].在敲除Mst1的T细胞中,Lats1/2的磷酸化水平没有变化,而MOB1的磷酸化完全消失,该结果暗示了MOB1可能在T细胞活化中发挥重要作用[25],而本研究团队发现敲除YAP并不能缓解Mst1缺失导致的缺陷表型,进一步暗示Mst1在T细胞中不是以经典Hippo信号通路来发挥作用的(未发表数据).在TCR刺激下,Mst1缺失的效应/记忆CD4+T细胞的凋亡比例大幅增加,说明Mst1在这些T细胞中具有抗凋亡活性,Mst1缺失会增强活化诱导的细胞死亡(AICD)效应[25].总之,这些结果表明Mst1/2在维持T细胞数目、迁移和活化方面都发挥重要的调控作用.
2.2 Mst1/2-TAZ信号调控CD4+ T细胞的分化命运
在TCR/抗原刺激活化和细胞因子等不同因素的调控下,初始CD4+T细胞会分化为不同亚型的T细胞,在免疫应答和调控中发挥不同的作用[44].其中,接受TCR/抗原刺激的初始CD4+T细胞在转化生长因子β(TGF-β)诱导下可分化为Treg,分泌TGF-β,发挥调控免疫耐受和免疫抑制的功能;而在TGF-β和IL-6的共同诱导下则分化为CD4+Th17,分泌IL-6和IL-17,参与防御胞外细菌和真菌感染、炎症反应和自身免疫反应.Treg和Th17比例的恒定对于维持机体免疫系统的稳态起着非常重要的作用,初始CD4+T细胞向Th17分化过多或向Treg分化过少,是导致多种自身免疫性疾病的主要原因.Treg和Th17亚型的分化是交互调控的,其中TGF-β在调控CD4+初始T细胞分化为Treg和Th17中发挥重要作用,而在TGF-β培养条件下添加IL-6会抑制Treg的分化,促进Th17的分化,这有助于机体在应对感染等外界侵扰时,促进机体从免疫耐受到免疫炎症反应的转化[44].研究发现,与野生型小鼠相比,6~8周Mst1-/-小鼠的胸腺和脾脏中CD4+Treg明显减少,调节功能缺陷[41,45].进一步研究发现Mst1通过多种方式调控和促进Treg中转录因子Foxp3的表达和功能,包括直接磷酸化转录因子Foxo1/3[41]、激酶AKT[41]和去乙酰化酶Sirt1[45]或调控Rac1-DOCK8信号通路[27].
最近,本研究团队发现[38]:Mst1-/-小鼠的Th17分化比例显著升高,小鼠易患干燥综合征和大肠炎.用钥孔血蓝蛋白(KLH)抗原和弗氏完全佐剂(CFA)诱导小鼠的免疫应答,在Mst1fl/flMst2fl/flOx40-Cre小鼠的引流淋巴结中,Th17比例显著高于野生型小鼠中,且Treg比例也明显下调.分析Hippo信号通路主要成员在几种CD4+T细胞亚型中的表达水平,发现激酶Mst1/2下游的转录共激活因子TAZ在Th17和Treg中表达水平都明显高于初始CD4+T细胞中,且Th17的高表达更为显著.临床类风湿性关节炎等病人的外周血记忆T细胞中TAZ的表达水平高于健康人中,且与Th17的核心转录因子RORγt水平呈正相关.机制研究显示,在TCR刺激初始CD4+T细胞时,TGF-β单独刺激能够大幅提升TAZ mRNA的表达水平;IL-6单独刺激虽无法提高TAZ mRNA的表达水平,但能够进一步加强TGF-β诱导TAZ mRNA的表达,且TGF-β和IL-6通过其下游转录因子Smad3和Stat3来调控TAZ的转录表达.
在调控Th17和Treg分化方面,本研究团队发现TAZ能够与Th17及Treg中的核心转录因子RORγt和Foxp3形成复合物[38]:首先,作为转录共激活因子,TAZ可以直接增强RORγt的转录活性;其次,由于Foxp3会被乙酰转移酶Tip60(HIV-1 TAT-interactive protein,60 ku)乙酰化而抑制其泛素化和蛋白酶体降解[46],TAZ通过与Tip60竞争性结合Foxp3,导致Foxp3乙酰化降低、泛素化增强和蛋白降解增加,从而削弱Treg的分化、促进Th17的分化.因此,Mst1/2-TAZ信号在调控初始CD4+T细胞分化为Th17和Treg的过程中起关键作用(图2),也证明了Hippo信号通路在免疫系统稳态调控中的重要性[38].
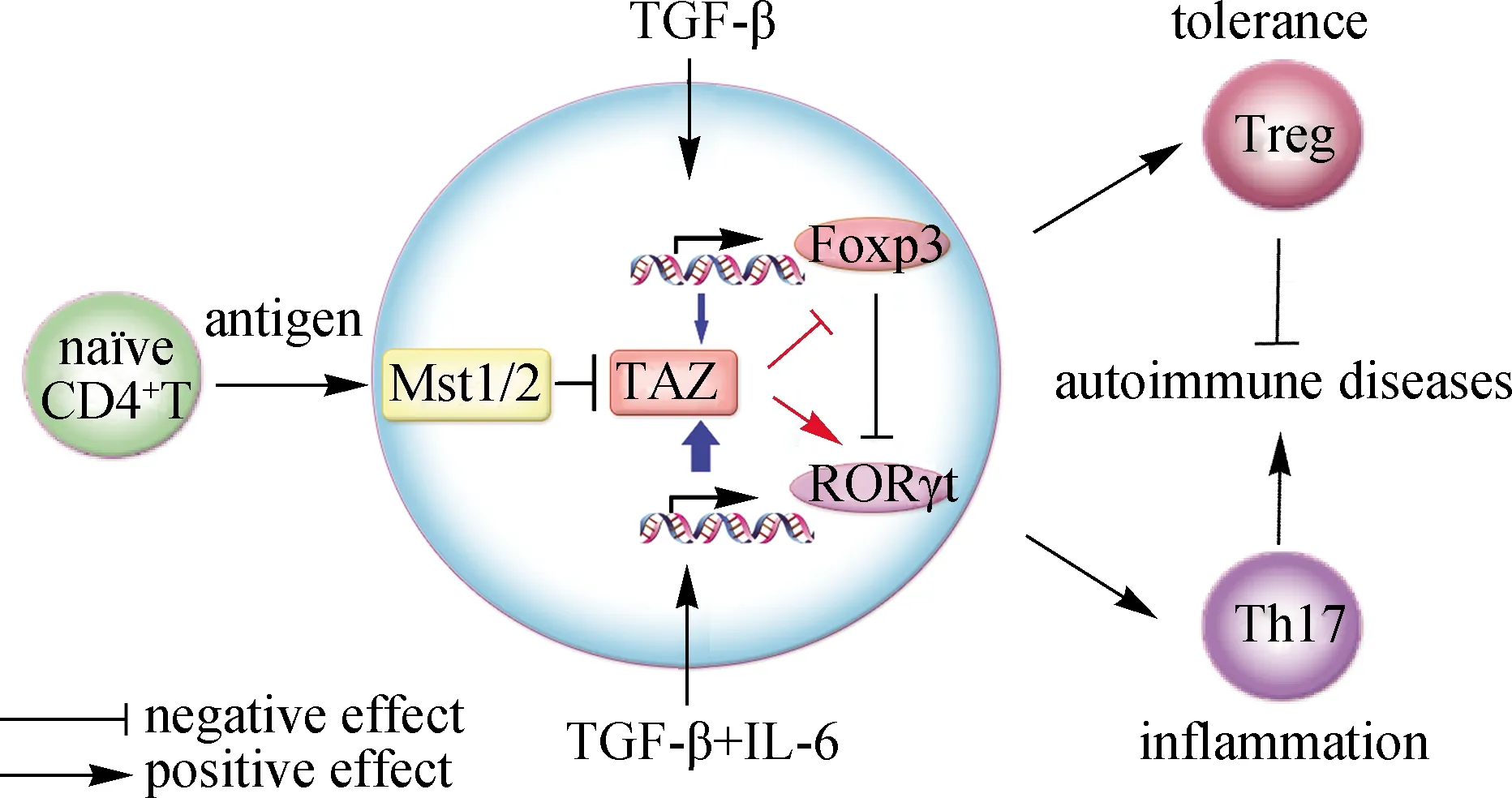
在Th17和Treg的分化过程中,TGF-β诱导TAZ的表达,而IL-6进一步增加TAZ的表达水平;作为转录共激活因子,TAZ会增强Th17中核心转录因子RORγt的转录活性以促进Th17的发育分化;TAZ也可通过调控Treg核心转录因子Foxp3的乙酰化和泛素化水平,促进Foxp3的降解,抑制Treg的分化.因此,Hippo信号通路可以调控机体免疫炎症和免疫耐受的稳态平衡.
3 Hippo信号通路在天然免疫细胞中的功能
天然免疫系统是机体区分自我和非我,以应对外环境侵扰(如各种病原感染)并在第一时间作出免疫反应和应答的重要防线.单核巨噬细胞是最重要的引发炎症反应的天然免疫细胞,其与另一类重要天然免疫细胞中性粒细胞均属吞噬型细胞,主要发挥吞噬和清除病原体的功能.当病原体入侵机体时,天然免疫细胞通过模式识别受体,如TLR、C型凝集素样受体、清道夫受体和补体受体等,来识别表达于病原体中的抗原相关的模式分子,如脂多糖(LPS)、脂蛋白、多肽和核酸分子等[47].
TLR可以识别多种不同的病原相关模式分子,在天然免疫细胞广泛表达,是抵御病原入侵的第一道防线,也是连接天然免疫应答和获得性免疫应答的桥梁[12].本研究团队用各种TLR的配体刺激野生型小鼠骨髓来源的巨噬细胞(BMDM),发现表达于细胞表面的TLR1、TLR2和TLR4在相应配体或激动剂刺激活化后,都会导致Mst1/2底物MOB1的磷酸化水平明显升高;表达于内体上的TLR7、TLR8和TLR9在相应配体或激动剂刺激后,MOB1的磷酸化水平没有变化;而同样表达于内体上的TLR3在聚肌胞苷酸poly(I:C)刺激下,MOB1的磷酸化水平略有升高[30].利用敲除MyD88(myeloiddifferentiationprimaryresponsegene88)的单核巨噬细胞系RAW264.7,进一步研究发现LPS(TLR4激动剂)、Pam3CSK4(TLR1和TLR2激动剂)和LTA(TLR2激动剂)激活Mst1/2依赖于MyD88信号,Mst1/2缺失并不影响TLRs介导的MAPK(包括p38、Jnk和Erk)的活化;然而与野生型BMDM相比,在Mst1/2缺失的BMDM中,LPS刺激导致更高的IKKα/β(IκB kinase α/β)和IκBα(inhibitor of NFκB kinase)磷酸化水平,以及相应更高的IL-6和肿瘤坏死因子α(TNFα)表达水平[30].此外,Mst1可以通过磷酸化和降解IRAK1调节TLR信号通路,抑制慢性炎症反应和肝癌发展[31].同样,结核杆菌(Mycobacteriumtuberculosis)也可以通过TLR2-IRAK1/4信号通路来调控Mst1/2的活性,从而调控趋化因子CXCL1/2的表达和IRF3介导的免疫应答[48].而在果蝇中的研究发现:Hippo信号是果蝇抵御革兰氏阳性菌和真菌感染所必需的,果蝇脂肪体(果蝇的免疫器官)中Hippo信号缺失的免疫表型与Toll受体信号缺失的表型非常类似,说明在果蝇脂肪体中经典Hippo信号通路在调控天然免疫功能中发挥重要作用;当Hippo信号通路失活时,下游转录共激活因子Yorkie活化,可以直接促进Cactus(果蝇中的NFκB抑制蛋白IκB)的转录表达,从而抑制Dorsal(果蝇中的NFκB)和Dorsal相关免疫分子(Dif)入核以及抗菌肽的表达[32].而在哺乳动物中,研究发现在LPS和IFNγ刺激下,YAP在巨噬细胞中的表达水平升高促进巨噬细胞向M1型极化以及促炎症因子IL-6的表达,而IL-4和IL-13刺激则抑制YAP的表达,因此巨噬细胞中特异性敲除YAP可明显减轻葡聚糖硫酸钠盐诱导的肠炎发生[49].这些结果都表明Hippo信号通路在进化上是保守的,但在高等哺乳动物中有着更为复杂的调控机制来调节天然免疫应答.
3.1 激酶Mst1/2调控吞噬细胞的细菌吞噬和杀伤作用
Mst1功能缺失的病人易发生细菌、病毒和真菌的多发感染性疾病[19-20].本研究团队前期发现Mst1-/-Mst2fl/flVav-Cre小鼠也经常发生肺炎、肺脓肿等多发感染性.与Mst1-/-Mst2fl/flVav-Cre小鼠不同,Mst1fl/flMst2fl/flLyz2-Cre小鼠(在髓系细胞中条件性敲除Mst1和Mst2)在正常SPF(specific pathogen free)条件下饲养到7个月,均未发现有炎症或感染症状;但在Mst1fl/flMst2fl/flLyz2-Cre小鼠中构建盲肠穿刺诱导的细菌性腹膜炎(CLP)模型时,与野生型小鼠相比,模型小鼠的死亡率更高,各组织中的细菌载量更多,血清中的炎症因子水平也更高[30].进一步研究发现TLR-MyD88信号介导的Mst1/2活化是吞噬型细胞(如巨噬细胞和中性粒细胞)吞噬和杀灭细菌所必需的[30];在大肠杆菌(Escherichiacoli)或李斯特菌(Listeriamonocytogenes)感染时,Mst1/2缺失的BMDM或中性粒细胞中吞噬的细菌比野生型细胞中少,但在感染后期胞内留存的细菌数却明显更多,这表明Mst1/2缺失影响了吞噬型细胞对细菌的吞噬和杀伤作用.
ROS在吞噬细胞的细菌杀伤作用中扮演着重要的角色,这些ROS主要来源于吞噬体上还原型辅酶Ⅱ(NADPH)氧化酶复合物产生的ROS和募集的线粒体产生的线粒体ROS(mROS).在Mst1/2缺失的吞噬细胞中,细菌感染后诱导产生吞噬体ROS和mROS的能力有明显缺陷,是导致细菌杀伤能力下降的主要原因;此外,膜表面的TLR1、TLR2和TLR4活化后可以诱导产生大量mROS和胞内总ROS,而表达于内体上的TLR3、TLR7、TLR8和TLR9活化后则无法诱导相应的ROS产生;有意思的是,用TLR1、TLR2和TLR4相应的激动剂刺激Mst1/2缺失的BMDM或中性粒细胞,均无法诱导mROS和胞内总ROS的产生,这与之前研究发现刺激这些膜上TLR才会激活Mst1/2的结果一致[30].在机制上,Mst1/2的磷酸化激活PKC,活化的PKC进而磷酸化其底物二磷酸鸟苷(GDP)解聚抑制剂LyGDI,活化小G蛋白Rac1,促进TRAF6-ECSIT(TNF receptor associated factror 6-evolutionarily conserved signaling intermediate in Toll pathway,mitochondrial)复合物形成,最终促进募集线粒体靠近吞噬体,并释放mROS杀灭吞噬体中的细菌;而同时Rac1是NADPH氧化酶复合物的主要成员之一,因此活化的Rac1也会促进吞噬体ROS的产生,进一步增强吞噬体中ROS水平以杀灭细菌[30].该研究揭示了一条全新的信号转导通路,即TLR-Mst1/2-PKC-Rac1-TRAF6-ECIST介导吞噬细胞中细菌诱导ROS产生的分子机制[30],表明TLR下游信号并非只有激活相关转录因子、促进炎症因子基因转录表达的作用,还可以通过蛋白质翻译后修饰作用活化小G蛋白,影响细胞骨架快速调控细胞器(吞噬体和线粒体)的迁移,从而实现抗感染天然免疫应答.
3.2 机械力受体Pizeo1调控Mst1/2促进巨噬细胞抗感染免疫
感染、炎症和肿瘤发生会导致组织中细胞间质的硬度、结构和成分等物理微环境的改变,研究发现细胞微环境中这些物理和机械信号可以调节多种细胞类型的分化、增殖和迁移[50].作为重要的天然免疫细胞,巨噬细胞持续穿梭于体液和各组织中以应对这些复杂的微环境,通过细胞本身硬度和弹性的内在变化来感知物理微环境变化.已有研究发现,贴壁细胞的生长密度和培养基硬度可以调控Hippo信号通路活性,细胞生长密度较低时或细胞培养在硬度高的介质上,都会抑制Hippo信号通路活性,导致下游分子YAP/TAZ进入细胞核,促进细胞生长,因此YAP/TAZ是两个极为关键的受机械力调控的转录效应分子,可以将物理信号最终转化为基因表达[51].
本研究团队前期发现,TLR活化信号会激活下游的Mst1/2,且这一活化过程依赖于MyD88分子,但TLR-MyD88复合物如何激活Mst1/2并不明确[30].最近本研究团队发现,培养在软基质上的巨噬细胞的吞噬和杀菌功能被严重削弱,外环境机械硬度信号是巨噬细胞实现细菌吞噬和杀伤所必需的[29].机械敏感离子通道(MSC)中Piezo1离子通道是近年发现的在血管发育、红细胞体积调节、细胞迁移等方面发挥重要作用的Ca2+通道[52].本研究团队的结果显示[29]:Piezo1受体在多种髓系免疫细胞中高表达,在细菌感染或LPS等一些TLR配体刺激下,其表达量会进一步升高.与野生型小鼠相比,天然免疫细胞中敲除Piezo1的Piezo1fl/flLyz2-Cre小鼠在CLP模型中生存率明显降低,各组织中细菌载量显著增加;而与Mst1/2缺失的BMDM表型类似,Piezo1缺失的BMDM的细菌吞噬和杀伤清除能力明显低于野生型细胞.使用Yoda1(Piezo1激活剂)处理能够显著增强野生型BMDM的细菌吞噬和清除能力,而对Piezo1缺失的BMDM则没有影响,说明活化Piezo1能够促进巨噬细胞的抗感染能力;细菌感染或LPS刺激会促进TLR4和Piezo1发生组装,从而增强依赖于Piezo1的钙内流和CaMKⅡ活化,CaMKⅡ再通过磷酸化Hippo信号通路的Mst1/2介导Rac1活化,促进丝状肌动蛋白重塑、增强吞噬作用、促进线粒体和吞噬体ROS的产生,从而增强杀菌能力.该结果表明机械力感受器Piezo1是激活Mst1/2-Rac1抗感染信号和诱导杀伤性ROS产生的关键上游分子[29].近期也有研究发现Piezo1可以调控巨噬细胞吞噬清除衰老红细胞和铁代谢[53],以及巨噬细胞通过Piezo1感受周期性的静水压变化[54],从而将胞外信号转化为胞内信号调控细胞的炎症反应.这些研究揭示了机械力感知和应答信号在巨噬细胞抗感染中的作用和机制,表明Piezo1所介导的机械力传导信号对于宿主抗病原体的天然免疫应答至关重要.
3.3 Mst1/2调控巨噬细胞的氧化还原稳态
ROS在维持细胞正常的生理功能中发挥重要功能,是免疫吞噬细胞杀伤病原和激活炎症反应的主要武器,但过量的ROS也会对细胞造成氧化应激损伤而导致衰老和死亡,因此调控ROS的产生和清除维持细胞的氧化还原稳态至关重要.在体外研究中,常使用过氧化氢溶液来激活Mst1/2,表明ROS可以有效激活激酶Mst1/2[25].早期研究发现在线虫(Caenorhabditiselegans)中敲除CST-1(Hippo激酶的同源分子)会加速衰老和缩短寿命[55].本研究团队前期发现,Mst1/2是巨噬细胞在细菌感染时诱导产生大量杀伤性ROS所必需的,然而同时Mst1/2缺失的巨噬细胞中ROS本底水平明显高于野生型细胞[30].在这些Mst1/2缺失的巨噬细胞中,蛋白的羰基化水平(氧化应激标记)、组蛋白H2A变体H2A.X的磷酸化水平(DNA损伤标记)、PARPγ(poly ADP-ribose polymerase γ)和Caspase3切割分子的水平升高,同时细胞出现提早衰老的特征,而这些现象都可以在ROS清除剂N-乙酰半胱氨酸(NAC)的处理下得到缓解,表明Mst1/2在调节巨噬细胞氧化应激稳态维持中也发挥重要作用[39].研究结果显示[39]:Mst1/2缺失的巨噬细胞中抗氧化酶系统存在缺陷,在LPS、抗霉素(atimycin A)、鱼藤酮(rotenon)、过氧化氢处理或大肠杆菌感染下,Mst1/2缺失的BMDM中抗氧化酶基因(如Nqo1、Ho-1、Gclc和Gclm等)的表达水平都明显低于野生型BMDM中.这些抗氧化基因多由抗氧化效应转录因子Nrf2调控表达,而Nrf2在巨噬细胞中高表达;与野生型细胞相比,Mst1/2缺失的巨噬细胞中Nrf2泛素化水平明显升高,蛋白水平显著降低.进一步研究表明Mst1/2能够感应ROS,并被募集到吞噬体和线粒体的ROS产生部位而被释放的ROS活化,进而调控Nrf2来维持胞内的氧化还原稳态,从而在巨噬细胞对病原体清除期间保护细胞免受氧化损伤,延缓衰老与死亡.
细胞中的Nrf2蛋白主要受泛素-蛋白酶体系统严格调控:在正常生理条件下,多聚化的Keap1与Cul3-E3 泛素连接酶靶向Nrf2,促进Nrf2泛素化和蛋白酶体降解;而当细胞处于氧化应激条件下,Keap1发生解聚,Keap1-Cul3-E3 泛素连接酶无法稳定结合到Nrf2上,导致Nrf2泛素化水平下降,蛋白水平升高,进入细胞核中与ARE(antioxidant response element)序列结合以激活下游抗氧化应激酶的表达[56-57].在调控机制上,本研究团队证实Mst1/2可直接结合Keap1,并对Keap1的4个位点进行磷酸化修饰,Mst1/2介导的Keap1磷酸化阻止了Keap1分子的多聚化,从而阻断了Nrf2的泛素化和蛋白降解;进一步利用病毒载体回补Nrf2,可明显降低Mst1/2缺失的巨噬细胞中ROS水平、DNA损伤和细胞凋亡比例,证实在巨噬细胞中Nrf2是Hippo激酶下游的关键分子[39].上述研究揭示在巨噬细胞参与宿主防御过程中存在一条新的抗氧化和抗衰老信号通路,阐明了Mst1/2参与调节巨噬细胞维持氧化应激稳态以实现清除病原体的同时,还能避免ROS诱导的自身损伤和细胞衰老的关键机制(图3),为进一步研究氧化应激如何促进衰老相关炎症和感染的发生和发展提供了重要的理论基础.

在细菌感染条件下,巨噬细胞中的TLR联合机械敏感受体Piezo1激活Mst1/2,活化Rac1,促进线粒体募集到吞噬体周围产生杀伤性ROS,同时增强吞噬体细胞膜上的NADPH氧化酶活性而产生更多杀伤性ROS,最终杀灭细菌;大量ROS会进一步活化Mst1/2,通过磷酸化Keap1来调控Nrf2的稳定性,促进抗氧化基因表达,实现细胞的抗氧化应激反应.因此,Hippo信号通路在调控巨噬细胞的氧化还原稳态中发挥着重要作用.
4 总结与展望
Hippo信号通路在进化上高度保守,是调控细胞增殖和死亡、维持机体组织器官稳态的重要通路,一直被认为是重要的肿瘤抑制信号通路.近年来,本研究团队和其他课题组的工作揭示了Hippo信号通路在免疫稳态调控中也发挥着重要功能.Mst1/2是Hippo信号通路的核心激酶,在巨噬细胞抗感染过程中,作为重要的分子开关协同调控两种重要信号转导,即诱导产生杀伤性ROS的信号和活化Nrf2以清除过量ROS的信号,以维持巨噬细胞的氧化还原稳态[29-30,39].这些结果揭示了天然免疫细胞在感染和不同外周环境刺激下,合适的免疫应答需要胞内多种细胞器和免疫效应分子在时间和空间上的协同作用.一些环节的调控缺陷会影响吞噬细胞对病原体的吞噬和杀伤,无法维持胞内的氧化还原稳态,导致细胞早衰和死亡.而在获得性免疫调控方面,Hippo信号通路抑制促炎性Th17的分化,促进免疫抑制性Treg的分化,在正常生理条件下对于维持免疫系统耐受和稳态至关重要,阐释了当Hippo信号通路失调时病人易发自身免疫性疾病的病理机制[38].这些研究表明非经典Hippo信号通路成员可能是治疗感染性疾病、自身免疫性疾病、免疫细胞衰老以及肿瘤等免疫失调疾病的潜在靶点.
作为肿瘤抑制通路,靶向促进Hippo通路活性治疗肿瘤的策略不能忽略Hippo信号通路活化对于Treg分化和功能的促进作用,因为Treg会抑制免疫系统对肿瘤细胞的清除;然而这种靶向治疗却可能会通过抑制Th17的分化和增强Treg的抗炎症效应而有利于治疗自身免疫性疾病.Hippo信号通路调控肿瘤发生发展以及组织再生和稳态,同时也调控免疫应答和功能,如果直接靶向Hippo通路的核心节点分子治疗疾病,可能会带来一些副作用,因此在设计小分子药物时要考虑到作用位点、作用效率,以及作用是否可逆等因素,例如:本研究团队发现的小分子药物XMU-MP-1能够可逆且特异性地抑制激酶Mst1/2的活性,因此可以通过精准的用药窗口促进组织再生和修复而避免造成组织异常增生,已在肝脏和肠道损伤再生动物模型中取得了很好的治疗效果[58].此外,只有深入研究Hippo信号通路在免疫系统中的精准调控功能,特别是该通路如何协同调控其他经典免疫信号通路,及其在调控肿瘤和免疫细胞互作中的作用,阐明在不同组织微环境和不同免疫应答事件中的具体效应分子,才能更好、更安全地将靶向Hippo信号通路作为治疗肿瘤、损伤再生、感染和自身免疫病等相关疾病的治疗策略.
