藤黄有效成分的纳米囊制备及其抗糖尿病活性评价
2022-05-17战鹤韩璐何忠梅时坤赵岩宗颖陈维佳杜锐
战鹤 韩璐 何忠梅 时坤 赵岩 宗颖 陈维佳 杜锐
中圖分类号 R944 文献标志码 A 文章编号 1001-0408(2022)09-1075-07
DOI 10.6039/j.issn.1001-0408.2022.09.09
摘 要 目的 制备藤黄酸(GA)、新藤黄酸(NGA)的纳米囊(GA-LNCs、NGA-LNCs),并进行其抗糖尿病活性评价。方法 以水为水相、中链甘油三酯为油相、聚乙二醇单硬脂酸酯为表面活性剂,采用相转换法制备GA-LNCs、NGA-LNCs。以包封率和载药量为指标,利用单纯型网格设计法优化上述2种纳米囊的处方工艺,并对其理化性质进行考察。建立糖尿病小鼠模型,灌胃给予GA-LNCs、NGA-LNCs(剂量分别为1.92、2.42 mg/kg),每天1次,连续给药6周,检测小鼠空腹血糖值和血清中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性以及丙二醛(MDA)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)含量。结果 这2种纳米囊的最优处方均为60%水、10%中链甘油三酯、30%聚乙二醇单硬脂酸酯(三者总量固定为2 g)以及35 mg GA或NGA。以最优处方制得的GA-LNCs、NGA-LNCs的包封率分别为(92.01±0.68)%、(93.12±2.11)%,载药量分别为(0.99±0.21)%、(1.21±0.22)%;两者均为黄色均一透明液体,无沉淀,微观形态均为类球形,且具有明显的壳膜结构,粒径分别为(28.11±9.76)、(22.06±6.84) nm,Zeta电位分别为(-4.09±1.00)、(-17.40±1.32) mV,多分散系数分别为0.93±0.06、0.74±0.12。动物实验结果显示,GA-LNCs、NGA-LNCs均可显著升高模型小鼠血清中SOD、GSH-Px活性和HDL-C含量(P<0.05或P<0.01),显著降低模型小鼠空腹血糖值和血清中MDA、TC、TG、LDL-C含量(P<0.05或P<0.01)。结论 本研究制得的GA-LNCs、NGA-LNCs理化性质良好,且具有良好的抗糖尿病活性。
关键词 藤黄酸;新藤黄酸;纳米囊;糖尿病;制备
Preparation of nanocapsules of active ingredients of Garcinia hanburyi and evaluation of their antidiabetic activity
ZHAN He1,HAN Lu1,HE Zhongmei1,SHI Kun1,ZHAO Yan1,ZONG Ying1,CHEN Weijia1,DU Rui1,2,3 (1. College of Chinese Medicinal Materials, Jilin Agricultural University, Changchun 130118, China; 2. Key Laboratory of Animal Production, Product Quality and Security, Ministry of Education of China, Changchun 130118, China; 3. Jilin Provincial Engineering Research Center for Efficient Breeding and Product Development of Sika Deer of China, Changchun 130118, China)
ABSTRACT OBJECTIVE To prepare Gambogic acid (GA) nanocapsules (GA-LNCs) and Neogambogic acid (NGA) nanocapsules (NGA-LNCs), and to evaluate their antidiabetic activities. METHODS Using water as the aqueous phase, medium- chain triglyceride as the oil phase and polyethylene glycol monostearate as the surfactant, GA-LNCs and NGA-LNCs were prepared by phase inversion method. Using entrapment efficiency and drug-loading amount as index, the formulation technologies of above 2 nanocapsules were optimized by simplex lattice design. Its physical and chemical properties were investigated. The diabetic mice model was established. GA-LNCs and NGA-LNCs (1.92 and 2.42 mg/kg respectively) were given intragastrically, once a day, for consecutive 6 weeks. The fasting blood glucose of mice, the activities of superoxide dismutase (SOD) and glutathione peroxidase (GSH-Px), the contents of malondialdehyde (MDA), total cholesterol (TC), triglyceride (TG), high-density lipoprotein cholesterol (HDL-C) and low-density lipoprotein cholesterol (LDL-C) were all detected. RESULTS The optimal formulation of 2 kinds of nanocapsules included 60% water, 10% medium-chain triglyceride, 30% polyethylene glycol monostearate (total amount of the three was 2 g) and 35 mg GA or NGA. The encapsulation efficiencies of GA-LNCs and NGA-LNC obtained by the optimal formulation were (92.01±0.68)% and (93.12±2.11)%; the drug-loading amount were (0.99±0.21)% and (1.21±0.22)%, respectively. GA-LNCs and NGA-LNCs were yellow, homogeneous and transparent liquid without precipitation. They were spherical in microscopic shape, and had obvious shell- membrane structure. The particle sizes were (28.11±9.76) and (22.06±6.84) nm; Zeta potential were (-4.09±1.00) and (-17.40±1.32) mV, and polydispersity were 0.93±0.06 and 0.74±0.12. The results of animal experiments showed that both GA-LNCs and NGA-LNCs could significantly increase the activities of SOD and GSH-Px and the serum content of HDL-C (P<0.05 or P<0.01) in model mice, and significantly decreased the fasting blood glucose and the serum contents of MDA, TC, TG and LDL-C (P<0.05 or P<0.01). CONCLUSIONS GA-LNCs, NGA-LNCs prepared in this study are good in physical and chemical properties and have good anti-diabetes activity.
KEYWORDS gambogic acid; neogambogic acid; nanocapsules; diabetes; preparation
糖尿病(diabetes mellitus,DM)是一种由遗传、环境和自身免疫等复合病因所引起的慢性代谢性疾病,其可诱发微血管和大血管病变、神经系统并发症等[1]。2020年全国流行病学统计显示,我国糖尿病患者总人数约1.298亿,且患病率保持持续增长的趋势[2]。目前,治疗DM的药物只能短暂地使患者血糖水平正常化[3]。因此,从天然产物中寻找治療DM且毒副作用小的药物是当今研究的热点。
藤黄为双子叶植物藤黄科藤黄属植物藤黄Garci- nia hanburyi Hook. f.的胶状树脂[4],早在《海药本草》中就有记载,现收录于《中药大辞典》中,其味酸涩、性凉、有毒,具有治疗痈疽肿毒、顽癣恶疮、损伤出血等功效[5-6]。现代研究表明,藤黄还具有抗菌、抗病毒、抗炎、抗肿瘤、神经保护等作用[7-11];其主要含有以藤黄酸(gambogic acid,GA)和新藤黄酸(neogambogic acid,NGA)为代表的笼状氧杂蒽酮类成分[12-13]。这2种成分均具有较好的抗肿瘤效果,可通过多途径抑制肿瘤细胞的增殖、侵袭、迁移,并诱导细胞凋亡[14]。另外,本课题组也首次发现,GA和NGA均具有降血糖作用,且该项研究成果已获国家授权发明专利(专利号为ZL 2014 1 0092956.9)[15] 。但这2种成分均具有一定刺激性,且难溶于水、生物利用度较低、血管刺激性较大[16-17],因此极大地限制了其临床应用。
纳米制剂包括纳米粒、纳米囊等,粒径介于1~1 000 nm,性质稳定、制备简便[18];且其对人体无毒,生物相容性较好,包载药物后可降低对正常器官、组织及全身的副作用,并改善难溶性药物的溶解度[19-21]。纳米囊根据成囊材料的不同可分为聚合物纳米囊和类脂纳米囊[22-23]。其中,类脂纳米囊是核-壳结构的新型载药系统,类似脂蛋白的结构,主要包裹亲脂药物[24]。基于此,本研究采用相转换法[25]将GA、NGA制成纳米囊(即类脂纳米囊),对其粒径、微观形态、Zeta电位、X-射线衍射等理化性质以及体外抗DM活性进行考察,以期为DM新药开发提供依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有1260型高效液相色谱仪(美国Agilent公司),2489 型紫外可见光分光光度计(美国Waters公司),BS210S型万分之一电子天平(德国Sartorius公司),FD-IC50型真空冷冻干燥机(北京博医康实验仪器有限公司),MIX15 eco型磁力加速搅拌器(常州市国旺仪器制造有限公司),FEI G2 120KV型透射电镜、m3000型马尔文激光粒度分析仪、BeNano 90 Zeta 型纳米粒度电位仪(丹东百特仪器有限公司),TGL-16M型低速离心机(上海科雅生物科技有限公司),DNM- 9602型酶标分析仪(北京普朗新技术有限公司),活力型罗氏血糖仪(杭州欧英米电子商务有限公司)。
1.2 主要药品与试剂
GA、NGA原料药由本实验室自制(质量分数均大于98%);本研究所用其他药品与试剂有:大孔吸附树脂D101(天津市光复精细化工研究所,批号1021Q011),中链甘油三酯、葡聚糖凝胶G-50、二甲双胍(上海源叶生物科技有限公司,批号分别为20111028、413B052、H20051277),聚乙二醇单硬脂酸酯(上海麦克林生化科技有限公司,批号20150905),D-甘露醇(北京酷来博科技有限公司,批号20110603 ),链脲佐菌素(streptozocin,STZ,美国Sigma 公司,批号WXBC6558V),超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、总胆固醇 (total cholesterol,TC)、三酰甘油(triacylglycerol,TG)、高密度脂蛋白胆固醇(high- density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)试剂盒(南京建成生物工程研究所,批号分别为20180608、20210417、20120323、20181129、20181116、20181129、20181116);GA、NGA对照品(成都德思特生物技术有限公司,批号分别为DT0015、DX0071,纯度均大于98%);其余试剂为实验室常用规格,水为纯净水。
1.3 动物
本研究所用动物为SPF 级C57BL/6J 小鼠,共 60只,雄性,体质量为18~22 g,购自北京华阜康生物科技股份有限公司,动物生产许可证号为SCXK(京)2019-0008。将小鼠饲养于温度 20~26 ℃、相对湿度 40%~70%的条件下,期间自由饮水与摄食,适应性饲养 1周后进行实验。
2 方法与结果
2.1 GA、NGA的含量测定
2.1.1 溶液的配制 (1)对照品溶液的配制:分别精密称取GA、NGA对照品2.00 mg,置于10 mL量瓶中,以乙腈定容,分别制成GA、NGA质量浓度均为0.20 mg/mL的对照品溶液,备用。(2)供试品溶液的配制:分别精密吸取“2.2.1”项下GA纳米囊(GA-LNCs)、NGA纳米囊(NGA-LNCs)0.1 mL至不同10 mL量瓶中,以乙腈定容,即得GA-LNCs、NGA-LNCs供试品溶液。
2.1.2 色谱条件 色谱柱为Silversil C18(250 mm×4.6 mm,5 μm);流动相为乙腈-0.1%磷酸溶液(90 ∶ 10,V/V);流速为1 mL/min;检测波长为360 nm;柱温为30 ℃;进样量为10 μL。
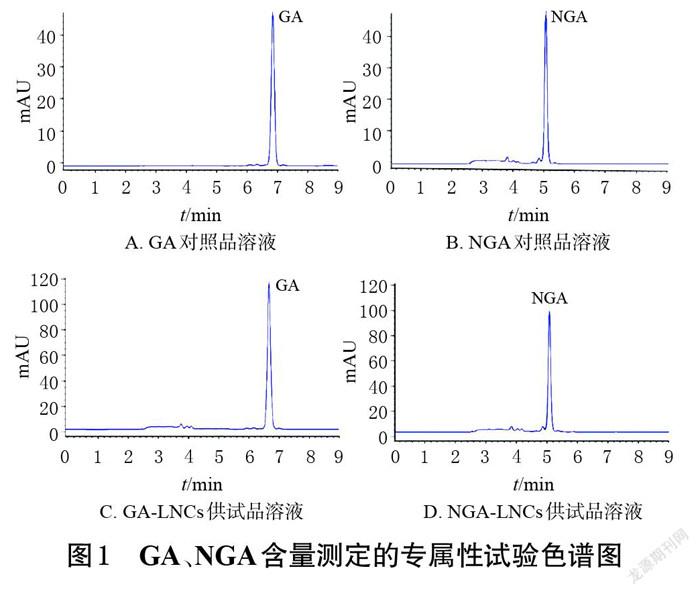
2.1.3 专属性试验 取“2.1.1”项下GA、NGA对照品溶液和GA-LNCs、NGA-LNCs供试品溶液适量,按“2.1.2”项下色谱条件进行分析,记录色谱图。结果显示,各样品中GA和NGA的峰形均较好,且不受辅料及空白溶剂的影响,结果见图1。
2.1.4 线性关系考察 取“2.1.1”项下GA、NGA对照品溶液适量,分别制成质量浓度均为0.01、0.02、0.04、0.08、0.12、0.16、0.20 mg/mL的系列溶液,再按“2.1.2”项下色谱条件进样分析,以各对照品的质量浓度为横坐标(X)、峰面积为纵坐标(Y),进行线性回归。结果显示,GA、NGA的回归方程分别为Y=14 970X-33(R2=0.999 6)、Y=10 050X-17(R2=0.999 6),检测质量浓度线性范围均为0.01~0.20 mg/mL。
2.1.5 精密度試验 分别精密吸取“2.1.1”项下GA、NGA对照品溶液适量,按“2.1.2”项下色谱条件连续进样6次,记录峰面积。结果显示,GA、NGA峰面积的RSD分别为0.87%、0.99%(n=6),表明仪器精密度良好。
2.1.6 重复性试验 取GA-LNCs、NGA-LNCs适量,各6份,分别按“2.1.1”项下方法制备供试品溶液,再按“2.1.2”项下色谱条件进样分析,记录峰面积,根据标准曲线计算GA、NGA的含量。结果显示,GA-LNCs、NGA-LNCs中GA、NGA的平均含量分别为9.01、8.64 mg/g,RSD分别为0.88%、1.42%(n=6),表明该方法重复性良好。
2.1.7 稳定性试验 取GA-LNCs、NGA-LNCs适量,分别按“2.1.1”项下方法制备供试品溶液,然后于室温放置0、4、6、12、24、48 h后,按“2.1.2”项下色谱条件进样分析,记录峰面积。结果显示,GA、NGA峰面积的RSD分别为0.98%、1.66%(n=6),表明这2种供试品溶液在室温放置48 h内稳定性良好。
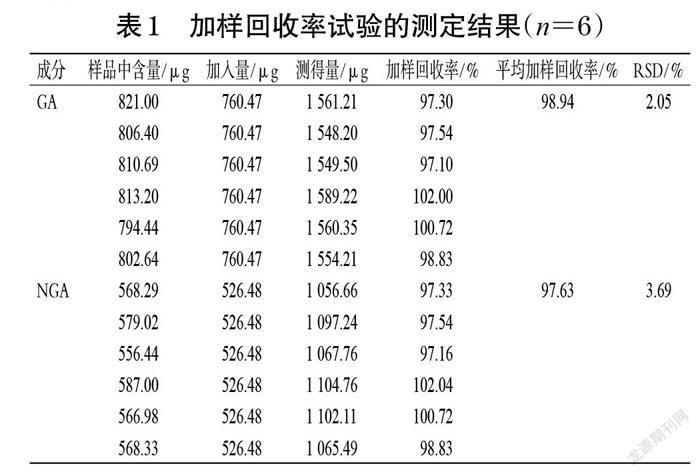
2.1.8 加样回收率试验 吸取已知GA、NGA含量的GA-LNCs、NGA-LNCs供试品溶液,各6份,分别加入GA对照品760.47 μg、NGA对照品526.48 μg,然后按“2.1.2”项下色谱条件进样分析,记录峰面积,并计算加样回收率。结果显示,GA、NGA的平均加样回收率分别为98.94%、97.63%,RSD分别为2.05%、3.69%(n=6)。结果见表1。
2.2 GA-LNCs、NGA-LNCs的制备工艺研究
2.2.1 纳米囊的制备 采用相转化法[25]进行制备。以中链甘油三酯为油相、水为水相、聚乙二醇单硬脂酸酯为表面活性剂[26],按相应比例混合后,加入GA 或NGA原料药35 mg,于室温下匀速搅拌至药物溶解;控制搅拌温度使其匀速上升或下降,完成室温→85 ℃→60 ℃→85 ℃→60 ℃→85 ℃→72 ℃的循环,以形成稳定的均相体系;当温度下降至70 ℃左右时,立即加入适量冰水并搅拌均匀,形成均一稳定的透明溶液,即得相应纳米囊。
2.2.2 载药量和包封率的测定 将葡聚糖凝胶G-50充分溶胀在水中24 h,然后填入注射器使水分自然滤出,再将注射器置于15 mL离心管中,以500 r/min离心1 min,除去多余的水分,即得凝胶柱。取所制得的纳米囊100 μL均匀加入凝胶柱,洗脱5次,每次用0.1 mL水洗脱,收集洗脱液,置于5 mL量瓶中,加入乙腈定容,按“2.1.2”项下色谱条件进样分析,并计算包入的药量W1。另取100 μL纳米囊,加入乙腈定容至5 mL,按“2.1.2”项下色谱条件进样分析,并计算总药量W2。 然后根据公式计算载药量和包封率:载药量=W1/W3×100%(W3为纳米囊的总质量),包封率=W1/W2×100%。
2.2.3 网格法优化GA-LNCs、NGA-LNCs的处方 以包封率和载药量为优化指标,以水相、油相、表面活性剂的比例为考察因素(固定总量为2 g),采用{3,2}单纯型网格设计法对GA-LNCs、NGA-LNCs的处方工艺进行优化[26]。GA-LNCs、NGA-LNCs单纯型网格法实验设计和结果见表2、表3。进一步通过Origin作图分析,得到载药量和包封率的三维图和等高线图,两者等高线图的叠加部分为载药量和包封率均较高的区域,即形成纳米囊的最优处方,结果见图2、图3。结果显示,当油相比例越小、水相比例越大时,GA-LNCs、NGA-LNCs的载药量和包封率均越高。由此可知,GA-LNCs、NGA-LNCs的最优处方均为60%水、10%中链甘油三酯、30%聚乙二醇单硬脂酸酯(三者总量固定为2 g)以及35 mg GA或NGA。
2.2.4 处方验证 按“2.2.3”项下优化的处方工艺,制备GA-LNCs、NGA-LNCs,平行3批,然后测定其包封率和载药量。结果显示,GA-LNCs的包封率和载药量分别为(92.01±0.68)%、(0.99±0.21)%,NGA-LNCs的包封率和载药量分别为(93.12±2.11)%、(1.21±0.22)%。
2.3 GA-LNCs、NGA-LNCs的理化性质考察
2.3.1 外观性状观察 取“2.2.4”项下制备的GA-LNCs、NGA-LNCs适量,加入冰水,于室温条件下放置24 h后,观察其是否有沉淀。结果显示,GA-LNCs、NGA-LNCs均为黄色均一透明液体,且均无沉淀。
2.3.2 透射电镜观察 取“2.2.4”项下制备的GA-LNCs、NGA-LNCs适量,以水稀释后,滴加至铜网,再以2%磷钨酸染色,待自然晾干后,采用透射电镜进行观察。结果显示,GA-LNCs、NGA-LNCs均为类球形,大小均匀,且具有明显的壳膜结构。结果见图4。
2.3.3 粒径、Zeta电位、多分散系数的测定 取“2.2.4”项下制备的GA-LNCs、NGA-LNCs适量,采用马尔文激光粒度分析仪和纳米粒度电位仪测定其粒径、Zeta电位、多分散系数(polydispersity,PDI)。结果显示,GA-LNCs、NGA-LNCs的粒径分别为(28.11±9.76)、(22.06±6.84) nm,Zeta电位分别为(-4.09±1.00)、(-17.40±1.32) mV,PDI分别为0.93±0.06、0.74±0.12。
2.3.4 X-射线衍射分析 X-射线衍射分析是研究药物晶体结构的有效手段,不同的晶体结构在不同位置会有强吸收峰。本研究选择甘露醇作为冻干保护剂,在GA-LNCs制备完成后加入甘露醇搅拌至溶解,以保护GA-LNCs的形态结构。取GA原料药、甘露醇、GA-LNCs(以甘露醇冻干)、甘露醇与GA-LNCs的物理混合物进行X-射线衍射分析。设置管压为40 kV,管流为40 mA,衍射角2 θ范围为10°~70°,扫描速度为4°/min。结果显示,GA存在晶型结构,主要衍射峰在23.15°,甘露醇衍射峰在18.26°,二者的吸收峰峰形均较为尖锐。在物理混合物中GA与甘露醇均以晶体形式存在,所以同时显示二者的吸收峰。GA-LNCs在冻干前加入甘露醇来防止纳米囊结构被破坏,使GA被包裹进纳米囊中,所以GA-LNCs的X-射线衍射图谱中没有GA的吸收峰,这说明GA被有效地包裹在纳米囊中。结果见图5。
2.4 GA-LNCs、NGA-LNCs抗DM活性评价
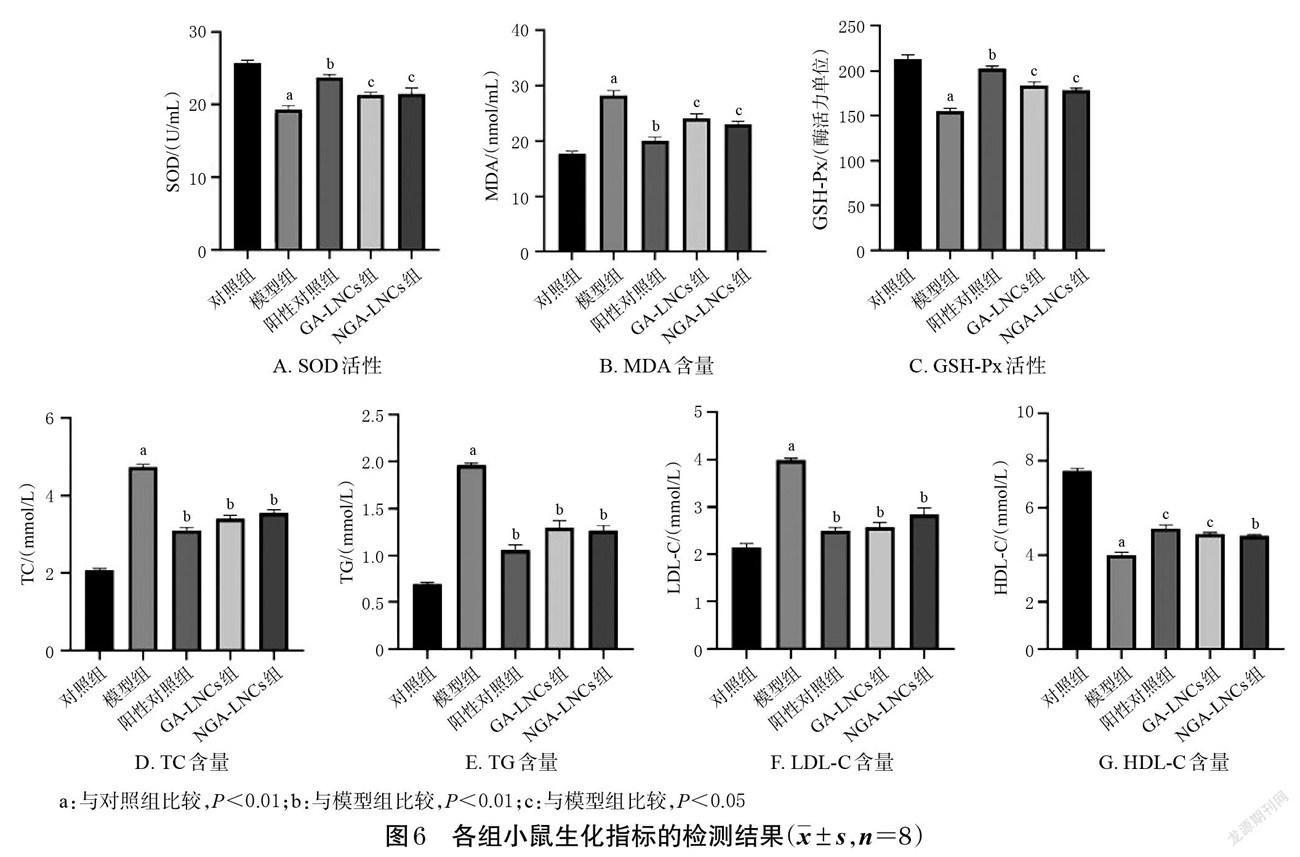
将小鼠随机分为对照组(以普通饲料饲养)和造模组(以高脂高糖饲料饲养),饲养期间每隔7 d对小鼠空腹血糖值(fasting blood glucose,FBG)进行检测。5周后,各组小鼠禁食不禁水12 h,造模组小鼠腹腔注射100 mg/kg STZ溶液,對照组同法注射等量柠檬酸缓冲液,72 h后,检测小鼠FBG,当FBG>11.1 mmol/L时,表明造模成功[27]。将造模成功的小鼠随机分为模型组、阳性对照组(二甲双胍200 mg/kg,剂量根据文献[27]设置)、GA-LNCs组(1.92 mg/kg,剂量根据预实验结果设置,以GA计)、NGA-LNCs组(2.42 mg/kg,剂量根据预实验结果设置,以NGA计),每组8只。对照组和模型组小鼠灌胃生理盐水,其余各组小鼠灌胃相应药物,每天1次,连续给药6周。末次给药12 h后(禁食),取血,离心取上清液备用,采用相应试剂盒检测各组小鼠血清中 SOD、GSH-Px 活性和 MDA、TC、TG、LDL-C、HDL-C含量。采用 SPSS 20.0统计学软件对数据进行分析,结果以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,检验水准α=0.05。结果显示,与对照组比较,模型组小鼠血清中SOD、GSH-Px活性和HDL-C含量均显著降低(P<0.01),FBG和MDA、TC、TG、LDL-C含量均显著升高(P<0.01);与模型组比较,各给药组小鼠血清中SOD、GSH-Px活性和HDL-C含量均显著升高(P<0.05或P<0.01),FBG(从给药第2周起)和MDA、TC、TG、LDL-C含量均显著降低(P<0.05或P<0.01)。结果见表4、图6。
3 讨论
本研究将GA和NGA通过相转换法制成纳米囊,以改善两者的口服生物利用度,以期为DM新药开发提供参考。在相转换法中,以不同比例水相、油相、表面活性剂制备的纳米囊呈不同色泽,按部分比例制得的纳米囊为混悬液而非澄清溶液。基于此,本研究固定纳米囊总量,以包封率和载药量为指标,采用单纯型网格法,优化GA-LNCs、NGA-LNCs水相、油相、表面活性剂的比例。结果表明,当水相为60%、油相为10%、表面活性剂为30%时,制得的纳米囊较为稳定。进一步观察其外观形态、粒径、Zeta电位、PDI等理化性质发现,GA-LNCs、NGA-LNCs均为黄色均一透明液体,无沉淀,且在透射电镜下显示为类球形,具有明显壳膜结构,粒子间分散状态也较为良好;粒径在20~30 nm范围内,这可能是由于GA和NGA中的酚羟基可与表面活性剂上的羧基发生酯化作用,使得粒径较小。
本课题组前期检测发现,NGA在检测范围内没有衍射峰,所以本研究仅考察了GA原料药及其纳米囊制剂的衍射图谱。结果发现,GA与甘露醇物理混合后,其图谱中同时存在甘露醇和GA的衍射峰,而在GA-LNCs(含有冻干保护剂甘露醇)图谱中未检测到GA的衍射峰,这表明GA被稳定地包封在纳米囊中,而不是单独存在。
DM引发的并发症与氧化应激反应有关,氧化应激可导致MDA含量升高以及SOD、GSH-Px活性降低,其中MDA可造成DNA和蛋白质的损伤,而SOD和GSH-Px可清除体内自由基,从而抑制氧化应激反应,提高机体抗氧化能力[28]。本研究结果显示,与模型组比较,GA-LNCs组和NGA-LNCs组小鼠血清中SOD、GSH-Px活性均显著升高,MDA含量均显著降低,这表明GA-LNCs、NGA-LNCs均可通过抗氧化途径发挥抗DM作用。
DM患者胰岛功能不足,体内脂质代谢酶活性随之下降,从而促进血脂升高,进而导致心血管疾病的发生[29]。本研究结果显示,与模型组比较,GA-LNCs组和NGA-LNCs组小鼠血清中HDL-C含量均显著升高,TC、TG、LDL-C含量均显著降低,表明GA-LNCs、NGA-LNCs均可有效调节DM模型小鼠的脂质代谢紊乱。
综上所述,本研究成功制备了藤黄2种有效成分的纳米囊,这2种纳米囊的理化性质良好,且具有较好的抗DM活性,可为藤黄的进一步合理开发及应用提供参考。
参考文献
[ 1 ] 房姝余,李梦芳,黄厚强,等.糖尿病患者体位性低血压的护理研究进展[J].护士进修杂志,2020,35(13):1180- 1183.
[ 2 ] LI Y Z,TENG D,SHI X G,et al. Prevalence of diabetes recorded in mainland China using 2018 diagnostic criteria from the American Diabetes Association:national cross sectional study[J].BMJ,2020,369:m997.
[ 3 ] 程智刚.蜂胶提取活性黄酮及酯萜类新工艺和其纳米制剂:蜂胶总黄酮硬脂酸固态脂质纳米粒制备及药理学研究[D].长沙:中南大学,2005.
[ 4 ] 郑赵情,张莉,沈凯凯,等.藤黄的研究进展[J].世界中医药,2016,11(7):1180-1188.
[ 5 ] 张莉,蔡双璠,孔思远,等.中国藤黄属植物的药理作用研究进展[J].世界中医药,2016,11(7):1189-1194.
[ 6 ] 马静,成志平,赵梦中,等.藤黄中藤黄酸和新藤黄酸的提取分离及药理毒理研究[J/OL].临床医药文献电子杂志,2020,7(23):161[2022-03-24]. https://kns.cnki.net/kcms/detail/detail.aspx?dbcode=CJFD&dbname=CJFDLAST- 2020&filename=LCWX202023155&uniplatform=NZKPT&v=TMhQVzmDaQtIvDkp-pnyyI1FcKrO5Oq8mIMmIOkOQNYowokP1XJwEewakBvyRUNN. DOI:10.16281/ j.cnki.jocml.2020.23.155.
[ 7 ] 杨莉,王梅,程卉,等.新藤黄酸誘导细胞凋亡抑制A549细胞裸鼠移植瘤增长的研究[J].中国中药杂志,2011,36(9):1217-1221.
[ 8 ] LI Q L,CHENG H,ZHU G Q,et al. Gambogenic acid inhibits proliferation of A549 cells through apoptosis- inducing and cell cycle arresting[J]. Biol Pharm Bull,2010,33(3):415-420.
[ 9 ] YAN F G,WANG M,CHEN H,et al. Gambogenic acid mediated apoptosis through the mitochondrial oxidative stress and inactivation of Akt signaling pathway in human nasopharyngeal carcinoma CNE-1 cells[J]. Eur J Pharmacol,2011,652(1/2/3):23-32.
[10] 仝雷,王世广,杨占峰,等.藤黄酸通过核因子κB抑制剂激酶α/p65信号通路抑制人胃癌细胞系SGC-7901的侵袭[J].解剖学报,2020,51(1):46-50.
[11] CASC?O R,VIDAL B,RAQUEL H,et al. Potent anti- inflammatory and antiproliferative effects of gambogic acid in a rat model of antigen-induced arthritis[J]. Mediators Inflamm,2014,2014:195327.
[12] 杨虹,丛晓东,王峥涛.药用藤黄化学成分的研究[J].中国药学杂志,2008,43(12):900-902.
[13] HATAMI E,JAGGI M,CHAUHAN S C,et al. Gambogic acid:a shining natural compound to nanomedicine for cancer therapeutics[J]. Biochim Biophys Acta Rev Cancer,2020,1874(1):188381.
[14] 何忠梅,赵昱玮,郜玉钢,等.藤黄酸、新藤黄酸及其组合物的医药用途:CN103816147A[P]. 2014-05-28.
[15] LIU Y L,CHEN Y C,LIN L F,et al. Gambogic acid as a candidate for cancer therapy:a review[J]. Int J Nanomedicine,2020,15:10385-10399.
[16] 唐校柱.新藤黄酸PEG化脂质体的制备、体内外抗肿瘤药效学、初步药动学研究[D].合肥:安徽中医药大学,2019.
[17] LIN T Y,FANG Q Y,PENG D Y,et al. PEGylated non-ionic surfactant vesicles as drug delivery systems for gambogenic acid[J].Drug Deliv,2013,20(7):277-284.
[18] 李光华.微粒给药系统在体内分布的特点及制剂研究进展[J].天津药学,2013,25(2):47-49.
[19] GUPTA A,ERAL H B,HATTON T A,et al. Nanoemulsions:formation,properties and applications[J]. Soft Matter,2016,12(11):2826-2841.
[20] LAXMI M,BHARDWAJ A,MEHTA S,et al. Development and characterization of nanoemulsion as carrier for the enhancement of bioavailability of artemether[J].Artif Cells Nanomed Biotechnol,2015,43(5):334-344.
[21] 周闻舞,顾海铮.壳聚糖微/纳米粒在定向给药系统中的应用研究[J].药物评价研究,2010,33(4):290-295.
[22] 尹孝莉,周思敏,吴方雨,等.新藤黄酸纳米乳的制备、表征以及体外抗肿瘤药效学的研究[J].中南药学,2021,19(4):565-572.
[23] JANAGAM D R,WU L F,LOWE T L. Nanoparticles for drug delivery to the anterior segment of the eye[J]. Adv Drug Deliv Rev,2017,122:31-64.
[24] BINKHATHLAN Z,LAVASANIFAR A. P-glycoprotein inhibition as a therapeutic approach for overcoming multidrug resistance in cancer:current status and future perspectives[J]. Curr Cancer Drug Targets,2013,13(3):326- 346.
[25] ANTON N,GAYET P,BENOIT J P,et al. Nano-emulsions and nanocapsules by the PIT method:an investigation on the role of the temperature cycling on the emulsion phase inversion[J]. Int J Pharm,2007,344(1/2):44-52.
[26] 翟英杰.罗哌卡因类脂纳米囊制剂及其经皮给药研究[D].济南:山东大学,2015.
[27] 孙宏莱,刘悦,刘德江,等.毛水苏多糖对糖尿病小鼠肾脏的保护作用[J].食品工业科技,2021,42(17):373-380.
[28] 美娜·斯拉木江,李娜,张明珠,等.苍柏逐瘀汤治疗糖尿病周围神经病变痰瘀阻络证临床观察[J].山西中医,2021,37(4):19-21,24.
[29] FILIPPATOS T,TSIMIHODIMOS V,PAPPA E,et al. Pathophysiology of diabetic dyslipidaemia[J]. Curr Vasc Pharmacol,2017,15(6):566-575.
(收稿日期:2021-12-03 修回日期:2022-03-25)
(編辑:唐晓莲)
