生物土壤结皮对东祁连山高寒草甸土壤特性的影响
2022-05-11卢研张倩张彩军孙小妹苏军虎
卢研,张倩,张彩军,孙小妹,苏军虎
(1.甘肃农业大学 草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070;2.甘肃农业大学—新西兰梅西大学草地生物多样性研究中心,甘肃 兰州 730070;3.甘肃省祁连山草原生态系统野外科学观测研究站,甘肃 兰州 730070;4.甘肃农业大学资源与环境学院,甘肃 兰州 730070)
生物土壤结皮(Biological soil crusts,BSCs)是由非维管束植物(苔类、藓类、藻类、地衣、真菌、细菌和蓝藻)通过菌丝体、假根和微生物分泌物等与表层松散的土壤颗粒紧密结合形成的集合体,是干旱、半干旱荒漠地表景观的重要组成成分[1]。研究表明,BSCs在很多脆弱或受损生态系统中占据着重要的生态位[2],在土壤生态系统的碳、氮循环中,发挥着重要的生态功能[3]。国内外对BSCs的研究目前主要集中在干旱、半干旱地区[4],涉及BSCs对土壤稳定性和理化性质、土壤生态水文过程的影响等方面[1,4],同时发现BSCs的存在可改变微生境,影响菌类和土壤动物及维管植物的生存和繁衍,多层次上影响着生态系统的结构和功能,促使生态系统健康发展[1,5]。
BSCs不仅在干旱、半干旱地区广泛分布,在高寒草甸也有着分布[6],尤其是在过度放牧及不合理的开发利用区[7]。作为原生演替的初始阶段,BSCs可在荒漠生态系统的裸地生存、发育[8],提高空斑的土壤养分含量[9]。在高寒草甸的研究发现,草地退化程度及其土壤状况会影响BSCs的生长发育[10]。而在黄河源区人工草地的研究表明,BSCs有利于改善土壤特性,提高土壤速效养分和土壤有机质的含量[6]。也就是说BSCs既可促进正向演替,又是逆向演替的表征。
众所周知,土壤酶活性和微生物量碳氮也与土壤养分含量息息相关,土壤酶主要来源于土壤微生物的活动、植物根系分泌物和动植物残体腐解过程[11]。其既是生态系统的生物催化剂,也是土壤有机体的代谢动力,在土壤物质循环和能量转化过程中起着重要作用,是土壤生态系统变化的敏感指标[12],能够较全面地反映土壤环境、肥力和质量的变化[13]。土壤微生物量可快速表征微生物的活跃性[14],在土壤养分循环中发挥着不可或缺的作用。那么BSCs对土壤酶活性和微生物量碳氮含量是否存在影响,如果存在影响,BSCs对土壤酶活性、微生物量碳氮和养分含量的影响率是否存在差异还有待进一步的研究。
近年来祁连山高寒草甸生态系统受人类活动干扰严重,BSCs呈斑块状镶嵌在高寒草甸中。本研究以高寒草甸为研究对象,比较BSCs覆盖和草本植物(Herbs)覆盖区的土壤特性,探究BSCs在高寒草甸生态系统中的作用,旨在为理解BSCs在高寒草甸中的生态功能提供理论依据,献力祁连山高寒草甸退化草地的修复和管理。
1 材料和方法
1.1 研究区概况
研究区位于甘肃省天祝县抓喜秀龙镇甘肃省祁连山草原生态系统野外科学观测研究站,地理位置N 37°10′~37°13′,E 102°45′~102°48′,平均海拔约2 900 m。该地区气温昼夜温差大,四季不甚分明,气温垂直分布明显,年均气温-0.1 ℃,年均日照时数2 500~2 700 h,降水主要集中在6-8月,年均降水量416 mm,年均蒸发量1 600 mm,属大陆性半干旱气候,无绝对无霜期,属于高寒草甸土[15]。草地类型为高寒草甸,优势种为矮嵩草(Kobresiahumilis),伴生种为扁穗冰草(Agropyroncristatum)、垂穗披碱草(Elymusnutans)、二裂委陵菜(Potentillabifurca)和鹅绒委陵菜(P.anserina)等。
1.2 样地设置及取样方法
选择试验站的3块围封样地,样地面积0.2 hm2,从2011年起全年围封禁牧。样地内BSCs呈25~48 cm2的斑块状分布,以苔藓结皮为主。在每块样地沿对角线设置3个0.5 m×0.5 m的样方,在每个样方内采集BSCs覆盖区和Herbs覆盖区的土壤,土样分5层采取,0~2、2~5、5~10 cm(直径5 cm的环刀采取)、10~20和20~30 cm(直径5 cm的土钻采取),1个样地的土样混合成1个样品。土样置于自封袋带回实验室进行自然风干,去除草根等杂物后过1 mm筛备用。
1.3 测定方法
土壤含水率用铝盒烘干法,pH用蒸馏水(1∶2.5土水比)浸提后用酸度计测定,全氮用半微量凯氏定氮法,全磷用钼锑抗比色法,全钾用火焰光度计测定,有机质用硫酸-重铬酸钾外加热法,速效氮用碱解扩散法测定,速效磷用高锰酸钾氧化-葡萄糖还原法测定[16],速效钾采用NH4OAc浸提-火焰光度法测定[17]。土壤脲酶活性用靛酚蓝比色法测定,土壤碱性磷酸酶活性用磷酸苯二钠法测定,土壤蔗糖酶活性用3,5-二硝基水杨酸比色法测定[11]。土壤微生物生物量碳(Soil microbial biomass carbon,SMBC)和土壤微生物生物量氮(Soil microbial biomass nitrogen,SMBN)含量采用氯仿熏蒸法[15],浸提液采用碳氮联合分析仪(Germany,analytikjena,Multi N/C 2100s)测定。
1.4 数据处理与分析
应用Excel 2010对所得数据进行简单处理并制作相关图表,采用SPSS 23.0软件进行独立样本T检验,采用R 3.6.3语言软件FactoMineR和Factoextra包对0~20 cm土层BSCs和Herbs覆盖区下的土壤指标分别进行主成分分析,lavaan包构建结构方程模型。
2 结果与分析
2.1 BSCs对土壤理化特性的影响
BSCs覆盖区,各土层pH均呈碱性,0~20 cm土层均表现为BSCs覆盖区的pH值高于Herbs覆盖区(图1-A)。0~2,2~5,5~10,10~20和20~30 cm土层BSCs覆盖区的含水率较Herbs覆盖区含水率分别升高了3.44%、1.51%、7.96%、5.70%、9.83%,其中0~2 cm土层BSCs覆盖区的含水率最大,为39.13%(图1-B)。BSCs覆盖区的pH值随着土层深度增加,逐渐上升,含水率先降低后上升。0~10 cm土层有机碳含量在BSCs覆盖区均低于Herbs覆盖区,分别降低了12.10%、5.87%、1.88%,其中0~2 cm土层差异显著(P<0.05),2~5 cm土层差异极显著(P<0.01),10~30 cm土层有机碳含量在BSCs覆盖区均高于Herbs覆盖区,分别增加了0.50%、5.43%(图1-C)。
在2~5、10~20和20~30 cm土层,BSCs覆盖区全氮含量相较于Herbs覆盖区分别升高了8.26%、51.80%和22.01%,其中10~20 cm土层BSCs覆盖区和Herbs覆盖区之间差异显著(P<0.05)(图1-D)。10~20 cm土层全磷含量,BSCs覆盖区升高了23.36%,与Herbs覆盖区间差异显著(P<0.05)(图1-E)。2~5、5~10、10~20和20~30 cm土层BSCs覆盖区全钾含量相较于Herbs覆盖区分别降低了1.67%、8.62%、2.91%和2.4%(图1-F)。相较于Herbs覆盖区,2~5、5~10和10~20 cm土层BSCs覆盖区的速效氮含量分别降低了7.21%、4.69%和11.45%,其中10~20 cm土层差异显著(P<0.05),0~2、20~30 cm土层的速效氮含量升高了0.71%、18.64%(图1-G)。0~2、10~20和20~30 cm土层BSCs覆盖区速效磷含量相较于Herbs,分别升高了33.86%、39.29%和18.03%,其中0~2 cm土层差异极显著(P<0.01)(图1-H)。除20~30 cm土层外,其他土层速效钾含量低于Herbs覆盖区,分别降低了11.08%、14.88%、15.77%和7.33%(图1-I)。BSCs覆盖下的土壤中,随着土层深度的增加,土壤速效氮、速效钾和有机碳含量逐渐降低(图1-G,图1-I,图1-C)。
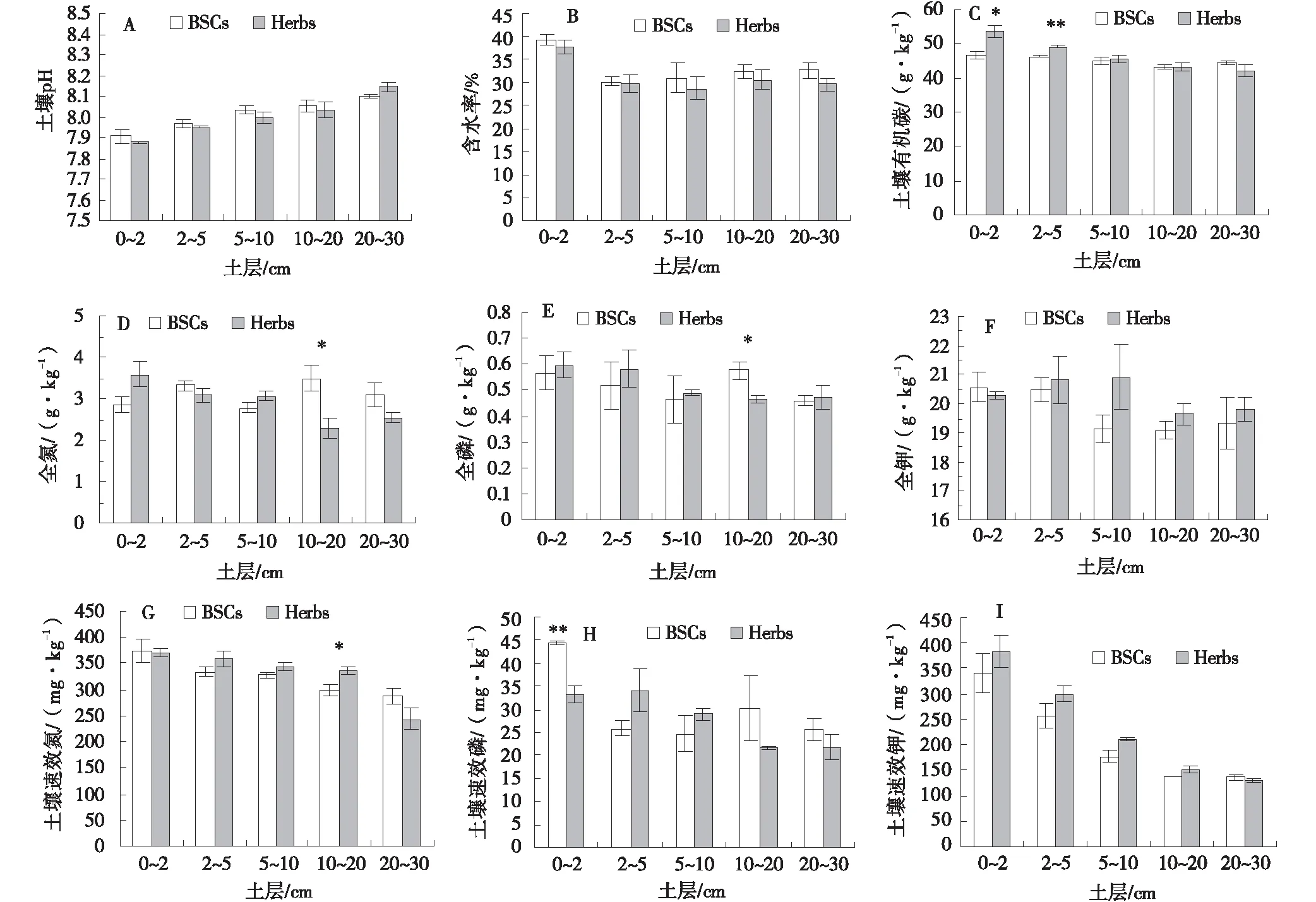
图1 土壤理化特性Fig.1 Soil physical and chemical properties注:BSCs:生物土壤结皮;Herbs:草本;** 表示BSCs与Herbs之间在0.01水平上差异显著;*表示BSCs与Herbs之间在0.05水平上差异显著。下图同
2.2 BSCs对土壤酶活性的影响
在0~2、5~10、10~20 cm土层BSCs覆盖区蔗糖酶活性高于Herbs覆盖区(图2-A),脲酶活性在各土层均低于Herbs覆盖区(图2-B),2~5、10~20 cm土层BSCs覆盖区碱性磷酸酶活性高于Herbs覆盖区,其中2~5 cm土层差异极显著(P<0.01)(图2-C)。在BSCs覆盖区,随着土层深度增加,土壤蔗糖酶活性呈逐渐升高,脲酶活性逐渐下降,碱性磷酸酶活性先升高后降低(图2-C)。
2.3 BSCs对土壤微生物生物量碳氮的影响
相较于Herbs覆盖区,0~2、2~5 cm土层BSCs覆盖区SMBC含量分别降低6.19%、21.74%,5~10、10~20 cm土层含量分别升高4.65%、27.06%(图3-A)。SMBN含量在0~2、2~5、5~10、10~20 cm土层BSCs覆盖区均低于Herbs覆盖区,分别降低了26.26%、30.48%、30.39%、15.35%,其中5~10 cm土层BSCs覆盖区和Herbs覆盖区之间差异显著(P<0.05)(图3-B)。随着土层深度的增加,BSCs覆盖区的SMBC含量先降低后升高,SMBN含量则逐渐降低。

图2 土壤酶活性Fig.2 Soil enzyme activity

图3 土壤微生物生物量碳氮Fig.3 Soil microbial biomass
2.4 土壤因子的主成分分析
BSCs覆盖区根据特征值高于1的原则提取4个公因子,累计贡献率达81.703%,能较全面地反映所有信息(图4-A)。第一主成分的特征值为6.439(表1),微生物生物量碳(0.917)、脲酶活性(0.903)、微生物生物量氮(0.848)、速效钾(0.825)、pH(-0.740)、有机碳(0.717)、蔗糖酶活性(-0.700)载荷高,与pH、蔗糖酶活性呈现负相关,各指标在主成分中的载荷值越大则与主成分关系越密切。Herbs覆盖区根据特征值高于1的原则提取4个公因子,累计贡献率达79.678%(图4-B)。第一主成分的特征值为4.482(表1),高载荷因子有速效钾(0.905)、有机碳(0.795)、脲酶活性(0.788),第二主成分的特征值为2.902,高载荷因子有SMBN(0.927)、碱性磷酸酶活性(0.727),第三主成分的特征值为2.508,高载荷因子有蔗糖酶活性(0.833),与之均呈现出较强的正相关。

图4 BSCs覆盖区和Herbs覆盖区的土壤因子主成分分析Fig.4 Principal component analysis of soil factors in BSCs coverage area and Herbs coverage area注:SWC:含水率,TN:全氮,TP:全磷,TK:全钾,AN:速效氮,AP:速效磷,AK:速效钾,SOC:有机碳,UE:脲酶,ALP:碱性磷酸酶,SC:蔗糖酶,SMBC:微生物生物量碳,SMBN:微生物生物量氮。下同
2.5 土壤特性对BSCs和Herbs覆盖区的响应率
由主成分分析结果筛选出代表土壤特性的指标,其中速效钾、有机碳含量、pH、脲酶活性、蔗糖酶活性、微生物生物量碳、微生物生物量氮含量代表BSCs覆盖区的土壤特性,速效钾、有机碳含量、脲酶活性、碱性磷酸酶活性、蔗糖酶活性、微生物生物量氮含量代表Herbs覆盖区的土壤特性。把BSCs覆盖区和Herbs覆盖区下土壤特性作为隐变量构建结构方程模型。结果表明,结构方程模型的拟合度指数分别为GFI=0.649,GFI=0.582,表明此结构方程模型都能够较好的解释BSCs覆盖区和Herbs覆盖区下土壤特性的变化。通过结构方程模型可以得出BSCs和Herbs对土壤特性的影响力(图5),BSCs对微生物生物量碳、微生物生物量氮含量、脲酶活性和速效钾含量的影响明显,通径系数分别为0.881、0.867、0.842、0.841。Herbs对脲酶活性和速效钾含量的影响明显,通径系数分别为0.961、0.814。
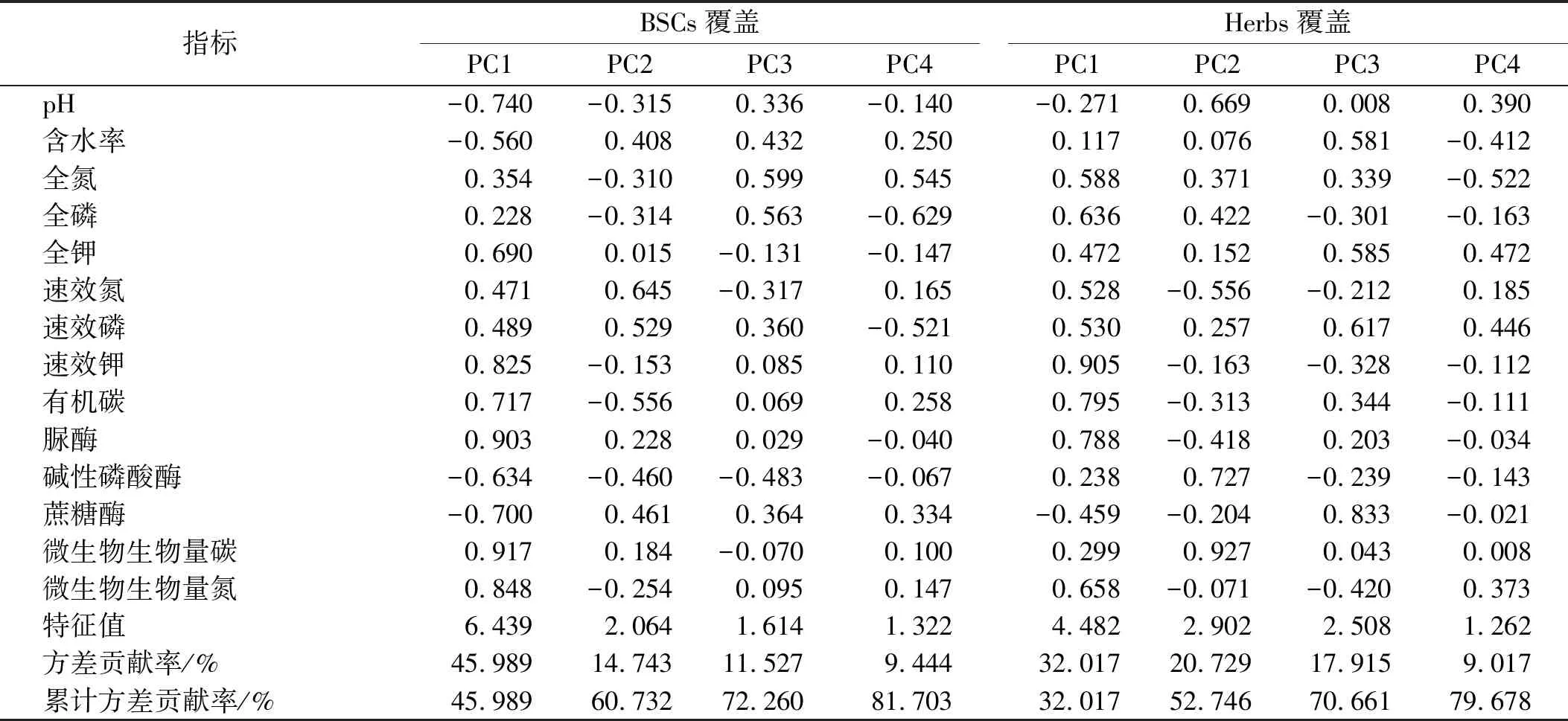
表1 土壤因子变量的载荷及解释方差
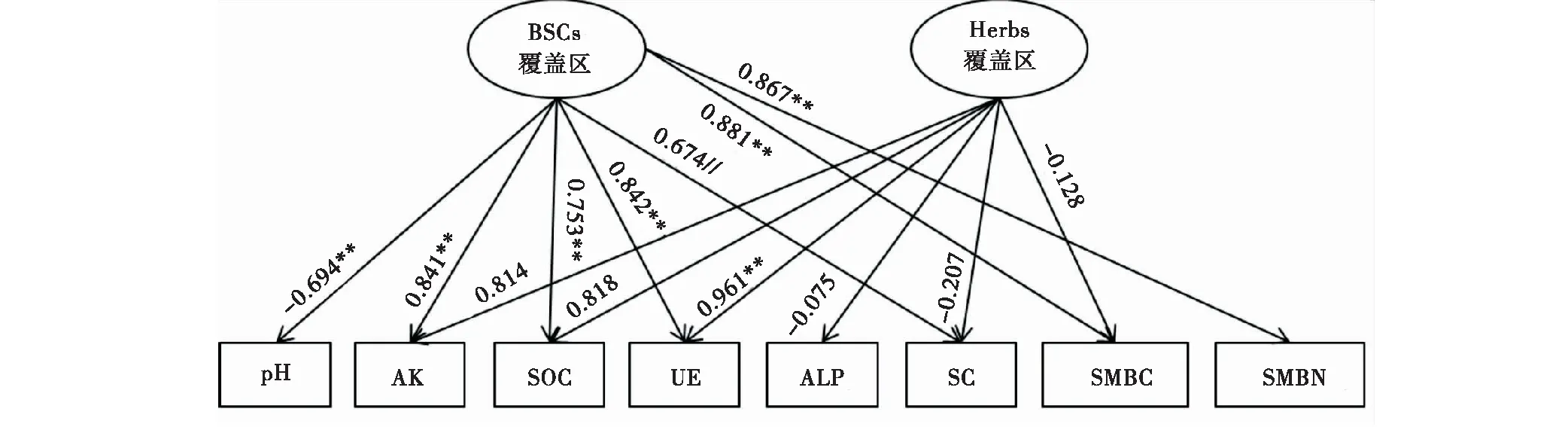
图5 BSCs覆盖区和Herbs覆盖区下的土壤特性Fig.5 Soil properties in BSCs coverage area and Herbs coverage area
3 讨论
土壤稳定性是群落稳定性恢复的前提,BSCs通过维持土壤稳定性来恢复草地生态系统[8],BSCs发生在所有主要土壤类型和几乎所有阳光可以到达土壤表面的植被群落中[4]。本研究发现在BSCs影响下土壤含水率有增加趋势,这可能是因为苔藓能通过卷曲叶片、改变叶片的方向减少水分蒸发,叶片的毛状叶尖结构能通过反射入射的光照减少水分蒸发,苔藓植物形成垫状、丛状或毯状的生长型,提高了毛细管系统的吸水能力,减少了空气在叶片表面的运动,从而减少了水分的蒸发,保持了水分[18]。
结构方程结果表明,BSCs对土壤特性的影响大于Herbs。Herbs仅影响了速效钾含量和脲酶活性,而BSCs对参试指标均为显著的正效影响,其中对土壤微生物生物量碳氮含量的影响最大。究其原因,可能是BSCs的存在改善了表层土壤的理化性质,为微生物的生存提供了适宜的生存环境,同时为微生物提供了重要的食物来源,使微生物数量增加,从而提高土壤微生物生物量碳氮含量[19]。众所周知,土壤碳、氮、磷、钾不仅作为土壤重要的营养元素,更是表征土壤肥力和土壤质量的重要指标[9]。土壤养分循环与平衡直接影响着生态系统生产力的高低,关系到生态系统的稳定性[20]。本研究发现BSCs对土壤理化性质有所改善,使0~2 cm土层速效氮和速效磷含量分别增加0.71%、33.86%,使10~20 cm土层全氮(55.8%)、全磷(23.36%)、速效磷(39.29%)和有机碳(0.50%)含量增加(图1)。孙华方等[6]研究发现,高寒地区BSCs覆盖区土壤养分含量普遍高于无BSCs覆盖区,对较长建植年限人工草地土壤速效氮、速效钾积累效果显著,能够增加土壤有机质含量。这与本研究结果相似,可能是因为BSCs中微生物能够在其生命活动过程中不断同化环境中的有机碳,同时又向外界释放碳素,而BSCs又作为土壤氮素输入的重要贡献者,在土壤碳氮循环过程中具有重要意义[4]。微生物作为土壤生态系统中最活跃的一部分,在养分转化过程中起重要作用,其中有机质或全效养分被转化为速效养分有利于速效养分在土壤中积累[20]。程才等[21]研究也表明在石漠化生境下,BSCs层养分含量显著高于下层土壤,BSCs覆盖的土壤养分高于无BSCs覆盖的裸土。
BSCs影响下,随着土层的增加,土壤蔗糖酶活性逐渐升高,脲酶活性逐渐降低(图2)。这与杨航宇等[22]研究相似,在腾格里沙漠BSCs能提高土壤表层碱性磷酸酶活性,且呈明显的垂直分布,即随着土层的加深,酶活性逐渐减弱。这是因为表层有少量的枯枝落叶和腐殖质可以支持微生物的生长,且温度条件和通气状况良好,表层土壤微生物很容易从BSCs获得充足营养,使表层的土壤酶活性相应提高[13,22]。而在BSCs的影响下脲酶活性低于Herbs覆盖区,这可能是因为在高寒草甸草地根际的影响高于BSCs产生的影响,马源等[23]研究指出,在高寒草甸退化草地土壤中,酶活性和微生物生物量的含量均表现为根际土壤高于非根际土壤。土壤根系可直接影响的土壤范围作为一个微生物的特殊生境,微生物受到环境因素刺激时会不断向周围分泌酶,表现为以植物根系为中心,向四周逐渐减小的变化规律[23]。但是表层土壤微生物能从BSCs获得充足营养和能量,促进土壤微生物的生长与繁殖,使得土壤微生物生物量及酶活性增加,从而改善了表层土壤的理化性质[24]。
4 结论
与Herbs覆盖区相比,BSCs覆盖区能改善土壤特性,使土壤含水率提高,最高达9.83%,全氮、全磷、速效磷、速效氮和有机碳含量分别提高55.8%、23.36%、39.29%、18.64%和5.43%,增加土壤蔗糖酶活性(0~2、5~20 cm土层)和表层(2~5 cm)碱性磷酸酶活性。BSCs对土壤特性的影响大于Herbs,Herbs仅对速效钾含量和脲酶活性影响显著,而BSCs对参试指标均为显著的正效影响,其中对土壤微生物生物量碳氮含量的影响最大。因此,BSCs具有改善高寒草甸土壤环境质量的生态功能,从而促进群落结构的正向演替,对高寒草甸生态系统的恢复具有重要的生态学意义。
