非小细胞肺癌靶向治疗相关肝损伤情况及其早期标志物的临床价值研究
2022-05-09鲁志兵占志强曾建伦黄行志李瑞娟彭济勇
鲁志兵,占志强,曾建伦,黄行志,李瑞娟,彭济勇
(江西省萍乡市人民医院肿瘤科,江西 萍乡 337000)
肺癌是目前全球病死率第一的癌症,我国肺癌的发病率约占全球的40%,且呈上升趋势,严重威胁患者的生命安全[1]。根据组织学分类可将肺癌分为非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌,其中NSCLC占肺癌总数的80%左右[2]。NSCLC 早期可采用手术切除,中晚期只能进行放化疗治疗。但近年来,肺癌化疗研究并未取得突破性进展,且具有较为严重的不良反应。随着医疗水平的不断进步,靶向治疗的出现不仅为肺癌治疗提供了新选择,还将其治疗提高到分子水平,取得了较好的临床疗效[3]。但靶向药物治疗也存在一定的不良反应,如增高患者心脏毒性风险,诱发肝损伤[4]。基于此,本研究选取本院收治的90 例NSCLC患者作为研究对象,旨在探究非小细胞肺癌靶向治疗相关肝损伤情况及其早期标志物预测早期肝损伤的价值,现报道如下。
1 资料与方法
1.1 临床资料 选取2019年12月至2021年1月本院收治的90 例NSCLC 患者作为研究对象,按治疗方式分为单纯化疗组(A 组)、单纯靶向组(B 组)和靶向化疗联合组(C 组),每组30 例。A 组男12 例,女18 例;年龄26~80 岁,平均(61.45±11.34)岁;腺癌 22 例,鳞癌 6 例,腺鳞癌 2 例;TNM 分期:Ⅰ期 11例,Ⅱ~Ⅲ期 15 例,Ⅳ期 4 例。B 组男 17 例,女 13例;年龄30~82 岁,平均(59.76±11.67)岁;腺癌23例,鳞癌5例,腺鳞癌2例;TNM分期:Ⅰ期10例,Ⅱ~Ⅲ期 16 例,Ⅳ期 4 例。C 组男 10 例,女 20 例;年龄28~81岁,平均(60.59±10.97)岁;腺癌21例,鳞癌7例,腺鳞癌2例;TNM分期:Ⅰ期12例,Ⅱ~Ⅲ期14例,Ⅳ期4例。3组患者临床资料比较差异无统计学意义,具有可比性。本研究经本院伦理委员会审核批准。
1.2 纳入及排除标准
1.2.1 纳入标准 均符合《美国国立综合癌症网络(NCCN)临床实践指南:非小细胞肺癌(2018.V6)》[5]和《非小细胞肺癌2017版NCCN治疗指南中文版》[6]中NSCLC 相关诊断标准。经细胞学或组织病理学检查确诊;预期生存期≥3 个月;经证实表皮生长因子受体(epidermal growth factor receptor,EGRF)基因等突变且接受过分子靶向治疗药物治疗;患者均自愿参与本研究并签署知情同意书。
1.2.2 排除标准 妊娠期或哺乳期女性;存在严重心、肾等功能障碍;合并其他恶性肿瘤或影响血清肿瘤标志物疾病;合并严重并发症。
1.2.3 剔除及脱落标准 治疗期间接受其他治疗影响研究疗效;由于患者自身因素无法完成治疗。
1.3 方法
1.3.1 A 组 实施肿瘤基础治疗+化疗治疗(PP 方案)。500 mg/m2培美曲塞(国药一心制药有限公司,国药准字H20080169,规格:0.5 g)中加入100 ml 0.9氯化钠溶液静滴,每次10~15 min,每3周重复1次,治疗过程需补充叶酸和维生素B12,治疗前1 d、当日和治疗后次日口服地塞米松(广东南国药业有限公司,国药准字H44024618,规格:0.75 mg×100片/瓶)每次4 mg,每天2次,同时在75 mg/m2顺铂(齐鲁制药有限公司,国家准字H20023461,规格:20 mg)中加入500 ml 0.9%氯化钠注射液静滴,并给予止吐和水化处理。均第1 天给药,21 d 为1 个治疗周期,治疗过程中根据患者化验指标给予抗感染治疗。
1.3.2 B 组 实施肿瘤基础治疗+靶向药物治疗。根据患者基因检测状况选择个性化靶向药物,如口服吉非替尼[齐鲁制药(海南)有限公司,国药准字H20163465,规格:0.25 g×10 片/盒],每次 250 mg,每天1 次;口服埃克替尼(贝达药业股份有限公司,国药准字20110061,规格:0.125 g×21 片/盒),每次125 mg,每天3 次;口服厄洛替尼(上海创诺制药有限公司,国药准字H20193262,规格:0.15 g×7片/盒),每次150 mg,每天1次,连续治疗4~8个月,耐药后出现T790M突变的患者更改为奥希替尼(阿斯利康制药有限公司,国药准字J20180027,规格:80 mg×30 片/盒),每次 80~40 mg,每天 1 次;ALK/ROS-1突变患者选择克唑替尼(美国Pfizer Inc,注册证号H20130076,规格:0.25 g×60粒/盒),每次250 mg,每天2次;HER2表达患者选择阿法替尼(齐鲁制药有限公司,国药准字H20203459,规格:40 mg×7片/盒),每次40 mg,每天1次。
1.3.3 C组 实施肿瘤基础治疗+靶向药物治疗+化疗治疗。培美曲塞+铂类化疗治疗同B组,间隔3周为1 个周期,治疗4 个周期,最后一次化疗结束后2周口服TKI 药物进行维持治疗,靶向药物治疗同A组,连续治疗4~8个月。
1.4 药物肝损伤分级 ①1 级轻度肝损伤:血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)和/或碱性磷酸酶(alkaline phosphatase,ALP)出现可恢复性升高,总胆红素(total bilirubin,T-Bil)<2.5×ULN(2.5 mg/dl或42.75µmol/L),且国际标准化比值(international normalized ratio,INR)<1.5,多数患者可适应或有乏力、厌食、右上腹痛、黄疸、皮疹等症状。②2级中度肝损伤:血清ALT和/或ALP升高,T-Bil≥2.5×ULN,或T-Bil无升高,但INR≥1.5,患者临床症状加重。③3级重度肝损伤:血清ALT和/或ALP升高,T-Bil≥5×ULN(5 mg/dl 或 85.5 µmol/L),可能伴有INR≥1.5,患者临床症状更重,需要住院治疗。④4级急性肝衰竭:血清ALT 和/或ALP 水平升高,TBil≥10×ULN(10 mg/dl 或171 µmol/L),或每天升高1.0 mg/dl(17.1 µmol/L),INR≥2.0 或凝血酶原活动度(prothrombin activity,PTA)<40%,可同时出现腹水或肝性脑病;或与药物性肝损伤(drug-induced liver injury,DILI)相关的其他器官功能衰竭。
1.5 观察指标 ①比较3组相关肝损伤情况。②分别于治疗前(T0)及治疗后1个月(T1)、治疗后2个月(T2)、治疗后3个月(T3)和治疗后6个月(T4)采患者清晨空腹静脉血,并采用丙酮酸氧化酶法检测肝损伤传统指标,包括ALT、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、谷氨酰转肽酶(glutamyl transpeptidase,GT);采用酶联免疫法检测肝损伤新型指标,包括谷氨酸脱氢酶(glutamate dehydrogenase,GDH)、对氧磷酶-1(paraoxonase-1,PON-1),操作步骤按试剂盒说明进行;丙酮酸氧化酶法试剂盒购自上海茁彩生物科技有限公司,货号:ZCS0378,GLD 试剂盒购自上海酶联生物科技有限公司,货号:ML076495,PON-1 试剂盒购自上海钦诚生物科技有限公司,货号:QC14576。③分析早期标志物评估早期肝损伤的灵敏度和特异性。灵敏性=真阳性例数/(真阳性例数+假阴性例数)×100%;特异性=真阴性例数/(假阳性例数+真阴性例数)×100%。
1.6 统计学方法 采用SPSS 21.0统计学软件进行数据分析,计数资料以[n(%)]表示,采用χ2检验,计量资料以“”表示,采用t检验,多组比较采用F检验,以P<0.05为差异有统计学意义;早期标志物诊断药物性肝损伤采用ROC 曲线,AUC 值>0.5 时,AUC越接近于1,说明诊断效果越好;AUC=0.5时,说明无诊断价值;AUC<0.5 时不符合真实情况,在实际中极少出现。
2 结果
2.1 3 组相关肝损伤情况比较 C 组肝损伤1 级发生率(16.67%)低于A 组(33.33%)和B 组(50.00%),差异有统计学意义(P<0.05);C组肝损伤2级、3级发生率均稍高于A组、B组,但组间比较差异无统计学意义,见表1。

表1 3组相关肝损伤情况比较[n(%)]Table 1 Comparison of related liver injury among the three groups[n(%)]
2.2 3 组不同时间肝损伤早期标志物水平比较T0时,3 组ALT、AST、GT、GDH、PON-1 水平比较差异无统计学意义;T1~T4时,3 组 ALT、AST、GT、GDH 水平逐渐下降,且 T1~T3时,上述4 项指标均高于T0时,差异有统计学意义(P<0.05);T1~T4时,3组PON-1水平逐渐上升,但T1~T4时,PON-1水平均低于T0时,差异有统计学意义(P<0.05);T4时,A组、C 组ALT、AST、GDH 水平均高于T0时,GT 水平低于T0时,差异有统计学意义(P<0.05);T1~T4时,C组ALT、AST、GDH水平均高于A组、B组,且A组高于B组,C组PON-1水平低于于A组、B组,且A组低于B组,差异有统计学意义见(P<0.05),见表2。
表2 3组肝损伤早标志物水平比较()Table 2 Comparison of early markers of liver injury among the three groups()

表2 3组肝损伤早标志物水平比较()Table 2 Comparison of early markers of liver injury among the three groups()
注:ALT,丙氨酸氨基转移酶;AST,天冬氨酸氨基转移酶;GT,谷氨酰转肽酶;GDH,谷氨酸脱氢酶;PON-1,对氧磷酶-1;T0,治疗前;T1,治疗后1个月;T2,治疗后2个月;T3,治疗后3个月;T4,治疗后6个月。与本组T0时比较,aP<0.05
T4 ATL(U/L)组别A组T1 AST(U/L)GT(U/L)T3 T1T4T1T2例数30 T3 T2 T4T2T3 B组30 30 C组F值P值T0 25.45±4.36 24.30±2.23 26.25±3.46 2.41 0.10 151.07±13.32a 149.45±10.32a 178.56±14.89 47.63<0.001 11.65±3.38a 10.64±4.37 12.54±3.24a 1.98 0.14续表118.43±12.43a 116.33±9.41a 150.23±10.95a 89.47<0.001 50.98±8.32a 48.43±7.21a 68.32±8.43a 54.83<0.001 26.32±3.35a 24.87±4.23 27.43±8.67a 1.42 0.25 T0 24.61±3.46 23.28±2.65 25.38±2.76a 1.08 0.35 151.43±19.67a 132.06±18.34a 172.49±22.32a 30.13<0.001 138.34±19.05a 112.67±14.45a 153.95±20.39a 39.60<0.001 70.46±18.29a 50.35±12.54a 89.44±16.35a 45.30<0.001 26.38±4.30a 25.45±3.76 27.65±5.66a 1.70 0.19 T0 20.34±3.64 19.36±4.65 20.54±3.47 0.77 0.47 183.45±13.34a 171.57±11.37a 201.64±16.36a 35.91<0.001 163.65±13.34a 152.38±14.83a 173.54±12.46a 18.24<0.001 110.34±9.56a 98.35±10.54a 122.36±8.45a 47.36<0.001组别A组B组C组F值P值GDH(U/L)例数30 30 30 PON-1(U/ml)T0T1T2T3T4T0T1T2T3T4 151.45±10.56a 152.47±9.64a 150.58±10.47a 0.26 0.77 7.45±2.82 7.56±3.02 7.74±2.64 0.08 0.92 30.54±12.63a 27.36±10.56a 39.46±12.65a 8.22 0.001 19.87±9.46a 17.34±9.66a 29.64±10.62a 12.85<0.001 14.45±7.90a 10.68±6.34a 20.08±8.67a 11.33<0.001 9.37±4.78a 9.84±4.39 10.59±5.65a 0.46 0.63 176.34±17.55 178.53±17.45 175.45±17.57 0.25 0.78 130.55±12.34a 135.37±10.56a 98.54±18.71a 58.75<0.001 143.51±19.21a 150.43±13.45a 105.53±12.43a 74.66<0.001 156.76±11.48a 160.37±12.39a 143.56±15.54a 13.38<0.001
2.3 肝损伤早期标志物诊断药物性肝损伤的价值ALT 的诊断灵敏度为83.4%,特异度为50.1%;AST的诊断灵敏度为78.6%,特异度为65.0%;GT的诊断灵敏度为71.9%,特异度为74.0%;GLDH 的诊断灵敏度为62.0%,特异度为81.1%;PON-1 的诊断灵敏度为85.8%,特异度为54.1%;5 项指标联合检测的诊断灵敏度为93.0%,特异度为63.2%,5 项指标联合检测的诊断灵敏度均高于5项指标单独诊断的灵敏度(P<0.05),见表3、图2。
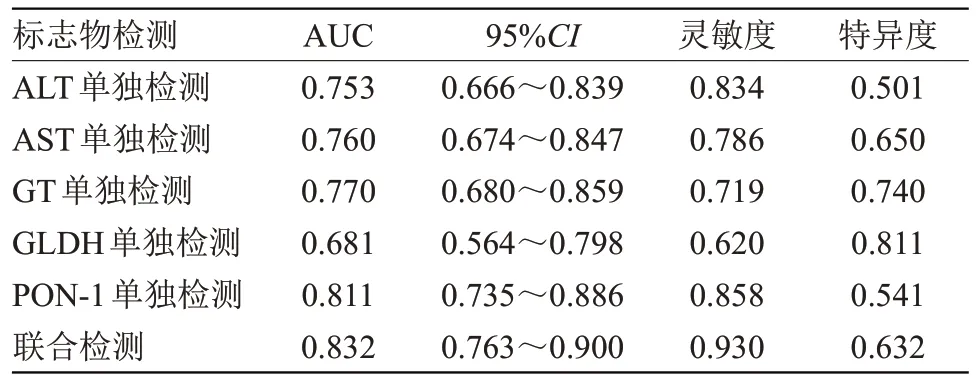
表3 早期标志物诊断药物性肝损伤的价值Table 3 Value of early markers in the diagnosis of drug-induced liver injury
3 讨论
药物性干损伤是临床癌症化疗和靶向治疗过程中一种常见的并发症,不仅影响患者肝功能,还会延长治疗时间,导致患者病情加重,严重威胁患者的生命安全[7-9]。目前临床上缺少特异性生物标志物,药物性肝损伤仅依靠排除法进行诊断,存在一定的诊疗误差,因此,寻找药物性肝损伤的早期生物标志物非常关键,也是目前临床研究的热点[10-11]。目前临床上,常用的肝损伤血清标志物包括ALT、AST、GT等传统标志物和GLDH、PON-1等新型标记物[12]。
本研究结果表明,C组肝损伤1级发生率(16.67%)低于A组(33.33%)和B组(50.00%),差异有统计学意意义(P<0.05),提示化学、靶向和靶向联合化学治疗都可能引发肝损伤,其靶向联合化疗治疗更易引发程度更重的肝损伤。此外,本研究结果表明,与T0比较,T1~T4时,3 组肝损伤早期标志物 ALT、AST、GT、GLDH 水平均上升,PON-1 水平均下降,T1~T4时,C 组 ALT、AST、GDH 水平均高于 A 组、B组,且A组高于B组,C组PON-1水平低于于A组、B组,且A组低于B组,差异有统计学意义(P<0.05)。说明ALT、AST、GT、GLDH、PON-1可反映靶向治疗相关肝损伤状况。本研究结果还显示,5 项指标联合检测的诊断灵敏度均高于5项指标单独诊断的灵敏度(P<0.05)。说明早期标志物对于靶向治疗致相关肝损伤的诊断价值较高。
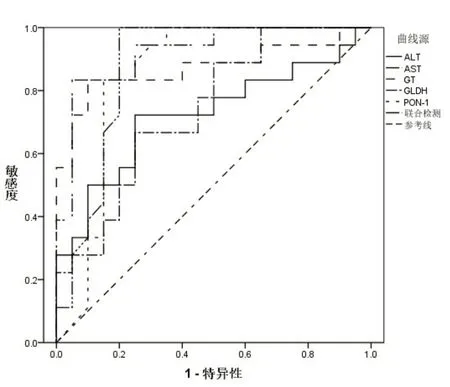
图1 早期标志物诊断药物性肝损伤的ROC曲线图Figure 1 ROC curve of early markers in the diagnosis of drug-induced liver injury
综上所述,非小细胞肺癌靶向治疗、化学治疗和靶向联合化学治疗均可能导致肝损伤,其中靶向联合化学治疗引发肝损伤的可能性更大,程度更重;ALT、AST、GT、GLDH、PON-1 可反映治疗相关肝损伤的情况,具有一定的诊断价值,可为NSCLC靶向治疗中早期防治肝损伤提供参考。
