地塞米松对脂多糖介导下人牙周膜干细胞骨向分化过程中的调控作用
2022-05-07何晓光
何晓光,赵 君,李 娜
(合肥市口腔医院 安徽医科大学合肥口腔临床学院 药剂科,安徽 合肥 230001)
牙周膜干细胞是牙周组织中的成体干细胞,具有多向分化的潜能,其骨向分化能力在牙槽骨的改建过程中起着重要的作用[1],研究[2]表明炎症状态下人牙周膜干细胞的骨向分化能力减弱,可能是通过NF-κB信号通路影响了其骨向能力的改变,从而解释了临床上牙周炎患者牙槽骨流失速度过快的原因。革兰阴性菌是牙周炎患者最常见的致病菌,其细胞壁的主要成分脂多糖(Lipopolysaccharide,LPS)是一种重要的炎症诱导因子,可以通过激活Toll样受体4的表达促发炎症因子的转录,形成炎性微环境[3-4]。
在一些炎症性疾病、自身免疫性反应和过敏性反应的临床给药中,地塞米松(Dexamethasone,Dex)作为糖皮质激素的代表之一被广泛使用[5-6]。研究[7-8]显示,Dex能够下调多条炎症相关通路的表达,包括NF-κB通路,从而发挥其抑制炎症反应、激活改善炎症环境等作用,而在牙周炎中Dex是否可以通过抑制NF-κB信号通路减缓牙周膜干细胞的炎性表达,从而达到促进成骨的目的是本研究拟探究的关键问题。
1 材料与方法
1.1 实验试剂及仪器 0.1%茜素红及Dex,美国Sigma公司;牛血清白蛋白、α-MEM培养液、LPS,美国Abcam公司;CO2恒温孵育箱,美国Thermo公司;超净工作台,中国苏州设备净化有限公司;体式显微镜及倒置相差显微镜及照相系统,日本OLYMPUS公司;酶联免疫检测仪,美国BIO-TEK公司;Real-time PCR仪,美国Applied Biosystems公司;细胞计数仪,中国Countstar公司。
1.2 取材 离体牙取材于合肥市口腔医院因正畸拔除的患者,年龄14~20岁。取材前征得患者及家属知情同意,要求患者无全身性疾病,牙周组织健康。
1.3 牙周膜干细胞的分离培养和纯化 本课题组借鉴牙周膜干细胞分离培养的方法[2-3]并加以改良,采取消化法(60 min)结合组织块贴壁法培养牙周膜细胞,细胞爬出后7~10 d传代。取对数生长期的第1代细胞进行纯化,将细胞进行低密度接种,出现细胞克隆集落后常规传代培养。
1.4 多向分化潜能鉴定 分别对低密度克隆化培养的牙周膜细胞进行成骨、成脂诱导,进行干细胞多向分化潜能的鉴定,培养21 d后分别用茜素红、油红O对其进行钙化结节与脂滴的染色。
1.5 实验分组 将第3代细胞随机分为4组,正常对照组为正常培养液培养的牙周膜细胞;Dex组为含Dex终浓度为1×10-8mol/L 培养液培养的牙周膜细胞、LPS组为10 μg/mL LPS刺激的牙周膜细胞,Dex+LPS组为同时含有1×10-8mol/L Dex和10μg/mL LPS培养液培养的牙周膜细胞。
1.6 Elisa检测炎症因子IL-6表达水平 分别于24 h后收集正常组、Dex组、LPS组及Dex+LPS组的培养液,Elisa试剂盒检测培养液中IL-6的表达水平,酶标仪450 nm波长读取光密度值,制作标准曲线,计算出各组IL-6的含量。
1.7 茜素红染色 将培养21 d的4组细胞弃上清液,PBS清洗2遍控干后4%多聚甲醛固定10 min。弃固定液PBS冲洗,加入1%茜素红染液染色,20 min后PBS洗净,倒置相差显微镜观察。
1.8 Real-time PCR检测各组细胞骨向分化诱导后RUNX-2、OPN、ALP表达 将各组细胞培养7 d后利用Trizol试剂盒mRNA,酶标仪测定mRNA纯度及浓度,按照逆转录试剂盒方法逆转录形成cDNA。qRT-PCR检测骨相关基因RUNX-2、OPN、ALP的相对表达量。引物由上海生工生物工程有限公司合成,引物序列见表1。
1.9 Western blot检测各组细胞核蛋白中p65的表达水平 收集4组细胞,吸取培养液控干培养瓶,用预冷的PBS清洗2遍并控干,利用核蛋白提取试剂盒提取细胞核蛋白,过程中注意冰上操作,电泳转膜后用5%脱脂牛奶室温封闭2 h,加入p65一抗,4℃环境下孵育过夜。洗膜后加入二抗(1∶5 000)孵育2 h,TBST洗涤4次,每次8 min,ECL化学发光试剂曝光显影。采用Image J软件分析条带灰度值,计算各目的蛋白与GAPDH灰度值的比值。

表1 引物序列
2 结果
2.1 人牙周膜干细胞培养与鉴定 常规培养液培养7 d左右观察到细胞从组织块周围爬出,多成长梭形(图1A),取对数生长期的第1代细胞低密度接种进行纯化,镜下可见克隆集落形成(图1B),消化克隆细胞进行常规传代培养,并对其进行干细胞多向分化潜能的鉴定,成脂、成骨诱导21 d后分别可见形成脂滴(图1C)和钙化结节(图1D)。

A.组织块周围有细胞爬出;B.低密度接种后克隆集落形成;C.成脂诱导21d后脂滴形成;D.成骨诱导21d后钙化结节形成。
2.2 Elisa检测各组细胞炎症因子IL-6表达水平 结果显示,LPS组IL-6表达水平高于正常对照组(P<0.05),提示LPS诱导炎症反应产生,Dex+LPS组IL-6表达水平较LPS组减轻(P<0.05),提示Dex起到了抗炎作用,见表2。

表2 各组细胞IL-6表达水平
2.3 茜素红染色观察各组细胞钙化结节形成情况 将各组细胞培养21 d后,茜素红染色观察钙化结节形成情况,正常对照组(图2A)、LPS组(图2C)未见明显钙化结节产生,Dex组钙化结节明显可见(图2B),Dex+LPS组钙化结节明显较LPS组多,较Dex组少(图2D),提示Dex可改善炎症状态下牙周膜干细胞骨向分化的能力。
2.4 Dex对LPS刺激下牙周膜干细胞骨基因ALP、RUNX-2、OPN mRNA表达的影响 结果显示,Dex组与Dex+LPS组骨相关基因ALP、RUNX-2、OPN mRNA表达量均较正常对照组上调(P<0.05);Dex+LPS组骨相关基因ALP、RUNX-2、OPN mRNA表达水平均较LPS组增加(P<0.05),见表3。

A.正常对照组;B.Dex组;C.LPS组;D.Dex+LPS组。

表3 各组细胞基因ALP、RUNX-2、OPN mRNA表达情况
2.5 NF-κB信号通路关键分子p65核蛋白表达水平 结果显示,LPS组p65核蛋白表达量升高(P<0.05),提示LPS刺激的炎症反应激活了NF-κB信号通路,而Dex+LPS组p65核蛋白表达量较LPS组降低(P<0.05),提示Dex可能抑制了NF-κB信号通路,见图3。
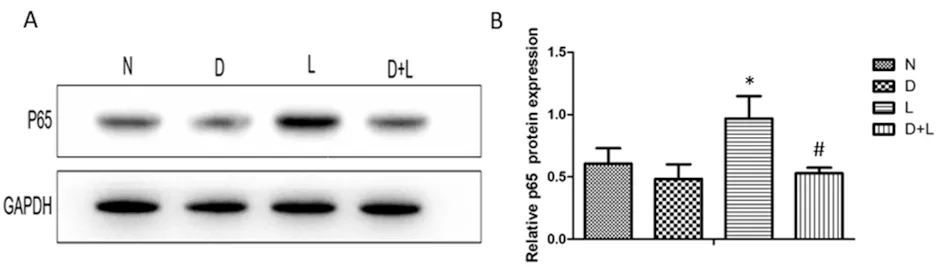
A.各组p65核蛋白表达;B.p65核蛋白与GAPDH灰度值的比值。*P<0.05 vs. 正常对照组(N);#P<0.05 vs. LPS组
3 讨论
牙周炎是一种炎症性、破坏性疾病,是由牙菌斑导致的牙周附着结构的破坏,是成人牙齿丧失的首要原因。我国是牙周病的高发国家,根据我国第四次全国口腔流行病学调查研究资料显示:中年人群的牙周炎患病率随着年龄的增长而逐渐升高,发展到老年人群的失牙率和无牙颌率居高不下[9]。牙周炎致病菌细胞膜外的LPS可通过Toll样受体4介导炎症反应的发生,在本研究中,课题组选用LPS刺激人牙周膜干细胞,并检测了炎症因子IL-6的表达,模拟了牙周炎的炎性微环境,并在此基础之上探讨了Dex的抗炎作用以及对人牙周膜干细胞成骨的影响,研究结果显示,LPS刺激后加入Dex能明显降低炎症因子的表达,并可上调成骨相关基因ALP、RUNX-2、OPN mRNA表达水平,提示Dex在一定程度上恢复了炎症状态下牙周膜干细胞的功能,从而达到减缓牙槽骨的丧失改善牙周健康的目的。
Dex是临床上使用最广的一种糖皮质激素,具有抗病毒、抑制炎症及免疫应答、抗休克作用。糖皮质激素在口腔临床治疗中可以辅助用于口腔黏膜疾病、牙周牙髓联合病变、下颌埋伏阻生智齿拔除术以及牙拔除术后的抗感染、防止干槽症等方面,研究表明Dex可以减轻炎症介导的对血管内皮细胞的抑制作用[10],亦可抑制人肺上皮细胞炎症反应[11]。本研究中,课题组研究了牙周膜干细胞在不同刺激因素下NF-κB信号通路中关键分子p65核蛋白表达水平,结果发现LPS刺激下人牙周膜干细胞p65核蛋白表达水平明显增高,提示NF-κB信号通路被激活,而加入Dex后p65核蛋白表达水平降低,NF-κB信号通路被抑制,成骨相关基因表达上升,提示Dex可能通过抑制炎症信号通路NF-κB从而促进人牙周膜干细胞的成骨分化,但本研究尚未对p65上游分子进行研究,亦没有建立牙周炎动物模型验证Dex的治疗效果,这也为后续的研究提供了思路。
