CT/MRI图像融合技术在颅内肿瘤放疗靶区勾画中的应用
2022-05-07王银华马金珠吴章杰施秀华
王银华,马金珠,吴章杰,施秀华,胡 俊,刘 飞,叶 斌
(1.芜湖市第二人民医院 肿瘤放疗科,安徽 芜湖 241000;2.皖南医学院 药学院,安徽 芜湖 241002)
随着放疗技术的日新月异,精准放疗在颅内肿瘤治疗中的参与度越来越高。而精准放疗最关键的步骤就是确定靶区位置和大小,目前颅内病灶放疗定位CT在部分病例中无法清晰显示病灶范围及其边缘,而磁共振成像(magnetic resonance imaging,MRI)由于成像的原理优势,对颅内病灶可清晰显示。CT/MRI图像融合(medical image fusion,MIF)技术可兼具头颅CT及MRI图像优势,有助于颅内肿瘤的靶区勾画[1-2]。本研究通过对比分析CT/MRI图像融合前后靶区体积以及危及器官剂量,探讨CT/MRI图像融合技术对颅内肿瘤的放疗靶区位置和体积准确性,及正常组织剂量有无影响,进一步探讨图像融合对颅内肿瘤放疗的临床价值。
1 资料与方法
1.1 一般资料 收集2014年5月~2020年3月芜湖市第二人民医院经CT模拟定位并行MRI检查的颅内肿瘤患者共20例,其中肺癌脑转移15例,肠癌脑转移1例,喉癌脑转移1例,脑胶质瘤3例,均诊断明确,所有患者既往均未接受过脑部放疗。年龄46~79岁,中位年龄65.5岁,均无放疗禁忌证。
1.2 方法 全部患者行CT模拟定位,选择合适的头枕,以热塑面膜固定。激光定位灯定好位置后在双耳屏前、额头正中线粘贴好金属标记,为CT定位的参考点。然后行全颅扫描,层厚3 mm,完成扫描后确认病灶是否扫全、定位标记是否存在等,确认无误后将图像传输至Eclipse TPS。
所有患者行MRI全颅脑平扫+增强扫描,Simens 1.5T或3.0T超导磁共振成像,采用标准头部正交线圈,MRI扫描范围与层厚同模拟CT,T1WI(TE/TR=11/500 ms)、T2WI(TE/TR=95/4 000 ms)采用专用造影剂钆双胺增强,扫描T1加权、T2加权及T1增强抑脂图像备用。
图像融合。MRI图像导入至放疗治疗计划系统,利用系统具有的图像融合功能,由主诊医师、物理师共同在计划系统(treatment planning system,TPS)中行CT与MRI的图像融合:先自动匹配进行粗融合,然后进一步以脑沟、脑池、脑干、眼球、视神经视交叉等作为内参考点微调反复手动匹配,要求外轮廓、重要解剖结构和骨性标志等基本一致。然后由主诊医师和物理师共同评估融合效果是否满意。
勾画靶区:由1名放疗科专业医师及1名影像科诊断医师一起读片,共同确定结果后于CT定位图像上完成靶区勾画,需要完成大体肿瘤靶区(gross target volume,GTV)、临床靶区(clinical target volume,CTV)、危及器官(organ at risk,OAR)(脊髓、脑干、左右眼球、左右晶状体、左右视神经、脑干)的勾画。其中GTV是指影像学可见的肿瘤体积。最后两名医生一起在融合图像上完成以上靶区的勾画。脑转移瘤处方剂量为全颅剂量40 Gy,每次2 Gy,共20次,肿瘤剂量50 Gy,每次2.5 Gy,共20次,同步推量;Ⅲ~Ⅳ级脑胶质瘤肿瘤/瘤床(GTVp/GTVtb)64.2 Gy,每次2.14 Gy,共30次,GTVp/GTVtb+5 mm 60 Gy,每次2 Gy,共30次,GTVp/GTVtb+20 mm 54 Gy,每次1.8 Gy,共30次。
1.3 观察指标 对CT和CT/MRI融合后勾画的GTV CT、GTV CT/MRI、OAR的受照射剂量进行对比。
2 结果
2.1 图像融合前后的肿瘤靶区体积GTV CT与GTV CT/MRI的比较 GTV CT/MRI勾画体积小于GTV CT,差异有统计学意义(P<0.001),详见表1。

表1 图像融合前后GTV CT与GTV CT/MRI的比较
2.2 图像融合前后颅内OAR受照射剂量的比较 CT与CT/MRI图像融合制定治疗计划后的OAR受照射剂量差异均无统计学意义(P>0.05),见表2。
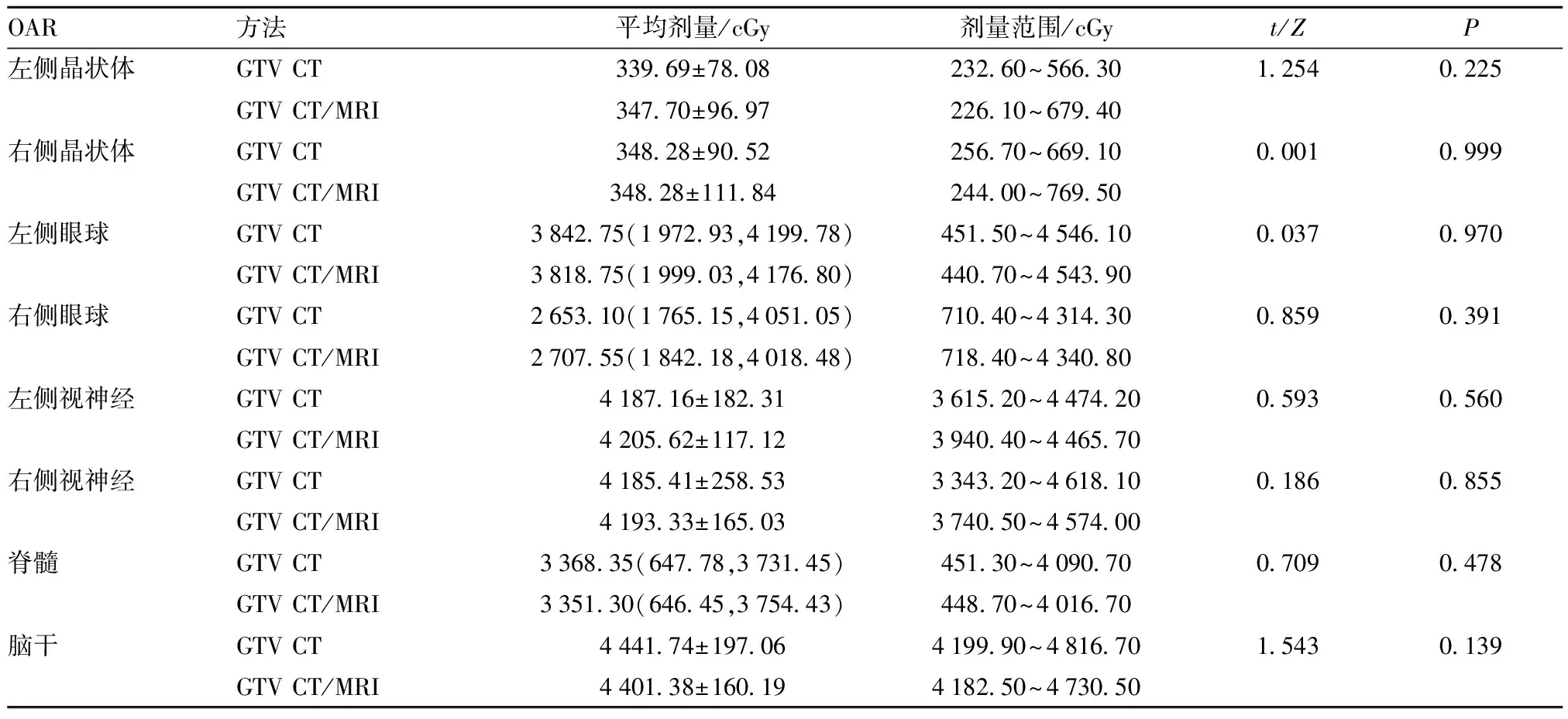
表2 图像融合前后颅内OAR受照射剂量的比较
2.3 图像融合前后的肿瘤靶区图像比较 本研究患者CT/MRI图像融合后的靶区在肿瘤周边水肿带、边界上更为清晰。CT/MRI融合将CT和MRI图像的优势结合,提高了靶区勾画精确性,见图1。
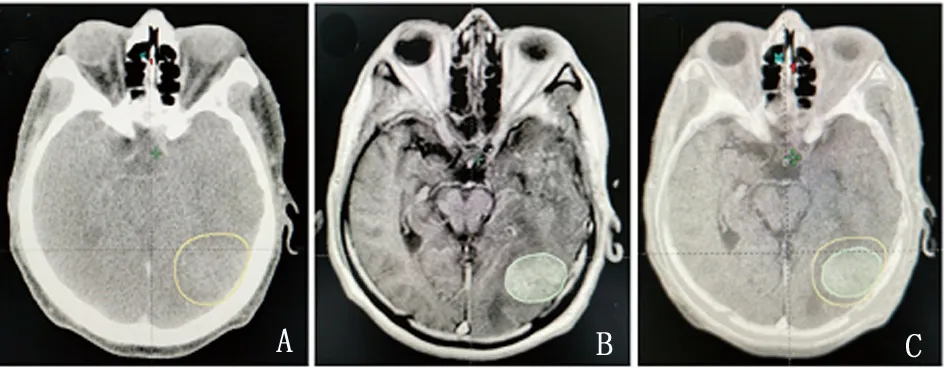
A.CT模拟定位的肿瘤靶区;B.CT/MRI融合后的肿瘤靶区;C:CT/MRI勾画GTV,边界更清楚。
3 讨论
颅内原发性恶性肿瘤以脑胶质瘤为主,手术治疗为主,不能手术者明确病理后可行放疗为主的综合治疗;继发性肿瘤由身体其他部位如肺、乳腺、子宫等转移至脑部。症状明显的脑转移患者可考虑外科手术切除、立体定向放疗或全颅放疗[3],保证放疗精准度最关键的是能否精准实施靶区勾画,而清晰的肿瘤图像信息是精准靶区勾画的保障。因此,颅内肿瘤精准放射治疗计划高度依赖影像图片提供的信息[4],肿瘤靶区位置确定和精准勾画靶区依据的影像图片的选择和处理是临床研究的重点。
目前的精准放疗模拟定位主要应用模拟CT进行图像采集,图像准确可靠且可三维重建便于设计三维放疗计划。此外,CT值与组织密度值呈线性对应关系,可直接用CT值大小进行放疗计划的计算,尤其是多排螺旋CT,图像质量优于单排模拟机CT[5]。对于颅内肿瘤,CT图片在肿瘤的钙化、瘤内出血、骨化或骨质改变等鉴别诊断方面有优势。但CT对软组织结构区分能力差,肿瘤边界较模糊,不利于靶区勾画。增强CT扫描有所改善,但仍有部分病灶显示不清或不显示,且部分患者对碘剂过敏,无法行增强造影。因此模拟CT图像的局限性成为精确靶区勾画的难题。
MRI在神经系统肿瘤靶区的确定上有更大优势[6];对肿瘤的内部性质、空间分辨率以及与周围结构关系的判定较CT准确。相关研究显示[7-9],MRI的图像质量显著优于CT,可更早、更清晰地显示肿瘤与周围组织结构的解剖关系,从而更清楚显示肿瘤侵犯范围,更好地区分肿瘤活性组织和水肿组织,弥补了模拟CT图像的不足。但当肿瘤出现钙化、瘤内出血、骨化或骨质改变时,MRI不如CT图像显示直观。CT/MRI图像融合技术克服了CT和MRI的图像缺点,实现了优势互补[10]。因其结合了CT和MRI图像的优势在神经系统靶区勾画中逐渐得到重视,胡杰等[11]研究表明CT与MRI融合技术在肿瘤放疗中能准确勾画靶区和OAR,可靠性好。另有研究显示CT/MRI图像融合勾画肿瘤靶区GTV更准确[12],由于MRI图像清晰,肿瘤和周边结构界限清楚,可使不同医生勾画的差异性减小,有利于保证靶区勾画的同质化。基于CT/MRI图像融合勾画肿瘤靶区GTV均小于基于CT图像上勾画的体积。本组研究也得出相似结论,GTV CT和GTV CT/MRI体积分别为17.10(9.60,31.13)cm3和7.85(4.38,16.85)cm3,两组差异有统计学意义(P<0.001),图像融合后勾画的靶区小于基于模拟CT勾画的颅内肿瘤体积,降低了瘤周组织不必要的射线照射。GTV CT和GTV CT/MRI体积的差异,分析原因可能为部分CT模拟图像由于边界不清晰,靶区勾画医生为了避免靶区遗漏,从而主观上将靶区范围外扩所致[13]。
此外,颅内肿瘤放疗时OAR比较易于勾画,有文献报道融合前后OAR体积比较差异不明显[14]。本研究结果显示各组计划制定后OAR放疗受照射剂量差异无统计学意义(P>0.05),分析原因可能为所选病例转移瘤占比较高,而转移瘤绝大多数瘤体体积较小,逆向调强计划制定时可设置相同OAR限量,有足够余地保证OAR达到临床剂量限制要求。如果颅内肿瘤靶区普遍较大,可能会有不一样的结果,值得临床进一步研究。
随着技术的进步,出现了磁共振放疗定位系统,可以使用MRI扫描定位。另外,由于18F-FDG PET在Ⅲ、Ⅳ级脑胶质瘤及脑转移瘤中均表现为高代谢病灶,显影清晰。PET/CT图像融合技术在临床也有较多的应用,但其价格较贵,一定程度上限制了该技术的广泛应用。
综上所述,颅内肿瘤患者精准放疗借助CT/MRI图像融合技术,可提高放疗靶区勾画的精准性,进一步实现精准放疗。该技术可操作性强,值得临床上进一步研究及推广应用。
