转运基因对大肠杆菌利用木糖产L-乳酸的影响
2022-05-07刘汝婷王金华
刘汝婷, 刘 枣, 王金华, 高 娃
(1 湖北工业大学生物工程与食品学院, 湖北 武汉 430068;2 发酵工程教育部重点试验室,湖北 武汉 430068; 3 工业发酵湖北省协同创新中心,湖北 武汉 430068)
乳酸中L-乳酸是广泛存在和使用的物质,大多运用于食品、化妆品、制药、纺织和化学领域[1-2]。目前,L-乳酸的应用已经扩展到可降解塑料工业。其中的聚乳酸(PLA)可作为生物降解和生物相容的高分子材料[3-4]。近年,人们环保意识不断提高,对绿色包装产品的需求量增大,驱动了聚乳酸(PLA)的大量生产[3]。木质纤维素在自然界广泛存在,其水解液含有大量五碳糖和六碳糖,主要有葡萄糖和木糖[5-7]。纤维素生物质是目前最丰富的非食物资源,是L-乳酸发酵的潜在底物原料,既可避免与民争粮的局面[8-9],还可解除发酵过程中葡萄糖对其他碳源利用抑制问题[10]。为进一步削弱葡萄糖效应对五碳糖的阻遏,通过基因工程技术对大肠杆菌进行遗传改造。除了与磷酸烯醇式丙酮酸-糖类磷酸转移酶系统(PTS)[11]密切相关,葡萄糖效应还与甲基半乳糖苷转运系统mglB、半乳糖转运系统galP等非PTS系统相关。江吉雄等[12]通过敲除mglB和galP基因,降低了混合糖发酵D-乳酸中的葡萄糖效应,使发酵周期缩短了约40%左右,转化率提高了2.30%;许琼丹等[13]通过敲除ptsG和mglB基因,也降低了混合糖发酵乙醇中的葡萄糖效应,使发酵周期缩短了约36%左右,转化率提高了5.80%。
基于此,本研究以WL210为出发菌株。该菌株可高效利用葡萄糖产L-乳酸,通过RED同源重组技术构建mglB基因缺陷菌株WL220,mglB/galP双基因缺陷菌株WL230,以减弱葡萄糖阻遏效应,提高混合糖中木糖的利用率,为采用基于木质纤维素等可再生原料高效生产L-乳酸提供理论基础。
1 材料与方法
1.1 材料
1.1.1菌株与质粒本文所用的菌株和质粒见表1。
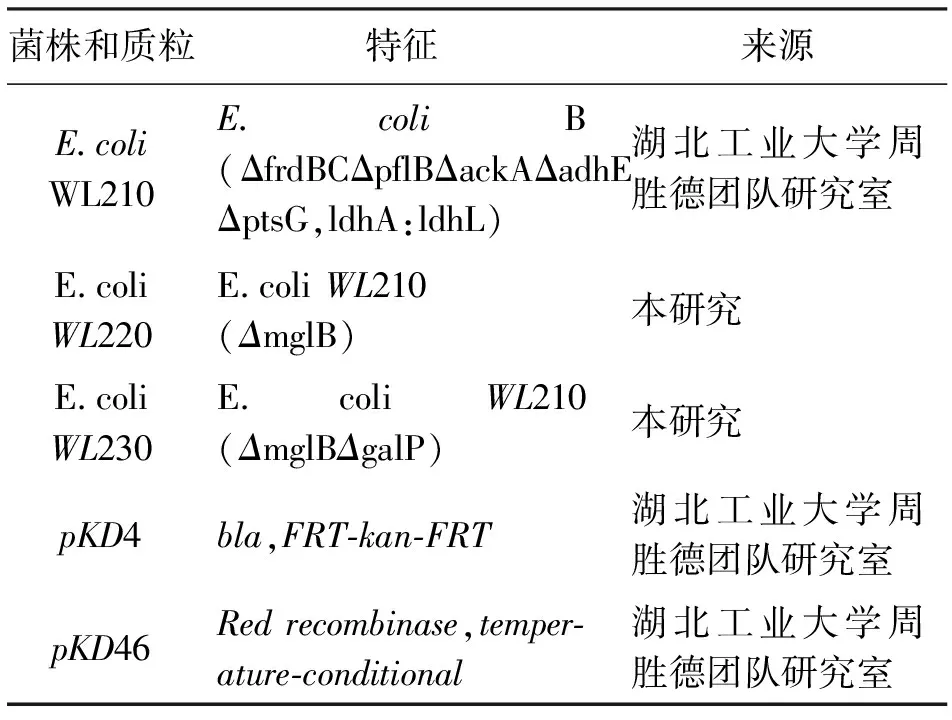
表1 本研究所用的菌株和质粒
1.1.2化学试剂与仪器CaCl2·2H2O、L-阿拉伯糖,国药集团化学试剂有限公司;DL5000DNAMarker,PCRMasterMix,美国Fermentas公司;10×TE溶液、氨苄青霉素、卡那霉素,浙江Mersco公司;PCR引物合成,上海生工生物工程技术服务有限公司。
MicroPluser电转仪(美国Bio-Red公司),MycyclerPCR仪(美国GC公司),Waterse2695型高效液相色谱仪(美国Waters公司),SartoriusBB-8846880发酵罐(德国SartoriusStedimBiotech公司)。
1.1.3培养基LB液体培养基:1%胰蛋白胨,0.5%酵母粉,0.5%NaCl。LB固体培养基:1%胰蛋白胨,0.5%酵母粉,0.5%NaCl,2%琼脂粉。选择培养基:LB固体培养基加抗生素(50μg/mL氨苄青霉素或卡那霉素)。种子培养基:LB液体培养基中加20g/L葡萄糖。
1.2 方法
1.2.1 mglB和galP基因的敲除PCR引物设计mglB和galP基因的敲除PCR引物设计如表2所示。

表2 敲除基因的引物与验证引物
根据mglB和galP序列设计敲除引物分别为ΔmglB-P1、ΔmglB-P2、ΔgalP -P1、ΔgalP -P2,如表2所示,该对引物5′端45bp片段与mglB和galP序列同源,以18-20bp(表2中下划线序列)与质粒pKD4上FRT-kan-FRT阅读框序列同源,以pKD4质粒为模板,用扩增引物ΔmglB-P1、ΔmglB-P2、ΔgalP -P1、ΔgalP -P2进行PCR扩增,获得带有kan抗性基因的敲除片段,经乙醇沉淀过夜后,切胶回收。使用CaCl2法[14]将pKD46转化至WL210的细胞中,通过氨苄平板筛选得到阳性菌落WL210/pKD46。挑选WL210/pKD46单菌落细胞接种于LB液体培养基中,30℃条件下培养至OD600为0.4~0.7;冰水浴35min后,用去离子水洗涤5次以上,弃去上清,得到感受态细胞WL210/pKD46悬浮液;取90μL的菌液和9μL打靶片段混匀后进行电转。将电击后的菌液转移到预热37℃LB液体培养基中,150r/min条件下复苏2h,涂布于选择性培养基,37℃过夜培养。挑取单菌落为模板,采用鉴定引物ΔmglB-P1、ΔmglB-P2进行PCR验证。将成功敲除mglB基因的WL210菌株命名为WL220。
敲除galP基因方法与敲除mglB基因方法相同。将成功敲除galP基因的WL220菌株命名为WL230。
1.2.3发酵实验挑选单菌落WL210、WL220、WL230接种于含有50mLLB液体培养基的锥形瓶中,150r/min,37℃过夜培养12h至OD为1.20左右。以10%的接种量接种至含有4L无菌培养基中,其碳源分别为6%葡萄糖、6%木糖、6%混合糖(3%葡萄糖和 3%木糖),发酵条件为37℃、200r/min,发酵时采用3mol·L-1的氢氧化钙作为中和剂,控制发酵液pH为6.80。定时定点取样,测定菌体浓度OD600,糖浓度及L-乳酸浓度。每次发酵实验进行3次平行实验。
1.2.4发酵产物检测分析菌体浓度测定采用可见光分光光度计测定波长600nm下OD600值。L-乳酸采用生物传感仪检测法[15];葡萄糖、木糖检测采用高效液相色谱分析,色谱柱为Bio-RadHPX87H,流动相为4mmol·L-1H2SO4,流速0.5mL/min,柱温40℃, 检测器为PDA、ELS检测器[16]。
2 结果与分析
2.1 重组菌E.coli WL230的构建
以出发菌WL210为对照,基因内部验证引物对菌株WL230进行PCR验证,其结果如图1所示。

1-E.coli WL210ΔmglB菌落PCR结果;2-E.coli WL210ΔgalP菌落PCR结果;3、4-菌株E.coli WL230菌落PCR结果图 1 E.coli WL210菌株敲除mglB 和galP基因的电泳图
WL210可扩增出半乳糖转运系统基因galP和甲基半乳糖苷转运系统基因mglB片段。基因片段长度分别为910bp和1475bp。图1中结果符合预期,表明重组菌E.coliWL230的mglB、galP片段敲除成功。
2.2 三菌株利用葡萄糖能力对比
为了探究三菌株利用单糖葡萄糖的能力,以6%葡萄糖为碳源,对比WL210,WL220(WL210ΔmglB)、WL230(WL210ΔmglBΔgalP)的菌体生长情况,结果如图2所示。菌株WL210、菌株WL220菌株WL230最大OD600分别为8.13、7.26、6.80。说明敲除基因后的菌株葡萄糖的消耗速率降低,菌体生长速率变慢。

图 2 三菌株单糖发酵(6%葡萄糖)的菌体生长情况
由图3可知,在利用葡萄糖方面,菌株WL210、菌株WL220、菌株WL230发酵结束时间分别为21h、24h、30h,平均耗糖速率分别为2.86g/(L·h)、2.50g/(L·h)、2.42g/(L·h)。
三菌株后期耗糖速率都变慢。与出发菌WL210相比,菌株WL220和菌株WL230利用葡萄糖的平均速率分别降低了12.50%、15.42%,发酵周期分别延长了14.28%、42.86%。在生产乳酸方面,菌株WL210、菌株WL220、菌株WL230最终乳酸产量分别为48.90g/L、47.10g/L、46.40g/L,生产强度分别为1.63g/(L·h)、1.57g/(L·h)、1.55g/(L·h)。对比出发菌WL210,菌株WL220、菌株WL230的生产强度分别降低了3.68%、5.11%。表明敲除ΔmglB、ΔgalP基因后,葡萄糖的消耗速率降低。

图 3 三菌株利用6%葡萄糖发酵产L-乳酸能力比较
结果表明,mglB、galP两个基因可以明显降低大肠杆菌利用葡萄糖的能力,并且三菌株中mglB/galP双基因缺陷菌株WL230生物量最大。
2.3 三菌株利用木糖能力对比
为了探究三菌株利用单糖木糖的能力,以6%木糖为碳源,对比WL210,WL220、WL230的菌体生长情况,结果如图4所示。菌株WL210发酵30h时,OD达到最大5.82后进入稳定期;WL220在42h时OD值达到最大6.01,WL230在48h时OD值达到最大6.59。虽然WL210最先进入稳定期,但其最大OD值是三菌株中最小,而WL220和WL230的最大OD值分别为WL210最大OD值的1.03倍、1.13倍。在30h之前,菌株WL210的生物量高于菌株WL220和菌株WL230;30h之后,菌株WL230的生物量都高于菌株WL210和菌株WL220。表明敲除基因后的菌株木糖消耗速率加快,菌体生长速率变快。
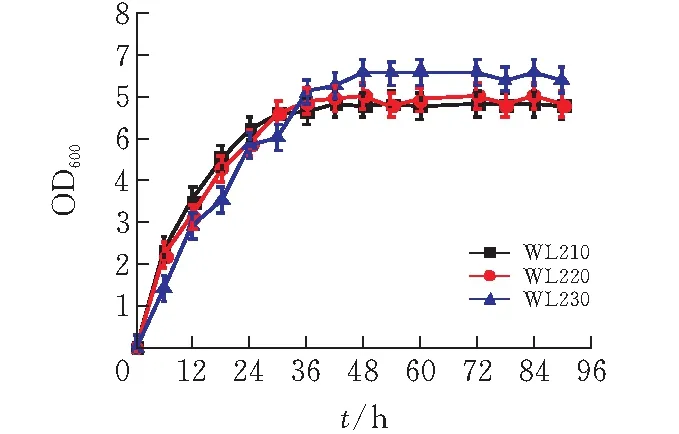
图 4 三菌株单糖发酵(6%木糖)的菌体生长情况
由图5可知,在利用木糖方面,菌株WL210、菌株WL220、菌株WL230发酵结束时间分别为90h、84h、78h,平均耗糖速率分别为0.67g/(L·h)、0.71g/(L·h)、0.76g/(L·h)。
对比出发菌WL210,菌株WL220和菌株WL230利用木糖的平均速率分别降低了7.14%、15.38%,发酵周期分别缩短了6.67%、15.38%。在生产乳酸方面,菌株WL210、菌株WL220、菌株WL230最终乳酸产量分别为43.12g/L、 45.98g/L、50.12g/L,生产强度分别为0.51g/(L·h)、0.59g/(L·h)、0.69g/(L·h)。对比出发菌WL210,菌株WL220、菌株WL230的生产强度分别提高了14.84%、35.60%。表明敲除ΔmglB、ΔgalP基因后,消耗木糖速率加快。

图 5 三菌株利用6%木糖发酵产L-乳酸能力比较
2.4 三菌株利用混合糖能力对比
为了探究三菌株混合糖中葡萄糖和木糖的利用速率,以6%混合糖(3%葡萄糖+3%木糖)为碳源,对比WL210,WL220、WL230的菌体生长情况,结果如图6所示。菌株WL210发酵36h时,OD达到最大7.1进入稳定期;WL220在48h时OD值达到最大7.58,WL230在54h时OD值达到最大8.38。虽然WL210最先进入稳定期,但其最大OD值是三菌株中最小,而WL220和WL230的最大OD值分别为WL210最大OD值的1.07倍、1.18倍。在12h之前菌株WL210的生物量高于菌株WL220和菌株WL230,而12h之后菌株WL230的生物量都高于菌株WL210和菌株WL220。结果表明,mglB/galP双基因缺陷菌株WL230所摄取的糖更多用于菌体生长,也具有更高的生物量[17]。
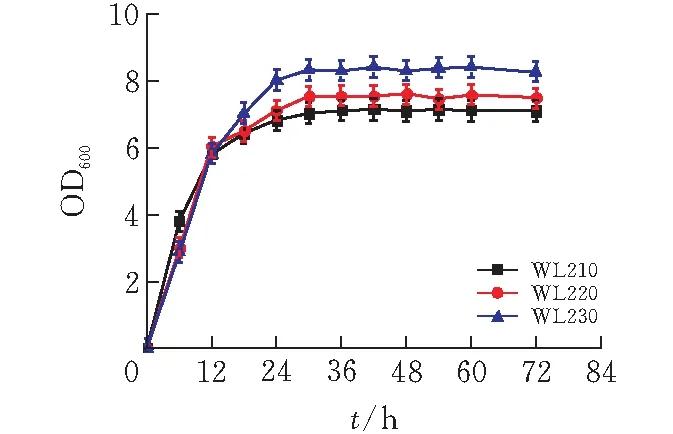
图 6 三菌株混合糖发酵(3%木糖和3%葡萄糖) 的菌体生长情况
由图7可知,菌株WL210优先利用葡萄糖,待发酵至18h时,开始利用木糖,至48h还剩余23.02g/L木糖未利用,而葡萄糖完全耗完;WL220同时利用葡萄糖和木糖,42h时葡萄糖利用完毕,发酵至48h时木糖剩余量为11.45g/L;菌株WL230可同时利用葡萄糖和木糖,发酵48h时木糖无残余,发酵至72h时葡萄糖消耗完毕。
图 7 三菌株混合糖发酵(3%葡萄糖+3%木糖) 的木糖和葡萄糖消耗曲线
菌株WL210、WL220、WL230消耗葡萄糖的速率分别为1.21g/(L·h)、0.78g/(L·h)、0.66g/(L·h),消耗木糖速率分别为0.15g/(L·h)、0.45g/(L·h)、0.62g/(L·h)。对比出发菌WL210,菌株WL220、菌株WL230,木糖的消耗速率分别提高了188.03%、298.92%。结果表明,mglB、galP两基因的缺失,可有效降低分解代谢阻遏效应,使葡萄糖消耗速率降低,而木糖消耗速率升高可能是两个基因对木糖消耗具有叠加效应[18]。
三菌株的L-乳酸产量如图8所示。在发酵30h之前,菌株WL210的乳酸产量高于菌株WL220、WL230,菌株WL210利用葡萄糖产L-乳酸的速率大于菌株WL220、WL230 产L-乳酸速率,分别为0.98g/(L·h)、0.88g/(L·h)、0.79g/(L·h);发酵30h后WL220、WL230的L-乳酸产量超过菌株WL210。发酵至36h,菌株WL210、菌株WL220、菌株WL230的乳酸产量分别为37.95g/L、43.02g/L、54.13g/L,生产强度分别为0.79g/(L·h) 、0.90g/(L·h)、 1.13g/(L·h),转化率分别为63.13%、71.88%、90.21%。对比出发菌WL210,菌株WL220、WL230生产强度分别提高了13.30%、42.63%,转化率分别提高了13.86%、42.90%。菌株WL230已消耗完所有碳源,而菌株WL210、WL220分别剩余22.01g/L、11.39g/L的木糖。结果表明,敲除mglB、galP后,WL220、WL230利用木糖产L-乳酸的能力远大于菌株WL210,由于mglB、galP这两个基因的缺失,葡萄糖消耗速率减弱[19]。

图 8 三菌株混合糖发酵(3%葡萄糖+3%木糖) 的乳酸产量
3 结论
本研究敲除甲基半乳糖苷转运系统基因mglB、半乳糖转运系统基因galP,构建mglB/galP双缺陷乳酸工程菌WL230。在混合糖(3%葡萄糖和3%木糖)发酵时,具有木糖利用效率高、发酵周期短、乳酸转化率高的特点。对比出发菌WL210,其木糖利用速率和乳酸生产强度分别提高了298.92%、42.63%,转化率高达90.21%,为采用基于木质纤维素等可再生原料高效利用木糖生产L-乳酸提供理论基础。
