细胞骨架调控大脑皮层神经元迁移机制的研究进展*
2022-05-05王舒婷熊欣欣刘媛媛
王舒婷, 熊欣欣, 刘媛媛,2,3△
广西医科大学 1基础医学院 2再生医学与医用生物资源开发应用省部共建协同创新中心 3长寿与老年相关疾病教育部重点实验室,南宁 530021
人类的大脑皮层是胚胎第4周时由神经管的前脑泡发育而成,具有复杂而重要的生理功能[1]。皮层的发育是一个持续且复杂的过程。其中,神经元有序迁移是形成正常皮层结构的基础。这一过程需要细胞内外多种结构和信号分子的参与。其中,细胞骨架是神经元迁移过程中重要的动力单位。细胞骨架功能异常会导致神经元形态结构的异常甚至神经元迁移出现障碍,进而导致自闭症、智力障碍及平脑症等多种严重的神经系统疾病[2-3]。那么,细胞骨架是如何调控神经元迁移的呢?相关分子机制的研究进展如何?了解这两个问题有助于我们更深入地理解神经系统发育的原理、了解相关研究现状并规划未来研究方向、开发探索针对相关疾病的诊治靶点与策略。因此,本文将以胚胎发育期神经元迁移为例,对细胞骨架、细胞骨架相关蛋白及其调控分子在神经元迁移过程中的作用进行阐述。
1 大脑皮层神经元迁移的主要方式
皮层发育过程非常复杂,神经元的正确迁移是皮层正常发育的必要条件。大脑皮层神经元的迁移模式主要分为两种,一种为放射状迁移(radial migration),是兴奋性锥体细胞的主要迁移模式;另一种为切向迁移(tangential migration),是以γ-氨基丁酸能(GABAergic)为主的抑制性中间神经元(interneuron)的主要迁移模式。不同的迁移模式有不同的迁移路径和方式。随着神经元的迁移,皮层由内向外形成了室管膜层(ventricular zone,VZ)、亚室管膜层(subventricular zone,SVZ)、中间带(intermediate zone,IZ)、底板(subplate,SP)、皮质板(cortical plate,CP)、边缘带(marginal zone,MZ)共6层结构。
神经元的放射状迁移是指神经祖细胞(neural progenitor cell,NPCs)自室管膜层(ventricular zone,VZ)沿着与大脑表面垂直的方向,点对点迁移到皮层相应位置的过程[4]。放射状迁移主要分为两种:放射状胶质细胞(radial glial cells)依赖的迁移以及非放射状胶质细胞依赖的迁移。后者又分为胞体转移(somal translocation)和多极性迁移(multipolar migration)两种类型。目前普遍认为在皮层发育早期,神经元主要以胞体转移的方式进行迁移。胞体转移的细胞不需要依赖放射状胶质细胞,其自身产生较长且有分支的前导突(leading process),持续性地与脑膜表面接触,介导整个胞体的移动。这个过程是连续的,胞体移动速度较快,且迁移结束后尾突起(trailing process)将变短或消失。随着皮层的增厚,放射状胶质细胞依赖的迁移逐渐变成放射状迁移的主要方式。在这种类型的迁移过程中,神经祖细胞先通过极化伸出较短的前导突与放射状胶质细胞的突起接触,同时在相反的方向伸出尾突起指向VZ,随后胞核向皮层顶部移动;然后在细胞骨架的作用下,前导突继续依附于放射状胶质细胞并向前移,胞核跟随向前移动,尾突起也不断延伸,直至迁移到目的位置。当细胞迁移到位后,前导突分化为顶树突,尾突起则作为轴突继续生长。在整个迁移过程中,前导突不产生分支,不与脑膜接触,且移动是间断性的[5-6]。而多极性迁移细胞则没有明显的双极突起,代之以多个较短的分支进行移动,这一形态主要存在神经祖细胞从VZ向IZ移动的过程中,同样不依赖放射状胶质细胞[7-8](图1)。

神经祖细胞定位于VZ,通过多极性转移迁移到IZ。确定迁移方向后,细胞通过放射状胶质细胞依赖的迁移方式移动到目的位置,或者通过胞体转移到达最终位置。图1 皮层神经元放射状迁移示意图Fig.1 Schematic diagram of radial migration of cortical neurons
与放射状迁移相比,切向迁移的细胞倾向于以大致平行于脑室表面的方向移动。发生切向迁移的细胞主要是中间神经元(interneuron,IN),起源于内侧神经节隆起(medial ganglionic eminence,MGE)或外侧神经节隆起(lateral ganglionic eminence,LGE),先通过切向迁移到MZ并做短暂逗留,然后通过放射状胶质细胞依赖的迁移方式沿着与锥体细胞迁移路径相垂直的方向迁移至CP[7]。
通过以上两种机制,来自神经祖细胞的兴奋性神经元首先于VZ产生,以多极神经元的形式迁移到IZ区,并在获得极性后通过放射状胶质细胞依赖的方式或者胞体转移的方式到达皮层;而抑制性神经元自MGE和LGE产生后,以切向迁移的方式迁移至皮层,与兴奋性神经元共同参与皮层神经环路的形成。
2 细胞骨架在神经元迁移中的作用及机制
细胞骨架是在细胞内起到形态支撑、物质运输、细胞迁移等多种作用的纤维状蛋白网络,是细胞维持正常生理功能的必需结构。已有多项研究表明,细胞骨架在神经元迁移中具有重要作用,神经元迁移涉及能量代谢、细胞器转移、胞体移动等多个过程——这些过程都离不开细胞骨架的支持。
2.1 微丝及相关蛋白在神经元迁移中的作用及机制
微丝作为细胞骨架的重要组成成分,主要由肌动蛋白单体聚合而成,在皮层神经元的迁移过程中起到维持细胞形态、提供收缩力等多重作用[9]。神经元迁移所需要的牵引力主要在前导突和尾突起两个突起中产生,微丝在这个过程中占据重要的地位[10]。在神经元的两种迁移方式中,细胞都以核转移的方式运动。这一过程主要包括两个步骤:前导突靠近胞体的部位扩张形成膨大(dilation/swelling),接着胞核和中心体等其他胞内结构移动至膨大,使膨大成为新的胞体[11]。研究发现,在降低C-Jun氨基末端激酶(C-Jun N-terminal kinases,JNK)信号通路中的支架蛋白POSH(plenty of SH3 domains)表达后,神经元的微丝组装受限,放射状迁移的神经元无法形成膨大,这提示微丝可能参与膨大的形成[12-13];另外,微丝的组装同样可以为小G蛋白超家族的亚家族成员Rho的效应蛋白mDia(mammalian diaphanous)所调控,而敲除mDia会阻断切向迁移神经元的中心体向膨大移动[14]。这些研究结果说明,微丝可能通过促进膨大形成和中心体的移动参与到神经元迁移过程中。而细胞内微丝会根据细胞的生理需求不断地解聚和重构,处于稳定的动态变化中。为了维持这种稳态,机体还需要多种肌动蛋白结合蛋白(actin binding proteins,ABP)参与其中,它们可以与微丝或肌动蛋白单体结合调控微丝组装与解聚。其中三种典型的肌动蛋白结合蛋白Arp2/3复合物(Arp2/3 complex)、肌动蛋白解聚因子(cofilin)、细丝蛋白A(ailamin A,FLNA)及其调控分子在调控神经元迁移方向中发挥重要的作用。
肌动蛋白单体组装成微丝的第一步是成核反应,即2~3个肌动蛋白单体组装成肌动蛋白寡聚体的过程,这一过程需要成核复合体Arp2/3复合物的参与[15]。Arp2/3复合物是一种肌动蛋白结合蛋白,主要有两大功能:一是与肌动蛋白单体结合,加快单体的成核速度;二是介导微丝的分支以促进微丝网络的形成。Wang等[16]通过胚胎电转技术发现降低神经祖细胞中Arp2/3亚基2(actin related protein 2/3 complex subunit 2,ARPC2)的表达后,皮层神经元迁移受到阻碍,证明了Arp2/3在神经元迁移中的地位。此外,Schaffer等[17]进一步研究发现,编码人类α-连环蛋白(α-N-catenin)的双等位基因CTNNA2缺失会导致Arp2/3复合物过度表达,造成皮层神经元迁移紊乱,这提示α-N-catenin可能通过调节Arp2/3的表达量,影响神经元迁移;另外,研究者们通过构建Wiskott-Aldrich综合征蛋白(Wiskott-Aldrich syndrome protein,WASP)家族成员N-WASP的4个结构域特异性删除的质粒,结合胚胎电转技术研究各个结构域对神经元迁移的影响,结果显示WASP通过VCA结构域改变Arp2/3复合体活性,调控微丝的组装,同时通过polyPro结构域接收上游信号分子的调控,协调控制神经元的迁移过程[18]。由此可见,多种信号分子可以通过Arp2/3复合体影响微丝的组装进而调控神经元迁移,证明了Arp2/3复合体在调控神经元迁移方向的研究价值。
与Arp2/3复合体相同,肌动蛋白解聚因子cofilin作为一种重要的微丝结合蛋白,同样在皮层神经元迁移过程中发挥着重要的作用。cofilin是一种肌动蛋白结合因子,它可以结合在微丝的负极端和肌动蛋白单体上,调控微丝的装配和解聚。既往研究表明,cofilin受酶联受体信号通路中的重要因子RacGTP酶激活蛋白1(Rac GTPase activating protein1,Rac1)调控。Rac1在大脑皮层中广泛表达,可以通过效应器p21激活激酶A(P21-activated kinase,PAK)发挥作用。PAK受Rac1激活磷酸化并激活LIM激酶,进而磷酸化cofilin并使其失活,从而导致肌动蛋白解聚和细胞骨架改组[19]。自闭症易感候选基因2(autism susceptibility candidate 2 gene,AUTS2)在神经元的胞质和核中都有表达,已被证实与自闭症、智力障碍等多种临床疾病相关。Hori等[20]采用胚胎电转实验发现,敲减AUTS2会造成神经元迁移能力受损,而过表达Rac1则能够缓解这一现象,说明AUTS2可能通过Rac1影响神经元迁移。同时,研究者们发现过表达AUTS2会促进轴突板状伪足的生成,而这一现象可以被降低Rac1表达所逆转。Hori等[21]推测AUTS2可能通过激活Rac1改变cofilin的活性,影响微丝的组装,进而影响了神经元的迁移。这一研究为自闭症的治疗提供了新的靶点和分子机制。
除Arp2/3和cofilin外,FLNA也在微丝的装配中具有不可替代的作用。FLNA作为肌动蛋白结合蛋白,其二聚体可以将微丝连结成松散的网络状结构,促进细胞形成片状伪足,为细胞的移动提供动力。研究发现多种分子通过FLNA调节神经元的迁移。例如,敲除LPA的神经元表现出明显的形态转换缺陷及FLNA表达下降,且过表达FLNA可以挽救前导突A缺失造成的神经元功能缺陷,提示前导突A通过调节FLNA影响神经元形态转变和迁移[22]。需要肌醇酶α(inositol-requiring transmembrane kinase/endoribonuclease 1α,IREα)是一种定位在内质网膜上的蛋白质,以往一直被认为在未折叠蛋白反应(unfolded protein response,UPR)中起信号传递的作用。Urra等[23]发现IREα可以募集FLNA从而促进神经元迁移和神经发育。另外,早在1998年就有研究证明脑室旁结节异位(periventricular nodular heterotopia)是由FLNA突变导致神经元迁移异常所致,但具体作用机制至今仍不明确[24]。近期,研究者们发现降低Hippo信号通路中的信号分子Mob2的表达会使FLNA磷酸化水平增高,活性降低,进一步导致神经元迁移受限并最终导致脑室旁结节异位[25]。这些发现为发育型脑疾病的治疗提供了新的靶点和研究方向,同时证明了FLNA在神经元迁移乃至皮层发育机制研究中的重要性和继续深入研究的必要性。
2.2 微管及其相关蛋白在神经元迁移中的作用及机制
微管是以γ微管蛋白为基底,由α微管蛋白和β微管蛋白两种单体聚合而成的管状结构,其主要功能是控制膜性细胞器定位和胞内物质运输。在神经元的迁移过程中,微管在促进前导突的延长和中心体的移动等过程中有重要影响[26]。放射状迁移神经元的膨大中含有大量的微管,提示中心体移动主要由微管调控。同时,研究者们认为微管可以通过在核周围形成包被使核延伸变形。这一过程可能通过微管在前方施加拉力以及微丝在后方提供的推力共同完成[11]。Aiken等[27]发现,编码α微管蛋白的基因TUBA1A在R402处的错义突变会造成微管与动力蛋白结合能力的减弱,使得神经元迁移出现异常,最终导致脑的形态结构异常。同样的,Breuss等[28]发现编码β微管蛋白亚基的基因TUBB5在人和小鼠的皮层中高表达,TUBB5 shRNA降低其表达会导致神经元迁移延迟且TUBB5基因突变导致小头畸形。与α、β微管蛋白不同,γ-微管蛋白位于微管组织中心,参与微管的成核反应。有研究发现,类中心体蛋白85 kD(centrosomal protein 85 like,CEP85L)可以与γ-微管蛋白相互作用,且神经元中心体周围微管在敲除CEP85L后排列混乱,乙酰化程度增加,同时神经元自身迁移能力出现缺陷。这些现象提示CEP85L通过调节γ-微管蛋白参与微管在中心体处的组装进而影响神经元的迁移[29]。不论是微管在神经元迁移过程中独特定位还是单体蛋白对神经元迁移的影响,都有力地证明了微管在神经元迁移中的地位。
微管作为细胞内的“高速公路”,其结构的维持和功能的实现需要多种蛋白协助完成。研究表明,微管相关蛋白及其调控因子通过调控微管的功能影响着神经元的迁移。下面将从微管结合蛋白双皮质素(doublecortin,DCX)和动力蛋白(dynein)两种蛋白出发,介绍微管相关蛋白及其调控因子调节皮层神经元迁移的研究进展。DCX是一种非常重要的微管结合蛋白,在神经元前体细胞中高表达。DCX突变会导致新皮质分层异常,从而出现智力障碍、难治性癫痫等症状。Yang等[30]在研究中发现DCX的启动子可以与由ADAM10剪切Notch产生的NICD结合,调节DCX在神经元内的表达水平,进而调控神经元的放射状迁移,提示ADAM10通过调节DCX表达水平调控神经元的迁移。动力蛋白dynein作为微管马达蛋白,利用水解ATP所产生的能量沿微管移动,与膜性细胞器或者大分子复合物结合,有助于对高尔基体和其他细胞器的定位以及细胞器和微管片断沿神经元轴突的运输。研究发现,动力蛋白中的LIC1亚单位可以同高尔基体结合蛋白bicaudal-D2(BICD2)进行连接。后者是一种在微管定向转运中起关键作用的动力蛋白激活衔接蛋白,它可以辅助动力蛋白将微管同细胞核等结构连接起来。且BICD2表达缺陷的小鼠会发生皮层神经元分层障碍,提示BICD2可能通过作用于动力蛋白参与皮层神经元的迁移和定位[31-32]。
2.3 中间纤维在神经元迁移中的作用及机制
中间纤维作为最稳定的细胞骨架成分,可以维持细胞形态,稳定微丝微管的装配,为细胞进行正常的生命活动所必需。然而,目前有关中间纤维调控皮层神经元迁移的研究仍然不多。有研究发现神经元前导突通过扭曲产生拉力带动细胞移动。中间纤维抑制剂calyculin A能够导致迁移神经元产生明显的前导突扭曲缺陷,提示中间纤维可能介导胞体转移过程中前导端的扭曲使胞体离开脑室带[33]。但尽管中间纤维在胞体转移过程中发挥重要作用,对其具体调控方式和分子机制领域的研究仍然较为欠缺。根据表达部位和结构特性,中间纤维可以分为6种类型,其中Ⅳ型神经丝蛋白在神经元中特异性表达。Yamasaki等[34]发现敲减应激激活的蛋白激酶/c-Jun氨基末端激酶信号通路(SAPK/JNK pathway)下游因子促分裂原活化蛋白酶7(mitogen-activated protein kinase 7,MKK7)会引起包括神经丝蛋白重链在内的多种蛋白表达降低,抑制小鼠皮层神经元的径向迁移,并且轴突向对侧皮层的投射也受影响。说明MKK7可能通过神经丝蛋白调控神经元迁移。与微丝微管不同,中间纤维没有极性,以网状、束状结构维持细胞的形态。中间纤维相关辅助蛋白在中间纤维结构和功能的维系中不可或缺,这暗示其在神经元迁移中的重要作用。然而有关中间纤维相关辅助蛋白在神经元迁移中的调控作用研究还不多见。
微丝作为细胞收缩的动力结构,在迁移神经元的前导突、尾突起和膨大中都有表达。同时,多种因素可以通过作用于Arp2/3、cofilin和FLNA影响神经元迁移。这些结果有地证明了微丝在神经元迁移中的作用。同样地,3种微管蛋白突变对神经元迁移造成的阻碍,DCX和dynein在神经元迁移中的作用,印证了微管在皮层神经元迁移乃至皮层发育中的重要地位。与微丝、微管不同,有关中间纤维在皮层神经元迁移中作用的研究较为稀缺。但即便如此,现有的研究结果也足以证明中间纤维在正常神经元迁移过程中的地位和深入研究的必要。
3 结语及展望
神经元迁移是中枢神经系统发育成熟的重要环节,了解神经元的迁移机制对神经系统创伤后修复、先天性遗传疾病的治疗等方面至关重要。细胞骨架以及细胞骨架结合蛋白的调控网络对于神经元的有序迁移起着非常重要的作用,也是一个庞大的放射状网络(图2)。我们针对皮层神经元迁移方式,详细论述了细胞骨架及其相关蛋白在其中的作用,介绍了相关调控机制研究的最新进展。虽然相关研究已经取得了许多重要突破,但细胞骨架在细胞迁移中的具体分工、在神经元形态转换中的作用方式以及在成年体内再生神经元迁移中的作用仍然不够明确,需要在未来的研究中进一步重点解决,这将有助于更好地防治细胞骨架缺陷受损造成的皮层发育不良等疾病,为人们有效地治疗神经系统发育性疾病做出科学贡献。
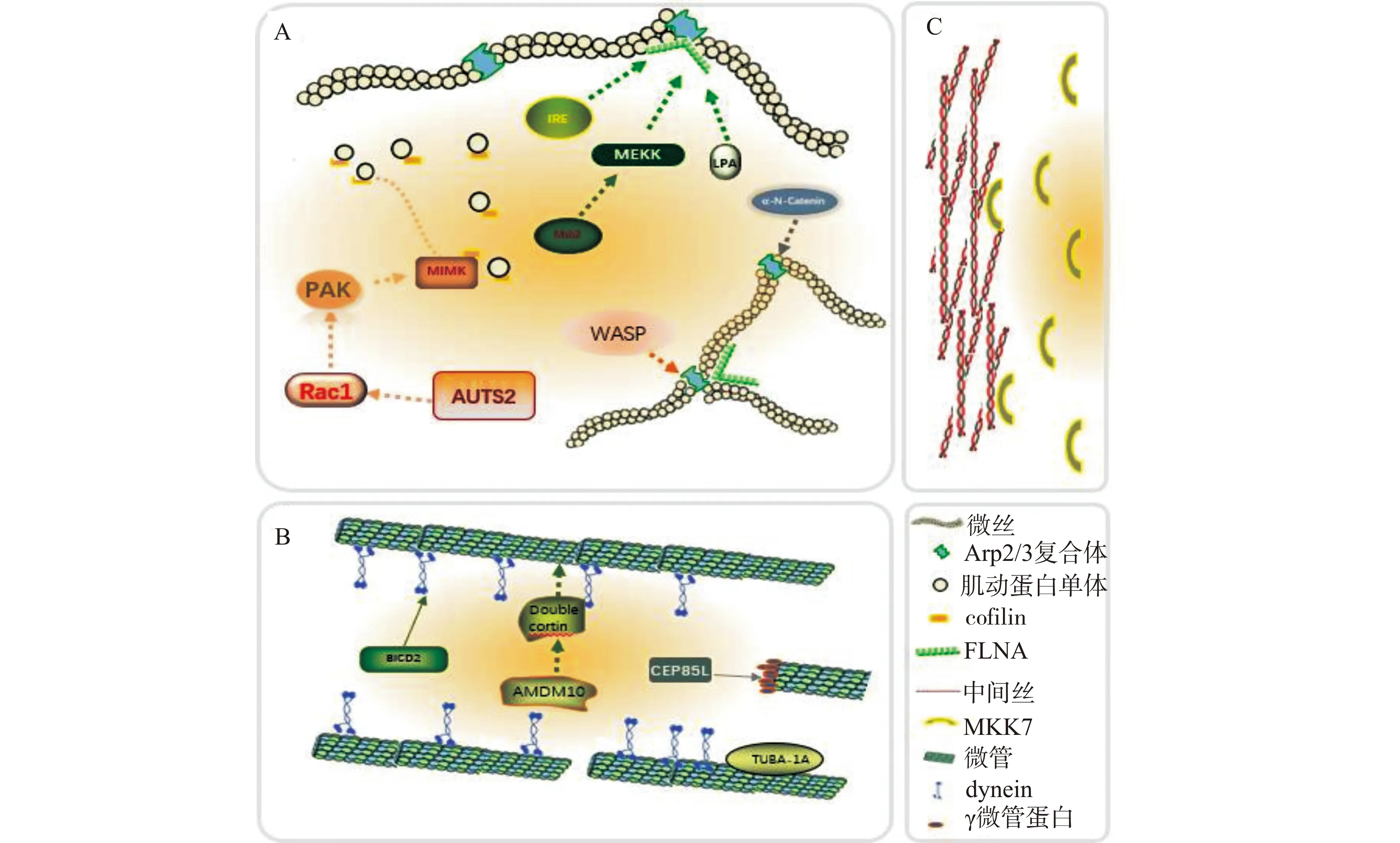
A:Arp2/3复合物、cofilin、FLNA及相关调控分子通过调节微丝的组装和肌动蛋白活性调控神经元迁移;B:双皮质素、动力蛋白及相关调控分子通过调节微管的组装和微管蛋白单体活性调控神经元迁移;C:MKK7通过调节中间纤维组装调控神经元迁移。图2 神经元迁移相关骨架蛋白分子调控机制示意图Fig.2 Schematic diagram of molecular regulation mechanism of cytoskeleton proteins related to neuronal migration
