磁化水对盐胁迫下黄瓜生长和生理特性的影响
2022-05-04蔡明蕾赵霖玉李秧秧
蔡明蕾, 赵霖玉, 李秧秧, 樊 军
(1.西北农林科技大学 林学院, 陕西 杨凌 712100;2.黄土高原土壤侵蚀与旱地农业国家重点实验室, 西北农林科技大学 水土保持研究所 陕西 杨凌 712100)
土壤次生盐渍化是限制目前设施蔬菜发展的主要障碍因子。次生盐渍化土壤一方面因过多的盐分积累降低土壤溶液的渗透势,导致植物根系吸水困难;另一方面,Na+和Cl-过量累积导致离子失衡和毒害干扰,最终影响植物生长发育,导致产量和品质降低[1]。因而寻找提高植物抗盐能力的措施或途径对减轻土壤次生盐渍化威胁具有重要的科学意义。
磁化水是指通过外加磁场,改变水的理化性质的方法[2-3]。作为一种安全高效、经济、环境友好的物理处理技术,在农林等各个领域表现出广泛的应用潜力。在一些作物上磁化水表现出提高抗盐性的能力,如水稻和菜豆上磁化NaCl溶液灌溉提高了盐胁迫下的发芽率和发芽指数[4-5],缩短了菜豆种子的萌发时间[5];向日葵和甜菜上磁化微咸水灌溉提高了盐胁迫下的株高、干重、产量,同时叶片叶绿素含量、养分(N、P、K等)含量也显著增加[6-7];棉花用磁化NaCl溶液灌溉显著提高盐胁迫下幼苗的干重,过氧化物酶(POD)和超氧化物歧化酶(SOD)活性及脯氨酸含量显著增加[8];小麦上磁化微咸水灌溉后籽粒产量增加19.2%,且植株含水量及N、Mg、Ca、Fe、Cu含量增加[9];杨树上磁化NaCl溶液灌溉增加了盐胁迫下地上部和根系生长,提高了叶光合速率,同时可通过离子选择性吸收来维持离子稳态[10-11]。从这些研究看,磁化水对盐胁迫下水分关系、光合活性、抗氧化酶活性、养分吸收能力等的增加是盐胁迫下磁化水增加植物抗盐性的重要机制,但不同植物其抗盐机制可能并不相同。
黄瓜(CucumissativusL.)作为主要的设施蔬菜之一,其对盐分敏感,特别是在苗期[12]。磁化水处理是否可提高黄瓜幼苗的抗盐能力尚不清楚。为此,本研究试图通过对盐胁迫下磁化水对黄瓜幼苗生长、水分关系、光合气体交换、抗氧化能力、养分含量等影响的研究,探究磁化水在提高黄瓜幼苗抗盐性方面的应用潜力和作用机制,为黄瓜上磁化水的合理应用奠定基础。
1 材料与方法
1.1 试验材料
试验在西北农林科技大学水土保持研究所人工气候室内进行。采用砂培试验,供试盆为外径11 cm,高30 cm的PVC管,底部装有可密封的堵头,侧壁底部留有通气孔。供试黄瓜品种为“津研4号”。黄瓜种子经浸种催芽,于2020年6月1日进行播种,每盆播4粒,待苗长到三叶期,每盆选择均匀一致的健康幼苗定苗至2株。人工气候室培养条件为:光周期12/12 h(昼/夜),温度25/18oC(昼/夜),光强600 μmol/(m2·s),相对湿度60%左右。生长过程中每日采用1/2 Hoagland营养液浇至田间持水量,直至黄瓜长到4~5片叶(2020年6月28日)时开始试验处理。
1.2 试验设计
采用二因素二水平试验设计,共4个处理:蒸馏水+0 mmol/L NaCl (DNa0)、磁化水+0 mmol/L NaCl (MNa0)、蒸馏水+100 mmol/L NaCl (DNa1)、磁化水+100 mmol/L NaCl (MNa1),磁化水是将15 L蒸馏水在3000 Gs磁场强度下循环20 min所得,每处理种植10盆。所有处理每日称重并浇至田间最大持水量,每隔1 d加入5 ml Hoagland营养液母液以补充所需养分,处理第10天及第20天进行植物生长和生理指标的测定和采样,其中叶光合气体交换参数为原位测定,其他参数均为破坏性测定,所有指标重复4次。
1.3 测定项目与方法
1.3.1 生长参数 黄瓜株高用直尺测定,叶面积利用扫描仪获取图像,image J软件分析。根系冲洗后用根系扫描仪(Epson Perfection V700,日本Epson公司)扫描,WinRHIZO根系分析软件(加拿大Regent仪器公司)获得根长和根表面积。新鲜地上部与冲洗后的根放入烘箱在105℃下杀青 0.5 h,70℃烘干至恒重,万分之一天平称其干重。叶面积、生物量及根系生长参数均以每盆(2株)计量。
1.3.2 叶水分状况 选择黄瓜植株顶部完全展开叶用PMS 600型压力室(美国PMS公司)测定上午10时的叶水势;采集渗透势分析的样品保存在超低温冰箱中直至测定,利用蒸汽压渗透计(Vapro 5520,美国Wescor公司)测定叶渗透势。
1.3.3 叶光合参数 叶绿素含量用80%丙酮浸提,分光光度法测定[13]。净光合速率(Pn)、气孔导度(gs)及蒸腾速率(E)均用Li-6800型光合仪(美国Li-COR公司)测定,测定时间为9:00—11:30,光强设定为1 200 μmol/(m2·s),CO2浓度控制在400 μmol/mol,温湿度为人工气候室温湿度值。瞬时水分利用效率为净光合速率(Pn)与蒸腾速率(E)的比值。
1.3.4 抗氧化能力 细胞膜透性用电导法测定[13],丙二醛含量(MDA)按照张志良的方法测定[13]。超氧化物歧化酶(SOD)活性利用氮蓝四唑(NBT)法测定,以抑制NBT光化还原50%为一个酶活性单位表示[13]。过氧化氢酶(CAT)活性用紫外分光光度法测定,以每分钟每毫克鲜重的吸光度变化值[ΔA240/(min·mg)FW)]来表示[14]。过氧化物酶(POD)活性用愈创木酚法测定,以每分钟每克鲜重的吸光度变化值[ΔA470/(min·gFW)]表示[14]。
1.3.5 养分及Na含量 样品粉碎过筛后,用H2SO4-H2O2法消煮,凯氏定氮法测定N含量,钼锑抗比色法测定P含量,火焰光度计法测定K与Na含量。
1.4 数据分析
采用双因素方差分析研究盐处理(S)、磁化处理(M)和及二者交互作用(S×M)对黄瓜生长和生理参数的影响。不同处理之间的差异采用单因素方差分析,若单因素方法分析达到显著(p<0.05)后,用Tukey法进行多重比较。所有测定值以平均值±标准误表示。统计分析用SPSS 25.0软件进行。
2 结果与分析
2.1 盐胁迫下磁化水对黄瓜幼苗生长的影响
处理10 d时,盐胁迫导致黄瓜株高、叶面积、根干重、生物量、根长及根表面积显著降低(p<0.05),磁化水处理显著增加黄瓜根长和根表面积(p<0.01),二者的交互作用仅对根表面积达到显著(p<0.05);非盐胁迫下,磁化水处理的根表面积显著增加33.5%,而盐胁迫下,磁化水处理的根长和根表面积显著增加32.3%和29.6%(表1)。处理20 d时,盐处理极显著地降低了黄瓜的所有生长参数(p<0.01),磁化水处理显著增加黄瓜的株高、叶面积、生物量、根长和根表面积(p<0.05),二者的交互作用对叶面积、生物量及根表面积达到显著(p<0.05);非盐胁迫下,黄瓜幼苗株高、根长及根表面积显著增加,增加幅度分别为9.8%,32.4%及52.6%,而在盐胁迫下,黄瓜幼苗株高、叶面积、生物量及根长、根表面积均显著增加,增加幅度分别为27.2%,91.2%,76.1%,80.8%和75.7%。表明磁化水改善盐胁迫下黄瓜生长的作用优于非盐胁迫下。

表1 不同处理黄瓜幼苗的生长状况
2.2 盐胁迫下磁化水对黄瓜幼苗叶水分状况的影响
处理10 d时,盐处理显著降低黄瓜幼苗的叶水势和渗透势,磁化水处理以及二者的交互作用显著影响黄瓜幼苗的叶渗透势(p<0.05);盐胁迫下磁化水处理显著降低了叶渗透势(图1)。处理20 d时,盐处理及磁化水处理显著影响黄瓜幼苗的叶水势及叶渗透势(p<0.05),且二者的交互作用显著影响叶渗透势(p<0.05);非盐胁迫下,磁化水处理的叶水势显著增加,但叶渗透势无显著变化,而盐胁迫下,叶水势显著增加22.6%,叶渗透势显著降低82.5%,表明盐胁迫下磁化水处理改善黄瓜幼苗叶水分状况优于非盐胁迫下,且主要通过叶渗透势降低来改善叶水分状况。
2.3 盐胁迫下磁化水对黄瓜幼苗叶光合作用的影响
处理10 d时,盐胁迫导致黄瓜叶片叶绿素含量及光合气体交换参数均显著降低(p<0.05),磁化水处理显著增加叶绿素含量、净光合速率(Pn)、蒸腾速率(E)以及瞬时水分利用效率(WUE)(p<0.05);非盐胁迫下,磁化水处理使黄瓜叶绿素含量和Pn分别显著增加22.1%和27.9%,而盐胁迫下,磁化水处理显著增加黄瓜的叶绿素含量、Pn、E、WUE,增加幅度分别为24.3%,471.9%,130.0%,102.9% (表2)。处理20 d时,盐胁迫极显著降低叶绿素含量和光合气体交换参数(p<0.01),磁化水处理显著增加黄瓜叶绿素含量和Pn(p<0.05);非盐胁迫下,磁化水处理使黄瓜叶绿素含量和Pn分别增加18.4%,36.3%,盐胁迫下黄瓜叶绿素含量、Pn和WUE分别显著增加69.8%,94.1%和212.1%。表明无论是在非盐胁迫和盐胁迫下,磁化水处理均可显著增加叶绿素含量,提高净光合速率,且这种作用在盐胁迫下更大;磁化水提高了盐胁迫下的WUE。
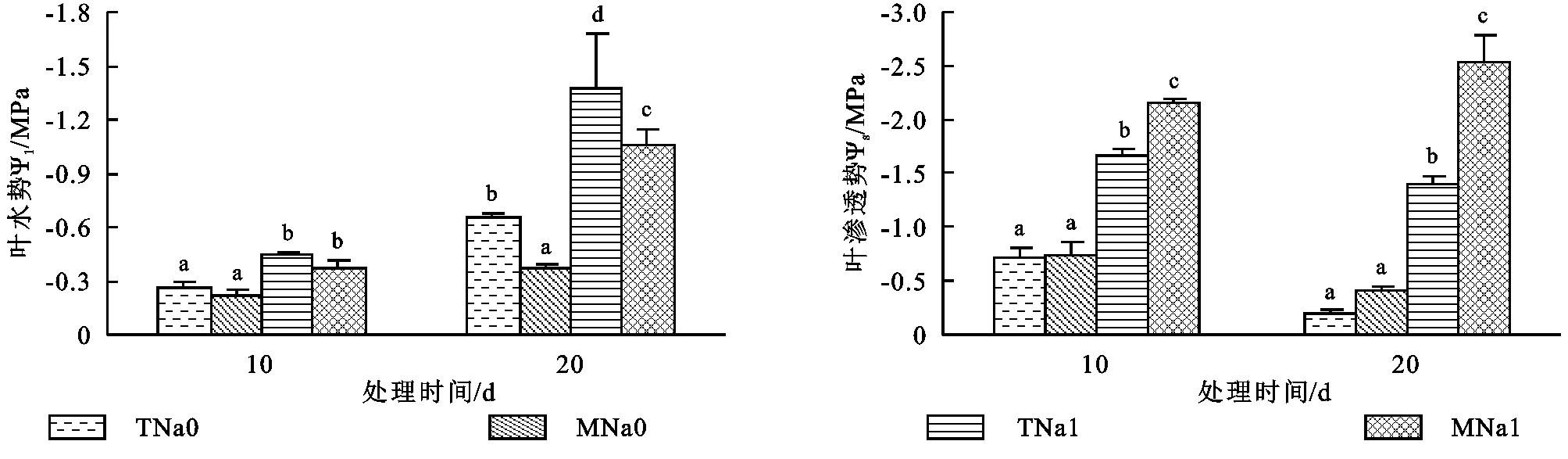
图1 不同处理黄瓜幼苗叶水分状况
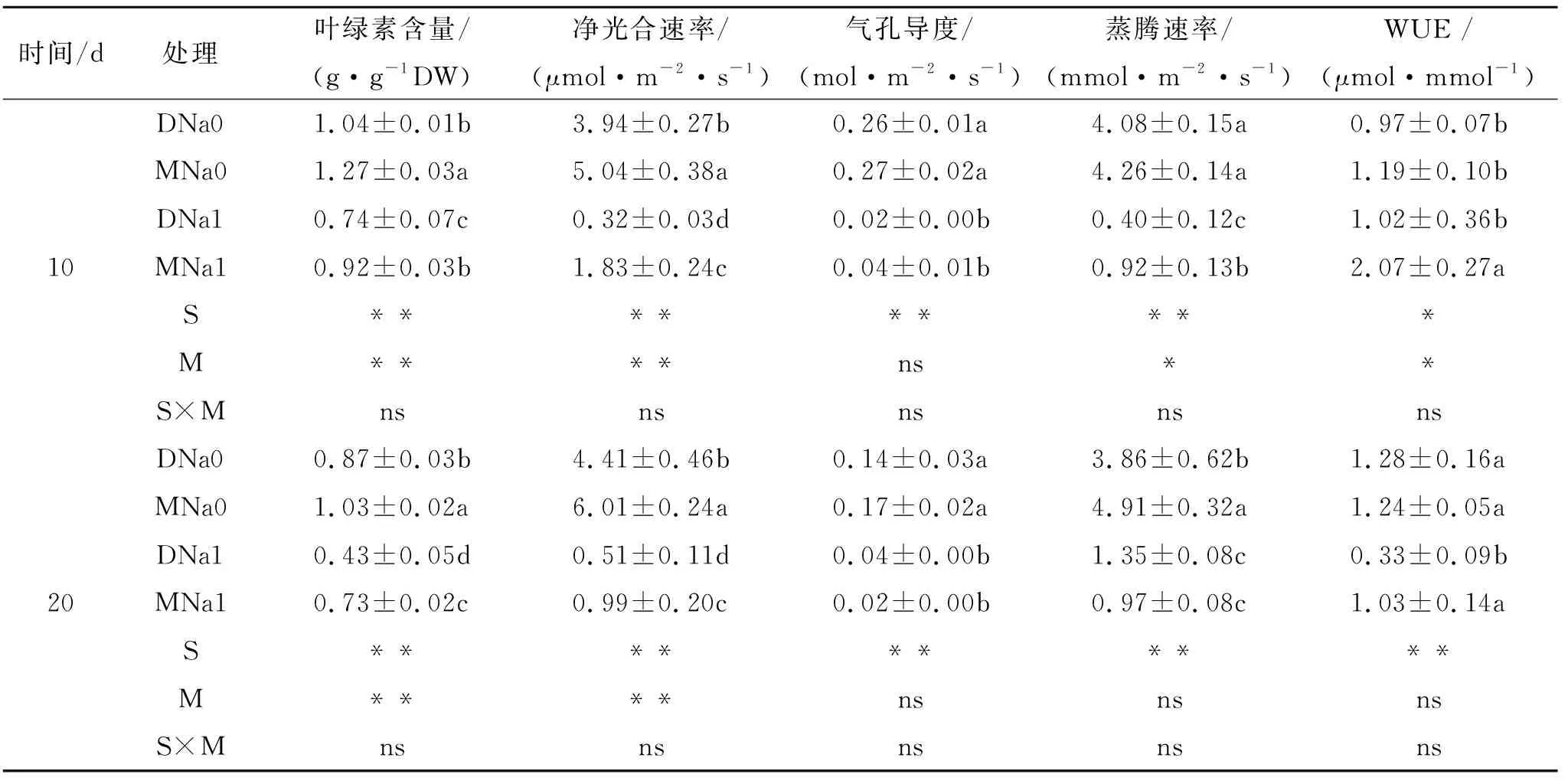
表2 不同处理黄瓜叶的光合参数
2.4 盐胁迫下磁化水对黄瓜幼苗叶抗氧化能力的影响
处理10 d时,盐胁迫显著增加了细胞膜透性、MDA含量和3种抗氧化保护酶(CAT、POD、SOD)活性(p<0.05),磁化水显著降低了细胞膜透性和MDA含量,增加了CAT、POD及SOD的活性(p<0.05),二者交互作用对细胞膜透性和MDA含量的影响达到显著(p<0.05);非盐胁迫下,磁化水使细胞膜透性显著降低10.0%,CAT和SOD活性显著增加21.8%和9.4%;盐胁迫下,磁化水处理使细胞膜透性和MDA含量显著降低22.5%和18.3%,CAT、POD、SOD分别显著增加17.7%,101.0%,11.8% (表3)。盐胁迫条件下,磁化水降低细胞膜透性及丙二醛含量,增加抗氧化酶活性的效果更甚。处理20 d时,盐胁迫显著增加细胞膜透性、MDA含量和CAT、POD活性,磁化水显著降低细胞膜透性和MDA含量,且3种保护酶活性显著增加,二者交互作用对CAT和POD活性的影响达到显著(p<0.05)。非盐胁迫下,磁化水使处理20 d时的细胞膜透性和MDA含量分别降低16.7%,18.7%,CAT活性显著增加17.6%;盐胁迫下,磁化水处理使细胞膜透性和MDA含量分别显著降低13.1%和21.0%,CAT和POD活性分别显著增加8.3%,49.1% (表3)。此时非盐胁迫和盐胁迫下磁化水保护细胞膜的作用相当,但作用机制不同。
2.5 盐胁迫下磁化水对黄瓜幼苗养分和Na离子吸收的影响
对叶片而言,处理10 d时,盐胁迫显著影响叶片中N、P、K、Na含量及K+/Na+(p<0.05),磁化水显著影响叶片中的N、P、Na的含量及K+/Na+(p<0.05),二者的交互作用显著影响叶片中Na含量及K+/Na+(p<0.05)(表4)。非盐胁迫条件下,磁化水处理10 d时叶片中仅P含量显著增加20.1%,而盐胁迫下,磁化水处理叶片中N、P含量分别显著增加30.2%,12.2%,Na含量显著降低21.1%,K+/Na+显著增加47.5% (图2)。处理20 d时,盐胁迫与磁化水均显著影响叶片中K、Na含量及K+/Na+且磁化水对N有着显著影响(p<0.05),二者的交互作用显著影响叶片中P、Na的含量(p<0.05)(表4)。非盐胁迫条件下,磁化水处理20 d时叶中N、P、K含量分别显著增加33.2%,28.6%和29.9%,而盐胁迫条件下,磁化水处理叶中N含量和K+/Na+显著增加13.1%和145.4%,Na含量显著降低46.3%。

表3 不同处理黄瓜幼苗叶细胞膜透性及抗氧化酶活性
对茎而言,处理10 d时,盐处理显著影响茎中N、P、K、Na的含量及K+/Na+(p<0.05),磁化水处理显著影响茎中K、Na含量和K+/Na+(p<0.05),二者的交互作用显著影响茎中N、K、Na的含量(p<0.05) (表4)。非盐胁迫下,磁化水处理10 d时茎中P、K、K+/Na+分别显著增加13.8%,20.5%和90.9%,而盐胁迫条件下,磁化水处理茎中的N、Na含量显著降低10.4%和14.1%(图2)。处理20 d时,盐处理显著影响茎的N、P、K、Na的含量及K+/Na+,磁化水显著影响茎的N、P、Na及K+/Na+,二者交互作用显著影响茎中P、Na的含量。非盐胁迫下,处理20 d时茎中N、P含量分别显著增加15.4%,13.8%,盐胁迫下,磁化水处理茎中N含量显著增加8.3%,Na含量显著降低13.6%,K+/Na+显著增加32.7%。
对根而言,处理10 d时,盐处理显著影响根中N、P、K、Na的含量及K+/Na+,磁化水显著影响根的Na含量以及K+/Na+。由表4可以看出,非盐胁迫下,磁化水处理10 d时根的K+/Na+显著增加223.7%,而盐胁迫下,磁化水处理根中的Na含量显著降低52.6%,K+/Na+显著增加308.0%。处理20 d时,盐处理显著影响根中的N、P、K、Na的含量及K+/Na+,磁化水处理显著影响根的N、P、Na及K+/Na+,二者交互作用对根中P、Na含量及K+/Na+影响也达到显著。非盐胁迫下,处理20 d时根中N含量增加7.4%,而盐胁迫下,磁化水处理根中P含量显著增加45.8%,Na含量显著降低35.5%,K+/Na+显著增加302.7%。表明磁化水改变黄瓜植株N,P,K的分布,降低了盐胁迫下黄瓜各组织的Na含量,增加K+/Na+,从而提高了黄瓜的抗盐胁迫能力。
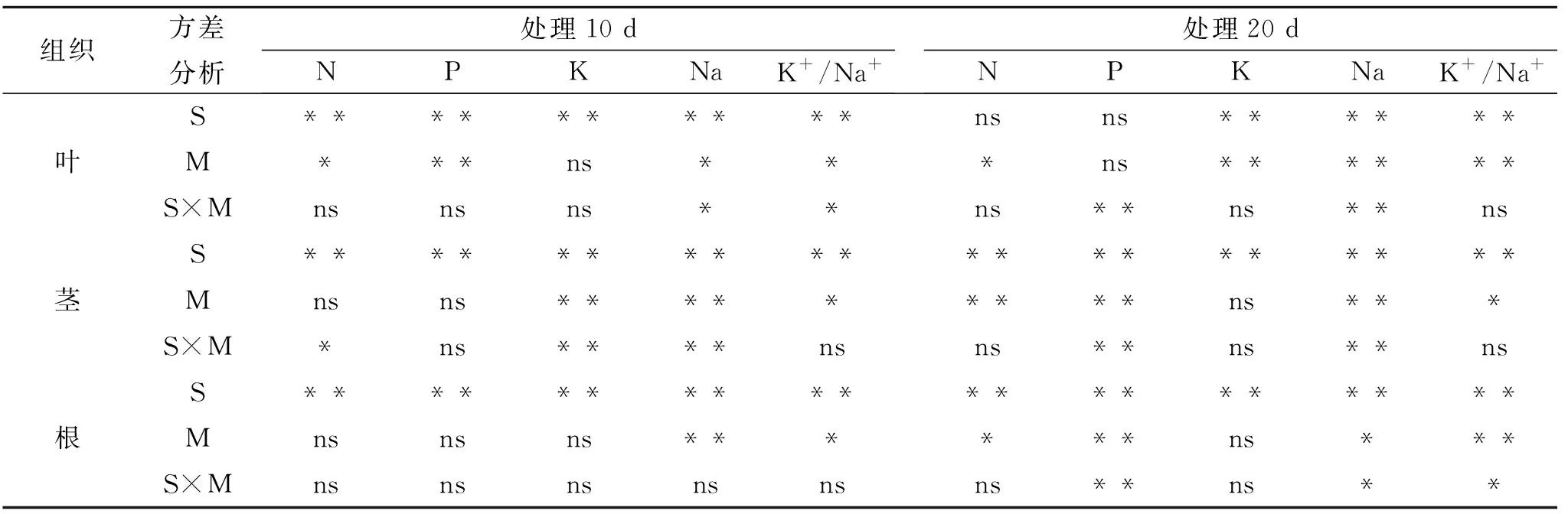
表4 不同处理黄瓜各组织中N,P,K,N含量及K+/Na+比的二因素方差分析

图2 不同处理黄瓜幼苗根、茎和叶中的N,P,K,Na含量及K+/Na+比
3 讨 论
3.1 黄瓜幼苗上应用磁化水的效应
研究表明:无论在非盐胁迫和盐胁迫下,磁化水均具有一定改善植物生长或生理活动的作用。非盐胁迫下,磁化水处理10 d时显著影响31个生长生理参数中的11个,磁化水处理20 d时显著影响31个生理参数中的15个,但并未显著影响总叶面积和生物量;在盐胁迫下,磁化水处理10 d时显著影响31个生长生理参数中的20个,但地上部生长无明显改善,磁化水处理20 d时显著影响31个生理参数中的23个,此时磁化水显著增加株高、叶面积和生物量(表5),这些结果表明盐胁迫下磁化水的应用效果大于非盐胁迫下,且在长时间盐胁迫和磁化水应用下,磁化水的效果更为明显。原因可能与磁化水应用频次和灌水量多造成的累积效应有关。

表5 不同盐处理条件下磁化水处理的效应
3.2 磁化水提高黄瓜幼苗抗盐性的生理机制
根是最早接收盐胁迫信号的组织[15]。盐胁迫对黄瓜根的生长有明显的抑制作用,表现为黄瓜根长、根表面积和根干重等显著降低。磁化水浇灌后盐胁迫处理根长及/或根表面积显著增加,与在向日葵[6]、甜菜[7]、杨树等[10]植物上研究结果一致。磁化水处理促进黄瓜根系生长可能主要与减少盐胁迫对根生物膜系统的伤害,及磁化水对细胞代谢和有丝分裂的诱导,从而促进细胞伸长的增强等[16]有关。磁化水处理20 d时盐胁迫处理叶渗透势显著降低,而叶水势显著增加,表明磁化水改善了盐胁迫下黄瓜幼苗的水分关系。前人研究亦表明磁化NaCl溶液提高了菜豆的根系吸水能力[5]和小麦植株的含水量[9]。磁化水对植物水分关系的改善可能与其对根系生长的改善,从而增加根系吸水能力有关。
盐胁迫导致黄瓜幼苗叶绿素含量,净光合速率、气孔导度、蒸腾速率等显著降低,表明过量的钠离子积累会破坏膜系统,限制叶绿体合成或加速其分解,导致气孔导度和光合速率下降。磁化水处理显著增加了盐胁迫下叶片光合色素含量与净光合速率,这与甜菜[7]、杨树[10]、菜豆[17]、豇豆等[18]的研究结果一致。其原因可能在于磁场对K+和GA3等有激活效应[19],导致细胞内叶绿体的数量增加,从而增加植物叶片的净光合速率。在杨树上报道磁化水降低了盐胁迫下的蒸腾速率[10],提高了水分利用效率,但我们本研究发现盐胁迫下磁化水引起黄瓜蒸腾速率的增加,说明水分利用效率增加的主要原因是光合速率的增加程度大于蒸腾速率的增加程度而非蒸腾速率的降低。
盐胁迫损伤程度取决于活性氧(ROS)的形成和抗氧化清除系统(抗氧化酶、非酶活性氧清除剂)清除ROS之间的平衡。NaCl处理导致黄瓜幼苗MDA含量和细胞膜透性增加,SOD、POD、CAT的活性增加,表明细胞膜脂质过氧化和抗氧化系统正在发生作用。盐胁迫下磁化水处理的MDA含量及细胞膜透性相对较低,这可能与其较高的ROS清除能力有关。盐胁迫下磁化水处理抗氧化酶活性的提高幅度高于非磁化水,与在棉花[8]上结果一致。前人研究也表明磁场处理对盐胁迫下烟草细胞SOD[20]活性有刺激作用。表明磁化水处理可以通过提高盐胁迫下抗氧化酶的活性,降低ROS的产生,减轻光合器官膜系统的损伤,提高光合能力。
盐胁迫下Na+的过量积累会影响K+的选择性吸收,导致植物离子失衡和高渗透胁迫[21]。抗盐植物可以通过调节细胞质中无机离子的数量和类型,维持较高的K+/Na+比值和细胞内离子稳态,从而维持细胞质微环境的稳定性[22-23]。本研究中,NaCl处理导致细胞内Na+浓度增加,K+浓度和K+/Na+比降低。磁化水处理降低了盐胁迫下叶、茎和根中的Na+的浓度,增加K+浓度及K+/Na+比,与向日葵[6]、杨树[11]上的结果类似。磁化水处理的胡杨[24]、大麦[25]和小麦[26]植株在整个植株水平上保持了较高的Na+流出量和较低的K+流出量,维持较高的K+/Na+。推测NaCl胁迫条件下,磁化水通过增加黄瓜Na+流出和减少K+的流出,来维持植株K+/Na+的稳态。
总之,盐胁迫下,磁化水表现出明显的改善黄瓜幼苗生长和生理活动的效果,其主要作用机制表现在:增加了根系生长;增加了叶水势或降低了渗透势,从而改善了叶水分状况;增加了叶绿素含量、光合速率和水分利用效率;通过保护酶活性增强而降低了细胞膜受伤害程度;降低根、茎和叶中的Na含量,增加了K+/Na+比,从而维持黄瓜幼苗细胞内的离子稳态。非盐胁迫下,尽管磁化水也有一定改善黄瓜生长和生理活动的作用,但其作用机制主要限于改善根系生长,增加叶绿素和光合速率,增加CAT活性而降低细胞膜受伤害程度和改善植物体内N或P营养状况。值得注意的是本研究仅磁化蒸馏水,然后用磁化蒸馏水配制含NaCl的溶液,而前人研究中多直接磁化微咸水或含NaCl的营养液,两种不同的处理方式下均发现磁化处理可提高植物的耐盐性,但这两种方式下磁化水效应是否存在差异,值得进一步研究。
4 结 论
(1) 无论在非盐胁迫和盐胁迫下,磁化水均具有一定改善黄瓜幼苗生长或生理活动的作用。磁化水在盐胁迫下改善黄瓜生长和生理活动的作用大于非盐胁迫下,且随处理时间延长,磁化水的效应增加。
(2) 盐胁迫下,磁化水处理改善黄瓜幼苗生长的主要生理机制在于:磁化水处理增加了黄瓜幼苗根系生长,改善了其水分关系;增加了叶绿素含量、光合速率和水分利用效率,从而提高了光合能力;通过保护酶活性增强降低了细胞膜受伤害程度;降低根、茎和叶中的钠含量从而增加K+/Na+比,有助于细胞内离子稳态的维持。
