农杆菌介导的MsDUF基因转化紫花苜蓿的遗传转化体系建立及优化
2022-04-27安明珠马向丽周凯段新慧姜华韩博
安明珠 马向丽 周凯 段新慧 姜华 韩博




摘要:为建立适宜MsDUF基因转化紫花苜蓿的遗传转化体系,本试验在已知的紫花苜蓿再生体系的基础上,采用农杆菌介导法,以保定紫花苜蓿(MedicagosativaL.cv.Baoding)下胚轴和子叶为转化受体,将MsDUF基因导入到紫花苜蓿中,通过对愈伤诱导、分化及生根培养阶段抗生素浓度的筛选建立了优化的遗传转化体系,同时对筛选获得的转基因紫花苜蓿进行PCR和RT-PCR检测。结果表明,农杆菌介导的MsDUF基因遗传转化的最佳条件为:将预培养2d的紫花苜蓿下胚轴用含pCAMBIA1301-MsDUF质粒的农杆菌菌液(OD600为0.3~0.5)侵染10min,共培养暗处理2d后转入含30mg/LHyg和500mg/LCef的愈伤诱导培养基和分化培养基上诱导分化,待抗性芽长到2~3cm高时转入含30mg/LHyg和300mg/LCef的生根培养基上,得到6株经PCR检测为阳性的抗性植株;选取5株进行RT-PCR检测,均检测出大小与目的条带相吻合的清晰条带,证明MsDUF基因已成功转入保定紫花苜蓿中。本试验成功建立了农杆菌介导的高效MsDUF基因转化紫花苜蓿的遗传转化体系,为进一步研究MsDUF基因功能奠定了基础,同时为紫花苜蓿育种和种质创新提供了基础材料。
关键词:紫花苜蓿;MsDUF基因;农杆菌介导;遗传转化体系;PCR检测;RT-PCR检测
紫花苜蓿(MedicagosativaL.)是世界上重要的优质豆科牧草之一,具有营养价值丰富、产量高、适口性好等优点[1,2],主要集中在我国西北干旱、半干旱及盐碱地区种植[3,4]。紫花苜蓿不仅是一种重要的经济饲料作物,还是一种很好的水土保持植物,在畜牧业可持续发展和环境改善等方面具有重要作用[5]。
紫花苜蓿的遗传转化率较低,易受多种因素的影响,例如外植体材料、植物激素、抗生素浓度等[6-8]。稳定的遗传转化体系是提高紫花苜蓿遗传转化率及产量的前提[9]。Deak等[10]在1986年首次对紫花苜蓿进行转基因改良,建立了紫花苜蓿遗传转化体系。此后,研究人员在此基础上进一步优化遗传转化体系,以期能够获得较高的转化率,提高紫花苜蓿的耐性[11,12]。He等[13]研究4个苜蓿品种的再生能力时,通过改变植物生长调节剂的浓度,进一步改良用于遗传转化的再生体系。李晶等[14]采用下胚轴作为转化受体,利用不同浓度潮霉素对转化植株进行筛选,建立了一个农杆菌介导的紫花苜蓿smt1富硒基因遗传转化体系,为富硒苜蓿新品种选育奠定了基础。薛晓峰[15]通过对紫花苜蓿遗传转化条件进行完善,将SeNHX1盐角草逆向转运蛋白基因导入紫花苜蓿中,建立了较为完善的苜蓿再生体系,为提高苜蓿的抗盐性提供了方法。张静[16]将LYZGFP双元基因导入3个苜蓿品种中,并对其遗传转化体系进行了优化,为研究转基因抗病苜蓿新品种奠定了基础。
MsDUF基因是从紫花苜蓿自身提取出的,是DUF4228家族成员之一,在紫花苜蓿各组织中均有发现,能在不同的逆境下上调表达[17]。但其他植物能否通过表达该基因而使抗逆能力提高还有待研究。
本试验采用农杆菌介导法,通过筛选转化受体及愈伤诱导、分化和生根培养基的最优抗生素浓度,建立了一套高效的MsDUF基因转化紫花苜蓿的遗传转化体系,这将为进一步研究MsDUF基因的功能奠定基础。
1材料与方法
1.1试验材料
1.1.1转化材料 供试品种为保定紫花苜蓿(MedicagosativaL.cv.Baoding),购自中国农业科学院北京畜牧兽医研究所。选取7日龄无菌苗的叶片和下胚轴作为遗传转化受体。
大肠杆菌DH5α由北京天根生化科技有限公司提供,农杆菌菌株GV3101由西北农林科技大学生命科学学院张大鹏提供;植物表達载体质粒pCAMBIA1301-MsDUF,由本实验室构建,该质粒携带有MsDUF基因。
1.1.2培养基 种子萌发培养基为1/2MS固体培养基,农杆菌介导培养基为YEB培养基,愈伤组织诱导培养基为UM+2mg/L2,4-D+0.25mg/LKT,分化培养基为UM+0.7mg/LKT,生根培养基为1/2MS培养基,预培养基、共培养基均为MS培养基。
YEB、MS、UM、1/2MS培养基配方参照《植物生理学实验》[18],所有培养基均需在121℃下灭菌25min,抗生素用BiosharpBS-PES-2233mm0.22μm一次性针头滤器进行过滤。培养基的大量元素、微量元素、铁盐和有机质母液的配制均参照《实用植物组织培养技术教程》[19]。
1.2试验方法
1.2.1转化受体的筛选及农杆菌介导转化 选取保定紫花苜蓿成熟种子,用75%乙醇消毒5min后,无菌水冲洗;再用10%次氯酸钠消毒10min,无菌水反复冲洗几次后将种子置于含有1/2MS固体培养基的无菌三角瓶中,在(25±2)℃培养箱中发芽并生长一周后,取无菌苗的子叶和下胚轴各100个作为外植体。
把pCAMBIA1301-MsDUF质粒转入到农杆菌中,然后在YEB培养基中低速振荡培养至OD600值为0.3~0.5;将苜蓿子叶和下胚轴放入MS培养基中预培养2d后,将其转移到上述含有农杆菌的YEB培养基中振荡培养10min,然后将外植体材料取出用无菌纸吸干后放在MS共培养基中暗培养2d,转到愈伤诱导培养基上,统计诱导出愈伤组织的外植体数及愈伤组织诱导率。
1.2.2愈伤组织诱导的抗生素浓度筛选 将苜蓿材料(每个处理50个样本,重复5次)从MS共培养基中取出后依次用灭菌水、含有400μg/mL头孢(Cef)的灭菌水冲洗,并在液体MS培养基里清洗几分钟,然后转到含有不同浓度潮霉素(Hyg浓度为10、30、50、70mg/L)和头孢(Cef浓度为100、300、500、700mg/L)的愈伤诱导培养基中进行培养,每20天继代一次,继代2次,观察抗生素抑制农杆菌的状况及愈伤组织的褐化情况,并统计愈伤数及愈伤率,选择最适抗生素浓度。
1.2.3分化培养的抗生素浓度筛选 将愈伤组织转移到分化培养基(抗生素浓度设计与愈伤组织诱导培养基中的相同)上,每个处理转移50个愈伤,重复5次,30d后观察胚状体分化及污染状况,统计分化出的胚状体数及分化率。
1.2.4生根培养的抗生素浓度筛选 待抗性芽生长至2~3cm高时转入含有不同浓度抗生素(抗生素浓度设计与愈伤诱导培养基中的相同)的生根培养基中进行生根培养,统计生根率,然后将获得的转基因植株移栽到花盆中进行炼苗。
1.2.5转基因植株的鉴定 (1)PCR检测:以CTAB法提取出的转基因紫花苜蓿叶片基因组为模板,使用目的基因特异引物MsDUF-F(5′-CTAATGGGGAACACTTTTGG-3′)和MsDUF-R(5′-AAATCTCCTCAGTTTGGTGAG-3′)进行PCR检测。
(2)RT-PCR检测:利用Trizol法提取经PCR检测阳性的转基因紫花苜蓿总RNA,并使用TaKaRa公司的去基因组DNA反转录试剂盒反转录为cDNA,以紫花苜蓿看家基因β-Actin作为内参,MsDUF-F和MsDUF-R为基因特异性引物,对MsDUF基因进行Real-TimePCR检测。
1.3数据统计与分析
采用MicrosoftExcel2010整理和分析数据。涉及的计算公式为:
愈伤诱导率(%)=诱导出愈伤组织的外植体数/接种的外植体总数×100 ;
分化率(%)=分化的胚状体数/转移的愈伤数×100 ;
生根率(%)=生根株数/分化株数×10
2结果与分析
2.1转化受体的选择
分别以下胚轴和子叶为外植体进行愈伤组织诱导,培养20d后下胚轴的愈伤诱导率达到99%(表1),高于子叶(90%),故选择下胚轴作为最优外植体。
2.2愈伤诱导培养基的抗生素浓度筛选
结果显示,当Hyg和Cef浓度较低时,愈伤组织呈现出淡黄色,内部致密外部松散,表面干燥,生长较快,但污染率较高;Hyg和Cef浓度高时,愈伤组织块表现为黄褐色,结构松软,用手捻碎愈伤块可发现水分含量较高,愈伤组织死亡率增加,愈伤诱导率降低,但污染率最低,表明抗生素浓度高对愈伤组织产生强烈的抑制作用。综合比较,30mg/LHyg+500mg/LCef处理的愈伤组织诱导效果最好(表2);在此条件下诱导培养5d,下胚轴开始膨胀变大,形成愈伤组织;10d后,愈伤组织块增大,呈白色或淡黄色,质地紧密(图1)
2.3分化培养基抗生素浓度的筛选
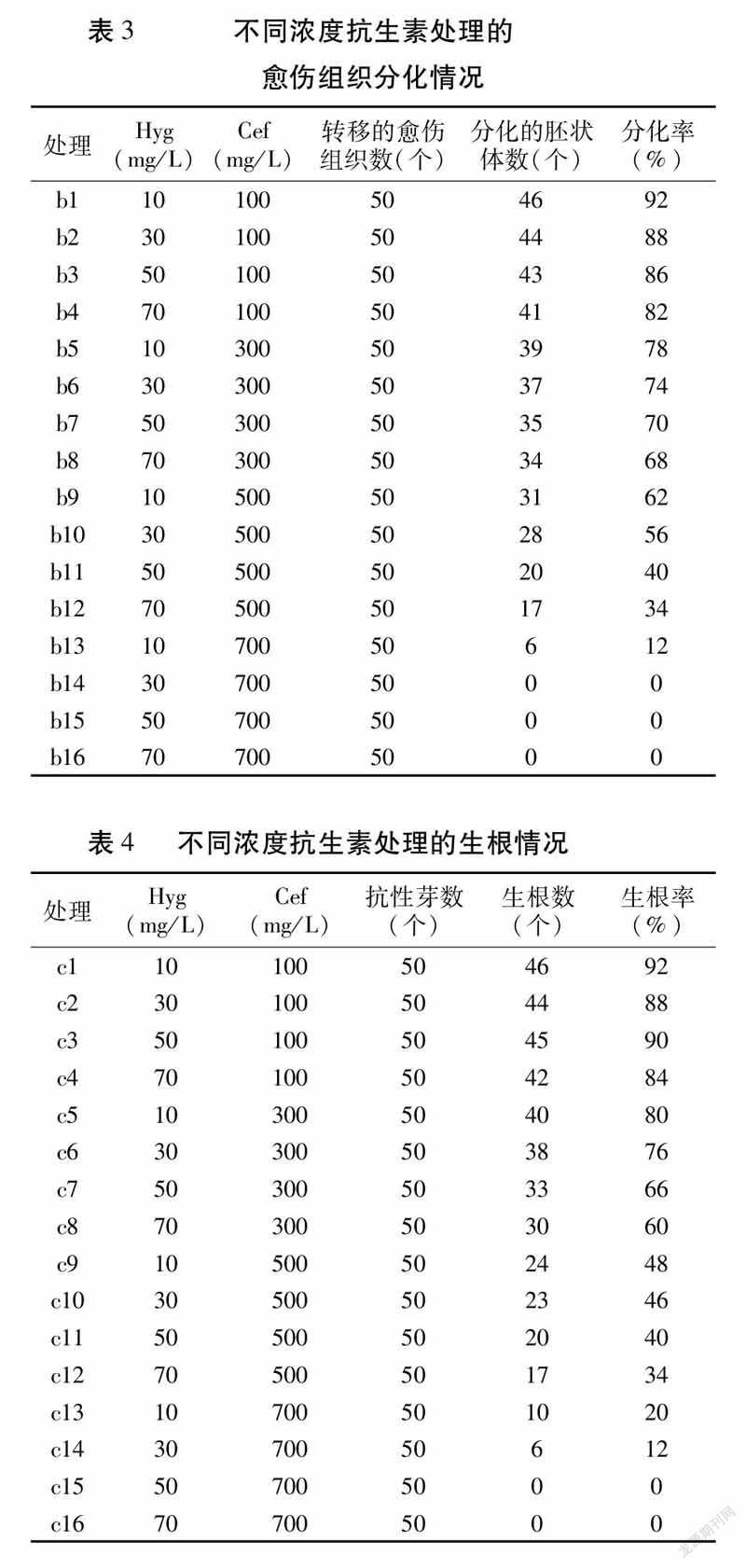
将愈伤组织转入含有不同浓度抗生素的分化培养基中,观察发现20d时,愈伤组织出现淡绿色的胚状体;30d后,随着抗生素浓度的增加,分化的胚状体数逐渐减少,分化率降低,抗生素浓度最高时全部褐化死亡。表明高浓度抗生素对愈伤组织分化有明显的抑制作用。综合愈伤组织污染及分化情况,选用30mg/LHyg+500mg/LCef作为分化培养的最适抗生素浓度处理(表3)。
2.4生根培养基的抗生素浓度筛选
抗性芽在添加不同浓度抗生素的1/2MS培养基上的生根率随抗生素浓度的升高而降低,甚至出现死亡(表4)。综合来看,当抗生素浓度为30mg/LHyg+300mg/LCef时根系的生长状况最佳,根系长、粗壮、须根发达(图2)。
2.5转基因苜蓿的PCR检测
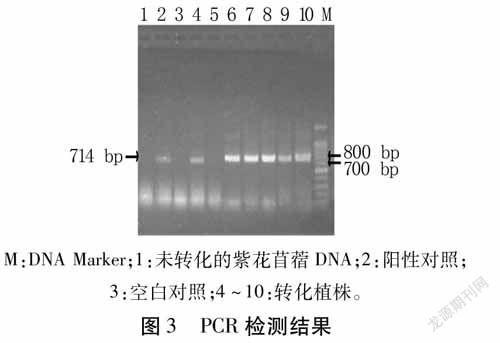
利用提取的转基因植株DNA为模板,以MsDUF-F和MsDUF-R为引物进行PCR扩增,以经过相同再生过程的野生型紫花苜蓿为阴性对照,水为空白对照,发现选取的7株转基因苜蓿中有6株检测出与目的基因大小相同的条带,经1%琼脂糖凝胶电泳检测,产物长度为714bp(图3)。初步得到6株转基因阳性植株。
2.6转基因苜蓿的RT-PCR检测
以反转录后的cDNA为模板、以MsDUF-F和MsDUF-R为引物进行Real-TimePCR扩增,经电泳检测后发现,从选取的5株再生苜蓿(分别对应图3中的6、7、8、9、10)中均检测出与目的基因大小相吻合的清晰条带(图4),表明目的基因已整合进紫花苜蓿中,同时可以在RNA水平上正常表达。
3讨论
紫花苜蓿在畜牧业发展和环境改良中具有重要作用,但随着干旱范围的扩大,紫花苜蓿的生长及产量受到了极大的限制[17]。高效的紫花苜蓿遗传转化体系能够降低成本,减少损失,使转化率增高[20],对进一步研究转化后的紫花苜蓿MsDUF基因功能具有重要作用。
要建立高效的紫花苜蓿遗传转化再生体系,选择再生能力好的外植体材料及适宜的抗生素浓度非常关键。紫花苜蓿外植体大多选用叶片、下胚轴及子叶。本研究分别用保定紫花苜蓿的下胚轴和子叶为外植体进行愈伤诱导率对比,发现用下胚轴为外植体时的愈伤诱导率较高,这与钱瑾[21]和王涌鑫等[22]的研究结果一致,而与谢鑫星等[23]的研究结果有所不同,可能是由于所用紫花苜蓿品种不同造成的。
在使用农杆菌介导MsDUF基因转入到紫花苜蓿中时,残留的农杆菌往往会造成培养基污染,使植株成活率降低。为解决该问题,通常采用在培养基中加入抗生素的方法来抑制农杆菌生长,进而提高转化率。但高浓度抗生素又会对植物细胞产生损伤[24,25],因此,选择适宜的抗生素浓度对于遗传转化成功尤为重要。本试验过程中发现,当抗生素浓度低时,愈伤组织成活率较高,但污染率也较高;而当抗生素浓度高时,虽然污染率降低,但是愈伤组织死亡率升高。这与马伶俐[26]和许来俊[27]的研究结果一致,也证明了选用适宜浓度的抗生素对获得较高遗传转化效率具有重要影响。
4结论
本研究建立了适宜农杆菌介导的转MsDUF基因保定紫花苜蓿的最佳遗传转化体系:以下胚轴为外植体,在MS培养基上预培养2d后,转移到OD600为0.3~0.5的农杆菌(含有pCAMBIA1301-MsDUF质粒)菌液内振荡培养10min,在MS共培养基中暗培养2d,再转入到愈伤培养基(UM+2mg/L2,4-D+0.25mg/LKT+30mg/LHyg+500mg/LCef)上诱导愈伤组织,光照16h、黑暗8h,每隔20天继代一次,继代2次后转移到分化培养基(UM+0.7mg/LKT+30mg/LHyg+500mg/LCef)上进行分化,30d后待抗性芽生长至2~3cm高时转移到生根培养基(1/2MS+30mg/LHyg+300mg/LCef)进行生根培养,获得完整植株后移栽到花盆中,经PCR和RT-PCR检測获得转基因阳性植株,说明MsDUF基因已经整合到植物基因组中。
