血管紧张素Ⅱ通过Raf/MEK/ERK通路对PDGF诱导的气道上皮细胞转分化的影响
2022-04-26杨丹芬谢圆媛康睿
杨丹芬 谢圆媛 康睿
支气管哮喘是危害人类生命健康的慢性呼吸道疾病,具有较高的发病率[1]。目前研究发现,气道重构是导致哮喘患者肺功能下降及哮喘症状反复发作的主要原因之一[2]。探寻气道重构及控制气道纤维化改变进程的调控机制,也是目前临床研究的重点任务之一[3]。大量文献研究发现,气道上皮细胞结构及功能改变是引起气道重构的关键环节[4],且气道上皮细胞间质-转分化(epithelial mesenchyme-transdifferentiation,EMT)进程也被认为是哮喘患者气道重构及纤维化发生演变的重要机制[5]。但气道上皮细胞EMT进程的分子生物学机制还不甚明确。近来研究发现,加速纤维肉瘤蛋白(rapidly accelerate fibrosarcoma protein,Raf)/丝裂原活化的细胞外信号调节激酶(mitogen activated extracellular signal regulated kinase,MEK)/细胞外信号调节激酶(extracellular signal regulated kinase,ERK)信号通路可调控细胞增殖、生长及分化过程[6],且能调控多种通路与大肠、肾小管、甲状腺等多种组织上皮细胞及癌细胞EMT进程[7]。但Raf/MEK/ERK通路在支气管哮喘气道上皮细胞EMT进程中的调控机制,研究较少。另外,又有研究报道,血管紧张素Ⅱ(Angiotensin Ⅱ,Ang Ⅱ)在支气管哮喘患者血清中分泌较高,且与患者气道炎症及气道重构关系密切[8],但Ang Ⅱ调控气道重构的具体机制还不甚明确。研究证实,Ang Ⅱ能通过Raf/ERK通路影响并促进肝癌细胞增殖[9],且能介导肝癌上皮细胞EMT进程[10]。Ang Ⅱ能否通过Raf/MEK/ERK途径介导气道上皮细胞EMT进程,参与支气管哮喘气道重构过程,笔者还未见报道。本研究体外培养并以血小板源生长因子(platelet-derived growth factor,PDGF)诱导气道上皮细胞,给予Ang Ⅱ处理,探究其转分化过程的分子机制,以期阐明Ang Ⅱ在支气管哮喘气道重构过程的调节机制,为支气管哮喘的临床治疗提供参考。
1 材料与方法
1.1 细胞及主要试剂与仪器 人气道上皮细胞株16 HBE(购自上海康朗生物科技有限公司,货号:KLH1041);血管紧张素Ⅱ(购自上海经科化学科技有限公司,货号:JKLN002722,规格:10 mg);重组人血小板源生长因子(PDGF)(购自美国sigma公司,冻干粉,临用前用无菌去离子水溶解,货号:BRP145,规格:50 μg);Raf/MEK/ERK通路抑制剂(索拉菲尼,sorafenib)(购自美国selleck公司,货号:S1040,规格:10 mg);兔抗人E-粘钙素(E-cadherin)、α-平滑肌肌动蛋白(α-SMA)、波形蛋白(vimentin)、纤维连接蛋白(FN)、胶原蛋白Ⅳ(ColⅣ)、Raf、MEK1及磷酸化MEK(p-MEK1)、ERK1及磷酸化ERK1(p-ERK1)、转化生长因子β1(TGF-β1)等抗体(均购自美国abcam公司,货号:ab407720、ab108424、ab92547、ab174833、ab34710、ab200653、ab32091、ab96379、ab32537、ab131438、ab215715);倒置显微镜(购自日本奥林巴斯,型号:CKX53)。
1.2 方法
1.2.1 细胞培养:16-HBE人气道上皮细胞株常规复苏后,用含10%胎牛血清的DMEM培养基于恒温培养箱中贴壁培养,待细胞生长到70%~80%时,用胰蛋白酶进行消化传代计数。
1.2.2 细胞分组处理:取生长到70%~80%的细胞,消化传代后,按1×105个/孔密度接种于六孔板中,进行以下分组处理:(1)分为对照组、PDGF[11]不同浓度刺激组(5、25、50、100、200 ng/L),24 h后,用免疫荧光法检测各组细胞中vimentin阳性表达水平,筛选出PDGF合适浓度。(2)分为正常对照组、PDGF诱导组(100 ng/L)、Ang Ⅱ[12]不同浓度组(10-7、10-6、10-5mol/L)组,各组均培养24 h后置于倒置显微镜下观察细胞EMT形态,并用WB法检测EMT间质转化相关蛋白及Raf/MEK/ERK通路蛋白表达。(3)分为正常对照组、PDGF诱导组、Ang Ⅱ组(10-6mol/L)、Raf/MEK/ERK通路抑制剂(sorafenib)[9]组(10 μmol/L)、Ang Ⅱ+sorafenib(10-6mol/L+10 μmol/L)组,各组均培养24 h后置于倒置显微镜下观察细胞EMT形态,并用WB法检测Raf/MEK/ERK通路蛋白表达。
1.2.3 免疫荧光染色法检测细胞vimentin阳性表达水平:取细胞,参照文献[13]加入丙酮固定、 0.5% 曲拉通(Triton X-100)室温透化、5% 牛蛋白血清封闭后,加入vimentin一抗抗体(1∶50)孵育过夜,再用Alexa Fluor594红色荧光标记的羊抗兔 IgG二抗孵育,用DAPI避光染核,防猝灭液封片后于激光共聚焦显微镜下观察,拍照,随机选6个,对vimentin阳性表达细胞数目进行计数。
1.2.4 倒置显微镜观察细胞形态:取各组细胞,置于倒置显微镜下观察细胞形态。
1.2.5 Western blotting检测各组细胞E-cadherin、α-SMA、vimentin、FN、ColⅣ、Raf、MEK、p-MEK、ERK、p-ERK、TGF-β1蛋白相对表达水平:取各组细胞,吸干培养液,用磷酸缓冲液反复清洗后,用蛋白裂解液裂解于冰上裂解20 min后,在4℃、1 000 r/min、10 min条件下离心并取上清液,用BCA法测定蛋白浓度后,取50 μg蛋白样品行上样及电泳分离后,加入一抗(E-cadherin、α-SMA、vimentin、FN、ColⅣ、Raf、MEK、p-MEK、ERK、p-ERK、TGF-β1抗体,稀释倍数均为1∶1 000,抗体GAPDH(内参)1∶2 000],于4℃冰箱内孵育过夜,加入二抗HRP(1∶3 000)孵育2 h,化学发光法显影后成像并用分析系统下拍照、分析灰度值。每组试验重复3次。

2 结果
2.1 不同浓度PDGF对人气道上皮细胞vimentin表达的影响 与对照组比较,随着PDGF浓度升高,vimentin红色荧光在胞浆着色逐渐增加,细胞vimentin阳性表达升高,并在100~200 ng/L时上升至稳定水平,其中PDGF浓度25、50、100、200 ng/L时vimentin阳性表达与对照组比较差异有统计学意义(P<0.05)。PDGF浓度100 ng/L与200 ng/L比较,差异无统计学意义(P<0.05),选用PDGF浓度为100 ng/L为诱导浓度。见表1。

表1 PDGF处理后6组vimentin阳性细胞数目比较
2.2 Ang Ⅱ不同浓度处理后对细胞EMT形态变化的影响 倒置显微镜下观察,正常对照组细胞呈铺路石样状态,细胞间紧密连接且稍凸起。PDGF诱导组细胞间连接减少,排列不规则,细胞肥大、呈长梭形、星形或多角形样类似成纤维细胞样形态改变。随着Ang Ⅱ浓度升高,细胞肥大、呈长梭形、星形或多角形样改变进一步加重,且Ang Ⅱ浓度10-6mol/L与10-5mol/L浓度细胞形态向接近。见图1。
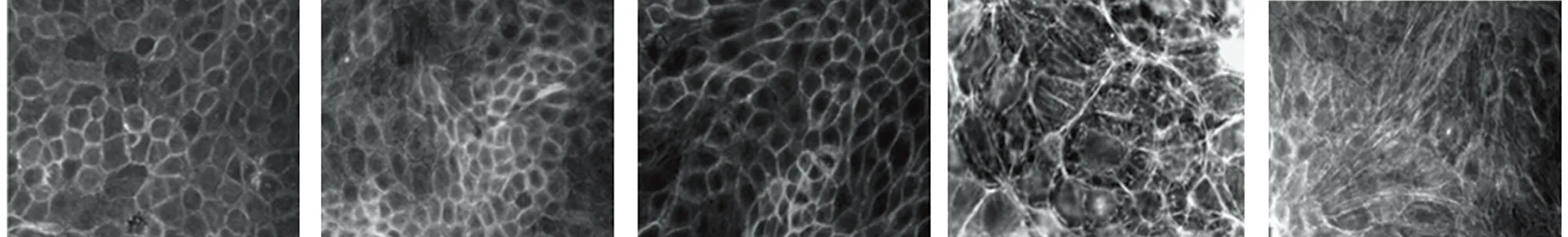
2.3 Ang Ⅱ不同浓度处理后对细胞E-cadherin、α-SMA、vimentin、FN、ColⅣ蛋白表达的影响 与正常对照组比较,PDGF诱导组E-cadherin表达降低,α-SMA、vimentin、FN、ColⅣ蛋白表达升高,差异均有统计学意义(P<0.05)。与PDGF诱导组比较,Ang Ⅱ不同浓度处理组E-cadherin表达进一步降低(P<0.05),α-SMA、vimentin、FN、ColⅣ蛋白表达进一步升高(P<0.05),且Ang Ⅱ浓度10-6mol/L组及10-5mol/L浓度组上述指标变化优于10-7mol/L组,差异有统计学意义(P<0.05)。Ang Ⅱ浓度10-6mol/L组与10-5mol/L浓度组比较差异无统计学意义(P>0.05)。见表2,图2。

表2 5组细胞E-cadherin、α-SMA、vimentin、FN、ColⅣ蛋白表达水平比较

图2 5组细胞E-cadherin、α-SMA、vimentin、FN、ColⅣ蛋白表达免疫印迹;A 正常对照组;B PDGF诱导组;C Ang Ⅱ浓度10-7mol/L组;D Ang Ⅱ浓度10-6mol/L组;E Ang Ⅱ浓度10-5mol/L组
2.4 Ang Ⅱ不同浓度处理后对细胞Raf/MEK/ERK通路蛋白表达的影响 与正常对照组比较,PDGF诱导组Raf、p-MEK/MEK、p-ERK/ERK、TGF-β1蛋白表达升高(P<0.05)。与PDGF诱导组比较,Ang Ⅱ不同浓度处理组Raf、p-MEK/MEK、p-ERK/ERK、TGF-β1蛋白表达进一步升高(P<0.05),且Ang Ⅱ浓度10-6mol/L组及10-5mol/L浓度组上述指标变化优于10-7mol/L组,Ang Ⅱ浓度10-6mol/L组与10-5mol/L浓度组比较差异无统计学意义(P>0.05)。见图3,表3。

图3 5组细胞Raf、p-MEK/MEK、p-ERK/ERK、TGF-β1蛋白表达免疫印迹;A 正常对照组;B PDGF诱导组;C Ang Ⅱ浓度10-7mol/L组;D Ang Ⅱ浓度10-6mol/L组;E Ang Ⅱ浓度10-5mol/L组
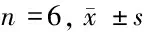
表3 5组细胞Raf、p-MEK/MEK、p-ERK/ERK、TGF-β1蛋白表达水平比较
2.5 Ang Ⅱ与sorafenib联合应用对细胞EMT形态的影响 倒置显微镜下观察,正常对照组细胞呈铺路石样状态且细胞间紧密连接较好。PDGF诱导组细胞间连接减少,细胞肥大、呈长梭形、星形或多角形样改变较多。与PDGF诱导组比较,Ang Ⅱ组细胞肥大、呈长梭形、星形或多角形样改变进一步加重,sorafenib组细胞长梭形、星形或多角形样改变减少,铺路石样改变较多,细胞间紧密连接较好。Ang Ⅱ+Sorafenib组细胞肥大、呈长梭形、星形或多角形样改变与PDGF诱导组接近,较Ang Ⅱ组加重。见图4。

2.6 Ang Ⅱ与sorafenib联合应用对细胞Raf/MEK/ERK通路蛋白表达的影响 与正常对照组比较,PDGF诱导组Raf、p-MEK/MEK、p-ERK/ERK、TGF-β1蛋白表达升高(P<0.05)。与PDGF诱导组比较,Ang Ⅱ组Raf、p-MEK/MEK、p-ERK/ERK、TGF-β1蛋白表达进一步升高(P<0.05),sorafenib组Raf、p-MEK/MEK、p-ERK/ERK、TGF-β1蛋白表达降低,差异有统计学意义(P<0.05)。Ang Ⅱ+Sorafenib组上述指标变化与Ang Ⅱ组相反,且差异有统计学意义(P<0.05)。见表4,图5。
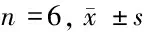
表4 5组细胞Raf、p-MEK/MEK、p-ERK/ERK、TGF-β1蛋白表达水平比较

图5 5组细胞Raf、p-MEK/MEK、p-ERK/ERK、TGF-β1蛋白表达免疫印迹;A 正常对照组;B PDGF诱导组;C Ang Ⅱ浓度10-7mol/L组;D Ang Ⅱ浓度10-6mol/L组;E Ang Ⅱ浓度10-5mol/L组
3 讨论
据世界流行病学分析,预计到2025年全世界支气管哮喘患者将达3亿[1]。支气管哮喘病因及发病机制一直是医学界研究的重点,而气道重构被认为是引起支气管哮喘患者通气功能障碍、气道反应性增高及哮喘症状控制不佳的重要原因[2]。探索支气管哮喘的病理改变机制,是目前哮喘防治的重要方向。
研究证实,哮喘患者气道损伤修复过程中,气道上皮细胞EMT过程与气道重构关系密切。魏盼等[14]结合前人研究发现作为气道第一屏障的上皮细胞,可分泌多种因子如TGF-β1,并通过多种信号通路诱发EMT,引起细胞外基质沉积、上皮纤维化、平滑肌增生与迁移等导致气道壁结构增厚,参与哮喘气道重构过程。Zou等[15,16]发现气道上皮、平滑肌等多种细胞均可分泌PDGF等细胞因子,并引起气道上皮细胞EMT及迁移、气道胶原合成、气道壁增厚,加重哮喘的发作,并认为PDGF是介导哮喘气道重构的免疫调节因子。本研究用不同浓度PDGF诱导培养人正常气道上皮细胞发现,随着PDGF浓度升高,EMT标志物vimentin阳性表达显著升高,并在100~200 ng/L时达到稳定,且与正常气道上皮细胞比较,100 ng/L浓度的PDGF诱导组细胞出现不规则、肥大、梭形等成纤维细胞样改变,提示PDGF可诱导气道上皮细胞EMT进程。另外研究证实,细胞EMT过程中会由上皮表型细胞样转变为成纤维间质细胞样(特征为E-cadherin表达降低,α-SMA、vimentin表达升高,FN及ColⅣ沉积增加)[17]。本研究也检测到PDGF诱导组出现E-cadherin表达降低,α-SMA及vimentin表达升高、FN及ColⅣ沉积增加,进一步证实PDGF诱导气道上皮细胞EMT模型造模成功。
近来研究报道,Ang Ⅱ在支气管哮喘气道重构过程中发挥重要作用。Magalhaes等[8,18]发现在支气管哮喘患者血清中Ang Ⅱ呈异常高表达水平,并认为Ang Ⅱ高表达与哮喘气道高反应状态及气道重构有一定的相关性。另外,Ang Ⅱ也与肾、肝、肺等组织上皮细胞EMT关系密切。陈毅华等[10,19]证实Ang Ⅱ可诱导肝及肾上皮细胞EMT转分化进程。本研究用不同浓度的Ang Ⅱ干预培养人气道上皮细胞,发现,随着Ang Ⅱ浓度升高,细胞不规则、肥大、梭形等成纤维细胞样改变进一步加重,E-cadherin表达进一步降低,α-SMA及vimentin表达、FN及ColⅣ沉积进一步增加,提示Ang Ⅱ升高也可促进人气道上皮细胞EMT进程,这可能为Ang Ⅱ参与支气管哮喘患者气道重构的可能机制之一。
TGF-β1被认为是诱导气道上皮细胞EMT转分化的经典通路之一[14]。Itoigawa等[20]证实TGF-β1可通过丝裂原活化蛋白激酶(MAPK)、细胞信号转导分子(Smad)等信号通路激活EMT相关标志物Vimentin、N-cadherin、α-SMA等转录及表达,促进哮喘患者气道重构过程。Rudzka等[21,22]证实MAPK可通过Raf即MAPK激酶的激酶(MAPKKK)、MEK、ERK完成三级激酶级联磷酸化介导细胞增殖凋亡,且TGF-β1刺激胞膜并与胞膜受体结合后,能够引起Ras/MEK/ERK相继激活介导Smad3/α-SMA通路的纤维化进程,预示TGF-β1介导EMT及气道重构的过程可能离不开Ras/MEK/ERK通路参与。本研究在PDGF诱导的气道上皮细胞EMT过程中,发现TGF-β1升高的同时,伴随着Ras、p-MEK/MEK、p-ERK/ERK表达的升高,而用sorafenib抑制Raf/MEK/ERK通路活化后,随着Ras、p-MEK/MEK、p-ERK/ERK表达的降低,TGF-β1表达也随之降低,且EMT相关标志物α-SMA及vimentin表达、FN及ColⅣ沉积表达也显著降低,细胞不规则、肥大、梭形等成纤维细胞样形态改变也随之减轻,证实Raf/MEK/ERK通路活化可能是TGF-β1介导气道上皮细胞EMT及气道重构过程中的关键通路,阻断Raf/MEK/ERK通路活化可抑制气道上皮细胞EMT进程。本研究还观察到Ang Ⅱ可进一步促进气道上皮细胞EMT进程及Raf/MEK/ERK通路进一步活化,这一作用可被Raf/MEK/ERK通路抑制剂sorafenib逆转,提示Ang Ⅱ可能通过促进Raf/MEK/ERK通路活化,促进气道上皮细胞EMT。
综上所述,Ang Ⅱ可通过激活Raf/MEK/ERK通路表达,促进气道上皮细胞EMT,可能为阐明哮喘患者气道重构的分子生物学机制提供一定理论依据,但气道上皮细胞EMT转分化及气道重构的分子机制复杂且途径较多,有待进一步探究。
