玉簪花物质基础及其药理活性研究进展
2022-04-26李亚楠皮可欣李建鑫王志娜苏伟萍
梁 啸,陶 霞,李亚楠,皮可欣,胡 钰,李建鑫,王志娜, 苏伟萍,徐 斌
(辽宁大学 药学院,辽宁 沈阳110036)
0 引言
百合科植物玉簪具有较强的耐寒性,常生长在阴凉潮湿的亚热带或温带地区.其不仅具有较强的适应能力,而且观赏价值极高,被广泛用作城市园林景观植被[1].我国地域辽阔,气候条件多样化,有玉簪(Hosta plantaginea)、紫萼(H.ventricosa)、东北玉簪(H.ensata)、白粉玉簪(H.albofarinosa)4类原产玉簪,其中,玉簪与紫萼种植最为广泛[2].玉簪作为中药材最早记载于《本草纲目》,其根、茎、叶、花均可针对不同症状分别入药治疗.其中,玉簪的花常治疗咽喉肿痛、小便不通、疮毒、烧伤[3].中成药玉簪清咽十五味丸,又名十五味白花龙胆散,记载于《至高药方》,在临床应用中,对急慢性咽炎、咽喉肿痛、口干咽燥、扁桃体炎的治疗效果极佳,其十五味中药成分中的玉簪花位于成分表首位.吴龙堂[4]为表明玉簪清咽十五味丸具有抗炎镇痛作用,采用热板法、醋酸扭体法制作致痛模型,发现玉簪清咽十五味丸可使小鼠疼痛阈值增加,同时,以耳肿胀法、角叉菜胶致大鼠足肿胀法制作炎症模型,发现玉簪清咽十五味丸具有较好的抗炎效果.随后,关爱灵等[5]以中成药玉簪花-15味散为研究对象,得出以玉簪花为主要原料药的玉簪花-15味散结合西瓜霜治疗急慢性咽喉炎具有安全性高、疗效确切的优点.据多项研究发现,玉簪花的化学活性成分主要以黄酮类、甾体类、单萜皂苷类、苯丙素类为主,但玉簪花中分别发挥抗炎镇痛、抗肿瘤活性及保肝作用的药效物质基础尚不明确,故引起学者的广泛关注并展开一系列研究.
1 化学成分研究
目前,文献检索发现玉簪花的主要化学活性成分为黄酮类、甾体类、单萜皂苷类、苯丙素类物质.
1.1 黄酮类物质
玉簪花中的黄酮类物质母核大多以山奈酚苷元为主.张金花[6]从乙酸乙酯部位分离出黄酮醇苷元及糖苷各2种化合物,分别为山奈酚(1)、槲皮素(2)、山奈酚-3-O-芸香糖苷(3)和山奈酚-7-O-β-D-葡萄糖苷(4).李占海等[7]从70%乙醇玉簪花提取物中首次分离出2种山奈酚双糖苷,山奈酚-3-O-β-D-吡喃葡萄糖基(1→2)β-D-吡喃葡萄糖苷(5).Yang等[8]分离出6种已知化合物和2种新化合物,其中新化合物Hostaflavanone A(6)为黄酮类化合物.He等[9]在80%乙醇粗提物的正丁醇馏分中分离出1种新的黄酮苷Hosta-Avonone A(7)和1种已知化合物山萘酚-3-O-槐糖苷-7-O-葡萄糖苷(8).此后,He等[10]继续以80%乙醇的玉簪花提取液为研究对象,从中发现10种已知化合物和2种新的黄酮化合物Plantanones A(9)和Plantanones B(10).
周庆光等[11]对80%的乙醇提取物进行分离提取,得到1种含四糖的山奈酚苷(11).王丽等[12]采用溶剂法和现代色谱分离技术,鉴定获得8种山奈酚苷,其中,山奈酚-3-O-β-D-吡喃葡萄糖基(1→2)-β-D-吡喃葡萄糖基-7-O-β-D-吡喃葡萄糖苷(12)、山奈酚-3-O-α-L-吡喃鼠李糖基-(1→6)-β-D-吡喃葡萄糖基-7-O-β-D-吡喃葡萄糖苷(13)、山奈酚-3-O-{β-D-吡喃葡萄糖基(1→2)-[α-L-吡喃鼠李糖基-(1→6)]-β-D-吡喃葡萄糖基}-7-O-β-D-吡喃葡萄糖苷(14)、山奈酚-3-O-{β-D-葡萄糖基-(1→2)-[α-L-鼠李糖基(1→6)]-β-D-葡萄糖苷}(15)为玉簪花植物中首次发现,而山奈酚-3-O-β-D-吡喃葡萄糖苷(16)、山奈酚-3-O-{β-D-吡喃葡萄糖基(1→3)-[α-L-吡喃鼠李糖基(1→6)]-β-D-吡喃葡萄糖苷}(17)、山奈酚-3,7-二-O-β-D-吡喃葡萄糖苷(18)、7-甲氧基-山奈酚-3-O-β-D-吡喃葡萄糖基-(1→2)-β-D-吡喃葡萄糖苷(19)则为首次从玉簪属植物中分离.
Yang等[13]从80%乙醇玉簪花粗提物中分离出1种新的化合物Hostafiavanol A(20)以及2种已知化合物二氢莰非醇(Dihydrokaempferol)(21)和柚皮苷(Naringnin)(22).Wei等[14]首次从玉簪花中分离出4种新的黄酮-木脂素异二聚体(23-26)与9种已知的类黄酮衍生物(27-35).Yang等[15]从玉簪花粗提物中分离出1种稀有的甲基类黄酮Plantanone D(36),此次Plantanone D的发现是玉簪花中甲基类黄酮骨架的首次报道.以上36种黄酮类化合物的分子结构如图1所示.
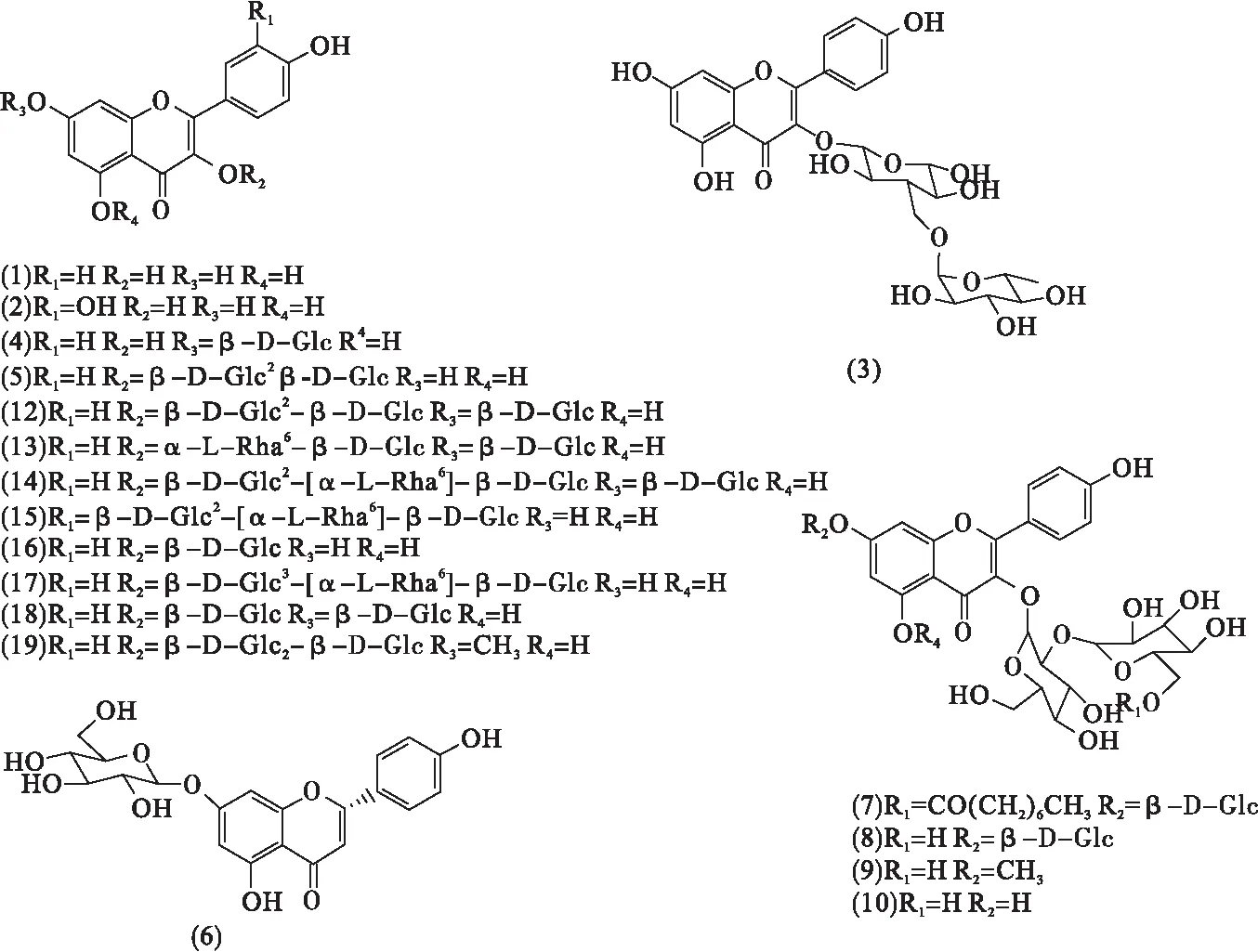



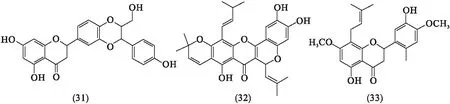

图1 玉簪花中的黄酮类化合物[6-15]
1.2 甾体类物质
甾体化合物是玉簪花物质基础研究中最先进行报道的化合物.在以生物活性为指导的前提下,张金花[6]、李文媛[16]首次从玉簪花正丁醇部位中分离得到6种甾体化合物,分别为胡萝卜苷(37)、支托皂苷元(38)、支脱皂苷元-3-O-{O-β-D-吡喃葡糖基-(1→2)-O-β-D-吡喃葡糖基-(1→4)-β-D-吡喃半乳糖苷}(39)、支脱皂苷元-3-O-{O-β-D-吡喃葡糖基(1→2)-O-[β-D-吡喃木糖基-(1→3)]-O-[β-D-吡喃葡糖基-(1→4)-β-D-吡喃半乳糖苷]}(40)、支脱皂苷元-3-O-{O-β-D-吡喃葡糖基-(1→2)-O-[O-α-吡喃鼠李糖基-(1→4)-β-D-吡喃木糖基-(1→3)]-O-β-D-吡喃葡糖基-(1→4)-β-D-吡喃半乳糖苷}(41)、β-谷甾醇(42).刘接卿等[17]从玉簪花95%的乙醇提取物的正丁醇部分中分离出10种甾体皂苷及苷元,分别为吉托皂苷元-3-O-β-D-葡萄糖(1→4)-β-D-半乳糖苷(43)与吉托皂苷元-3-O-{β-D-木糖(1→4)-β-D-葡萄糖-(1→2)-[β-D-木糖-(1→3)]-O-β-D-葡萄糖(1→4)-β-D-半乳糖苷}(44)是首次从玉簪花中分离的甾体化合物.
刘鑫[18]分离得到11种甾体化合物,其中(25R)-2a,3β,17β,24β-四羟基-5a螺甾烷(45)、(25R)-2a,3β,24β-三羟基-5a-螺甾-9(11)-烯-12酮(46)与16,22-氧代-26-羟基胆甾-4烯-3-酮(47)为新化合物.Li等[19]分离出4种新的呋喃甾醇糖苷化合物,即Hostaplantagineosides A(48)、Hostaplantagineosides B(49)、Hostaplantagineosides C(50)和Hostaplantagineosides D(51).以上甾体类化合物分子结构如图2所示.



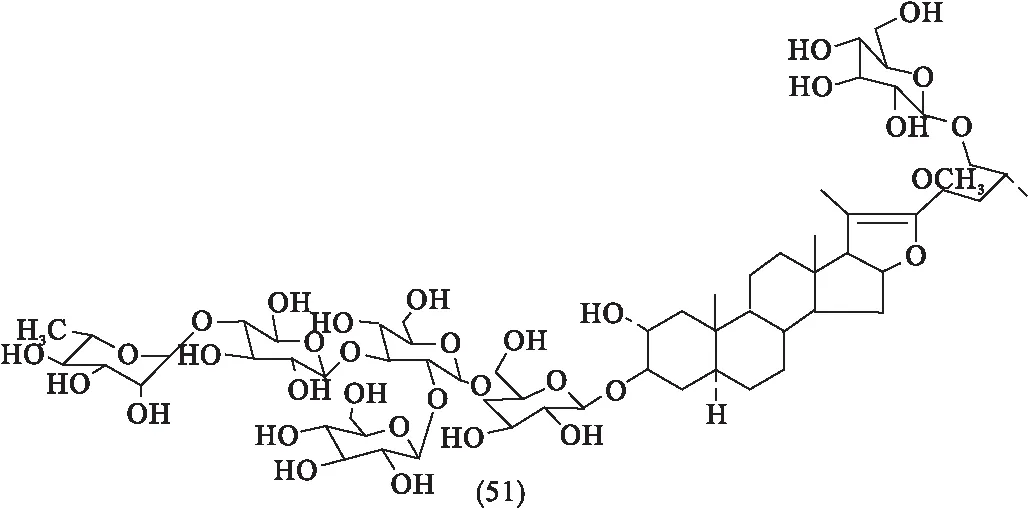
图2 玉簪花中的甾体类化合物[6,16-19]
1.3 苯丙素类
刘鑫[18]首次从70%乙醇提取液中分离得到3种苯丙素类化合物,即邻苯二甲酸双-(2-甲基)-庚酯(52)、3-(4-羟基-3-甲氧基苯基)-丙烯酸甲酯(53)与(1E,4E)-1,5-双-(4-羟基-3-甲氧基苯基)-1,4-二烯-3-戊酮(54),邻苯二甲酸双-(2-甲基)-庚酯(52)属于首次分离得到.以上苯丙素类化合物分子结构如图3所示.

图3 玉簪花中的苯丙素类化合物[18]
1.4 单萜苷类
Wang等[20]系统地对玉簪花提取物进行化学成分研究,从中发现2种单萜苷类化合物A(55)和B(56).Bao等[21]从玉簪花提取液的乙酸乙酯馏分中分离出3种甲基环己烯型单萜苷类化合物(57)、(58)和(59).其中,化合物(57)为新化合物.以上单萜苷类化合物分子结构如图4所示.

图4 玉簪花中的单萜苷类化合物[20]
1.5 其他物质
玉簪花中还具有十二烷酸(60)、棕榈酸单甘油酯(61)、香荚兰酸(62)、(2S)-1-O-亚麻烯酰基-3-O-β-D-吡喃半乳糖基甘油(63)、(2S)-1-O-(10,3)-十七烯酰基-3-O-β-D-吡喃半乳糖基甘油(64)、1-O-β-D-吡喃葡萄糖基(2S,3R,4E,8Z)-[(2-羟基十六烷酰基)酰氨基]-4,8-十八碳二烯-1,3-二醇(65)、腺嘌呤核苷(66)、羟基苯甲酸(67)、对羟基苯丙酸(68)、熊果酸(69)和对羟基苯甲酸(70)[6,12,15,18,22].Zhang等[23]分离出5种新化合物Hostine A-E(71-75).以上化合物分子结构如图5所示.

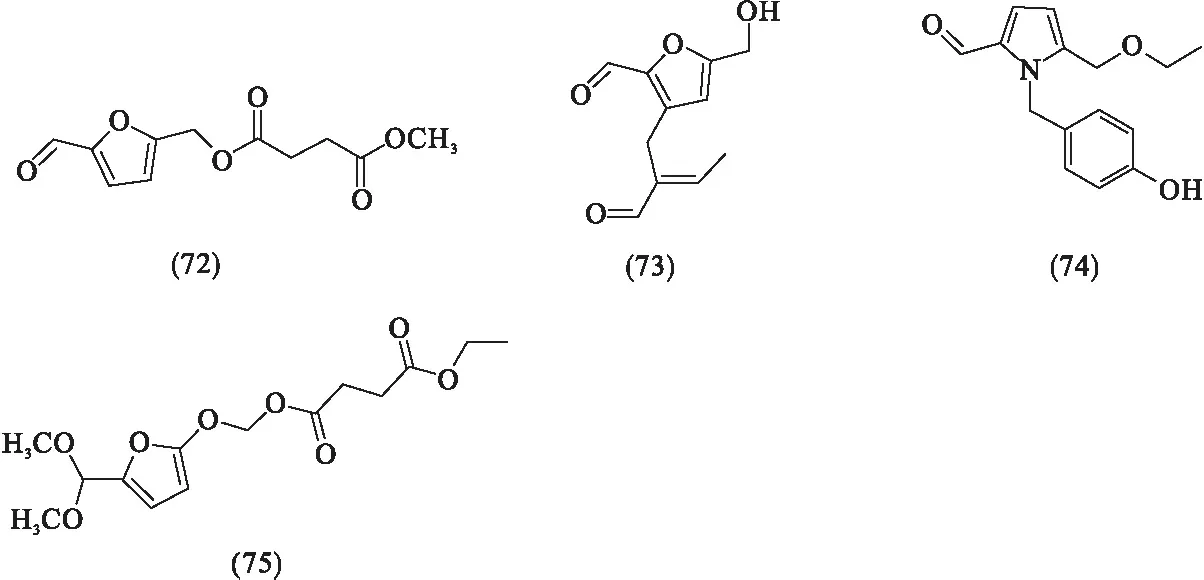
图5 玉簪花中的其他类化合物[6,12,15,18,22-23]
2 药理活性
2.1 抗菌作用
辛颖等[24]分别通过体内药理实验与体外药理实验证明玉簪花提取物具有抑菌药理活性.采用沟槽法和药物琼脂培养法进行体外药理实验时发现,提取物在低浓度1.00 g/mL时,乙型溶血性链球菌与金黄色葡萄球菌的生长均受到抑制.体外抗菌实验结果显示,提取物以0.20 g/kg为最低抑菌浓度,且抑菌活性随着提取物浓度增大呈依赖性增强趋势.
李文媛等[16]以白色念珠菌为实验菌种,氟康唑作为阳性对照药,对化合物(39)、(40)、(41)进行抗菌活性研究,测得化合物(39)、(41)抑菌最适合浓度范围分别为32~64 μg/mL和16~32 μg/mL,化合物(41)以更低的浓度达到显著的抑菌效果,证明了化合物(39)和(41)是玉簪花中呈现抗菌作用的活性成分之一.
对单萜苷类化合物(55)与(56)抗菌活性的研究表明,与链霉素和化合物(56)相比,化合物(55)对金黄色葡萄球菌的抑菌作用更高,说明玉簪花中单萜苷类化合物展现出的抗菌活性,具有作为食品防腐剂的潜力[20].
2.2 抗肿瘤作用
李文媛[16]在对所提取的化合物进行抗菌实验的基础上,又进一步对化合物(39)、(40)、(41)展开细胞毒活性研究.随后,武毛毛等[25]对活性化合物(38)、(39)、(40)和(41)的4种细胞(狗肾细胞MDCK、人慢性髓源性白血病细胞K562、人肝癌细胞株SMMC-7721和小鼠淋巴瘤细胞YAC-1)的生长抑制作用进行补充.结果表明,4种甾体化合物对不同的肿瘤细胞均有不同程度上的抑制作用.其中,化合物(39)虽对肿瘤细胞有较强的生长抑制活性,但其对正常细胞的强效抑制作用限制了临床应用的发展,化合物(38)对正常细胞的抑制活性较弱,但对抑制小鼠淋巴瘤细胞YAC-1呈现很好的活性,可以对其深入研究,进而发展成潜在抗肿瘤药物.
刘接卿等[17]在对已提取的单体化合物作出鉴定后,继续以10-羟基喜树碱、顺铂为阳性对照药,对10种单体化合物的抗肿瘤活性进行体外研究.结果表明,化合物(39)、(40)、(41)、(44)对贴壁实体肿瘤细胞的生长抑制作用要强于悬浮白血病细胞,其抗实体肿瘤活性均强于阳性对照药顺铂和10-羟基喜树碱,其强效的抗肿瘤活性为后期肿瘤疾病的治疗提供了光明前景.
刘鑫[18]对已分离的10种化合物进行体外抗肿瘤活性筛选实验.化合物(46)的给药浓度与肿瘤细胞(人乳腺癌细胞MDA-MB-231)的抑制关系呈正相关.甾体化合物(45)对MDA-MB-231肿瘤细胞的活性抑制率呈剂量依赖性增强.化合物(45)和(47)对人肝癌细胞也具有一定程度的抑制活性.
以上实验结果表明,甾体皂苷类成分是玉簪花产生抗癌活性的主要物质.
2.3 抗炎作用
蒙药《邦占-15味》,又名哈斯哈图古日-15味散,该药以玉簪花为主要原料药,是蒙医常用于治疗咽炎、扁桃体炎的非处方药之一[26].在蒙医用中草药玉簪花治疗咽喉炎的指导下,研究人员对其单独是否具有抗炎药理活性进行探究.吕小满等[27]将70%乙醇的玉簪花提取液用石油醚萃取,将乙醇萃取液浓缩后分别以高剂量(26.4 g/kg)、中剂量(13.2 g/kg)、低剂量(6.6 g/kg)经小鼠口服灌胃,获得对二甲苯导致的耳廓肿胀炎症模型.结果表明,26.4 g/kg(高剂量)的玉簪花提取液的抗炎作用为52.0%,对血管通透性增加和水肿的早期炎症有明显改善.该研究对玉簪花后期化合物单体的抗炎活性研究,以及抗炎机制研究起到了重要的指导意义.
随后,辛颖在确定玉簪花提取液具有抗炎活性的基础上,进一步对其提取液的不同溶剂的萃取液的炎症抑制活性深入研究.辛颖[28]将95%乙醇的玉簪花提取液经石油醚、乙酸乙酯、正丁醇萃取为3部分.其中,乙酸乙酯部位和正丁醇部位对受外界致炎的耳廓肿胀小鼠的急性炎症有显著抑制效果.50%乙醇玉簪花提取液对大鼠炎症模型(耳廓肿胀与棉球肉芽肿)亦有相当程度上的消炎效果[29].何军伟等[30]用50%、65%、80%、95%乙醇提取液的高中低剂量分别对小鼠耳廓肿胀的抗炎作用进行研究,发现80%乙醇提取液的高中低3个剂量组的抗炎作用均强于其他3个浓度的乙醇提取液.选用80%乙醇进行提取可以更好地富集活性成分.
研究人员对黄酮苷(6)、(7)和(8)进行体外抗环氧合酶(COX-1和COX-2)的抗炎活性评估,发现化合物(7)与(8)均表现出显著的环氧合酶抑制活性,且对COX-1的抑制作用大于COX-2,化合物(6)表现出中等的环氧合酶抑制活性[8,17].Zhang等[23]通过检测由脂多糖(LPS)诱导的小鼠细胞中NO释放的抑制作用来研究5种黄酮类化合物的抗炎作用,实验以小白菊内脂为阳性对照药,分别测得小白菊内脂、Hostine C(73)、hostine D(74)、hostine E(75)的IC50值,发现Hostine C(73)、Hostine D(74)和Hostine E(75)具有显著的抗炎活性[23].
由此说明黄酮苷类活性物质是玉簪花发挥抗炎作用的主要物质.
2.4 抗氧化活性
Plantanones A(9)与Plantanones B(10)不仅对COX-1和COX-2表现出显著的抑制作用,而且对DPPH(1,1-二苯基-2-三硝基苯肼)自由基清除的抗氧化作用也呈现出较强的活性[10].首次报道的甲基类化合物Plantanone D(36)通过与阳性对照L-抗坏血酸相比,具有明显的抗氧化活性[15].以上研究可以证明玉簪花抗氧化活性主要来源于黄酮类化合物.
2.5 保肝活性
Wei等[14]对所分离的13种化合物分别测定了CCl4诱导的人L-O2细胞损伤的肝保护活性,发现化合物黄酮-木脂素异二聚体(25)、黄酮-木脂素异二聚体(26)、类黄酮衍生物(30)和类黄酮衍生物(31)表现出适度的肝保护作用.
3 展望
综上,玉簪花作为我国蒙古族传统中草药,其悠久的用药历史是临床用药的坚实基础.由于玉簪花具有多种化学成分,具体发挥疾病治疗的活性成分尚不明确,单体物质的药代动力学研究呈现空白,故无法开发成为针对性明确的单体药物,进而无法有效治疗疾病.后期研究人员应对已分离的化合物深入进行药理机制、药代动力学实验研究,丰富中药单体成分,为临床用药提供更多治疗方法.
