负载酶@ZIF-8复合物的聚合物微颗粒可控制备
2022-04-26张彦汪伟谢锐巨晓洁刘壮褚良银
张彦,汪伟,2,谢锐,2,巨晓洁,2,刘壮,2,褚良银,2
(1 四川大学化学工程学院,四川 成都 610065;2 四川大学高分子材料工程国家重点实验室,四川 成都 610065)
酶具有催化条件温和、催化效率高以及选择性强等特点,在食品加工、医药生产以及工业废水处理等方面均展现出广阔的应用前景。但是,酶分子的空间结构容易受到温度、紫外光等因素的影响,导致酶的活性下降甚至完全失活,这极大限制了酶的应用范围。利用物理吸附、化学结合或者包封的方法将酶负载到固体载体上实现固定化,可有效维持酶的活性、提升其稳定性,有利于其催化反应和回收再利用。如研究者通过将酶固定化到多样化的功能微颗粒上,有效实现了酶催化反应和便捷回收利用。然而,如何在保持酶良好催化特性的同时来实现酶的良好储存性能和环境耐受性,仍然存在着挑战。
金属有机骨架(metal organic-frameworks,MOFs)材料具有比表面积大、孔隙率高、孔径可调等特点,在吸附分离、废水处理、酶固定化等领域具有重要作用。特别是MOFs 材料的微孔结构可对酶分子的空间结构起到良好的保护作用。而在MOFs 材料中,ZIF-8 由于具有合成条件温和、物理化学稳定性好等优点,因而在酶固定化方面具有良好的应用前景。如利用基于仿生物矿化法的酶固定化技术,研究者将脂肪酶、葡萄糖氧化酶和过氧化物酶等封装到ZIF-8的微孔结构中,有效提升了酶的稳定性,拓宽了酶在催化生产、分析检测、药物递送等领域的应用。若能将ZIF-8 材料巧妙耦合到微颗粒中以用于酶的固定化,将可在保持酶良好催化特性的同时实现其良好储存性能和环境耐受性,这对于酶固定化功能微颗粒的发展具有重要意义。
针对上述难题,本文首先利用微流控技术连续可控地制备了含有丙烯酰胺与丙烯酸单体的W/O乳液[图1(a)],以W/O乳液为模板制备了聚丙烯酰胺-共聚-丙烯酸水凝胶(PAM-AA)微颗粒,再由原位仿生物矿法在PAM-AA微颗粒上原位生长负载酶的ZIF-8(酶@ZIF-8)纳米颗粒构建了一种负载酶@ZIF-8 的PAM-AA 微颗粒(酶@ZIF-8/PAM-AA微颗粒)[图1(b)]。基于ZIF-8的微孔结构对酶分子的良好保护作用,该微颗粒可展现出良好的催化活性,同时亦具有良好的储存性能和环境耐受性。该研究工作为设计构建新型酶固定化功能微颗粒提供了一种新模型。
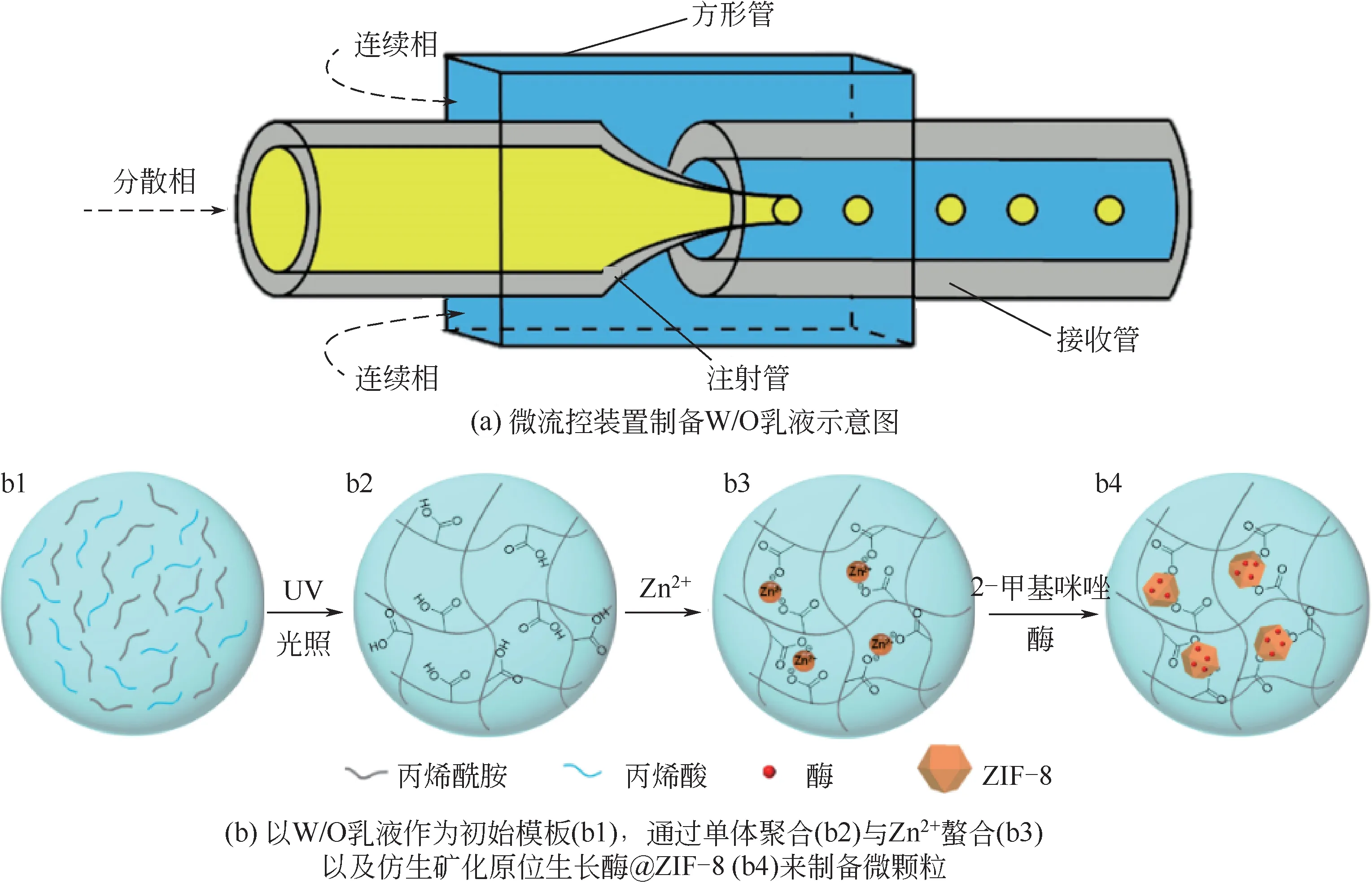
图1 酶@ZIF-8/PAM-AA微颗粒的制备过程示意图
1 材料和方法
1.1 试剂与仪器
丙烯酰胺(AM,分析纯)、丙烯酸(AA,分析纯)、'-亚甲基双丙烯酰胺(BIS,分析纯)、六水合硝酸锌[Zn(NO)·6HO,纯度99%],成都市科龙化工试剂厂;2-羟基-2-甲基苯丙酮(HMPP,分析纯)、正十二烷(纯度98%)、聚异丁烯双丁二酰亚胺(T154)、石油醚(分析纯)、异丙醇(分析纯)、2-甲基咪唑(Hmim,纯度98%)、辣根过氧化物酶(HRP,分析纯)、30%过氧化氢(分析纯)、2,2'-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)(ABTS,分析纯),阿拉丁试剂公司;去离子水(电阻率>18.2MΩ),源自Millopore Elix-10 纯水系统(Millipore 公司)。以上试剂均直接使用。
注射泵(LSP01-2A型),保定兰格恒流泵有限公司;高速摄像机(Phantom MIRO3 型),美国Vision Research公司;工业光学显微镜(BX61型),日本Olympus 公司;体式显微镜(SZX16 型),日本Olympus公司;扫描电子显微镜(SEM,TM3030型),日立高新技术公司;X 射线电子能谱分析仪(XPS,XSAM 800 型),英国曼彻斯特Kratos 公司;紫外光谱仪(UV-2700 型),日本岛津仪器公司;水平拉针仪(P-97),美国Sutter 公司;显微断针仪(MF-830),日本Narishige公司。
1.2 微流控装置的构建
制备PAM-AA微颗粒所用的玻璃毛细管微流控装置结构如图1(a)所示。该单级微流控装置主要由注射管、方形管和接收管三部分组成。其中,方形管为横截面外径为1.4mm、内径为1.0mm的方形玻璃管,而注射管和接收管均是外径为960μmol/L、内径为550μmol/L的圆柱形玻璃管。其中,注射管的一端经过水平拉针仪和显微断针仪加工为锥形,其锥口内径为100μmol/L。将上述方形玻璃管和圆形玻璃管如图1(a)所示组装起来,并使用环氧树脂胶将装置黏合、固定在玻片上,从而构建得到用于制备PAM-AA微颗粒的微流控装置。
1.3 PAM-AA微颗粒的微流控制备
将2g AM、200μL AA、0.1g BIS 以 及60mg HMPP 加入到10mL 去离子水中,并将溶液充分搅拌均匀作为分散相;使用含有1g T154、0.2g HMPP的20g 正十二烷作为连续相。如图1(a)所示,使用注射泵将分散相和连续相溶液分别以20μL/min 和200μL/min 的流速注射进微流控装置相应的玻璃管微通道内,从而使得分散相在注射管锥口处被连续相剪切形成均一的液滴。将液滴接入与连续相组成相同的接收液中,并在紫外光下照射10min,使得液滴中的AM 与AA 聚合形成PAM-AA 水凝胶微颗粒。将制得的微颗粒用石油醚清洗两次,再用异丙醇清洗两次以洗掉其中的正十二烷,最后利用去离子水洗涤两次,从而得到PAM-AA微颗粒。
1.4 HRP@ZIF-8/PAM-AA微颗粒的制备
将上述制备得到的PAM-AA 微颗粒加入到含有0.405g Zn(NO)·6HO、20mg HRP 的4mL 去离子水中,震荡10min,使溶液中的Zn与PAM-AA 的羧基充分螯合。然后,加入20mL Hmim 水溶液(1.25mol/L),并在恒温振荡器(温度设置为10℃)中震荡反应10min。反应完成后,将所得微颗粒用去离子水多次洗涤,并经过滤得到HRP@ZIF-8/PAM-AA 微颗粒。该微颗粒经冻干后置于干燥柜中储存待用。
1.5 乳液及微颗粒的形貌结构和组成表征
利用工业显微镜和体式显微镜对W/O 乳液以及微颗粒的形貌进行观察,并对微颗粒的粒径进行测量,利用式(1)计算乳液以及微颗粒的变异系数()。
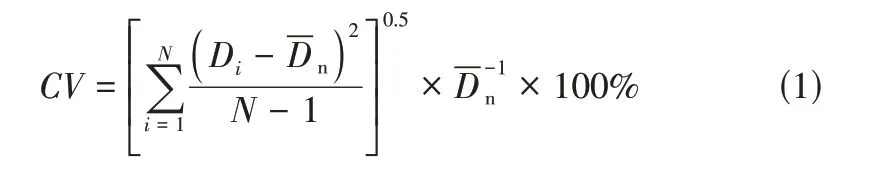

使用SEM 对干燥后的HRP@ZIF-8/PAM-AA 微颗粒表面以及剖面处的微观形貌结构进行观察。利用X 射线光电子能谱仪(XPS) 对干燥后的HRP@ZIF-8/PAM-AA 微颗粒进行元素分析。利用热重分析仪(TGA)测试HRP@ZIF-8/PAM-AA 微颗粒中HRP@ZIF-8 的负载量。称取5~8mg 干燥的HRP@ZIF-8/PAM-AA 微颗粒样品置于坩埚中并放入TGA 进行测试。参数设置为:在氮气氛围下,温度从35℃以10℃/min 的升温速度升高到800℃。在相同的测试条件下测试PAM-AA 微颗粒的质量变化,导出质量变化数据并作出质量变化图,对比两种曲线计算出HRP@ZIF-8的负载量。
1.6 HRP@ZIF-8/PAM-AA微颗粒的催化性能
利用ABTS 显色反应对HRP@ZIF-8/PAM-AA微颗粒的催化活性进行表征。在HRP 的催化作用下,HO可将ABTS 的铵盐转化为阳离子自由基ABTS(显黄绿色)。由于ABTS在415nm 处有强烈的光吸收,因此可利用紫外分光光度计检测反应液在415nm处的吸光度大小来反映溶液中ABTS的浓度,并由此确定HRP的催化效率。取10mg干燥的HRP@ZIF-8/PAM-AA 微颗粒加入到装有4.8mL PBS缓冲液(0.1mol/L,pH=7.4,547μmol/L ABTS)的棕色试剂瓶中,将溶液摇匀使微颗粒均匀分散。将100μL 的NaHPO-KHPO缓 冲 液(0.2mol/L,pH=6.0)以及100μL HO(1%)加入到上述溶液中,并使用紫外分光光度计中测试该溶液在415nm处的吸光度,自反应60s 开始每隔120s 取一个数据点。
在制备得到HRP@ZIF-8/PAM-AA 微颗粒后,每隔24h 取出10mg 样品测试其催化活性,以表征其在常温常压下的储存性能。催化活性的测试方法同上,待反应5min 后利用紫外分光光度计测试反应液在415nm的吸光度。
此外,利用ABTS 显色反应法测试HRP@ZIF-8/PAM-AA 微颗粒的环境耐受性。分别称取10mg HRP@ZIF-8/PAM-AA 微颗粒,均匀分散到装有4.8mL PBS 缓冲液(0.1mol/L,pH=7.4,547μmol/L ABTS)的三个棕色试剂瓶。将三份溶液分别置于80℃恒温水浴槽、UV 光照、胰蛋白酶三种条件下处 理30min 后,分 别 加 入100μL 的NaHPO-KHPO(0.2mol/L,pH=6.0) 缓 冲 液 以 及100μL HO(质量分数1%),反应5min 后检测反应液在415nm处的吸光度。
2 结果与讨论
2.1 HRP@ZIF-8/PAM-AA微颗粒的形貌尺寸
微流控技术可控产生的乳液液滴微具有均一尺寸的特点,这为功能微颗粒的构建提供了良好模板。本实验中,采用了微流控装置可控产生的单分散W/O 乳液液滴作为模板来构建PAM-AA 微颗粒。如图2(a)所示为用于制备该PAM-AA微颗粒的W/O乳液的光学显微镜图片,从图中可以看出,从微流控装置中产生得到的W/O 乳液呈球状,无色透明且大小均一。以该乳液液滴为模板,通过紫外光照引发液滴中的单体AM 和AA 发生聚合,可制备得到尺寸与液滴模板相当的PAM-AA 微颗粒。如图2(b)所示为PAM-AA 微颗粒的光学显微镜图片,从图中可以看出,该微颗粒保持了良好的球形度,且具有均一的尺寸。如图2(c)所示,W/O乳液液滴的平均粒径为468.02μm,值为1.70%,这说明乳液具有良好的单分散性。此外,相较于图2(a)中的W/O乳液,置于水相中的PAM-AA微颗粒粒径明显增大,其平均粒径增加为501.64μm。这是由于凝胶微颗粒内AA的存在使得微颗粒含有大量亲水的羧基,因此使得微颗粒吸水能力增强,最终导致微颗粒更加溶胀、粒径增加。

图2 W/O乳液液滴及PAM-AA微颗粒的光学显微镜图以及粒径分布图
如图3(a)所示HRP@ZIF-8/PAM-AA 微颗粒的光学显微镜图。与图2(b)中未负载HRP@ZIF-8 的空白PAM-AA 微颗粒相比较,负载HRP@ZIF-8 后的HRP@ZIF-8/PAM-AA 微颗粒由无色变为棕色,且透明度降低。这是由于HRP@ZIF-8 纳米颗粒的存在降低了PAM-AA 微颗粒的透明度,说明HRP@ZIF-8 成功地接枝到凝胶微颗粒上。此外,HRP@ZIF-8/PAM-AA 微颗粒的粒径分布如图3(b)所示,从图中可以看出,该微颗粒的粒径呈现出正态分布,其平均粒径为559.97μm、值为2.17%,仍具有良好的单分散性。相比于PAM-AA 微颗粒,HRP@ZIF-8/PAM-AA 微颗粒的粒径增加主要是由于其内部负载填充了HRP@ZIF-8纳米颗粒所致。
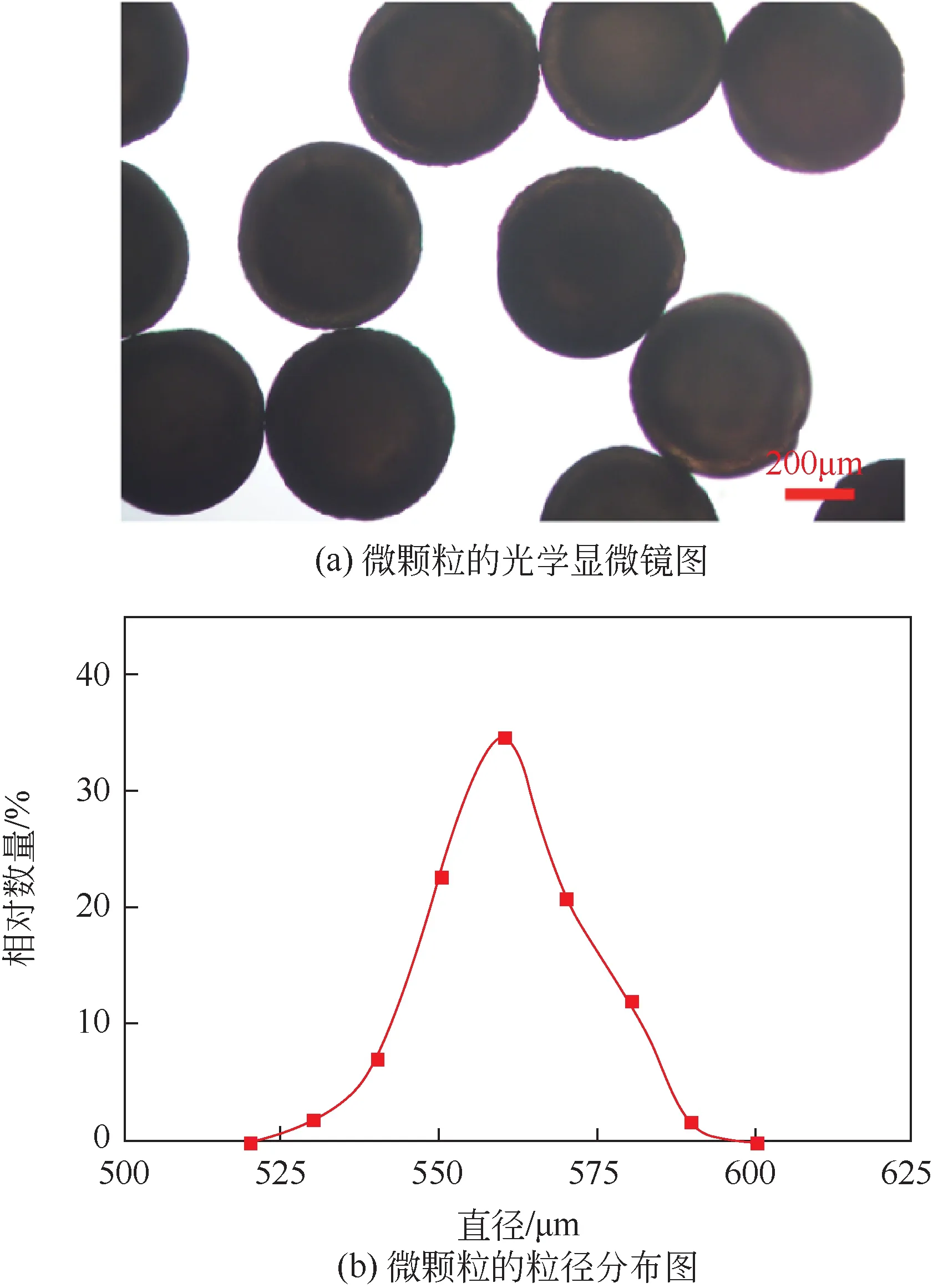
图3 HRP@ZIF-8/PAM-AA微颗粒的光学显微镜图及粒径分布图
2.2 HRP@ZIF-8/PAM-AA 微颗粒的微观结构组成
HRP@ZIF-8/PAM-AA 微颗粒的SEM 形貌表征结果如图4(a)所示。从图中可以观察到HRP@ZIF-8/PAM-AA微颗粒表面为多孔的网络结构,这种多孔网络结构可促进催化过程中反应物质在微颗粒中的传递,有利于HRP@ZIF-8催化反应的顺利进行。此外,该微颗粒呈现出非球形结构,这是由于在液氮中冷冻的过程中冰晶沿着微颗粒内部的生长方向不均匀,因此导致微颗粒形貌改变。图4(b)所示为HRP@ZIF-8/PAM-AA 微颗粒表面的放大结构,从该图中可以看出,由于PAM-AA 凝胶网络上原位生长了HRP@ZIF-8 纳米颗粒,因而使得其表面粗糙度增加。同时,从如图4(c)所示HRP@ZIF-8/PAM-AA 微颗粒断面的SEM 图可看出,微颗粒内部亦呈现多孔网络结构,但从微颗粒剖面处的放大SEM 图[ 图4(d)] 中 可 看 出, 微 颗 粒 内 部 的HRP@ZIF-8 纳米颗粒含量明显降低。该结果说明HRP@ZIF-8纳米颗粒主要负载到了微颗粒的表面,这更有利于HRP@ZIF-8纳米颗粒与底物充分接触,促进催化反应进行。此外,微颗粒在800r/min的转速下经机械搅拌1h 后,仍能保持良好的球形度,这说明微颗粒具有良好的机械强度,能够适用于机械搅拌过程。

图4 HRP@ZIF-8/PAM-AA微颗粒的SEM图
HRP@ZIF-8/PAM-AA 微颗粒的XPS 表征结果如图5 所示。从图5 中可以看出,微颗粒在285.35mV、399.75mV、531.9mV、1022.1mV 以及1045.2mV 有明显的出峰。通过与标准的光电子能谱图相对照分析可知,在285.35mV 处峰为C 1s 的峰,在399.75mV 处峰为N 1s 的峰,在531.9mV 处的为O 1s;而在1022.1mV和1045.2mV出现两个峰分别代表Zn 2p3/2和Zn 2p1/2的峰;两种不同的峰出现是因为微颗粒上存在Zn—N键以及与羧基螯合的Zn,这说明HRP@ZIF-8成功地负载到了PAMAA微颗粒上。

图5 HRP@ZIF-8/PAM-AA微颗粒的XPS分析图
HRP@ZIF-8/PAM-AA 微 颗粒以及PAM-AA 微颗粒的热重分析表征结果如图6所示。在温度小于400℃时,两条曲线几乎重合,其质量的降低主要是由于凝胶网络结构中的水分挥发以及凝胶网络的破坏、热解;而当温度超过400℃之后,微颗粒的质量减缓降低,凝胶结构基本热解完毕。当温度升高至450℃以后,ZIF-8 结构逐渐被破坏、热解,通过计算HRP@ZIF-8/PAM-AA 微颗粒和PAM-AA微颗粒在450℃位置处的质量差即可估算出为微颗粒中HRP@ZIF-8 纳米颗粒的负载量。计算结果表明HRP@ZIF-8 纳米颗粒在微颗粒中的负载量约为14%。
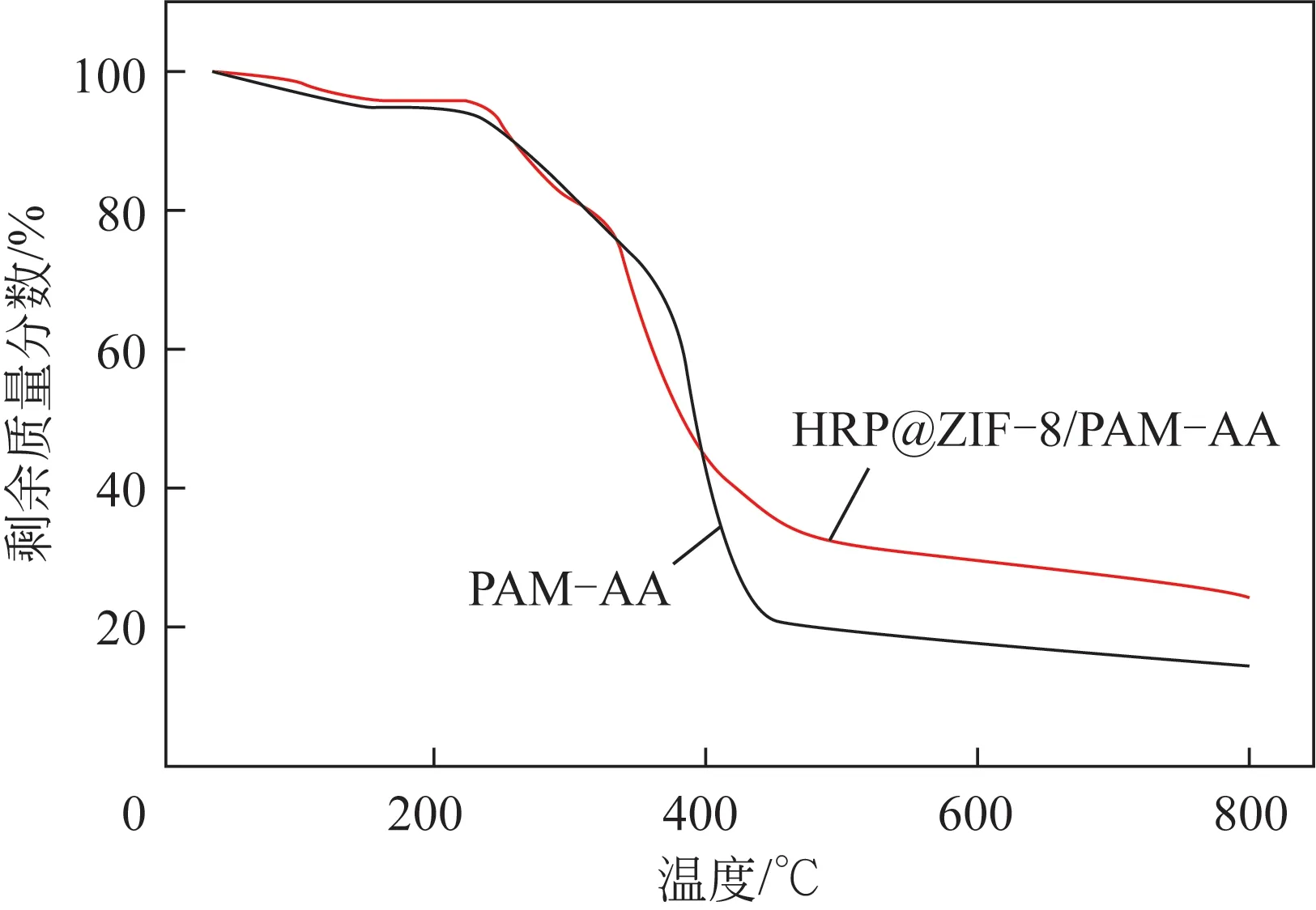
图6 HRP@ZIF-8/PAM-AA微颗粒的热重分析
2.3 HRP@ZIF-8/PAM-AA微颗粒的酶催化活性
如图7 所示为分别含有HRP@ZIF-8/PAM-AA微颗粒以及PAM-AA 微颗粒的反应液在415nm 处的吸光度随时间变化的曲线。从图7 中可以看出,含PAM-AA 微颗粒的反应液在415nm 处的吸光度无明显变化,一直维持在零,说明PAM-AA 微颗粒由于不含HRP@ZIF-8 纳米颗粒而不具备催化性能。相比之下,含HRP@ZIF-8/PAM-AA 微颗粒的反应液在415nm处的吸光度随着时间的增大而呈正比地增加,且拟合优度()为0.9924。这说明HRP@ZIF-8/PAM-AA 微颗粒具有良好的催化性能,能将ABTS 的铵盐转化为了ABTS。此外,通过减小颗粒尺寸可以增大微颗粒的比表面积、减小传质路径,从而通过传质强化进一步提高酶的催化活性和表观反应速率。由于该微颗粒的尺寸主要决定于W/O 乳液液滴的尺寸,因此可利用通过调节微流控装置的微通道尺寸和液相流速等手段来减小W/O乳液液滴的尺寸,从而减小微颗粒的尺寸,进一步提升其催化性能。

图7 含HRP@ZIF-8/PAM-AA微颗粒及PAM-AA微颗粒的反应液在415nm处的吸光度随时间的变化
2.4 HRP@ZIF-8/PAM-AA 微颗粒的储存性能和环境耐受性
如图8(a)所示为HRP@ZIF-8/PAM-AA 微颗粒在常温下的酶相对活性随时间的变化。从图8(a)中可以看出,随着时间由1 天逐渐延长至7 天,HRP@ZIF-8/PAM-AA 微颗粒的酶相对活性基本维持不变。这说明HRP@ZIF-8/PAM-AA 微颗粒中ZIF-8 的微孔结构可以对HRP 起到良好的保护作用,有利于酶的长期保存。如图8(b)所示为HRP@ZIF-8/PAM-AA 微颗粒在不同处理条件下的酶相对活性。从图8(b)中可以看出,相比于常温常压条件下的HRP@ZIF-8/PAM-AA 微颗粒,经80℃处理后的HRP@ZIF-8/PAM-AA 微颗粒仍能保持约75%的活性;同时,分别经过紫外线照射处理或者胰蛋白酶处理后的HRP@ZIF-8/PAM-AA 微颗粒亦可保持75%以上的活性。上述结果说明,ZIF-8的微孔结构可有效地保护HRP,使其能经受热处理、紫外线处理以及胰蛋白酶处理的苛刻处理条件,展现出良好的环境耐受性。这主要是因为,ZIF-8材料的微孔结构对酶分子的空间结构具有“限域”作用,使酶即使在外界条件改变的情况下其具有活性的优势空间结构亦能得到很好的保护,从而提高了酶的稳定性和环境耐受性。
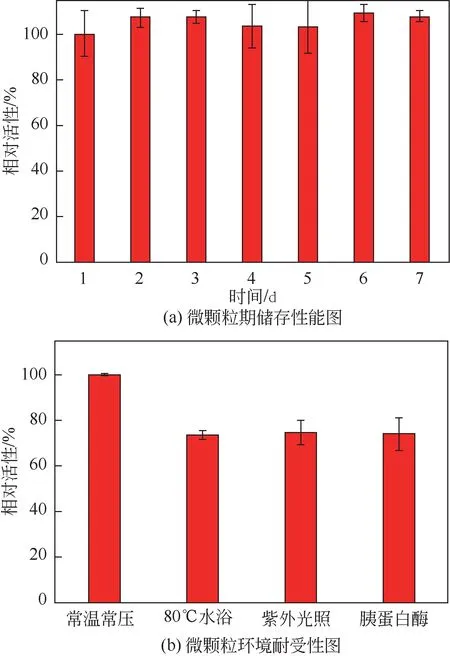
图8 HRP@ZIF-8/PAM-AA微颗粒的储存性能和环境耐受性能
3 结论
综上所述,本文基于微流控法可控制备得到均一PAM-AA 微颗粒,利用仿生物矿化法在该微颗粒的水凝胶网络结构中原位生长酶@ZIF-8 纳米颗粒,成功构建了酶@ZIF-8/PAM-AA 微颗粒。该微颗粒的表面富集有酶@ZIF-8 纳米颗粒,而ZIF-8纳米颗粒的微孔结构可有效保护内部封装的酶,使其在保持良好催化活性的同时,能有效地经受热处理、紫外照射、胰蛋白酶处理等条件的影响,具有良好的储存性能和环境耐受性。该研究工作为新型酶固定化功能微颗粒的设计构建提供了新的策略。
