土壤微生物多样性通过共现网络复杂性表征高寒草甸生态系统多功能性
2022-04-25张君红王健宇孟泽昕董政宏刘凯茜陈文青
张君红,王健宇,孟泽昕,何 佳,董政宏,刘凯茜,陈文青, *
1 西北农林科技大学草业与草原学院,杨凌 712100
2 西安交通大学人居环境与建筑工程学院,西安 710049
3 中华环境保护基金会,北京 100062
生物多样性与生态系统功能(BEF)的关系是当前生态学研究的热点问题[1]。土壤微生物群落是陆地生态系统的重要组成部分,在养分循环、有机物分解和促进植物生长等生态功能方面发挥着重要作用[2—5]。由于土壤微生物不仅具有高度的物种多样性,而且物种间存在复杂的相互作用关系,因此,揭示土壤微生物多样性与生态功能的关系除了关注其物种数量效应外还需进一步考虑微生物间复杂的相互作用关系[5—7]。早期对BEF的研究多侧重于单一生态功能与生物多样性的关系[8—10]。随着研究的深入,人们逐渐认识到较高的生物多样性能显著提高生态系统对多种生态系统功能的支持能力,并将生态系统能够同时维持多种生态系统功能和服务的能力定义为生态系统多功能性(EMF)[9]。相较于单一生态功能的研究,EMF可使生物多样性的多功能冗余减小,并且使多样性的重要性得以体现[11—12],因此EMF能更好地反映BEF关系。
土壤微生物多样性与生态系统功能的关系仍然存在争论[13—16]。虽然相关的原位调查研究[13, 17]和控制实验[14, 18]的研究结果均表明微生物多样性与生态功能存在显著的正相关关系,但也有研究显示两者间存在负相关[15]和无显著关联关系[16]。上述研究均基于微生物多样性中的物种数目与EMF的关系展开,忽视了复杂微生物群落间的相互作用关系在生态系统功能维持中的作用。在自然环境中,微生物通过协同、竞争及拮抗等一系列直接和间接的生态作用相互关联形成微生物网络[7, 19]。该网络是生态系统实现能量流动、物质循环和信息传递基本功能的基础[19—20]。此外,微生物间的相互作用关系受时间和空间尺度的影响,不同尺度上同一共存物种间的关系存在差异[21],相同的共存物种并不代表着相同的种间关系。以往的研究多单独考虑微生物物种多样性对生态系统功能的影响,缺少综合考虑物种多样性和微生物互作网络对EMF影响的研究,因此不能全面反映BEF关系[2, 13, 19]。
微生物共现网络可揭示微生物间复杂的相互作用关系,能反映物种多样性不能反映的生态联系和生态过程[7, 22—23]。当前研究多关注不同生境微生物共现网络的模式或结构特征,微生物网络结构与生态功能间的关系仍缺乏进一步研究[24—27]。Wagg等[19]通过室内微生物多样性控制试验,利用边密度作为微生物网络复杂性指标来表征微生物间复杂的相互作用关系,证实土壤微生物网络复杂性在维持生态系统功能方面发挥着积极作用。这项研究通过不同孔径筛网对天然草地生态系统采集到的土壤过筛,根据微生物个体尺寸差异构建了不同群落复杂性的微生物群落,尽管可在一定程度反映群落复杂性对生态功能的影响,但该方法划分出的群落并不能代表自然环境中的微生物群落,微生物在自然环境中并非根据人为划分的个体尺寸聚集成群落,而是由一系列生物和非生物因子长期共同作用形成群落[19, 28]。因此,本研究采用原位调查试验分析原位生境中微生物网络复杂性与EMF的联系以期深化对微生物BEF关系的认识。
青藏高原是世界海拔最高和面积最大的高原,在涵养水源、调节气候以及土壤有机碳固持等生态功能方面发挥着重要作用[29—31]。青藏高原高寒生态系统对气候变化十分敏感,气候变化会导致微生物多样性丧失,进而对EMF产生不利影响[1]。高寒草甸作为该系统具有代表性的草地生态系统类型,研究该区域土壤微生物多样性和网络复杂性与EMF的关系对全球变化背景下高寒草地生态系统生态功能的维持具有重要意义[1, 32—33]。高寒生态系统中的气候和土壤特性在不同海拔高度上差异较大,环境因子会影响微生物群落组成以及微生物间的相互作用[27, 34—35]。因此,本研究于青藏高原高寒草甸选取了6个海拔高度(3755 m、3994 m、4225 m、4534 m、4900 m、5120 m),分析了微生物多样性和网络复杂性与EMF的联系,进一步揭示该区域微生物多样性与EMF的关系,以期为全球变化背景下高寒草地生态系统生态功能的微生物调控机制提供更全面的见解。
1 材料与方法
1.1 研究区概况
研究区位于西藏自治区米拉山西坡(29°49′59"—29°49′42"N, 91°37′55"—92°20′22"E),海拔3700—5300 m,区域年均温-0.8—5.3℃,年降水量250—640 mm,雨热同期,多集中于生长季(5—9月)。土壤类型以高山草原土、高山草甸土和高山寒冻土为主[36—37]。植被类型以高寒草甸为主,主要有三刺草(Aristidatriseta)、固沙草(Orinusthoroldii)、喜马拉雅草沙蚕(Tripogonhookerianus)、白草(Pennisetumflaccidum)、丝颖针茅(Stipacapillacea)、长芒草(Stipabungeana)等[37—38]。沿海拔高度(3755 m、3994 m、4225 m、4534 m、4900 m和5120 m)选取坡度、坡向一致且无明显的家畜和人为活动干扰,具有代表性的植被和土壤特性的6个50 m×50 m样地。
1.2 样品采集
于2019年8月(该地区植物生物量最大时期),在6个样地内以五层嵌套的四边形取样方式设置20个1 m2(1 m×1 m)样方(图1),样方分别位于四边形的四个角。以单位面积内物种的数量作为植物多样性(Plant richness, PSR)指标。齐地刈割收集地上植物部分,置于105℃烘箱0.5 h杀青后,60℃烘至恒重,称重即得地上生物量。本研究使用植物生物量表征地上净初级生产力(Aboveground net primary production, ANPP)[28]。用土钻采集表层土壤样品(直径5 cm,深度20 cm),每个样方内采集6—7个子样,去除杂质混合均匀后过2 mm土筛,将所得土壤样品分两部分:一部分带回室内冰箱置于4℃储存,用于测定土壤理化性状和部分生态功能指标;另一部分储存于-80℃冰箱,用于微生物分析。

图1 取样示意图
1.3 气候和土壤因子测定
将土壤与水1:2.5混合成悬浊液,使用pH计(UV- 1800, Shimadzu, Japan)测定土壤pH值。采用烘干法测定土壤含水量(Soil moisture, SM),具体操作为称取5 g土壤在105℃烘12 h。取1 g风干土壤,加入20 mL的0.11 mol/L乙酸,先于离心机中以30 rpm离心20 h,后3000 rpm离心20 min,得到土壤可交换阳离子(Na+、K+、Ca2+、Mg2+、Al3+)提取物,随后使用ICP-OES(Spectro Analytical UK, Halesowen, UK)测定其含量[39]。参照Kettler等人[40]的方法测定土壤质地,即砂粒、粉粒和黏粒含量(Sand%, Silt%, Clay%)。具体操作步骤如下:取15 g风干土壤,加入3%的六偏磷酸钠溶液45 mL,于往复式振动筛120 rpm振动2 h,后将土壤悬浮液过0.053 mm筛收集砂粒。将过筛后的土壤溶液充分搅拌,室温下静置2 h,上部悬浮液部分即为黏粒,沉淀部分为粉粒。将收集到的砂粒和粉粒于105℃下烘干至恒重,计算其占原始样品质量的百分比,即为砂粒和粉粒含量,100%减去砂粒和粉粒含量得黏粒含量。通过CHELSA(http://chelsa-climate.org/)在30弧秒(约1 km)分辨率下得到6个海拔的年均温(Mean annual temperature, MAT)和年降水量(Mean annual precipitation, MAP)[41—42]。
1.4 DNA提取、高通量测序及生物信息学分析
每个土样各称取3份0.25 g土壤,按PowerSoil DNA提取试剂盒(MO BIO laboratories, Carlsbad, CA, USA)说明书提取微生物DNA,然后将其合并以减少误差。在1%琼脂糖凝胶上分离和识别DNA提取物,并使用NanoDrop UV-Vis分光光度计(ND- 2000c, NanoDrop Technologies, DE, USA)测定提取DNA的浓度和纯度。使用515F(5′-GTGCCAGCMGCCGCGGTAA- 3′)和806R(5′-GGACTACHVGGGTWTCTAAT- 3′)扩增细菌16S rRNA基因[43],ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA- 3′)和ITS2- 2043R(5′-GCTGCGTTCTT CATCGATGC- 3′)扩增真菌ITS基因[44],并通过上海美吉生物医药有限公司在Illumina MiSeq测序平台对扩增产物进行高通量测序。
按Caporaso等人[45]的方法使用QIIME 1.9.1对序列进行优化和数据质控,具体步骤如下:(i)在50 bp的滑动窗口内,去除序列平均质量小于20,长度小于50 bp和模糊碱基数;(ii)对长度大于10 bp的重复序列进行组装,无法组装则去除;(iii)根据barcode和引物区分样品,并调整序列方向。随后使用UPARSE在97%的相似性阈值下划分分类操作单元(Operational taxonomic units, OTUs)和去嵌合体[46]。基于SILVA数据库(SILVA 132)和UNITE真菌ITS数据库(7.2版),利用RDP分类器对75%相似阈值的OTU进行分类学分析[47—48]。细菌和真菌群落的OTUs分别作为细菌(Bacterial richness, BR)、真菌多样性(Fungal richness, FR)指标。
1.5 生态系统功能测定和生态系统多功能性指数计算
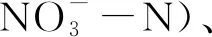
使用平均值法计算EMF指数。首先将上述10种生态功能参数通过(Xraw-Xmin)/(Xmax-Xmin)标准化,再计算平均值即得EMF指数;其中,Xraw代表每个样方的生态功能值,Xmax代表所有样方的最大生态功能值,Xmin代表所有样方的最小生态功能值[5, 52]。
1.6 微生物共现网络构建与分析
由于微生物共现网络模式受扩散限制和环境过滤等某些生态过程影响[55],因此本研究对每个海拔高度20个样方的土壤微生物群落构建综合网络,可最大程度减少上述生态过程对微生物网络的影响。在构建网络之前,移除丰度小于0.015%和单个样地物种出现频率小于5的OTUs。通过计算Spearman相关系数和Jaccard距离,基于随机矩阵理论(Random matrix theory, RMT)方法,确定构建微生物共现网络的阈值[26]。通过Permutation和Bootstrap,迭代1000次获得Spearman相关系数和Jaccard距离的P值。然后使用Brown′s方法合并上述P值[56]。根据Benjamini-Hochberg等人[57]的方法控制False discovery rate(FDR)对P值进行校正,使用FDR校正后具有统计显著性(P<0.05)的关系构建综合网络。使用R语言igraph包和Gephi对网络进行可视化。随后我们使用R语言igraph包的subgraph函数从上述所构建的综合网络中提取每个样方(每个海拔各20个)的子网络(Sub-network),每个子网络由每个样方所包含的OTUs以及OTUs间的关系构成[19, 58]。由于表征网络的复杂性的节点(Node)、边数(Link)、连接性(Connectance)和边密度(Linkage density)存在极显著相关性,因此本研究使用边密度作为真菌(Fungal network complexity, FNC)和细菌网络复杂性(Bacterial network complexity, BNC)指数[19, 25—26, 59],以探究其与EMF的关系。节点为OTU,边为OTUs间的联系,连接性表示网络中节点间实际发生的相互作用数之和(边之和)占总的潜在相互作用数(边数)的比例,边密度由边数除以节点数得到[19, 25—26, 59]。
1.7 统计分析
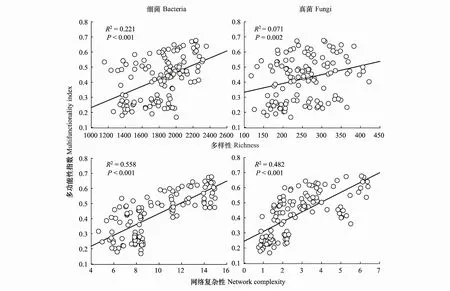
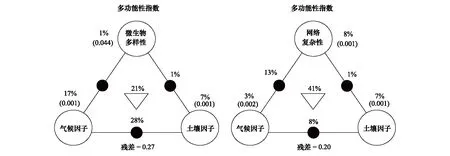
使用单因素方差分析(One-way analysis of variance)和Duncan多重比较检验比较不同海拔高度间环境因子(SM、pH、Na+、K+、Ca2+、Mg2+、Al3+、Clay、Silt、Sand)的变化。采用主成分分析(Principal component analysis, PCA)分别提取土壤Na+、K+、Ca2+、Mg2+和H+、Al3+含量的第一主成分作为代表盐基离子(Soil base mineral cations, SBC)和酸性离子(Soil acid cations, SA)的综合指标,并引入后续的分析,通过提取主成分可减少上述离子间的共线性[60]。使用普通最小二乘法回归(Ordinary least squares linear regressions)分别分析微生物属性(BR、FR、BNC、FNC)与EMF,海拔与微生物属性(BR、FR、BNC、FNC)的关系。使用Pearson相关分析分别筛选出与微生物属性(BR、FR、BNC、FNC)和EMF均显著相关的非生物因子,通过偏线性回归(Partial least squares regression, PLSR)排除上述非生物因子影响,分析微生物属性(BR、FR、BNC、FNC)和EMF指数的关系。将非生物因子对EMF的影响纳入方差分解分析(Variance partition analysis, VPA),评估气候(MAT、MAP)、土壤因子(SM、SBC、SA、Clay、Silt、Sand)、微生物多样性(BR、FR)和微生物网络复杂性(BNC、FNC)对EMF的影响。通过构建结构方程模型(Structural equation model, SEM)进一步分析环境因子(MAT、SM、SBC、SA、Clay)、微生物多样性(BR、FR)、微生物网络复杂性(BNC、FNC)与EMF的直接和间接关系。在进行SEM构建之前,基于先验知识预先设定系统内因子间的关系(表1,图2)。SEM分析的数据均使用R语言的scale函数进行标准化,且通过Pearson相关分析保证所有变量间均存在显著的线性关系(P<0.05),并且不存在多重共线性(r<0.8)。模型拟合度符合以下条件:0.97≤CFI≤1.00;0.95≤GFI≤1.00;0.95≤NFI≤1.00;0≤χ2/df ≤2且0.05 图2 气候、土壤和微生物属性预测生态系统多功能性的结构方程先验模型 在青藏高原高寒草甸地带,不同海拔高度间年均温变幅为-0.8—5.3℃,年均降水量变幅为250—640 mm。土壤K+、Al3+、粉粒和砂粒含量沿海拔高度呈显著升高的趋势(P<0.05),但土壤pH、Ca2+、Mg2+、Na+和黏粒含量沿海拔高度呈显著降低的趋势(P<0.05)(表2)。 表2 气候和土壤因子沿海拔高度的变化 与真菌沿海拔高度变化的共现网络相比,细菌形成了更复杂的共现网络(图3)。细菌和真菌的节点和边沿海拔高度显著减少(P<0.05),而细菌和真菌的连接性、边密度在海拔高度上无显著变化(图3)。随着海拔高度的升高,细菌和真菌的多样性和网络复杂性均呈现显著下降(P<0.05)的趋势,其中细菌多样性和网络复杂性的下降趋势均比真菌明显,细菌和真菌网络复杂性的下降趋势均比多样性明显(图4)。 图3 不同海拔高度微生物的共现网络和网络拓扑结构属性 图4 微生物多样性和网络复杂性与海拔高度的关系 Pearson相关分析显示,MAP、MAT、SM、Clay、SBC和SA均与BR、BNC、FNC和EMF显著相关(P<0.05),其中MAP、SM与其显著负相关(P<0.05),MAT、Clay、SBC、SA与其显著正相关(P<0.05)。此外,Sand与FNC、EMF显著正相关(P<0.05),Clay、SBC与FR、EMF显著正相关(P<0.05)(图5)。 图5 生态系统多功能性指数与环境因子和微生物参数的相关性分析 细菌和真菌的网络复杂性和多样性与生态功能多样性指数均显著正相关(P<0.05),其中细菌和真菌的网络复杂性对EMF的解释度高于多样性(图6)。排除环境因子的影响后,细菌和真菌复杂性与多功能性指数的显著负相关(P<0.001)关系仍然存在,但R2分别从0.558下降至0.185,0.482下降至0.200;而细菌和真菌多样性与生态系统多功能性指数的显著正相关关系(P<0.05)在排除环境因子影响后呈现出不相关关系(图6,图7)。 图6 土壤细菌、真菌网络多样性及复杂性与生态系统多功能性的关系 图7 土壤细菌、真菌网络多样性及复杂性与生态系统多功能性的偏回归分析 VPA分析显示微生物多样性、气候、土壤因子单独作用及其交互作用对EMF的总贡献率达73%,而微生物网络复杂性、气候、土壤因子及其交互作用对EMF的总贡献率可达80%。其中微生物多样性、气候因子和土壤因子分别单独解释了1%、17%和7%的EMF差异,气候和土壤因子的交互作用解释了28%,土壤因子和微生物多样性共同解释了1%,三者共同解释了21%。而微生物网络复杂性、气候因子和土壤因子单独对EMF的贡献率分别为8%、3%和7%,微生物网络复杂性单独贡献率高于多样性;气候和土壤因子共同解释了8%的EMF差异,气候因子和网络复杂性共同解释了13%,土壤因子和网络复杂性共同解释了1%。微生物网络复杂性与环境因子交互作用对EMF的贡献率高于多样性;微生物网络复杂性、气候因子和土壤因子三者共同解释了41%的EMF差异,高于微生物多样性、气候因子和土壤因子三者共同作用。以上结果表明微生物网络复杂性与非生物因子较微生物多样性与非生物因子对EMF的解释度更好(图8)。 图8 微生物参数(微生物多样性和网络复杂性)、气候和土壤因子解释生态系统多功能性变异百分比的方差分解分析 使用SEM进一步分析环境因子、微生物属性和EMF间的作用关系,SEM解释了EMF变化的83%。在考虑年均温、土壤含水量、土壤黏粒含量、土壤盐基离子和酸性离子影响时,细菌和真菌网络复杂性仍直接正向影响EMF;微生物多样性通过正向促进网络复杂性间接影响EMF。年均温、土壤酸性离子和土壤盐基离子环境因子主要通过影响微生物网络复杂性间接影响EMF,其中土壤酸性离子负向影响细菌网络复杂性,土壤盐基离子正向影响网络复杂性,年均温正向影响细菌网络复杂性和真菌网络复杂性。综上,环境因子和微生物多样性对EMF的影响主要通过微生物网络复杂性实现(图9)。 图9 气候、土壤和微生物属性预测生态系统多功能性的结构方程模型 研究表明海拔高度涵盖了降水、温度、土壤理化性质等诸多环境因素的综合效应[33, 82],本研究中年均温、土壤可交换阳离子和土壤质地等环境因素随海拔高度变化,符合上述研究结果。SM随海拔的升高而升高,与张鹏等[83]在藏东横断山区的研究结果一致。这是由于海拔会影响水热分配,高海拔地区土壤温度低,降水和冷凝水多,导致SM随海拔高度的升高而升高[84]。与西藏色拉山[85]的试验结果一致,我们的研究结果表明土壤pH随海拔的升高而下降。土壤的酸化往往促使土壤固相铝转变成交换性Al3+,因此土壤Al3+含量随海拔的升高而升高[86]。此外,本研究中的土壤Ca2+、Mg2+、Na+含量随海拔的升高而下降,其原因可能是随海拔升高而降低的土壤pH改变了土壤酸缓冲体系,使得高海拔主要通过消耗土壤盐基离子发挥酸缓冲作用,导致土壤Ca2+、Mg2+、Na+含量随海拔的升高呈下降趋势[87]。但K+与Ca2+、Mg2+、Na+盐基离子含量的变化趋势相反,这可能是由于K+含量主要受成土母质的影响[88]。本研究区高海拔成土母质为石灰岩风化物,石灰岩母质发育而来的土壤K+含量较高[89],导致高海拔K+含量高。此外,本研究中土壤盐基离子含量呈现Ca2+>Mg2+>K+>Na+,符合一般规律,而且土壤交换性Ca2+在4个盐基离子中占比最大[90]。 环境因子会影响微生物群落组成以及微生物间的相互作用[27, 34—35],本研究结果表明年均温、酸性离子、盐基离子和黏粒含量是微生物多样性和网络结构复杂性的重要环境驱动因子。其中,年均温对微生物多样性和网络复杂性的影响最显著,这可能是由于年均温与微生物的代谢过程和生化过程紧密相关,导致年均温对微生物影响最明显[91]。一项位于高草草原生态系统的原位模拟增温研究发现,增温提高了微生物分类多样性[92]。该研究认为温度是起着决定性作用的环境过滤因子,可对微生物进行选择,例如升温促进碳利用率更高的微生物生长,降低微生物群落演替过程的随机性,使群落发生趋异演替(Divergent succession),从而改变微生物群落结构[92]。酸性离子则可能抑制细胞外酶活性,使得微生物多样性和网络复杂性发生改变[93—94]。对卧龙自然保护区真菌群落的研究和东北地区细菌群落的研究均表明,土壤pH是土壤真菌和细菌群落组成与多样性的重要影响因子[94—95]。随着土壤酸化程度的加剧,土壤固相铝会转变成交换性Al3+,增多的Al3+会抑制胞外酶活性并且对土壤微生物产生生理胁迫,从而改变微生物群落结构[81, 93]。Ca2+和Mg2+的减少则会使微生物对环境胁迫的敏感性增加,使土壤微生物丰度减少[60]。张广帅等[96]对土壤微生物群落结构与环境因子关系的研究也发现,土壤Ca2+和Mg2+对土壤微生物群落结构具有显著性影响。此外,一项关于高寒草甸的观察研究发现,土壤黏粒影响了微生物数量[97]。因此,随着海拔的升高,年均温、盐基离子、酸性离子和土壤质地可能通过调节土壤中微生物的代谢活动或聚集情况,影响微生物多样性和共现网络的形成。 许多微生物多样性的控制试验结果表明多样性与生态功能间呈正相关关系,较高的多样性可为各种时空环境条件下功能的维持提供更大的保障[14, 23, 98—99]。本研究发现,尽管土壤真菌和细菌多样性与EMF存在显著正相关关系,但在排除同时影响微生物多样性和EMF的环境因素后,细菌和真菌多样性与EMF不存在显著相关关系。上述结果表明,自然界中环境因素很大程度上影响了土壤微生物多样性与EMF的联系。自然生态系统具有空间和时间尺度的环境异质性,环境因素会同时影响微生物群落和生态系统功能,进而影响土壤微生物多样性与生态功能的关系,例如,环境因子同时正向或负向影响微生物多样性和生态功能会导致两者出现正向关系,若对两者产生相反的影响则会导致两者出现负向关系[100]。本研究中的年均温、盐基离子和酸性离子均正向影响细菌多样性和EMF,黏粒含量和盐基离子正向影响真菌多样性和EMF,导致细菌和真菌多样性与EMF出现正向关系。此外,本研究通过控制影响微生物复杂性和EMF的环境因子后,发现两者关系不同于微生物多样性与EMF的关系,微生物网络复杂性与EMF关系的显著正相关关系在控制环境因子后仍然存在。一项微生物多样性控制试验结果也表明,网络复杂性与生态系统功能正相关[19]。这可能是由于生态系统生态功能并不是通过物种单独作用维持,而是由不同物种间的相互联系(即互作网络)共同维持[19]。鉴于微生物群落间的关联是生态系统物质循环、能量流动和信息传递等基础功能的基础[19—20],因此,生态系统土壤养分有效性、碳循环和氮循环等诸多生态过程是土壤微生物间相互作用、协同驱动的结果[101]。有研究表明,即使单一生态过程也需要多个微生物类群通过彼此间相互作用共同驱动[101]。例如,异养细菌群落间的相互作用可提高有机碳分解和氮矿化速率[101];纤维素的分解依赖疣微菌门(Verrucomicrobia)、绿弯菌门(Chloroflexi)和浮霉菌门(Planctomycetes)等微生物间的协同作用[102]。由此可见,个体微生物间网络复杂性的提高可能意味着彼此间功能联系的增加,网络复杂性的增加可提高生态系统能量流动和物质循环的效率,进而对EMF产生正向影响[20]。因此,相较于微生物物种多样性,网络复杂性与EMF的联系更加紧密。 SEM结果进一步显示细菌和真菌多样性通过促进相应的网络复杂性间接正向影响EMF。虽然物种多样性并不能直接反映微生物所发挥的生态功能,但较高的物种多样性可以促进微生物网络的复杂程度,进而使得微生物间的生态联系越紧密[19, 103]。综上所述,微生物网络复杂性比物种多样性能更好地预测EMF,较高的微生物物种多样性通过促进网络复杂性维持生态系统功能。 沿青藏高原高寒草甸海拔高度,研究土壤微生物多样性和网络结构复杂性对生态系统多功能性的影响发现:相较于微生物物种多样性,网络复杂性可更好地预测生态系统多功能性;微生物多样性通过促进网络复杂性间接正向影响生态系统多功能性。因此在进行土壤微生物多样性与生态功能关系的研究时,有必要将微生物网络复杂性纳入。本研究的结果扩展了BEF关系的研究,有利于加深对高寒草地生态系统生态功能微生物调控机制的认识。
2 结果与分析
2.1 不同海拔高度环境因子的特征
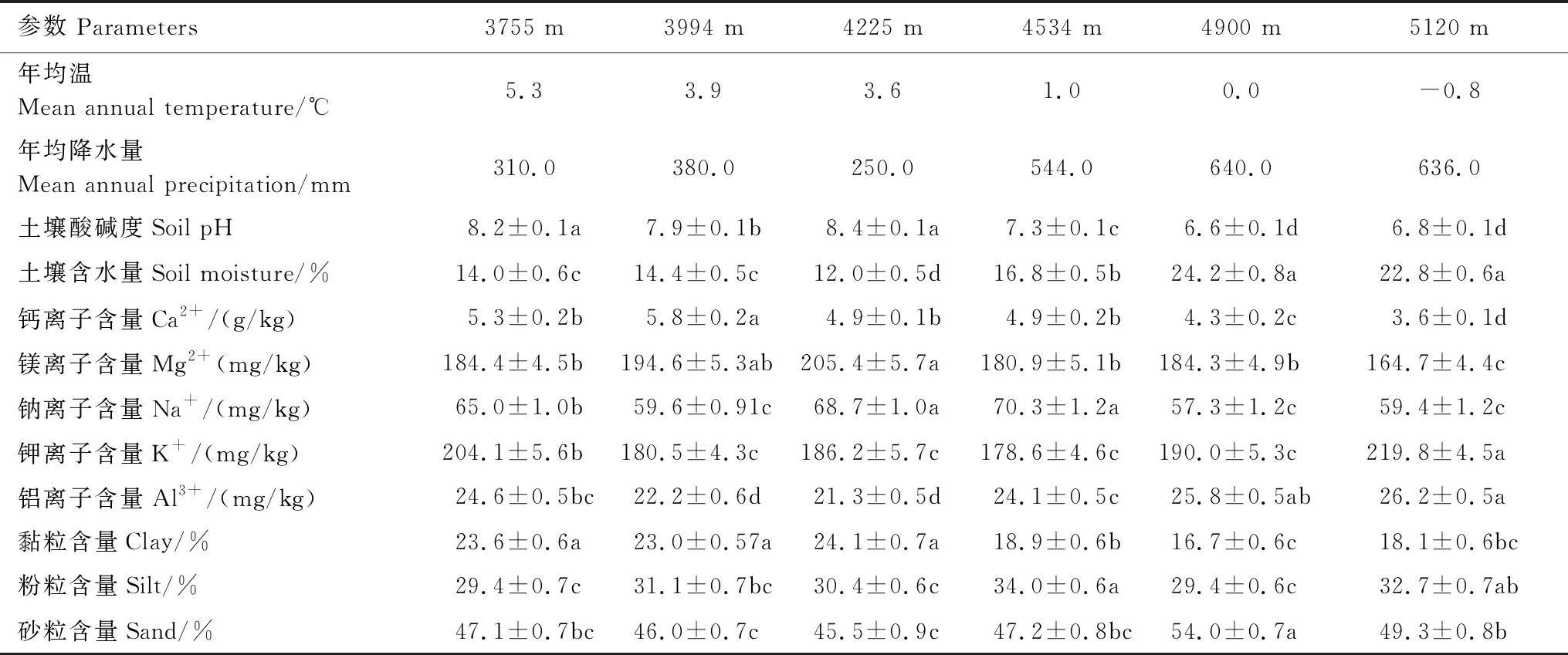
2.2 不同海拔高度微生物共现网络和属性的变化
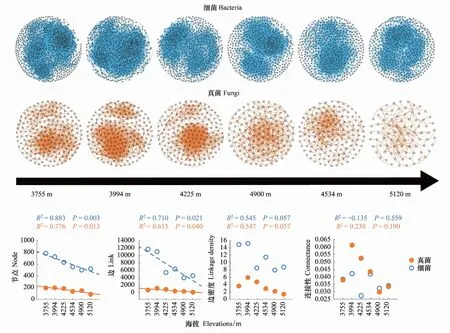
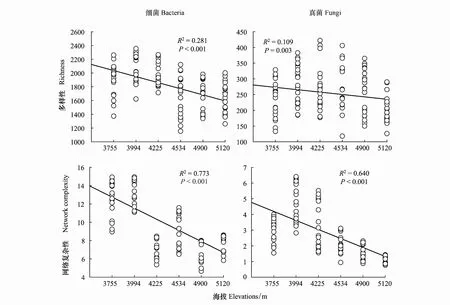
2.3 微生物多样性、网络复杂性与生态系统多功能性的关系


2.4 环境因子和微生物参数对生态系统多功能性的影响

3 讨论
3.1 环境因子随海拔高度的变化
3.2 环境因子对微生物属性的影响
3.3 微生物物种多样性和网络复杂性对生态系统多功能性的影响
4 结论
