犊牛肺源致病性大肠杆菌的分离鉴定及毒力基因检测
2022-04-22伍麦尔麦海提阿吾提买海提夏克热木阿布力孜
伍麦尔·麦海提,阿吾提·买海提,夏克热木·阿布力孜,俞 进
(1. 塔里木大学动物科学学院,新疆阿拉尔 843300;2. 新疆生产建设兵团塔里木动物疫病诊断与防控工程实验室,新疆阿拉尔 843300;3. 阿克苏地区动物疫病控制诊断中心,新疆阿克苏 843000)
肺源致病性大肠杆菌属肠外致病性大肠杆菌 (Extraintestinal pathogenicEscherichia coli,ExPEC)。ExPEC是一类重要的人兽共患病原体,可凭借特有的毒力因子定植于人和动物肠道外器官和组织,进而引发疾病,对畜牧业生产和公共卫生安全造成极大威胁。
2000 年,Russo 等[1]提出将ExPEC 作为所有能够引起肠外疾病的非共生大肠杆菌分离株的统称,并报道了大肠杆菌导致的奶牛乳房炎、子宫内膜炎和犊牛腹泻、尿路感染以及新生儿脑膜炎等疾病,但均与肺部感染无关。近年来,肺源大肠杆菌引发的动物疾病时常发生,如蔡瑶等[2]、王朋[3]分别于患有呼吸系统疾病的猪及林麝的内脏器官中分离得到所对应的肺源性大肠杆菌;顾晓晓[4]在患有类似疾病的犊牛内脏内同样分离出牛的肺源性大肠杆菌。ExPEC间存在基因差异性,包括许多毒力基因编码的毒力因子[5],如黏附类(P、S、I 型菌毛和Curli 菌毛)、侵袭类、毒素类(溶血素、空泡毒素)、摄铁因子类、血清抗性及其他毒力因子。本研究从发生呼吸道感染的犊牛病料组织中分离鉴定得到的ExPEC,并进行毒力基因检测,为该地区牛场呼吸道疾病的诊断与防治提供参考。
1 材料与方法
1.1 试验材料
2021年8月~11月采集自阿克苏地区某规模化牛场因呼吸系统疾病死亡新生牛犊的肺脏、淋巴结、脾脏、心脏、肝脏等器官组织38 份,-80 ℃保存。昆明系小鼠,体重(28±2)g,购自塔里木大学实验站。
1.2 试剂与仪器
主要试剂:麦康凯琼脂培养基、伊红美蓝琼脂培养基、LB液体培养基,均购自北京奥博星生物技术有限公司;微量生化反应管,购自杭州天和微生物制剂有限公司;细菌基因组提取试剂盒,购自北京全式金生物技术有限公司;琼脂糖凝胶DNA 回收试剂盒,购自天根生化科技有限公司;核酸染液gold view,购自上海浩然生物技术有限公司;DL-2000 DNA Marker,购自TaKaRa 公司;2×master PCR Mix,购自广州东盛生物科技有限公司。
主要仪器:超净工作台(上海博讯实业有限公司)、冷冻混合球磨仪(弗尔德仪器设备有限公司)、GHP-9080 恒温培养箱(上海一恒科学仪器有限公司)、ECLIPSE Ci-L显微镜(尼康中国)、漩涡混合器(其林贝尔仪器制造有限公司)、恒温摇床(上海智诚分析仪器制造有限公司)、Eppendorf 5415-离心机(艾本德国际贸易有限公司)、恒温水浴锅(金坛市医疗仪器厂)、PCR仪(Bio-Rad产品有限公司)、电子天平(上海舜宇恒平科学仪器有限公司)、DYY-7C 型稳压稳流电泳仪(北京市六一仪器厂)、伯乐GelDoc Go凝胶成像仪(Bio-Rad产品有限公司)、微波炉、高压锅。
1.3 试验方法
1.3.1 细菌培养与分离
按常规无菌操作,病料剪成1 m³,加1 mL生理盐水研磨。将研磨的组织上清液接种于麦康凯琼脂培养基和伊红美蓝培养基,37 ℃恒温培养箱12~14 h,观察菌落形态。
1.3.2 染色镜检
接种环挑取纯化后的单菌落,于载玻片上均匀涂开,经火焰固定,按照革兰染色和瑞特氏染色步骤涂片处理,油镜下观察。
1.3.3 生化试验
无菌挑取单菌落,吸取2~5 μL单菌落的增菌液,注入鉴定生化管。注入菌落或菌液与生化培养基结合,将生化管开放一侧封住,生化管倒置于恒温培养箱内,37 ℃恒温培养12 h,部分生化试验需培养24~48 h(如葡萄糖磷酸盐蛋白胨生化管);V-P 等部分试验需要在生化管加入大肠杆菌并孵育一段时间后加入部分试剂,产生鉴定反应,培养完成观察其生化试验结果。
1.3.4 分离株16Sr RNA扩增
细菌DNA 提取方法按照说明书操作,提取的DNA于-20 ℃保存。16Sr RNA 通用引物序列参考王尧[6]的引物序列。PCR 扩增程序为:95℃预变性5 min;95 ℃变性30 s;55 ℃退火30 s;72 ℃延伸2 min,35个循环;72 ℃延伸7 min。PCR扩增体系为:DNA模板1 μL;上游引物和下游引物1 μL;EasyTaq Super Mix 12.5 μL,加入ddH2O 补至25 μL。
PCR产物经目的条带切胶回收,送至上海生工生物工程股份有限公司进行测序。测序结果与NCBI/BLAST 工具进行序列比对,确定具体菌属。细菌通用引物序列见表1。

表1 引物序列设计Tab.1 Primer sequence design
1.3.5 动物试验
雌、雄各半的28 只小鼠,随机分为试验组和对照组。试验组每只腹腔注射0.2 mL 浓度1.71×109CFU/mL 的菌液,对照组注射相同剂量的生理盐水,观察小鼠的精神、腹泻、饮食和死亡情况。
1.3.6 毒力基因PCR扩增引物的设计与合成
引物序列参照文献[7-10]设计,PCR 检测ExPEC 的8 个毒力基因,包括ompC、eae、ST、LT、Stx1、hlyF、fyuA、fimC。由上海生工生物工程技术服务有限公司合成,引物序列及其目的条带大小见表2。
所有毒力基因PCR扩增体系为;上游引物和下游引物各0.5 μL,ddH2O 为10.5 μL,Mix 酶12.5 μL,DNA 模板1 μL。PCR 扩增程序为:95 ℃5 min,94 ℃50 s,72 ℃ 60 s,32个循环;72 ℃再延伸10 min。退火温度见表2。

表2 ExPEC毒力因子引物序列Tab.2 ExPEC virulence factor primer sequences
PCR 产物经1%琼脂糖凝胶电泳,切胶回收产物送至上海生工生物工程技术服务有限公司测序。
1.3.7 小鼠器官病理组织学观察剖检观察试验组和对照组小鼠的病理变化,小鼠死后迅速取出所需组织,避免因挤压细胞使其受到损伤,按常规方法制作石蜡切片,HE染色,显微镜观察病变。
2 结果与分析
2.1 细菌培养结果(见图1)
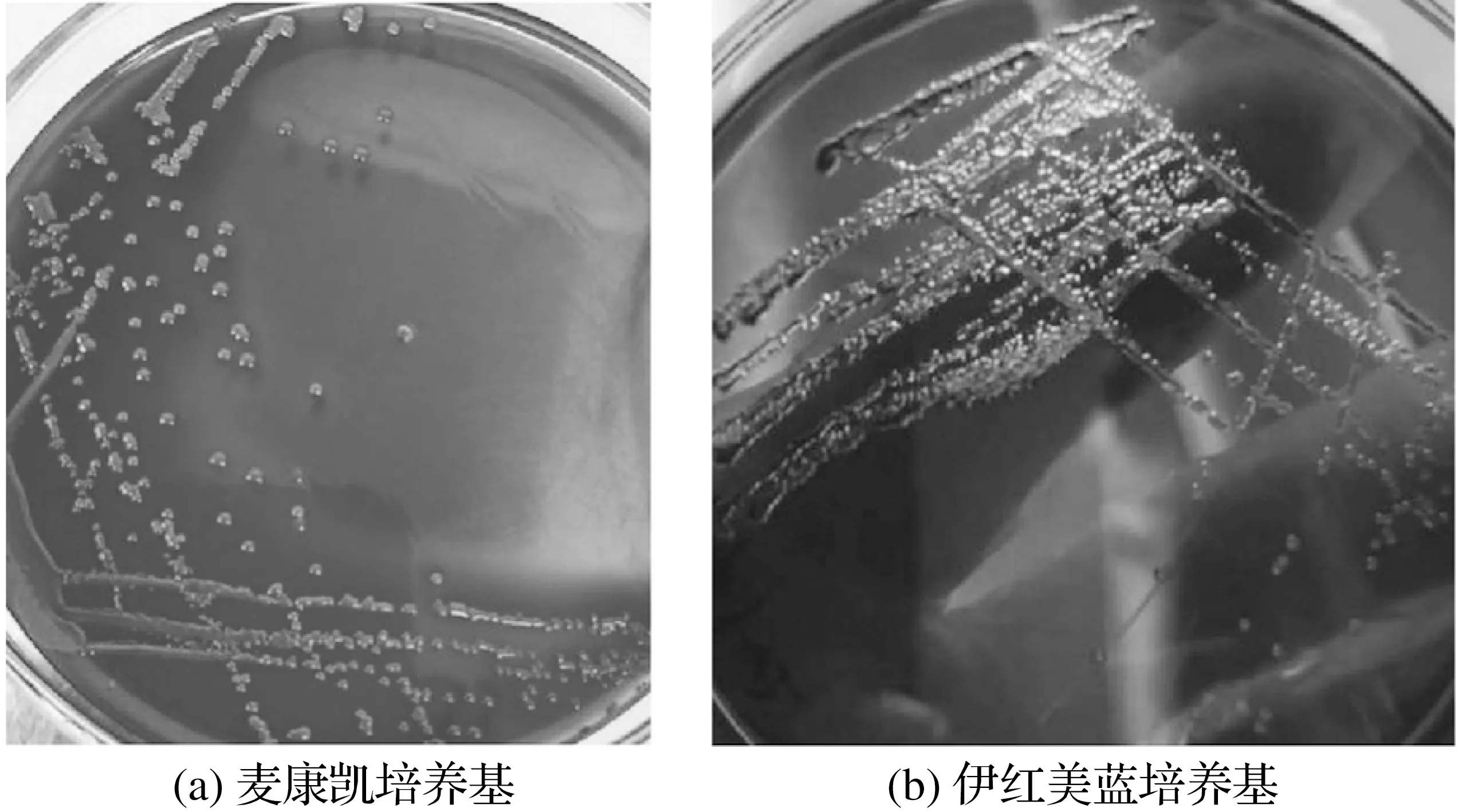
图1 分离菌株菌落形态Fig.1 Colony morphology of isolated strains
由图1可知,该菌在麦康凯琼脂培养基上形成粉红色、边缘整齐、表面光滑湿润的菌落;在伊红美蓝琼脂上产生黑色带金属光泽的菌落。
该菌对培养基的营养要求很低,普通培养基上,37 ℃条件下24 h内生长情况良好。判断该菌为兼性厌氧菌。
2.2 染色镜检结果(见表2)
由表2 可知,显微镜下分离菌株为革兰阴性菌,呈粗短,无芽孢,两端钝圆的中等大小杆菌。瑞特氏染色可见微荚膜和两端深染的菌体。

图2 分离菌株染色镜检结果Fig.2 Microscopic examination results of staining for isolated strains
2.3 生化鉴定结果(见表3)

表3 生化鉴定结果Tab.3 Biochemical identification results
由表3可知,分离菌硫化氢、枸橼酸盐、VP等试验结果均为阴性,反应过程无变色;棉籽糖、山梨醇、侧金盏花醇和木糖等试验中均由蓝紫色变成黄色,结果为阳性;在蛋白胨水培养基中呈红色,结果为阳性。参照《伯杰细菌鉴定手册》,分离菌株与ExPEC的生化反应特点基本一致。
2.4 小鼠致病性试验结果(见图3)

图3 小鼠致病性试验结果Fig.3 Pathogenicity test results in mice
试验组小鼠接种携带不同毒力基因肠外致病性大肠杆菌后,先后表现不同程度的精神沉郁、昏睡、蜷缩、呼吸急促、无腹泻、眼睛分泌物较多和无法站立等临床症状,12~36 h内小鼠全部死亡。对照组小鼠在观察期内正常饮食,未出现明显临床症状及死亡情况。
对照组小鼠肺为粉红色,质轻柔软,富有弹性,表面平滑,试验组小鼠剖检病变是肺充血、出血、淤血、手摸不弹性;对照组小鼠肝脏呈暗红色,试验组小鼠肝脏肿大发黑,胸腔积液浑浊,小肠和其他器官无明显病理变化。试验组剖检小鼠的肺脏、肝脏等组织处,均能够分离得到形态一致的菌落,对其进行革兰染色和瑞特氏染色镜检,生化鉴定比对结果显示,分离出的感染菌在外部形态、生理生化特性和初始分离得到的感染菌为同一种菌。
2.5 分离株16S rRNA分子生物学鉴定结果(见图4)

图4 分离株16S rRNA分子生物学鉴定结果Fig.4 Molecular biological identification results of 16S rRNA isolates
由图4可知,疑似ExPEC的临床分离菌株PCR扩增目的条带均为1 500 bp左右,与此次引物扩增目的条带相符。将与目的条带相符的部分PCR 产物送至上海生工生物工程股份有限公司进行测序,与NCBI数据库进行比对;结果显示,分离株与大肠杆菌相似度高于99%,符合判定标准。
2.6 分离株毒力基因扩增检测结果(见图5)
本试验所检出的38 株大肠杆菌中26 株携带毒力基因。由图5 可知,分离菌携带ompC(1 236 bp)、fyuA(774 bp)、hlyF(599 bp)、fimC(497 bp)等4种毒力基因,未检出eae、LT、ST、Stx1等毒力基因。毒力基因的携带情况结果显示,毒力基因hlyF的携带率最高,为46.15%;毒力基因fimC、fyuA和ompC携带率依次为38.46%、34.61%和11.53%,其余毒力基因携带率均为0。

图5 分离株毒力基因扩增检测结果Fig.5 Virulence gene amplification test results of isolat es
2.7 病理学观察结果(见图6)

图6 病理组织切片结果Fig.6 Result of pathological tissue sections
由图6可知,试验组小鼠肺脏肺泡壁界限不清,组织切片可见明显的充血和淤血,肝脏可见出血和淤血,其他器官无变化;对照组小鼠肺脏和肝脏均未见明显的病变。
3 讨论
本研究中采用细菌形态学鉴定和分子生物学鉴定方法,根据致病性大肠杆菌的病原学特征对分离株进行初步鉴定,为减少假阳性现象出现,使用选择性培养基麦康凯、伊红美蓝琼脂培养基筛选ExPEC,并通过染色镜检鉴定分离菌为革兰阴性菌。对分离菌进行生化试验,结果显示,分离菌大部分符合ExPEC 典型生化特征;通过16S rRNA PCR 扩增,将所得的序列与NCBI 比对,结果显示,分离株与NCBI中ExPEC 16S rRNA的同源性超过99%。因此,鉴定分离株为肺源致病性大肠杆菌。据文献报道,16S rRNA序列的同源性大于97%即可认定为同一种[11];结合本试验鉴定结果,可将该分离菌株鉴定为ExPEC。
本研究使用8种毒力基因特异性引物进行PCR扩增,经1%琼脂糖凝胶电泳,结果显示,分离菌携带ompC、fyuA、hlyF、fimC等4种毒力基因,并扩增出相应大小的目的片段;未检测出eae、LT、ST、stx1等毒力基因。毒力基因hlyF的携带率最高,为46.15%;fimC、fyuA和ompC的检出率分别为38.46%、34.61%和11.53%。邓显佑[12]采用LT、ST毒力基因检测贵州矮马腹泻,而本试验未检测出LT、ST毒力基因。有研究显示,毒力基因hlyF在动物群体中分布广泛,且在肠道外的大肠杆菌感染中较为常见[13]。也有研究发现,在肠道分离得到的大肠杆菌也携带此种毒力基因,但有关其致病性强度的报道较少[14]。顾晓晓[4]对新疆部分地区牛和绵羊的脏器病料中分离的132 株ExPEC 进行25 种毒力基因的检测,结果显示,毒力基因ompC检出率较高。而本试验ompC毒力基因检出率为11.53%。有研究者认为,从动物肠道以外的脏器中分离到的大肠杆菌均可判定为ExPEC,也有人提出可根据大肠杆菌携带的特定毒力基因种类和数量初步确定是否为ExPEC[15]。马增军等[16]在猪源ExPEC中检测出ler、iutA、irp2、fyuA、astA等5种基因,其中iutA和fyuA检出率最高;结果表明,同时携带iutA、fyuA和ler基因的菌株更易引起动物患病,对机体危害严重。本研究与上述报道的ExPEC 毒力基因携带率的毒力因子具有差异性,但同样携带fyuA基因,此类毒力基因可能导致犊牛死亡。
4 结论
近年来,随着我国养殖业的迅速发展,疆内部分地区ExPEC引起动物发病的报告越来越多,但南疆地区该菌株的研究和防控尚未引起养殖企业的足够重视,所需数据及建议仍非常稀少,文献资料严重缺乏。本试验通过对已确定为牛肺源致病性大肠杆菌的菌株进行毒力基因检测和小鼠致病性试验,进一步明确该病原菌的致病性和流行病学规律,以期为该地区牛场呼吸道疾病的诊断与防治提供参考。
