铁皮石斛镰刀菌根腐病病原菌的鉴定及其对链霉菌发酵液的敏感性分析
2022-04-22张祥丽曹瑱艳杨怡华申屠旭萍俞晓平
张祥丽,曹瑱艳,杨怡华,宋 阳,申屠旭萍,俞晓平
(中国计量大学生命科学学院/浙江省生物计量及检验检疫技术重点实验室,杭州 310018)
铁皮石斛Dendrobiumofficinale是一种多年生的附生草本植物,被誉为“九大仙草之首”,属兰科石斛属[1]。铁皮石斛具保健功能和治疗效果且药用历史悠久,因在抗肿瘤降血糖、促进消化、降血压血脂和增强免疫系统等[2]诸多作用中都具有独特功效,而享有“药中黄金”的美称,是传统的名贵中草药材。铁皮石斛生长偏好温湿气候和半阴环境,因此病虫害发生率高。自20世纪80年代以来,由于人们过度采挖野生铁皮石斛,使本就珍贵的野生资源几近枯竭,因此铁皮石斛的集约化生产成为大势所趋。
截至2019年,我国铁皮石斛产量达到3.1万吨,浙江省是我国铁皮石斛道地药材的主产区,在20世纪90年代基本实现了铁皮石斛人工栽培的规模化发展,近年来全省栽植面积增至约2800公顷,铁皮石斛产量已达7900吨,年产值为45亿元[3]。金华市武义县是浙江省乃至全国的铁皮石斛主要生产地。2011年,寿仙谷牌“武义铁皮石斛”被列入国家地理标志登记保护名单,目前其种植面积占全省的10%以上。该地区铁皮石斛的人工栽培主要以工厂化大棚栽培为主,虽然已取得一定经验,但目前人工种植方面依旧面临诸多难题。其中,由于要满足铁皮石斛特殊的生长习性,要对其培育条件加以严格控制。而温暖湿润阴凉的环境亦是病害滋生的温床,加之铁皮石斛叶茂茎嫩,营养价值高,易吸引病虫侵袭,有些种植基地空气不流通、过于潮湿,就会导致病虫害的逐年加重。
浙产铁皮石斛害病种类多而杂,常见病害有黑斑病、炭疽病、疫病、轮斑病、白绢病、锈病、根腐病等 12种,虽然目前对于浙产铁皮石斛病害的防治已经取得了一些成果,但是由于相关研究还处于刚起步阶段,因此存在诸多不足,如病害发生规律不明晰、缺乏病原菌系统鉴定、防治技术单一落后等。目前国内对于铁皮石斛病害,已有与疫病、茎腐病、黑斑病、炭疽病病原菌鉴定和防治有关的报道[4,5],但对于铁皮石斛根腐病菌依旧限于病原菌鉴定方面,且相关报道极少,病害防控技术主要基于大田作业的经验积累,缺乏科学研究的指导。
根腐病主要由立枯丝核菌Rhizoctoniasolani、镰孢属Fusarium等真菌引起,镰刀菌作为根腐病的主要致病菌(包括尖孢镰刀菌F.oxysporum、茄病镰孢菌F.solani、层出镰刀菌F.proliferatum、黄色镰刀菌F.culmorum、燕麦镰刀菌F.avenaceum、接骨木镰刀菌F.sambucium等)[6-10],因其生态适应性广,侵染能力强,在任何生育期都能感染致病,严重危害铁皮石斛的培育,造成大量减产,其引发的根腐病病害发生特点为根部腐烂,初期根尖、根茎出现水渍状的褐色斑痕,并由病害处向四周扩展,病情蔓延至茎叶,最严重时可致植株死亡[11]。种植基地根腐病的肆虐对铁皮石斛的质量和产量造成了严重影响,但是因种植区域、栽培模式和气候环境及管理等方面的差异,病害发生情况不尽相同,其病原菌的优势种群也存在差异。为进一步确认武义铁皮石斛根腐病致病菌群的具体特点,本研究将对前期从武义寿仙谷铁皮石斛种植基地采集的病株中分离纯化获得并经科赫法则验证的根腐病病原菌镰刀菌进一步进行形态学和分子序列鉴定,明确其分类地位,筛选对该病原菌具有较强抑制作用的杀菌剂并用于田间防治,旨在明确浙江省金华市武义县铁皮石斛根腐病的病原菌并为其有效防治提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 病原真菌 为本课题组前期从武义寿仙谷铁皮石斛种植基地采集的病株中分离纯化获得并经科赫法则验证的根腐病病原菌,初步鉴定为镰刀菌(编号GF-14)[12]。
1.1.2 培养基 葡萄糖酵母矿物质(Glucose yeast extract mineral,GYM)培养基:10 g麦芽提取物,4 g葡萄糖,4 g酵母提取物,2 g NaCl,1 g酶解酪蛋白,600 μL OB 溶液(5 g CuSO4·5H2O,7.5 g FeSO4·7H2O,5 g MgSO4·7H2O,3.6 g MnSO4·7H2O,9 g ZnSO4·7H2O,35 g CuCl2·2H2O,1 L 蒸馏水),1 L 蒸馏水,pH调至7.0;马铃薯葡萄糖琼脂(Potato dextrose agar,PDA)培养基:200 g马铃薯,20 g葡萄糖,20 g琼脂,1 L 蒸馏水,pH 调至 7.0;合成低营养琼脂(Synthetic low nutrient agar,SNA)培养基:1 g KH2PO4,1 g KNO3,0.5 g MgSO4·7H2O,0.5 g KCl,0.2 g葡萄糖,0.2 g蔗糖,20 g琼脂粉,1 L蒸馏水,pH调至7.0;康乃馨叶片琼脂(Carnation-leaf agar,CLA)培养基:6~8 mm2康乃馨叶片(处理:烘干并紫外灭菌过夜),20 g琼脂粉,1 L蒸馏水,pH调至7.0;丰加霉素液体发酵培养基:3 g NH4NO3,5 g CaCO3,5 g (NH4)2SO4,10 g MgSO4·7H2O,10 g麸皮,15 g玉米粉,20 g黄豆粉,1 L蒸馏水,pH调至7.0;木霉素液体发酵培养基:0.001 g ZnSO4·7H2O,0.01 g NH4Cl,1 g牛肉浸膏,5 g蛋白胨,20 g葡萄糖,1 L蒸馏水,pH调至7.0。
1.1.3 引物 本研究中所用引物[12,13]如表1所示。

表1 本试验中所用的引物序列Table 1 Primers used in this study
1.1.4 杀菌剂 淀粉酶产色链霉菌1628发酵液母液:淀粉酶产色链霉菌1628于丰加霉素液体发酵培养基中以28 ℃、180 r/min振荡培养7 d后用4层纱布过滤,所得的上清液即为1628发酵液母液[14],经HPLC方法测定,该发酵液中主要含有4种代谢产物,其中丰加霉素浓度为178.32 mg/L、四霉素A浓度为186.72 mg/L、四霉素P浓度为502.13 mg/L、四烯霉素B浓度为48.07 mg/L[15];脐孢木霉菌Trichodermabrevicompactum0248发酵液母液:脐孢木霉菌0248于木霉素液体发酵培养基中以28 ℃、180 r/min振荡培养5 d后用4层纱布过滤,所得的上清液即为0248发酵液母液[16],经GC方法测定,该发酵液中主要代谢产物为木霉素,含量稳定在138.80 mg/L左右[17](其中淀粉酶产色链霉菌1628和脐孢木霉菌0248均保存于浙江省生物计量及检验检疫技术重点实验室);96%宁南霉素原药:购自天津阿尔塔科技有限公司;76%井冈霉素可湿性粉剂:购自上海阿拉丁生化科技股份有限公司;50%多菌灵可湿性粉剂:购自四川国光农化股份有限公司。
1.1.5 仪器设备 GZX-9140-MBE烘干箱、恒温培养箱(上海博迅实业有限公司医疗设备厂),SW-CJ-1F单人双面超净工作台(浙江苏净净化设备有限公司),T100 PCR仪、Sub-Cell GT核酸电泳仪、Gel Doc XR凝胶成像仪(美国Bio-Rad公司),YS100显微镜(日本Nikon公司)。
1.2 方法
1.2.1 病原真菌的分子鉴定 采用CTAB法[18]提取DNA作为PCR模板,以表1中引物(ITS1/ITS4、EF1/EF2、Fa/G2R、5f2/7cr)进行 PCR 扩增。PCR 体系(50 μL)如下:10×Buffer(Mg2+plus)4 μL、10 mol/L dNTP 1 μL、10 μmol/L 正、反向引物各 0.5 μL、2 U/μLTaqpolymerase 0.8 μL、DNA 模板 150~200 ng、ddH2O 补至 50 μL。PCR 程序设置为:94 ℃预变性 2 min;94 ℃变性 45 s,55 ℃~62 ℃退火 30 s,72 ℃延伸 0.5~2 min,35个循环;最后72 ℃延伸10 min。经1.0%琼脂糖凝胶电泳后回收片段,并送测序。引物合成和测序均由上海桑尼生物科技公司完成。测序结果于镰刀菌属数据库(http://fusariumdb.org/)进行同源序列比对,并使用软件Clustal X和MEGA 7.0.26构建系统发育树。
1.2.2 病原真菌的形态学鉴定 将斜面保菌的致病菌株(GF-14)菌丝切成直径为5 mm的菌块接种于PDA平板中央,25 ℃、黑暗环境下培养7 d,观察菌落大小、形态、菌丝质地以及色素产生情况;同时将GF-14菌块以相同方式接种于SNA平板上,20 ℃、黑暗环境下培养14 d,直接在SNA平板上观察产孢细胞的形态;将新鲜的康乃馨叶片剪成6~8 mm2的片状置于直径为90 mm的灭菌培养皿中,将叶片烘干去除水分,然后将平皿打开置于超净工作台,紫外杀菌过夜。取10片处理后的康乃馨叶片置于冷却的CLA平板上,25 ℃光暗交替培养14 d,挑取菌丝至玻片,400×显微镜下观察分生孢子的形态和隔膜数量等。随机选择30个大、小孢型分生孢子在光学显微镜下测定其大小,具体参考《真菌鉴定手册》[19]、《镰刀菌属》[20]及近期相关文献进行形态鉴定。
1.2.3 抑菌活性测定 按1.1.4中方法分别制备菌株1628和菌株0248发酵液母液,并将粉剂(96%宁南霉素原药、76%井冈霉素可湿性粉剂)与无菌水按质量比1:1制成液体药剂待用。配制PDA培养基经121 ℃、15 min高温灭菌待降温至50 ℃~60 ℃,将4种供试杀菌剂与PDA培养基按体积比1:9分别制成含10% 1628发酵液、10% 0248发酵液、9.6%宁南霉素、7.6%井冈霉素的含药平板,按体积比1:99分别制成含1% 1628发酵液、1% 0248发酵液、0.96%宁南霉素、0.76%井冈霉素的含药平板,接种铁皮石斛病原菌GF-14菌饼(直径为5 mm)于PDA含药平板中央,28 ℃恒温培养5 d后,采用十字交叉法测量菌落直径,每组设置3个重复,取平均值计算抑制率,对照组为无菌水处理。抑制率(%)=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100。
1.2.4 平板对峙培养 将供试菌株淀粉酶产色链霉菌1628以平板划线法接种于GYM平板,供试病原菌菌株GF-14以同样方法接种于PDA平板,在28 ℃、黑暗条件下培养3 d。以菌饼接种法接种以上两株菌株5 mm直径菌块于PDA平板上,其中病原菌GF-14接种于平板中央,链霉菌1628以距平板中心3 cm的边缘处选取4个点进行接种,28 ℃黑暗条件培养5 d,采用十字交叉法测量菌落直径,每组设置3个平行重复,取平均值计算抑制率,对照组为仅接种病原菌GF-14和仅接种链霉菌1628的PDA平板。菌丝生长抑制率(%)=(对照培养菌落半径-对峙培养菌落半径)/(对照培养菌落半径-菌饼直径)×100。
1.2.5 田间防效测定 试验地点为杭州市中国计量大学微型农田,试验用田面积约16 m2。于2019年10月采集武义寿仙谷铁皮石斛种植的“仙斛1号”一年生健康组培苗,当天带回随即进行栽培,2020年8月份进入发病期,对发病症状进行记录,统计病情指数。根据发病严重程度分为4级:0级,健康苗;1级,低于25%的叶片枯死;2级,26%~50%的叶片枯死;3级,51%~75%的叶片枯死;4级,76%~100%的叶片枯死[21]。选取对病原菌GF-14菌丝生长抑制效果明显的杀菌剂用于铁皮石斛根腐病病发期的田间防效试验,以淀粉酶产色链霉菌1628的发酵液未稀释时为100%的1628发酵液,采用100%和50%的1628发酵液作为田间防效测定的供试药剂,于7 d统计发病情况。其中铁皮石斛根腐病田间试验区分为:阴性对照区(施用清水)、阳性对照区(施用50%杀菌灵)、1628发酵液处理1区(施用100% 1628发酵液)、1628发酵液处理2区(施用50% 1628发酵液),采用手动压力式喷雾器于整株植物均匀喷洒各供试药剂,喷洒量为500 kg/hm2,每个分区样本量为 30株。由于施药前分区间病情指数各不相同,防效计算以每分区本区块施药前的发病情况为基础。病情指数和防效计算:病情指数=∑(各级病株数×对应各级代表数值)/(调查总株数×发病最高级的代表数值)×100,校正防效(%)=100×[1-(处理药后病情指数×对照药前病情指数)/(处理药前病情指数×对照药后病情指数)][22]。
1.3 数据统计与分析
采用SPSS软件对各供试药剂对病原菌菌丝生长及田间生防作用数据进行单因素方差分析,采用T-test进行差异显著性分析。
2 结果与分析
2.1 铁皮石斛根腐病病原真菌的分子生物学鉴定
以病原菌GF-14基因组DNA为模板,使用ITS1/ITS4、EF1/EF2、Fa/G2R和5f2/7cr引物分别对内部转录间隔区ITS、翻译延伸因子TEF-1α、RNA聚合酶最大亚基RPB1和RNA聚合酶第二大亚基RPB2基因进行扩增,分别得到500 bp片段(图1a)、730 bp片段(图1b)、1800 bp片段(图1c)、1000 bp片段(图1d),经胶回收后送生物公司测序,测序结果上传NCBI网站,登录号分别为rDNA-ITS(MW172977)、TEF-1α(MW172978)、RPB1(MW172979)和RPB2(MW172980)。BLASTN分析结果显示,该菌与变红-木贼镰刀菌复合种群F.incarnatum-equisetispecies complex(即为FIESC)同源性最高,其rDNA-ITS基因与FIESC 15-a(NRRL43619)同源性为99.8%、TEF-1α基因与FIESC 16-c(NRRL34059)同源性为100%、RPB1基因与FIESC 15-a(NRRL32864)同源性为99.74%、RPB2基因与FIESC 15-a(NRRL32175)同源性为98.63%(图2)。

图1 4对镰刀菌特异性引物ITS1/ITS4、EF1/EF2、Fa/G2R和5f2/7cr的PCR扩增结果Fig.1 Results of PCR amplifications with four specific primer pairs (ITS1/ITS4, EF1/EF2, Fa/G2R and 5f2/7cr)
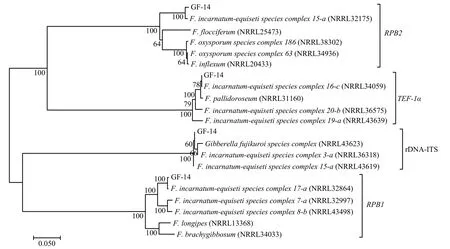
图2 基于rDNA-ITS、TEF-1α、RPB1、RPB2序列构建GF-14相似菌株的系统发育树Fig.2 Phylogenetic tree of GF-14 based on rDNA-ITS, TEF-1α, RPB1, RPB2 sequences
2.2 铁皮石斛根腐病病原真菌的形态学鉴定
致病菌株GF-14在PDA培养基上气生菌丝密集发达、略有发散,呈棉絮状;在25 ℃、黑暗条件下培养,平均菌丝生长速度为每天15.2~18.5 mm,3 d后长满90 mm直径平板。初期菌丝呈圆形扩散,正面为白色至淡奶油色,背面中部菌核处为褐色,后期平板正面呈不规则状并有深黄色菌丝斑块(图3G-I)。显微镜下可见产孢结构和分生孢子:分生孢子呈假头状分布在产孢细胞顶部(图 3A),瓶梗型产孢细胞在菌丝上侧生,多有3~5个分枝(图3B,C)。大型分生孢子为镰刀形,顶端渐尖稍弯曲,3~6个分隔,大小为(18.0~32.0)μm×(3.0~5.0)μm(图3D,E);小型分生孢子为纺锤形、卵形,2~3个分隔,大小为(7.0~10.0)μm×(2.1~3.0)μm(图 3F)。根据菌落形态特征、产孢结构、大分生孢子和小分生孢子的形态特征,结合分子学鉴定的结果,将致病菌株GF-14鉴定为变红-木贼镰刀菌复合种群[23,24]。

图3 菌株GF-14的形态Fig.3 Morphology of strain GF-14
2.3 铁皮石斛根腐病病原菌对供试杀菌剂的敏感性
10%的1628发酵液对菌株GF-14的抑制作用最强,菌丝生长抑制率为98.22%,而1%的1628发酵液对菌株GF-14的抑制率仅为55.58%。脐孢木霉菌0248的发酵液对菌株GF-14的菌丝抑制效果较差,10%和1%的0248发酵液对菌株GF-14的菌丝抑制率分别为28.89%和11.11%。而宁南霉素、井冈霉素不论是高浓度还是低浓度处理对GF-14均无明显抑制作用(表2)。试验结果表明,淀粉酶产色链霉菌1628发酵液对GF-14具有较强抑制作用。

表2 供试杀菌剂对铁皮石斛根腐病致病菌菌丝生长的影响Table 2 Effects of fungicides on the hyphae growth of root rot pathogen of D.officinale
2.4 平板对峙试验
淀粉酶产色链霉菌1628与铁皮石斛根腐病菌GF-14在PDA平板上对峙培养5 d后,病菌GF-14的菌落前缘在靠近链霉菌 1628方向的生长受到抑制,菌丝呈明显抑制状态(图 4),经测定计算,菌丝生长抑制率为32.65%。

图4 淀粉酶产色链霉菌1628与铁皮石斛根腐病原菌GF-14的对峙培养(5 d)Fig.4 The confrontation(5 d) culture of S.diastatochramogenes 1628 and GF-14 (5 d)
2.5 田间防效测定结果
100%的1628发酵液对铁皮石斛根腐病病株的防效在施药第7 d时最高,为34.90%,显著高于50%的1628发酵液处理;50%浓度的多菌灵是目前田间使用最常用的剂量,其田间防效在施药第7 d达30.68%,与100%的1628发酵液在施药第7 d时的田间防效无显著性差异,表明1628发酵液可以取代50%多菌灵作为防治铁皮石斛根腐病的新型杀菌剂(表3)。

表3 供试杀菌剂对铁皮石斛的田间防效Table 3 Control effects of fungicides on D.officinale
3 讨论
ITS序列是位于rDNA中18S和5.8S之间(ITS1)以及5.8S和26S之间(ITS2)的非编码转录间隔区,其间隔序列短,利于进行PCR扩增,是广泛应用于真菌分类中的标记序列,但ITS作为rDNA中的中度保守区,进化速度相对较快,在某些真菌中间隔区差异性较小,不适合属内种的鉴定。为了解决这一问题,其他可作为分类标记的基因也被应用于镰刀菌的分类鉴定,包括翻译延伸因子α亚基基因TEF-Iα、RNA聚合酶基因RPB1、RPB2和β-微管蛋白基因Tub等[25,26]。为了更准确地鉴定病原菌GF-14的分类地位,本研究结合病原菌内多个非连锁基因rDNA-ITS、TEF-Iα、RPB1和RPB2的比对分析和形态鉴定的结果,将其鉴定为变红-木贼镰刀菌复合种群。本研究中的分子鉴定涉及的系谱系统发育种类鉴别技术(Genealogical concordance phylogenetic species recognition,GCPSR)使结果更为准确可靠,并为之后的镰刀菌菌种鉴定提供新思路。
除了对病原菌进行分类鉴定外,本研究继续对其在不同杀菌剂作用下表现的敏感性进行了测定。农用抗生素是一种由微生物产生的、能抑制或杀灭植物病原菌的生物农药,也称微生物农药,以其安全高效、可降解性、环境污染小等特点受到广泛关注,并成为未来农药发展的一个重要方向。在将生防菌用于作物的土传病害、开发新型农用抗生素方面,我国已取得诸多成果[27]。根腐病是作物的常见病害之一,由真菌引起的根腐病达到其病害发生率的70%以上[28,29],镰刀菌是主要致病菌之一,严重威胁着农作物产量和质量。目前,采用微生物源农药对根腐病进行防治也取得诸多成效,Saad等[30]发现从木棉树和榕树的根际微生物中分离得到的植物促生菌其混合菌株可有效抑制蚕豆根腐病的病情指数,使其降低了32.4%~57.4%,杨瑞先等[31]使用解淀粉芽胞杆菌Bacillusamyloliquefaciensmd8和md9合成的伊枯草菌素类物质可有效抑制牡丹根腐病原菌的菌丝生长,卢志军等[32]通过平板培养法发现枯草芽胞杆菌B.subtilisHL29对苜蓿根腐病镰刀菌抑制率能达到72.79%~81.09%。
针对铁皮石斛根腐病的相关报道主要集中于对致病真菌的分离鉴定及生物学特性分析上,对防治用药方法的比较分析却少之又少。浙江省的铁皮石斛种植具有区域性强、用药水平不均的特点,因此经常由于滥用、误用农药致使农药残留而影响药材质量安全[33]。淀粉酶产色链霉菌1628是本课题组前期从浙江天目山采集的土样中分离鉴定得到的一株生防放线菌,经研究发现其产生的代谢产物对多种植物病原真菌具有较强的抑制作用[34-36]。通过分析比较不同杀菌剂对铁皮石斛根腐病病原菌的防治效果,发现 1628发酵液能高效抑制病原菌GF-14菌丝的生长,10%的1628发酵液对病原菌的抑制率高达98.22%,显著高于脐孢木霉菌 0248发酵液的抑制效果,而宁南霉素、井冈霉素(均为市面可购最高纯度产品)则显示无抑制效果。在淀粉酶产色链霉菌1628与石斛根腐病菌GF-14的平板对峙试验中,病原菌GF-14菌丝生长状态受到菌株1628的抑制率为32.65%,菌株1628对病原菌GF-14有一定防治效果。此外,在后续田间防效测定时1628发酵液原液与50%多菌灵防效无显著差异,说明菌株1628代谢产物可以取代多菌灵发挥作用。多菌灵虽然在我国的使用范围广泛,但其对哺乳动物的毒害作用不可忽视,而 1628代谢产物作为更环保安全的新型抑菌剂,为后续铁皮石斛根腐病的防治开辟了新途径,提供了可靠的理论依据。
