木薯炭疽病拮抗木霉菌筛选与室内防效研究
2022-04-22张静雅李欣雨王伟伟侯巨梅
张静雅,李欣雨,张 成,王伟伟,张 鹏,侯巨梅,刘 铜,∗
(1.海南大学植物保护学院/热带农林生物灾害绿色防控教育部重点实验室,海口 570228;2.海南省绿色农用生物制剂创制工程研究中心(海南大学),海口 570228)
木薯ManihotesculentaCrantz为大戟科木薯属植物,是非洲、亚洲、美洲和拉丁美洲、热带和亚热带地区数百万人的主要粮食作物[1]。随着经济的增长和能源缺口的不断加大,木薯作为一种粮食作物和能源材料,其种植面积在不断地扩大[2]。然而,在我国广西、广东、海南等木薯主产区,炭疽病发生普遍[3],成为木薯产业发展的限制因素之一。木薯炭疽病由Colletotrichumgloeosporioidesf.sp.manihotisHenn(Penz)Sacc侵染引起[4],主要危害木薯茎部、叶片和果实,常在多雨季节发生[5],严重影响木薯产量和品质。目前,对木薯炭疽病的防治主要以化学防治为主[6],然而长期使用化学农药会导致病原菌出现抗药性以及农药残留、环境污染等问题。因此,筛选和使用高效、无残留的生物菌剂进行防治尤为重要。
木霉菌Trichodermaspp.适应性广、生长繁殖能力强,在自然界各种生态环境中广泛分布[7]。它可以产生多种拮抗病原物物质、细胞壁降解酶类和促生因子。因此,木霉菌作为重要的生防菌,被广泛应用于农业生产中[8]。木霉菌对炭疽病的防治已有较多报道。如棘孢木霉GYSW-6m1对草莓炭疽菌LC0220具有较强的竞争、抗生和重寄生作用,同时对草莓幼苗也表现出较好的促生作用[9];长枝木霉SMF2孢子悬浮液喷施和灌根处理葫芦,可以显著降低葫芦炭疽病的发生[10],利用哈茨木霉GZ-5可以有效地防治菩提树炭疽病[11],但目前应用于防治木薯炭疽病的木霉菌鲜有报道。因此,本研究拟从木薯根际土壤分离获得的木霉菌中,筛选出对木薯炭疽病菌具有较强拮抗作用的菌株,进行室内防效测定,以期开发为防治该病害的生防菌剂。
1 材料与方法
1.1 供试材料与培养基
木薯炭疽病病叶从海南省儋州木薯种质资源圃采集;15株木霉菌分离自木薯根际土壤样品,由海南省绿色农用生物制剂创制工程研究中心提供;用于室内致病性检测和防效的木薯叶片为华南9号品种。
PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂20 g,蒸馏水定容至1 L;PSA培养基:马铃薯200 g,蔗糖20 g,琼脂20 g,蒸馏水定容至1 L;CMA培养基:玉米粉25 g,琼脂20 g,蒸馏水定容至1 L;OA培养基:燕麦粉60 g,琼脂15 g,蒸馏水定容至1 L;CMD培养基:玉米粉50 g,葡萄糖10 g,琼脂18 g,蒸馏水定容至1 L;SNA培养基:KH2PO41.0 g,KCl 0.5 g,KNO31.0 g,MgSO4.7H2O 0.5 g,葡萄糖0.2 g,蔗糖0.2 g,琼脂18 g,蒸馏水定容至1 L。
1.2 病原菌的分离、致病性分析及鉴定
从海南儋州木薯种质资源圃选择新鲜、病斑清晰的木薯病叶,利用手术剪刀在病健交界处剪取约0.5 cm×0.5 cm病叶组织,采用组织分离法[12]进行病原菌分离。待病斑周围长出菌丝后,挑取菌丝转接于新鲜的 PDA平板上,采用单孢分离法[13]对病原菌进行纯化。将纯化的菌株接种于新鲜木薯叶片进行致病性检测,根据柯赫氏法则,等叶片发病后与自然发病叶片症状进行比较,重新分离病原菌,与原接种菌进行比较分析。病原菌的鉴定采用形态学和分子鉴定的方法相结合进行。将病原菌接于 PSA、PDA、CMA和OA培养基上进行菌落形态和颜色特征观察,收集在PDA培养基上产生的分生孢子,进行分生孢子形态观察。采用CTAB法[14]提取病原菌DNA,参考林春花[15]报道的引物序列,分别扩增rDNA-ITS、GAPDH、ACT、CHS-1和TUB2基因序列,将PCR产物回收后克隆进行测序,序列提交GenBank中进行比对,手动修正错误序列后,下载相似性高的菌株及模式菌的相关序列,用ClustalX软件进行比对后,将不同序列拼接在一起,利用MEGA 7.0进行多基因联合系统发育树的构建,通过自展法(Bootstrap)进行检验,设置1000次重复,进行病原菌的分子鉴定。
1.3 对峙培养
拮抗木薯炭疽病菌的木霉菌筛选参照赵玳琳等[9]方法。分别将15株木霉菌与木薯炭疽菌进行平板对峙培养,即取5 mm菌饼接种于直径为90 mm的培养皿两端,两菌饼相距5 cm。以只接木薯炭疽病菌的平板作为对照,每个处理3次重复。放置于28 ℃培养,并于接种后3、5、7 d测量菌落半径,计算抑制率。抑制率(%)=(对照组半径-处理组半径)/对照组半径×100。
1.4 木霉菌挥发性物质对炭疽病菌的抑制作用
将木霉菌LG004-52、ZJB3-12和LS073-23的菌饼(5mm)接种于PDA培养基中间,于28 ℃培养2 d后,将木薯炭疽病菌接种于另一个 PDA培养基中间,然后将与接种木霉菌株的培养皿对扣以灭菌玻璃纸隔开,避免菌丝和孢子干扰。以空白培养基与炭疽病菌对扣为对照,每个处理设置3次重复,培养3、5、7 d后测量病原菌菌落直径,计算抑制率。抑制率(%)=(对照组直径-处理组直径)/对照组直径×100。
1.5 木霉菌发酵液对炭疽病菌的抑制作用
将木霉菌LG004-52、ZJB3-12和LS073-23菌饼(5 mm)转接含150 mL PD培养基的250 mL锥形瓶中,于28 ℃、180 r/min培养7 d后用灭菌滤纸过滤,将滤液用0.22 μm过滤膜除菌2次后即为无菌发酵液。取无菌发酵液与PDA培养基按1:1比例混合倒平板,待其冷却后,将木薯炭疽病菌转接培养基中央,分别于3、5和7 d测量菌落直径,计算抑制率。
1.6 木霉菌的鉴定
1.6.1 木霉菌形态学鉴定 将木霉菌分别转接于PDA、SNA和CMD培养基上,参考木霉菌种群分类系统以及《真菌鉴定手册》[16-19],根据菌株在SNA培养基上培养72 h时菌落形态、分生孢子梗、瓶梗以及分生孢子的特征对木霉菌进行形态学鉴定。
1.6.2 木霉菌分子鉴定 采用CTAB法提取木霉菌基因组DNA[20],利用引物rpb2-5f(5′-GAYGAYMGW GATCAYTTYGG-3′)和 rpb2-7cr(5′-CCCATRGCTTGYTTRCCCAT-3′),扩增rpb2 基因序列。PCR 反应体系(25 μL):2×GreenTaqMix 12.5 μL、10 μmol/L 上下游引物各 0.5 μL,模板 DNA 1 μL,ddH2O 10.5 μL。反应程序:95 ℃预变性10 min;95 ℃变性1 min,59 ℃退火90 s,72 ℃延伸90 s,35个循环;72 ℃延伸10 min。利用DNA纯化回收试剂盒(天根生化科技)回收PCR产物,连接到pBM16A载体(北京博迈德基因技术有限公司),挑选阳性克隆送往生工生物工程(上海)股份有限公司测序。将序列提交 NCBI数据库进行比对,下载相似性高的菌株序列,采用MEGA 7.0构建系统发育树,进行木霉菌分子鉴定。
1.7 室内防效试验
制备木霉菌孢子悬浮液(5×106孢子/mL),将孢子悬浮液均匀喷施在大小一致的木薯叶片上,以喷施无菌水为对照,每个处理20片叶片。待叶片晾干后,用无菌针刺伤叶片并在伤口上放置一个直径为5 mm的木薯炭疽病菌菌块,每片叶子中央接种1个菌块,保湿培养4 d后,将发病木薯叶片和标尺一起拍照,使用软件IMAGE J(Wayne Rasband,National Institute of Health,USA)按照图片中标尺大小设定尺度,测量病斑面积,计算抑制率。抑制率(%)=(对照组面积-处理组面积)/对照组面积×100。
1.8 数据统计与分析
利用Excel 2010软件进行数据统计分析,SPSS 25对抑菌率数据进行差异显著性分析。
2 结果与分析
2.1 木薯炭疽病菌分离与鉴定
通过组织分离法和致病性检测,获得3株疑似炭疽病菌的分离物(DZT-1,DZT-2和DZT-3)(图1A,B),将其中菌株DZT-1转接于PSA、PDA、CMA和OA培养基上进行形态学观察,其菌落为圆形,边缘齐整(图1C);病菌在PDA和PSA培养基上气生菌丝旺盛,产孢时呈现黑褐色,但产孢时间不规律(图1C);分生孢子呈圆柱形,有1个隔,无色;附着孢无色,圆柱形(图1D、E);其形态特征与蔡吉苗[21]描述的胶孢炭疽菌形态一致,因此推测可能为胶孢炭疽菌。

图1 菌株DZT-1致病性检测与形态学鉴定Fig.1 Pathogenicity test and morphological identification of strain DZT-1
通过扩增克隆获得该菌rDNA-ITS(登录号:MZ373236)、基因GAPDH(登录号:MZ403777)、ACT(登录号:MZ403778)、CHS-1(登录号:MZ403779)和TUB2(登录号:MZ403780)片段序列,将序列按ITS-GAPDH-ACT-CHS-1-TUB2的顺序分别首尾相连,以NJ法构建菌株的多基因系统发育树(图2)结果显示,菌株DZT-1与胶孢炭疽菌C.gloeosporioidesCORCG4和IMI356878聚类同一支,表明DZT-1可能为胶孢炭疽菌。因此,通过形态学和分子生物学的鉴定,该病原菌被鉴定为胶孢炭疽菌。
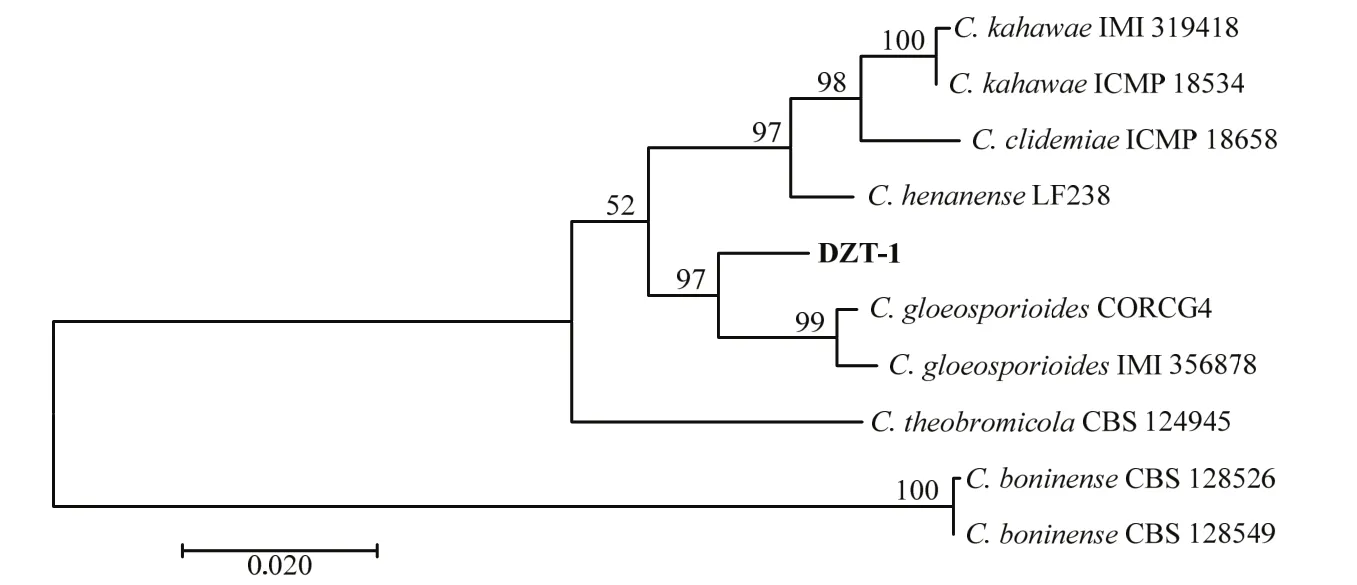
图2 基于ITS、GAPDH、ACT、CHS-1和TUB2基因序列联合构建的多基因系统发育树Fig.2 A polygenic phylogenetic tree was constructed based on ITS, GAPDH, ACT, CHS-1 and TUB2 gene sequences
2.2 对峙培养
通过平板对峙试验,15株供试木霉菌株对木薯炭疽病菌DZT-1均表现一定抑制作用(表1,图3),其中菌株LG004-52、ZJB3-12和LS073-23培养7 d时,对胶孢炭疽病菌DZT-1的抑制率分别为82.69%、82.69%和83.45%,均高于其他菌株(P<0.05),表明这3株木霉具有对木薯胶孢炭疽菌具有较强的拮抗作用,并进一步开展抑菌和室内防效试验。

图3 不同木霉菌株与木薯胶孢炭疽菌DZT-1的对峙培养Fig.3 Confrontation culture of different Trichoderma strains against C.gloeosporioides DZT-1

表1 15株木霉菌对木薯胶孢炭疽菌的抑制作用Table 1 Inhibitory effect of 15 Trichoderma strains isolates against C.gloeosporioides
2.3 木霉菌挥发性物质的抑菌作用
通过挥发性物质的拮抗试验,木霉菌株LG004-52对炭疽菌DZT-1的抑制率显著高于菌株LS073-23和ZJB3-12;但随着培养时间延长,3株木霉菌株的抑制率差异不显著(表2,图4)。木霉菌株ZJB3-12产生的挥发性代谢产物在前期抑制炭疽菌气生菌丝生长,DZT-1菌饼周围出现圆形空洞(图4)。
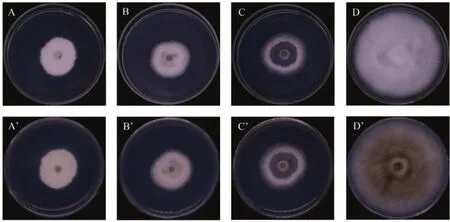
图4 3株木霉菌挥发性物质对木薯胶孢炭疽菌的抑制作用Fig.4 Inhibition of volatile substances of 3 Trichoderma strains against C.gloeosporioides
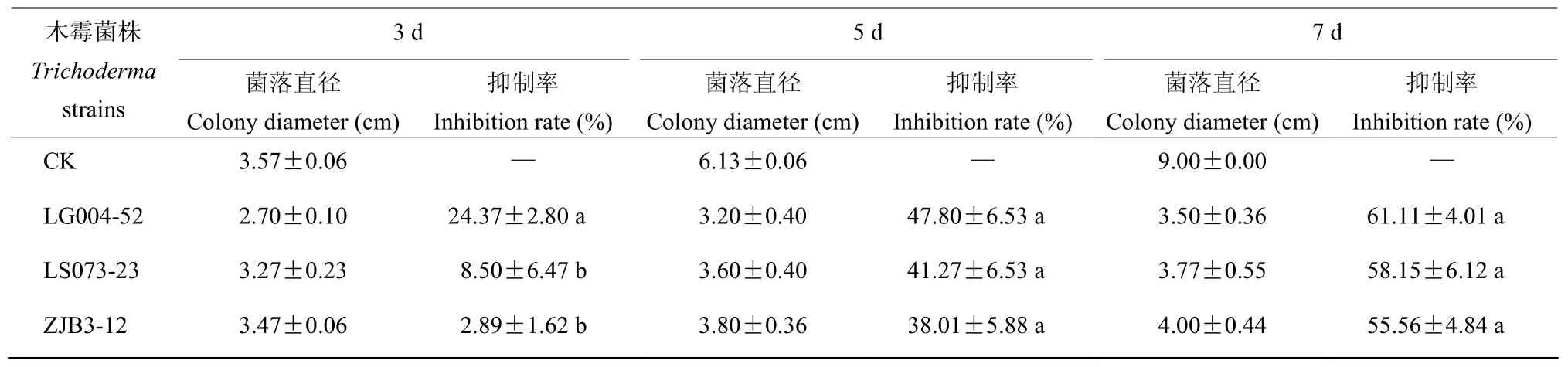
表2 3株木霉菌挥发性物质对木薯胶孢炭疽菌的抑制作用Table 2 Inhibitiory of volatile substances of 3 Trichoderma strains against C.gloeosporioides
2.4 木霉菌株发酵液抑菌作用
通过发酵液的抑菌试验,在 3株木霉菌中,菌株 ZJB3-12的发酵液呈金黄色,对胶孢炭疽菌 DZT-1抑菌作用最强,可完全抑制炭疽菌菌丝的生长,抑制率为100%;其次是菌株LS073-23的发酵液,抑制率为83.70%;菌株LG004-52发酵液对病原菌菌丝半径无影响,但菌丝生长稀疏。因此,木霉菌ZJB3-12发酵液中可能产生了较强的抑菌活性物质,抑制了胶孢炭疽病菌的生长(表3,图5)。
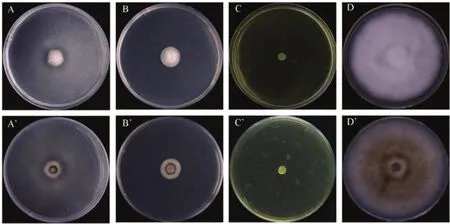
图5 3株木霉菌的发酵液对木薯胶孢炭疽菌的抑制作用Fig.5 Growth inhibition of 3 Trichoderma strains against C.gloeosporioides
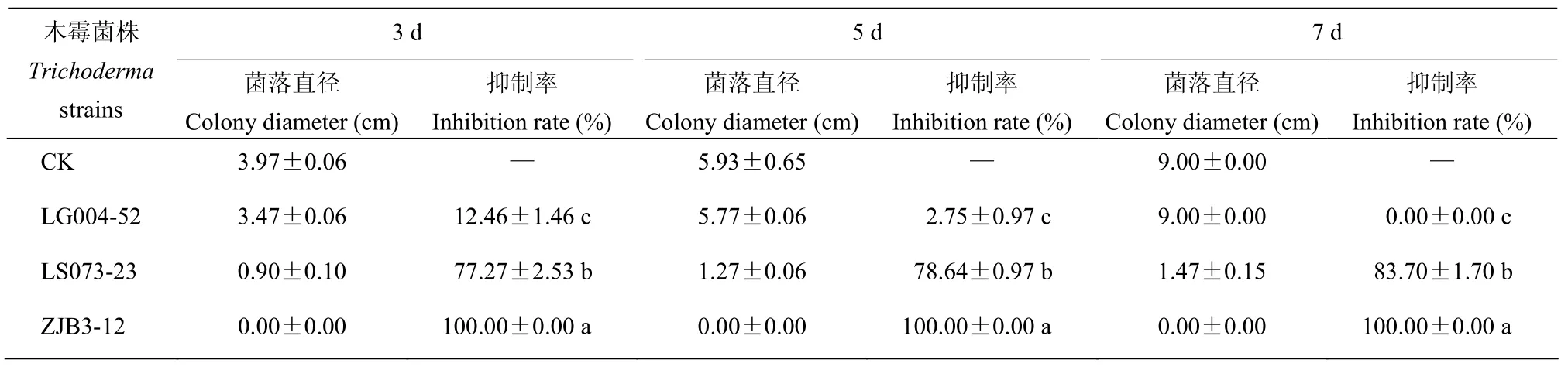
表3 3株木霉菌发酵液对木薯胶孢炭疽菌的抑制作用Table 3 Inhibitory of metabolites of 3 Trichoderma strains against C.gloeosporioides
2.5 木霉菌株的鉴定
2.5.1 形态学鉴定 菌株LG004-52在PDA培养基上气生菌丝茂盛,长而呈绒毛状,接种点中心具有环状的不育区域;在SNA培养基上,其气生菌丝稀疏,在接种点周围有少量淡绿色孢子堆;在CMD培养基上,气生菌丝茂盛,可见浅绿色的孢子堆。分生孢子梗侧枝短,不分枝,壶腹型或瓶状,单生,成对或3个轮生,分生孢子绿色,平滑,球形(图6A1-A6)。
菌株LS073-23在PDA培养基上,气生菌丝茂盛,分生孢子形成明显的深绿色同心环;在SNA培养基上,几乎没有气生菌丝,分生孢子初期白色,后期变绿;在CMD培养基上气生菌丝不明显,浅绿色孢子堆离散分布于接种点对面。分生孢子梗金字塔型,具有轮生或经常明显配对的侧枝,分支与主枝呈近直角,分生孢子近球形、粗糙、墨绿色(图6B1-B6)。

图6 3株木霉菌的形态图Fig.6 Morphology of 3 Trichoderma strains
菌株ZJB3-12在PDA上培养基上,气生菌丝茂盛,分生孢子丰富,分散均匀,呈同心环状,产生黄色色素;在SNA培养基上,气生菌丝稀疏,分生孢子丰富,浅绿色;在CMD培养基上,几乎没有气生菌丝,分生孢子堆离散型分布。分生孢子梗长梗草型,可育枝通常由几个层次的分枝组成,顶端附近的枝条上有单一的瓶梗,不再分枝;分生孢子圆柱状,通常顶生于直的、钩状的或者弯曲单个瓶梗内(图6C1-C6)。2.5.2 分子生物学鉴定 通过PCR扩增,分别从菌株LG004-52、LS073-23和ZJB3-12获得1294、1343和1291 bprpb2基因片段;经过裁剪后利用MEGA7.0的NJ法构建系统发育树,菌株LG004-52(登录号:MZ361837)、LS073-23(登录号:MZ361838)和ZJB3-12(登录号:MZ361839)分别与短密木霉T.breve、棘孢木霉T.asperellum和长枝木霉T.longibrachiatum聚为同一分支。因此,结合形态学特征和分子鉴定结果,将3株木霉菌分别鉴定为短密木霉、棘孢木霉和长枝木霉。
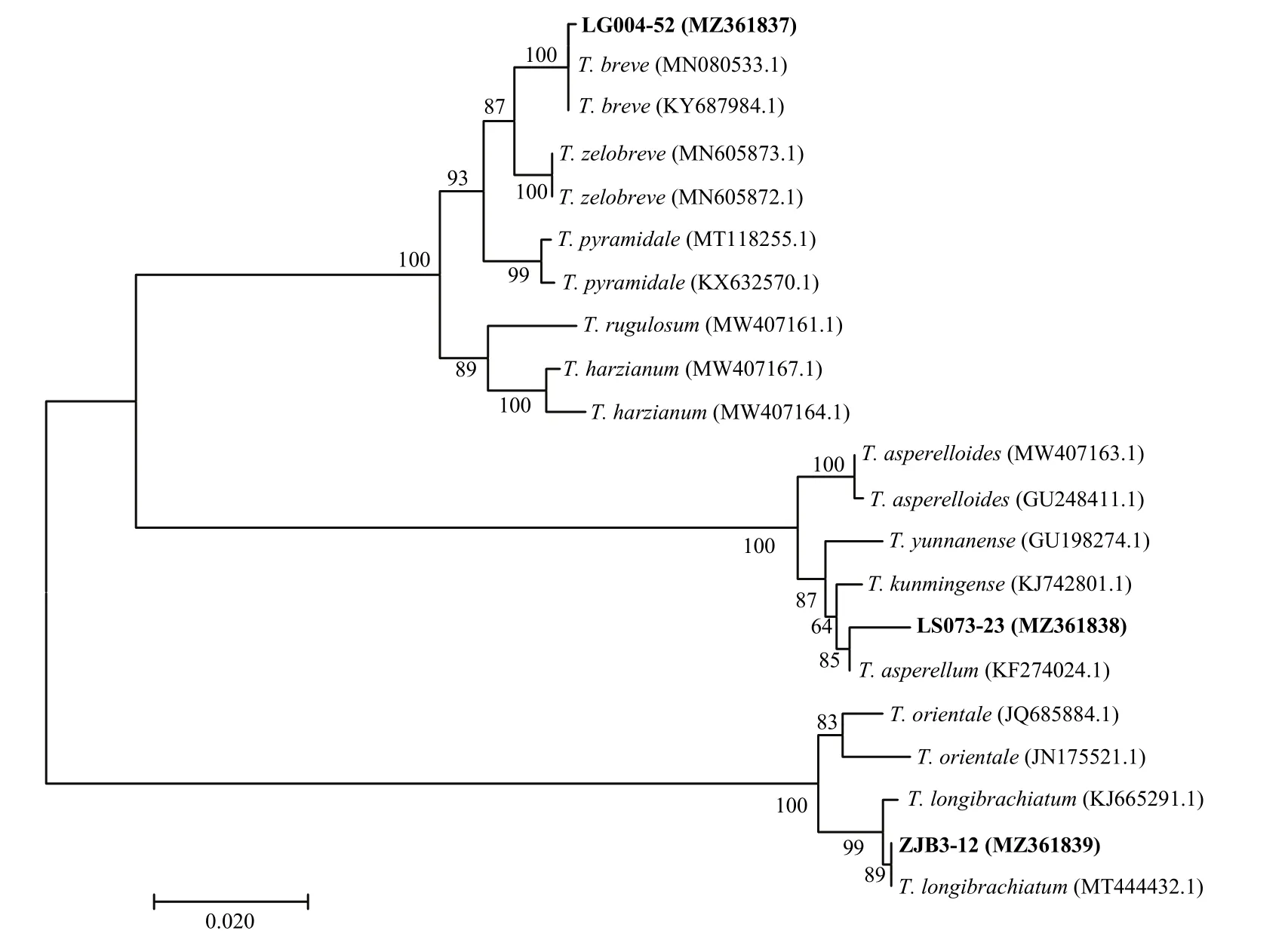
图7 3株木霉菌基于rpb2序列构建的系统发育树Fig.7 Phylogenetic tree of 3 Trichoderma strains based on rpb2 sequence
2.6 木霉菌对炭疽病的室内防效
通过室内保湿培养4 d后,木霉菌株LG004-52、LS073-23、ZJB3-12孢子悬浮液处理过的叶片的平均病斑面积分别为3.84、3.79和1.51 cm2,对照组平均病斑面积为6.13 cm2,3株木霉对炭疽病的抑制率分别为37.36%、38.17%和75.37%,其中木霉ZJB3-12对木薯叶片炭疽病的发生抑制作用最强(表4,图8)。因此,该菌株可以作为木薯炭疽病生物防治的候选菌株。
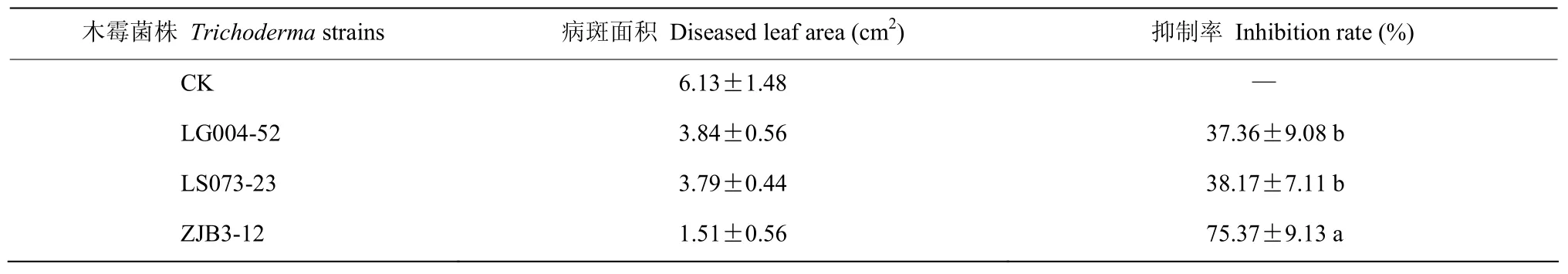
表4 3株木霉菌对木薯叶片炭疽病的防效Table 4 Control effect of 3 Trichoderma strains on cassava leaves of C.gloeosporioides

图8 3株木霉菌孢子悬浮液对木薯炭疽病的离体叶片防效Fig.8 The control effect of conidia suspension of 3 Trichoderma strains isolates to C.gloeosporioides on isolated leaves
3 讨论
木薯炭疽病是木薯生产中危害非常严重的一种世界性病害[21]。中国热带农业科学院环境与植物保护研究所在对中国广西、广东、海南等木薯主产区的病害普查中,发现该病发生普遍[4]。1993年蒋冬荣[22]在广西桂林木薯优良品种“南植188”发现木薯炭疽病菌,初步鉴定该病病原是黑盘孢目的刺盘孢菌。2008年蔡吉苗等[23]在海南儋州发现木薯炭疽病,经致病性测定,形态学鉴定结合ITS序列分析确定其为胶孢炭疽菌。然而,单一的ITS序列只能鉴定少部分炭疽菌种,越来越多的研究采用多基因进行炭疽菌的鉴定与遗传多样性分析。本研究除了对炭疽菌DZT-1进行柯赫氏法验证、形态学观察以外,并采用ITS-GAPDH-ACTCHS-1-TUB2多基因联合建树分析,将该病原菌鉴定为胶孢炭疽菌。
目前,对木薯炭疽病的防治主要是采用化学防治,对于利用木霉制剂来生物防治木薯炭疽病国内外未见报道。但是利用木霉菌防治其他作物的炭疽病已有较多的报道。如张晓梦等[24]利用绿色木霉和棘孢木霉防治枸杞炭疽病菌,2株木霉菌株均表现抑菌作用和促进植物生长的能力,并存在多种生防因子。赵兴丽等[25]发现棘孢木霉使茶炭疽病菌菌落萎缩,颜色变暗;其进发酵液也能有效抑制茶炭疽病菌菌丝生长,使菌丝表面皱缩。
木霉菌对植物病原菌的作用机制并不是单一的,有时是两种或几种生防机制协同作用[26]。Lazazzara等[27]研究表明在木霉挥发性代谢产物(VOCs)中,α-farnesene、cadinene、1,3-octadiene、2-pentylfuran和6-pentyl-2H-pyran-2-one降低了葡萄叶片霜霉病的严重程度。王子晴等[28]研究结果显示钩状木霉C6挥发性物质对北细辛菌核病菌抑制率为53.73%,哈茨木霉A17、钩状木霉A26、拟康氏木霉B30、钩状木霉C6的发酵液对北细辛菌核病菌的抑制率分别为56.33%、77.22%、82.28%和46.20%。Xin等[29]研究发现木霉菌株T2发酵液中的活性代谢产物6-pentyl-2h-pyran2-one(6PP)扰乱了三七根腐病菌的代谢平衡,特别是氨基酸代谢。Mao等[30]对菌株MHT1134的抑菌能力进行了评价,发现灭菌和未灭菌处理的发酵液均能有效抑制病原菌的菌丝生长,抑菌效果分别达50.71%和74.01%。本研究通过平板对峙试验,筛选到3株对木薯炭疽病菌表现较强抑菌作用的木霉菌株,其挥发性代谢产物及无菌发酵液对木薯炭疽病菌丝生长具有明显的抑制作用,其中木霉菌株ZJB3-12挥发性代谢产物对病原菌菌落生长造成明显“空洞”现象;且其发酵液可完全抑制木薯炭疽病菌菌丝的生长,推测该菌株的发酵液中可能存在对炭疽病菌具有高活性的物质。通过室内防效试验,木霉菌株ZJB3-12分生孢子悬浮液降低木薯离体叶片上炭疽病的发生。因此,木霉菌株ZJB3-12具有良好的生防潜力,将是后续的田间应用的候选菌株。目前关于该菌株无菌发酵液的抑菌活性成分正在进行分离鉴定,将明确其抑菌机制,为开发生物农药奠定基础。
