白细胞介素-6和铁代谢相关蛋白在一氧化碳中毒迟发性脑病中的表达变化
2022-04-21韩琴高叶雷蕊绮蒋力辜刚凤彭红艳李经伦
韩琴 高叶 雷蕊绮 蒋力 辜刚凤 彭红艳 李经伦
一氧化碳中毒迟发性脑病(delayed encephalopathy after acute carbon monoxide poisoning,DEACMP)是指急性一氧化碳(carbon monoxide,CO)中毒患者经及时救治后意识恢复,并度过“假愈期”(2~60 d)后,再次出现以认知功能障碍、行为障碍、失语症、锥体外系等为主的神经精神症状。研究认为DEACMP主要病理机制是海马区神经元延迟死亡,其发病机制可能与缺血缺氧、免疫与炎症、线粒体功能抑制等有关[1]。研究发现脑铁过载是多种认知功能障碍疾病的重要环节[2]。杨晓燕[3]研究发现急性CO中毒期,大鼠脑组织缺氧,应激状态下可释放大量炎症因子白细胞介素6(interleukin 6,IL-6)。去铁胺(defetoxamine,DFO)是一种铁螯合剂,能快速与铁离子结合形成复合物排出体外。已有研究证实DFO可通过减少铁沉积、抑制炎症反应和脂质过氧化等减少细胞凋亡[4]。但是DEACMP脑组织中是否存在铁代谢紊乱,DFO能否改善DEACMP的神经功能障碍均尚无定论。因此,本实验拟通过建立DEACMP大鼠模型,观察急性大鼠CO中毒后海马区铁代谢相关蛋白的表达变化,探讨铁代谢紊乱与DEACMP的相关性、DFO的干预效果及其可能机制,以及IL-6在铁代谢中的作用。
1 材料和方法
1.1 材料
1.1.1实验动物:体重300~320 g雄性SD大鼠170只〔购于成都达硕实验动物有限公司,动物许可证:SCXK(川) 2019-030,饲养于干净恒温动物房,室内温度20~24℃,湿度为40%~60%,12 h明暗交替〕。
1.1.2主要试剂和仪器:CO气体(体积分数为99.9%,购于泸州市西南化工研究院);Morris水迷宫分析跟踪系统(由西南医科大学公共卫生学院提供);DFO(瑞士诺华制药有限公司,批号S0965);兔源铁调素(hepcidin,Hep)抗体购于美国LSBio公司,鼠源IL-6抗体、二价金属离子转运体1(divalent metal-ion transporter-1,DMT1)抗体及兔源膜铁转运蛋白(ferroportin,FPN)抗体、兔源甘油醛-3-磷酸脱氢酶(GAPDH)抗体均购于英国Abcam公司;苏木素染液、伊红染液、核固红染液、2%(质量浓度)亚铁氰化钾水溶液、2%(体积浓度)盐酸、DS-PAGE凝胶制备试剂盒、RIPA总蛋白裂解液、异硫氰酸荧光素(FITC)标记羊抗兔IgG抗体、辣根过氧化物酶(HRP)标记羊抗兔和羊抗鼠IgG抗体、ECL化学发光检测试剂盒、BCA蛋白质浓度测定试剂盒均购自美国ASPEN公司;蛋白提取试剂盒购于北京普利莱公司;TBST缓冲液购于德国Sigma公司;4%(质量浓度)多聚甲醛、4′,6-二脒基-2-苯基吲哚(DAPI)染液、抗荧光淬灭封片剂均购于武汉阿斯本生物技术有限公司。5%(质量浓度)牛血清白蛋白(BSA)购于瑞士Roche公司;普通光学、倒置显微镜购于OLYMPUS。脱水机、包埋机、组织摊片机均购于武汉俊杰电子有限公司。
1.2 方法
1.2.1实验动物筛选及实验分组:采用Morris水迷宫试验对170只大鼠训练6 d,于第7天用定位航行和空间探索实验检测大鼠认知功能。(1)定位航行实验:将大鼠面朝水池壁,分别从四个象限放入水池,直到大鼠成功爬上平台,记录其从下水至找到平台的时间(逃避潜伏期),评估大鼠学习能力。(2)空间探索实验:完成定位航行实验后撤去水迷宫中的平台,记录大鼠在120 s内穿越平台次数,评估大鼠记忆能力。参照赵瑛等[5]的研究方法,大鼠逃避潜伏期小于120 s,判定为合格。其中165只大鼠合格,用于后续实验。
实验将分为对照组、模型组、干预组三组,每组各50只,按照随机数字表法从合格SD大鼠中选出。三组大鼠于造模前1天随机各选10只大鼠完成水迷宫实验,将此次的记录结果作为基线结果。
1.2.2模型制备:参照李勇军等[6]的方法用改良式间隔腹腔注射CO制备DEACMP大鼠模型。(1)模型组:大鼠首次(上午8:00)按体重100 mL/kg腹腔注射CO气体,每隔4 h追加首剂的50%(按体重50 mL/kg)共3次,制备DEACMP模型。(2)干预组:制备DEACMP模型同模型组;于造模前1 h(7:00)按体重100 mg/kg腹腔注射DFO,之后每天上午7:00注射等量DFO 1次,直至处死。(3)对照组:与模型组同法注射等体积空气,无其他操作。如大鼠死亡,立即按相应方法重新操作,以保证每组50只。
参照张晓莉[7]DEACMP大鼠造模成功标准:大鼠出现精神萎靡、呼吸急促、口唇及皮肤黏膜呈樱桃红、肢体抽搐、昏迷等CO中毒症状;并且水迷宫实验发现大鼠认知功能下降。
1.2.3各组大鼠临床表现及认知功能检测:观察三组大鼠注射空气或CO后的临床表现,并分别于造模后第1、3、7、14、21天的上午9:00随机选10只,采用水迷宫试验(同实验动物筛选)检测大鼠学习和记忆能力。
1.2.4各组大鼠海马CA1区脑组织形态观察及相关指标检测:三组均于造模后第1、3、7、14、21天(上午10:00)随机抽取5只大鼠,腹腔注射10%(质量浓度)水合氯醛(按体重3 mL/kg)进行麻醉,生理盐水心脏灌洗、4%(质量浓度)多聚甲醛固定,取出脑组织于固定液中固定24 h以上,酒精梯度脱水,石蜡包埋,行冠状位切片,片厚4 μm,每个脑组织连续选取8张海马组织切片,其中2张用于HE染色、3张用于免疫荧光、3张用于普鲁士蓝染色。其余大鼠麻醉处死,于冰面上分离新鲜海马组织,放入-80℃冰箱中,用于Western blot实验。
(1)HE染色:取海马组织石蜡切片,进行HE染色,脱水封片。400倍光学显微镜下观察三组大鼠各时间点海马CA1区锥体细胞形态变化。
(2)免疫荧光检测:各组海马标本切片风干后置于EDTA中修复,避光孵育10 min,PBS浸洗,甩干后5%(质量浓度)BSA封闭20 min;依次加入稀释的Hep抗体(1︰1000)、FITC标记的羊抗兔IgG抗体(1︰50)37℃孵育30 min,DAPI染液(15 min)PBS冲洗3次,待染色后滴加适量的荧光淬灭剂封片,每张切片取5个不同的400倍视野,荧光显微镜下观察海马CA1区Hep蛋白表达情况,并用ImageJ软件进行分析。本实验中采用DAPI染色固定细胞核,被DAPI染色的细胞核呈蓝色。Hep蛋白在细胞膜上,FITC标记后出现红色荧光。
(3)Western Blot检测:按蛋白提取试剂盒说明提取海马组织总蛋白,以BCA蛋白质浓度测定试剂盒测定海马组织蛋白浓度,经电泳、转膜,加入IL-6(1∶500)、Hep(1∶1000)、FPN(1∶500)、DMT1(1∶1000)、内参GAPDH(1∶1000)一抗过夜,用TBST洗3次后,加入稀释好的HRP标记的相应种属二抗(1∶1000),孵育30 min,滴加ECL化学发光检测试剂,于暗室中曝光、显影、定影,将胶片进行扫描存档,采用AlphaEaseFC软件分析IL-6、Hep、FPN、DMT1蛋白表达条带灰度值。以GAPDH表达相对水平的平均值作为标准化内参。目标蛋白的相对含量=目标蛋白条带灰度值/GAPDH条带灰度值。
(4)普鲁士蓝染色:将2%(质量浓度)亚铁氰化钾水溶液、2%(体积浓度)盐酸溶液按1∶1混合后对切片进行染色,核固红染液浸染、水洗,脱水封片。于400倍显微镜下观察三组大鼠海马CA1区铁沉积情况。若在海马CA1区细胞内及细胞间观察到蓝色颗粒,说明有铁沉积。
1.3 统计学处理采用SPSS 25.0软件进行分析。计量资料均符合正态分布,用均数±标准差表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较用最小显著差异法(LSD-t)。以P<0.05表示差异有统计学意义。
2 结果
2.1 各组动物临床表现对照组大鼠腹腔注射空气后正常进食,精神行为无异常。模型组和干预组大鼠腹腔注射CO气体数分钟后开始出现CO中毒症状:呼吸急促、躁动不安、大小便失禁、口唇黏膜呈樱桃红色,之后逐渐站立不稳、四肢瘫软、精神萎靡、蜷缩于角落,少数出现抽搐、昏迷,立即将其置于通风处,症状可逐渐恢复。
2.2 Morris水迷宫检测大鼠认知功能对照组各时间点大鼠逃避潜伏期及穿越平台次数差异无统计学意义(P>0.05)。模型组及干预组,与造模前、造模后第1、3、7天比较,造模后第14、21天大鼠逃避潜伏期延长、穿越平台次数减少(P<0.05)。造模前及造模后第1、3、7天比较,以及造模后第14和21天比较,逃避潜伏期及穿越平台次数差异无统计学意义(P>0.05)。
对照组、模型组和干预组三组比较,造模前、造模后第1、3、7天逃避潜伏期及穿越平台次数差异无统计学意义(P>0.05)。与对照组造模后第14、21天比较,模型组和干预组大鼠逃避潜伏期明显延长,穿越平台次数显著减少(P<0.05);与模型组造模后第14、21天比较,干预组逃避潜伏期缩短、穿越平台次数显著增加(P<0.05)。具体见表1、表2。以上结果显示,在造模后第14天模型组大鼠出现明显的认知功能障碍,表明在造模后第14天大鼠发生DEACMP。
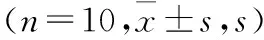
表1 各组大鼠不同时间点逃避潜伏期比较

表2 各组大鼠不同时间点穿越平台次数比较次)
2.3 三组大鼠海马CA1区神经元形态比较对照组各时间点海马CA1区神经元,整齐排列,细胞膜结构完整,细胞质均一染色,胞核轮廓清晰,呈深蓝色。模型组造模后第1天细胞形态无明显改变,第3天和第7天海马细胞肿胀、排列紊乱无序、稀疏,第14天和第21天海马CA1区细胞呈不规则形,胞浆浓缩深染、核固缩、碎裂,神经元水肿、坏死明显。与模型组相比,干预组造模后第3、7天部分细胞肿胀减轻,第14、21天海马CA1区神经元坏死明显减少。具体见图1。
注:A:对照组;B:模型组;C:干预组 图 1 造模后第14天时各组大鼠海马CA1区神经元表现比较(HE×400):对照组海马神经元整齐排列,细胞膜结构完整,细胞质均一染色,胞核轮廓清晰,呈深蓝色;模型组和干预组均有神经元坏死,与模型组比较,干预组神经元坏死减少(图B、C中箭头所示为坏死神经元)
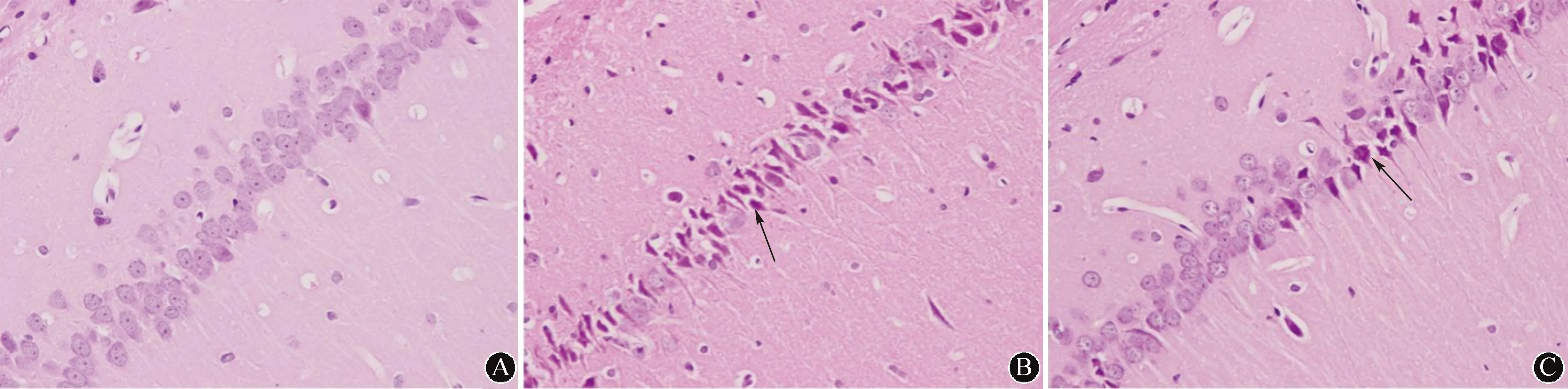
2.4 三组大鼠海马CA1区Hep蛋白表达比较对照组海马CA1区Hep蛋白在各时间点表达差异无统计学意义(P>0.05)。模型组、干预组各时间点Hep蛋白表达呈现先增高后降低的趋势,于第7天达高峰,第1、3、7天依次增高,第7、14、21天依次降低(均P<0.05)。与对照组比较,模型组和干预组大鼠各时间点海马CA1区细胞膜Hep蛋白表达均增加(P<0.05),且干预组与模型组比较各时间点Hep蛋白表达均减少(P<0.05)。具体见图2、表3。
注:Hep:铁调素;蓝色荧光为细胞核,红色荧光为细胞膜Hep蛋白;DAPI:4′,6-二脒基-2-苯基吲哚;Merge:DAPI+Hep;图中箭头所示为Hep蛋白 图 2 造模第14天各组大鼠海马CA1区Hep蛋白的表达情况(免疫荧光×400)

表3 造模后不同时间点各组大鼠Hep蛋白表达比较
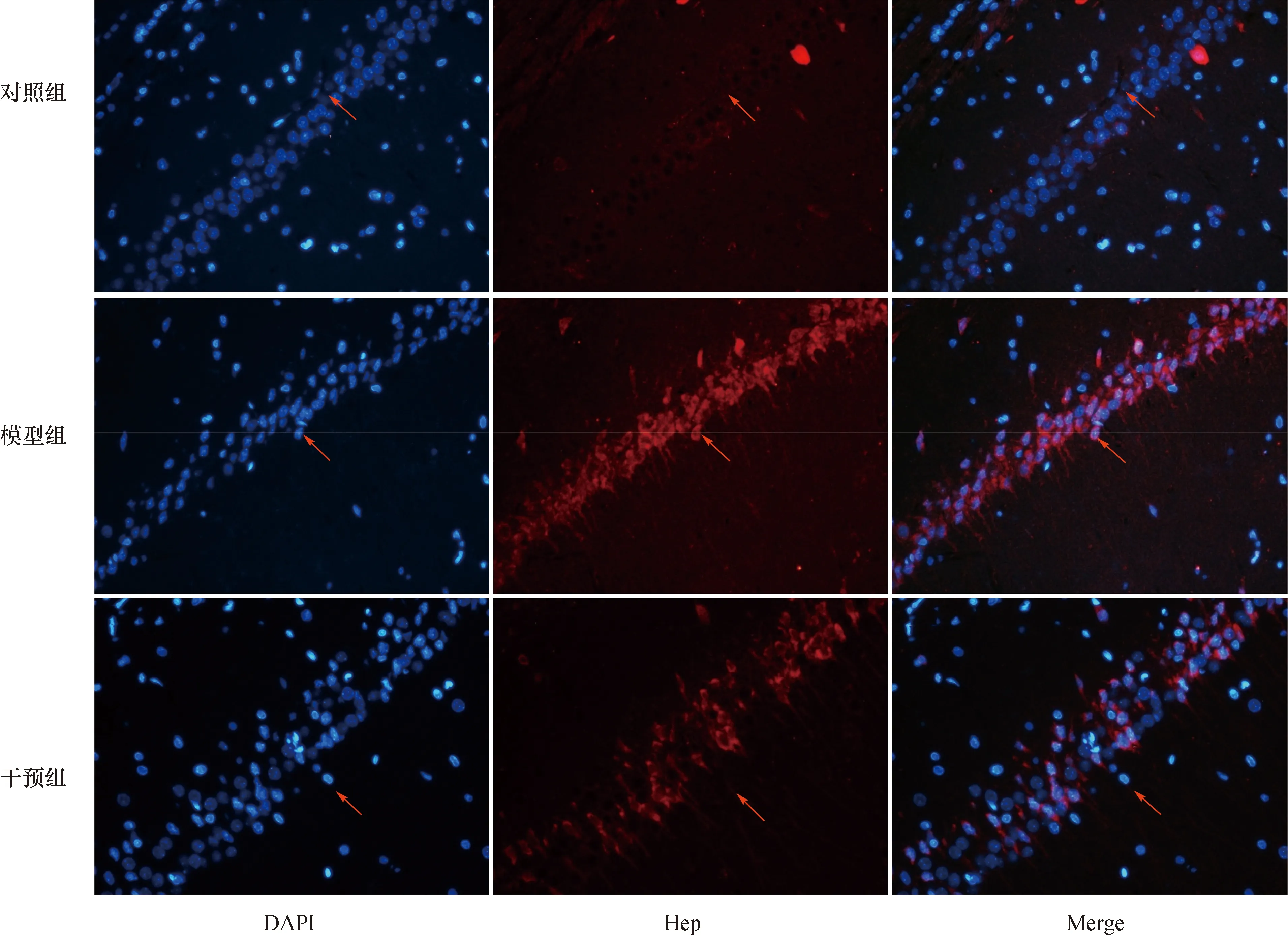
2.5 各组IL-6、Hep、FPN、DMT1蛋白的表达对照组各时间点IL-6、Hep、FPN、DMT1蛋白表达差异无统计学意义(P>0.05)。模型组、干预组IL-6、Hep、DMT1表达呈先升高后降低的趋势,于第7天达高峰,第1、3、7天依次增高,第7、14、21天依次降低(均P<0.05);FPN呈先降低再升高趋势,于第7天达低谷,第1、3、7天依次降低,第7、14、21天依次增高(均P<0.05)。
与对照组各时间点比较,模型组和干预组IL-6、Hep、DMT1表达增多,FPN表达减少(P<0.05),且干预组与模型组各时间点比较IL-6、Hep、DMT1表达减少,FPN表达增多(P<0.05)。具体见图3、表4~7。
注:IL-6:白细胞介素-6 ;Hep:铁调素 ;FPN:膜铁转运蛋白;DMT1:二价金属离子转运体;GAPDH:甘油醛-3-磷酸脱氢酶(标准化的内参 ) ;因对照组在各时间点无明显差异,故仅列出1个条带 图 3 各组大鼠海马区IL-6、Hep、FPN、DMT1蛋白的表达(Western Blot)

表4 三组大鼠各时间点IL-6 蛋白相对表达水平比较

表5 三组大鼠各时间点Hep蛋白相对表达水平比较

表6 三组大鼠各时间点FPN蛋白相对表达水平比较

表7 三组大鼠各时间点DMT1蛋白相对表达水平比较
2.6 各组大鼠海马CA1区铁沉积比较对照组各时间点海马CA1区均未见明显铁沉积。模型组、干预组在第1、3、7天未见明显铁沉积,第14、21天海马CA1区观察到铁沉积于细胞质或细胞间隙中,但与模型组比较,干预组铁沉积减少(图4)。
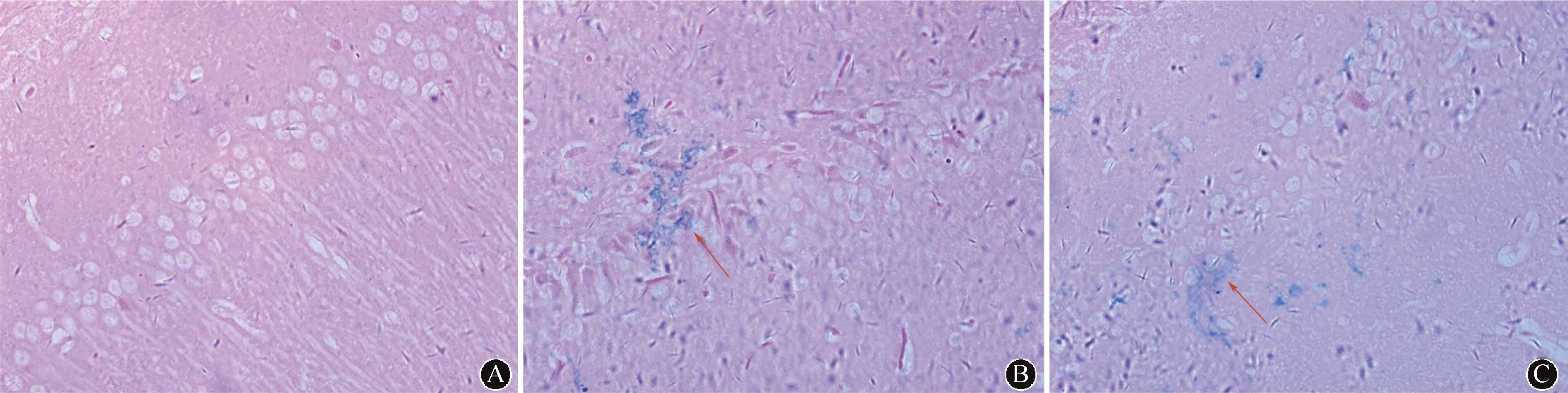
注:A:对照组B:模型组 C:干预组;图中箭头所示为铁沉积 图 4 造模第14天时三组大鼠海马CA1区铁沉积比较(普鲁士蓝染色×400)
3 讨论
DEACMP具有高发病率、高致残率、高死亡率的特点,是CO中毒严重的后遗症之一,严重影响患者的生活质量,增加家庭及社会经济负担。目前DEACMP的发病机制仍未完全明确,因此探究其病理机制及相关预防治疗手段成为全球研究重点。 本实验通过改良式腹腔注射CO法建立大鼠DEACMP模型,在注射CO后大鼠出现明显的中毒表现,Morris水迷宫检测提示模型组在造模后第14天出现了明显学习和记忆力下降,且大鼠海马CA1区出现大量神经元坏死,与前人研究结果符合[8],提示造模成功,大鼠发生DEACMP。大鼠海马区的病理改变(神经元延迟死亡)与 Morris水迷宫行为学检测结果相符,与临床上发生DEACMP的时间吻合。
在中枢神经系统中,铁参与运输氧、神经递质和髓鞘的合成、DNA合成、细胞代谢等重要的生理过程。目前已知Hep是hepcidin 抗微生物肽(hepcidin antimicrobial peptide,Hamp)基因编码的铁代谢关键调节蛋白,具有由8个半胱氨酸残基和4个二硫键构成稳定的发夹结构。研究表明FPN1是目前已知的惟一跨膜铁输出蛋白,Hep主要通过与细胞膜表面的FPN1结合,介导其内化降解,减少铁向细胞外转移。DMT1是哺乳动物体内的跨膜金属离子转运体,促进亚铁转入细胞质[9]。在细胞铁代谢相关研究中,Hep、FPN、DMT1常作为其重要蛋白标志物。Ward等[10]的研究证实铁稳态受损会导致细胞内铁代谢紊乱,继而引起细胞凋亡,导致迟发性损伤。与对照组比较,模型组在中毒后第1、3天Hep、DMT1蛋白表达轻度增多,第7天达高峰,FPN表达减少,第7天达低谷,此时海马区铁沉积不明显,海马神经元肿胀,排列紊乱无序,大鼠学习和记忆能力正常,大鼠未发生DEACMP。中毒后第14天、21天Hep、DMT1蛋白表达仍高,FPN蛋白表达少,海马区出现铁沉积,且神经元坏死严重;水迷宫实验结果显示大鼠逃避潜伏期延长,穿越平台次数减少,大鼠出现认知功能障碍,表明已发生DEACMP。上述结果提示在急性CO中毒大鼠海马区存在铁代谢紊乱,且后者可能与DEACMP的发生发展有关。
IL-6可使STAT3(信号转导与转录激活因子)蛋白发生磷酸化,后者与Hep启动子结合,促进Hep mRNA的转录、Hep蛋白表达增多,还可促进膜受体蛋白FPN泛素化降解,最终导致铁外排受限[11]。Urrutia等[12]发现炎症反应可诱导DMT1表达介导细胞内铁聚集。有研究发现过载铁通过促炎性细胞因子分泌和Fenton反应产生自由基,发生氧化应激反应,引起细胞功能损伤,继而导致海马神经元坏死,认知功能障碍[13]。本研究结果显示,与对照组相比,模型组IL-6在中毒后呈现先升高后降低的趋势,于第7天达高峰,第21天时IL-6表达仍较高,提示CO中毒大鼠海马区存在持续炎症反应。本研究还发现,模型组Hep、DMT1蛋白的表达趋势与IL-6一致,FPN蛋白表达趋势与IL-6相反,提示铁代谢紊乱可能与IL-6介导的持续炎症反应有关。
DFO是一种具有三异羟肟酸结构的多价螯合剂,其主要与游离铁、铁蛋白和含铁血黄素中的三价铁离子结合形成稳定无毒的铁胺复合物排出体外,从而降低活性铁的浓度或清除过量游离铁[14],其保护作用在出血性脑卒中、阿尔茨海默病、脊髓损伤、帕金森病等疾病研究中初步得到证实[15]。既往研究显示DFO可以改善认知功能。朱丹等[16]采用腹腔注射DFO可通过下调铁蛋白的含量改善SD老龄大鼠术后学习和记忆能力。Zeinivand等[17]的研究也发现DFO可能通过抑制神经炎症因子释放和氧化应激来维持铁稳态,改善2型糖尿病的记忆功能障碍。本研究中模型组各时间点IL-6、Hep、DMT1蛋白表达增加,FPN蛋白表达减少,且于造模后第14、21天出现铁沉积,海马神经元明显坏死,大鼠出现认知功能障碍(逃避潜伏期延长,穿越平台次数减少);与模型组比较,采用DFO干预后IL-6、Hep、DMT1蛋白表达降低,FPN蛋白表达增加,且铁沉积减少,海马CA1区神经元坏死减少,大鼠认知功能改善。上述结果提示DFO可能通过螯合蓄积铁离子和抑制IL-6的表达,调节海马区铁代谢,减少海马区铁沉积和神经元延迟死亡,从而改善急性CO 中毒后迟发的认知功能障碍。
综上,急性CO中毒大鼠海马区存在铁代谢紊乱,且铁代谢紊乱可能与DEACMP的发生发展有关。DFO可能通过螯合游离铁离子和抑制炎症反应减少铁沉积,减轻神经元死亡,改善CO中毒后神经细胞损伤和认知功能障碍,可能为DEACMP的临床治疗提供了新的实验依据和方向。
