叶下珠提取物对大鼠脑缺血损伤的神经保护作用
2022-04-20温小龙李骏鹏刘鑫鑫李宗慧熊芸雲虞道锐
温小龙,李骏鹏,刘鑫鑫,李宗慧,熊芸雲,虞道锐
(1. 海南医学院第二附属医院药学部,海南 海口 570311;2. 海南医学院临床学院,海南 海口 571199;3. 海南医学院基础医学与生命科学学院,海南 海口 571199)
脑卒中是常见的心脑血管疾病、是由于脑组织血液循环异常而引起脑损伤的疾病,临床上主要分为出血性和缺血性脑卒中,缺血性脑卒中占脑血管疾病的比率极高,达到了80%左右[1]。纵观全球的脑血管疾病,由于脑动脉闭塞引发的急性缺血性脑损伤是关键因素,发病年龄多见老龄人群,其发病率和死亡率较高[2]。我国卫生部卫生经济研究所的一份报告显示,来自脑血管疾病的花销每年超过上百亿人民币,带来日益严重的社会经济负担[3]。一旦发生脑缺血损伤,会有一系列的变化引起神经元等脑组织肿胀、变性、死亡,比如氧化应激、炎症因子释放、兴奋性氨基酸释放等[4]。目前,对该病有效的治疗药物较少,患者从中受益少,且容易造成出血和再灌注损伤风险,因此,迫切深入探索有效的神经保护药物,发展神经科学领域工作尤为重要。
叶 下 珠[Phyllanthus urinaria(P. urinaria)L.]属大戟科叶下珠属植物,别名珍珠草,广泛生长在热带和亚热带地区,我国主要生长于两广和海南地区[5]。作为一味传统中药,其味微苦、性凉,具有清热解毒、利水消肿等功效,在治疗肠炎出现的痢疾、泄泻及无名肿痛等疾病颇为见长[6]。现代药理表明,叶下珠有抗肿瘤、抗氧化、抗血栓的作用[7],其毒副作用低,具有良好的临床应用潜力。且叶下珠在治疗急性脑缺血方面,尚未见有深入的报道。因此,本研究采用SD 大鼠,通过改良线栓法建立大鼠右侧大脑中动脉阻塞(MCAO)模型。考察叶下珠提取物对急性脑缺血损伤后的保护作用及其作用机制,为发展新治疗该疾病的药物提供理论支持。
1 材料与方法
1.1 主要试剂及仪器
SOD 测试试剂盒:Solarbio 公司,生产批号:20181117;NO 测试试剂盒:南京建成生物科技有限公司,生产批号:20180609、eNOS 测试试剂盒:碧云天生物技术公司,生产批号:S1817;兔抗大鼠Caspase-3 多克隆抗体:Abcam 公司,生产批号:ab18137;PI3K 多 克 隆 抗 体:Abcam 公 司,生 产 批号:ab191607;Akt 多克隆抗体:Abcam 公司,生产批 号:ab18785;显 色 剂DAB:Invitrogen 公 司,生产批号:191013;激光多普勒血流测量仪:英国moor 公 司;荧 光 显 微 镜:Olympus 公 司szx16 型;专业图像处理分析系统Image Pro Plus v6.0:美国Media Cybernetics 公司。
1.2 叶下珠提取物制备及给药
所用叶下珠由中国热带农业科学院品种资源研究所采集,海南医学院生药学考研室提供提取制备工艺来制备叶下珠提取物。即称取叶下珠适量,先蒸馏水浸泡30 min 后武火加热,煮沸后调文火继续煮1 h,然后搅拌过滤。药渣以同样方法重复操作两次后合并滤液,最后采用旋转蒸发仪浓缩,根据所需浓度加水稀并灌封至4 ℃冰箱保存。MCAO 造模前以灌胃给药途径1 次/d给药量,叶下珠提取物组大鼠以最大致死量的药量的10% 确定给药剂量,分别以5、10 g/kg 两个剂量连续给药,假手术组、MCAO 组大鼠给予同等体积的生理盐水,连续给药7d 后制作大鼠实验性脑缺血损伤模型(MCAO)模型,并继续灌注药液1 次/d 直至取材。
1.3 实验动物分组与MCAO 模型制备
健康成年SD 大鼠:长沙天勤生物技术有限公司,数量72 只,清洁级,体质量:280~350 g,动物合格证号:SCXK(湘)2018-001。室温分笼饲养,适应1 周实验室环境后以每组18 只的数量随机分为假手术组,叶下珠提取物低、高剂量组(PuL 5、10 g/kg)。本研究所使用的实验动物均遵守海南医学院伦理委员会标准,同时,手术时模拟临床使用麻醉、给药时严格规范操作以减少不适,实验结束时对未死亡的动物采用脱臼安乐死的手段进行处理,并暂存于学校实验动物冰箱中,由学校统一处理。
第7 天给药1 h 后开始造模,参照改良的Lon‑ga 线栓法制备大鼠实验性缺血性模型(MCAO 模型)[8],具体操作如下:大鼠按体重腹腔注射1.5% 浓度的戊巴比妥钠进行麻醉,接下来以暴露颈部的方向固定在鼠板上,切开颈部皮肤,用止血钳钝性分离肌肉组织,直至暴露颈动脉三角。分离出颈总动脉,颈总动脉穿一条手术线备用提拉,再细心分离分叉处颈内动脉和颈外动脉。用4 号黑丝线结扎阻断颈外动脉的远心端,颈总动脉和颈内动脉则用动脉夹阻断,用眼科剪在颈总动脉靠近分叉口的位置斜45 度剪开一小口,把事先制备好的鱼线从颈总动脉向颈内动脉方向插入约为18 mm 的深度,阻断大脑中动脉起始部让其缺血状态。2 h 后将鱼线拔出一小段,造模即完成。假手术组仅分离不做插管。
1.4 主要检测指标及检测方法
1.4.1 神经功能评分 各组大鼠末次给药制备MCAO 大鼠模型后。在24、48、72 h 进行大鼠神经功能评分。参照Longa 神经评分标准[9]进行操作。0~5 分进行评分作为MCAO 模型制备成功的标志,并将作为后续实验观察评估受试药有无保护神经的作用。
1.4.2 脑组织梗死面积检测 MCAO 造模成功后第72 小时进行TTC 染色实验,将各组随机取出6只大鼠用1.5%的戊巴比妥钠麻醉后,立刻断头取出全脑组织,冰生理盐水洗净表面的血迹后放在合适的大鼠脑模槽中。放置在-20 ℃的冰箱中至变硬后取出,用手术刀片切成冠状片,每张切片间隔2 mm 左右。将切好的脑片放置于已配好的1%TTC溶液中染色,可见梗死区域不着色,而其余区域均变红。最后拍照测量全脑区和梗死区面积,此步骤用专业图像分析系统(Image Pro Plus v6.0)来完成,接下来计算出梗死面积的比率以反映梗死灶的大小,公式为:梗死区面积/全脑区面积×100%。
1.4.3 脑组织SOD、NO、eNOS 水平的检测 在72 h时间点进行大鼠神经功能评分后,各组随机取6只大鼠以1.5%戊巴比妥钠麻醉,断头冰上取脑组织洗净后,加冰生理盐水匀浆,在低温离心机中以3 000 r/min离心15 min,取上清液放置冰箱中备用,检测时取出已制备好的上清液根据SOD、NO、eNOS 试剂盒中的说明严格操作,检测各组大鼠脑组织中SOD、NO、eNOS 的水平。
1.4.4 Caspase-3 免疫荧光染色检测 余下各组大鼠于72 h 神经功能评分后麻醉,并予4 ℃PBS 缓冲液和4%多聚甲醛灌注,灌注固定后取脑,以冠状平均切成两份,一份脑组织放-80 ℃冰箱中保存,另一份脑组织进行石腊包埋并切片,此操作多制备几张脑组织切片,随机抽取各组一张脑组织切片经脱蜡渗水,再抗原修复后,用记号笔圈片上的脑组织,滴加caspase-3 抗体在圈内的脑组织上,放置于4℃冰箱中,第2 天取出滴加荧光二抗,常温放置1 h,用PBS 缓冲液冲洗,用碘化吡啶复染,甘油固定封存并干燥。观察caspase-3 的阳性表达情况,此步骤采用荧光显微镜采集图片,再经专业图像分析系统(Image Pro Plus v6.0)分析其表达情况。每个标本以5 个不同视野分别计数染色结果,确定阳性细胞数的平均值。
1.4.5 脑组织中PI3K、AKT 蛋白表达水平检测
从-80 ℃冰箱中取出另一份脑组织,加入裂解缓冲液中匀浆,冰浴10 min,提取各组大鼠脑组织总蛋白备用,以文献[10]中的蛋白质免疫印迹(Western blot)方法步骤进行操作。最后滴加ECL 发光液显色,通过凝胶图像处理系统曝光和采照。用GAP‑DH 作为对照在专业图像软件分析脑组织中PI3K、AKT 蛋白表达水平。
1.5 统计学处理
所有数据应用统计学软件SPSS 26.0 分析,采用t检验分析两两比较两独立样本,用±s表示计量资料,以P<0.05 为差异具有统计学意义。
2 结果
2.1 叶下珠提取物对大鼠神经功能评分的影响
各组大鼠MCAO 造模成功后,3 个时间段各组大鼠神经功能评分均明显高于假手术组(P<0.01);脑缺血24 h 后叶下珠提取物低、高剂量组大鼠的神经功能评分虽低于为MCAO 组,但差异无统计学意义[(2.67±0.41)、(2.65±0.39)vs.(2.92±0.33);F低=0.543,F高=0.672;t低=2.045,t高=1.759;P均>0.05];随 着 脑 缺 血 时 间的延长,48 h后MCAO组评分有增高趋势,但叶下珠提取物低、高剂量组与其相比均有显著性下降[(2.34±0.34)、(2.30±0.34)vs.(3.09±0.34);F低=0.013,F高=0.155;t低=5.449,t高=5.314;P均<0.05],而到了72 h,整体有下降趋势,尤其叶下珠提取物低、高剂量组的神经功能评分最为明显,差异有统计学意义[(1.59±0.29)、(1.31±0.35)vs(2.67±0.31);F低=0.104,F高=0.002;t低=7.111,t高=7.789;P均<0.01]。提示叶下珠可有效保护大鼠脑缺血的损伤,剂量依赖性不大,见图1。
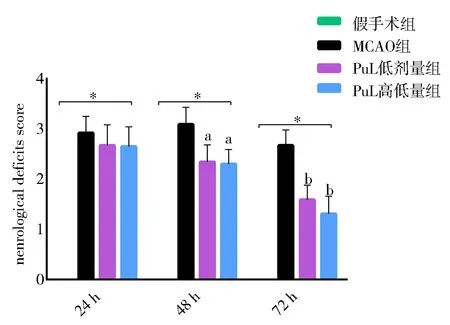
图1 叶下珠提取物对大鼠神经功能评分Fig 1 Neurological function score of Phyllanthus urinaria extract in rats
2.2 叶下珠提取物对大鼠脑梗死面积的影响
手术造模后,MCAO 组和给药组大鼠的脑梗死面积百分比明显增加,表明模型成功。而大鼠脑缺血72 h 后,叶下珠提取物低、高剂量组大鼠的脑梗死面积百分比明显低于MCAO 组,[(21.21±2.78)、(20.72±2.75)vs.(34.73±3.19);F低=0.04,F高=0.06;t低=25.875,t高=12.663;P均<0.01]。结果提示,叶下珠能有效降低实验性脑缺血大鼠模型脑梗死面积来保护的脑神经系统。叶下珠提取物高剂量大鼠的脑梗死面积的百分比虽略低于低剂量组,但两组无显著性差异(P>0.05),见图2。
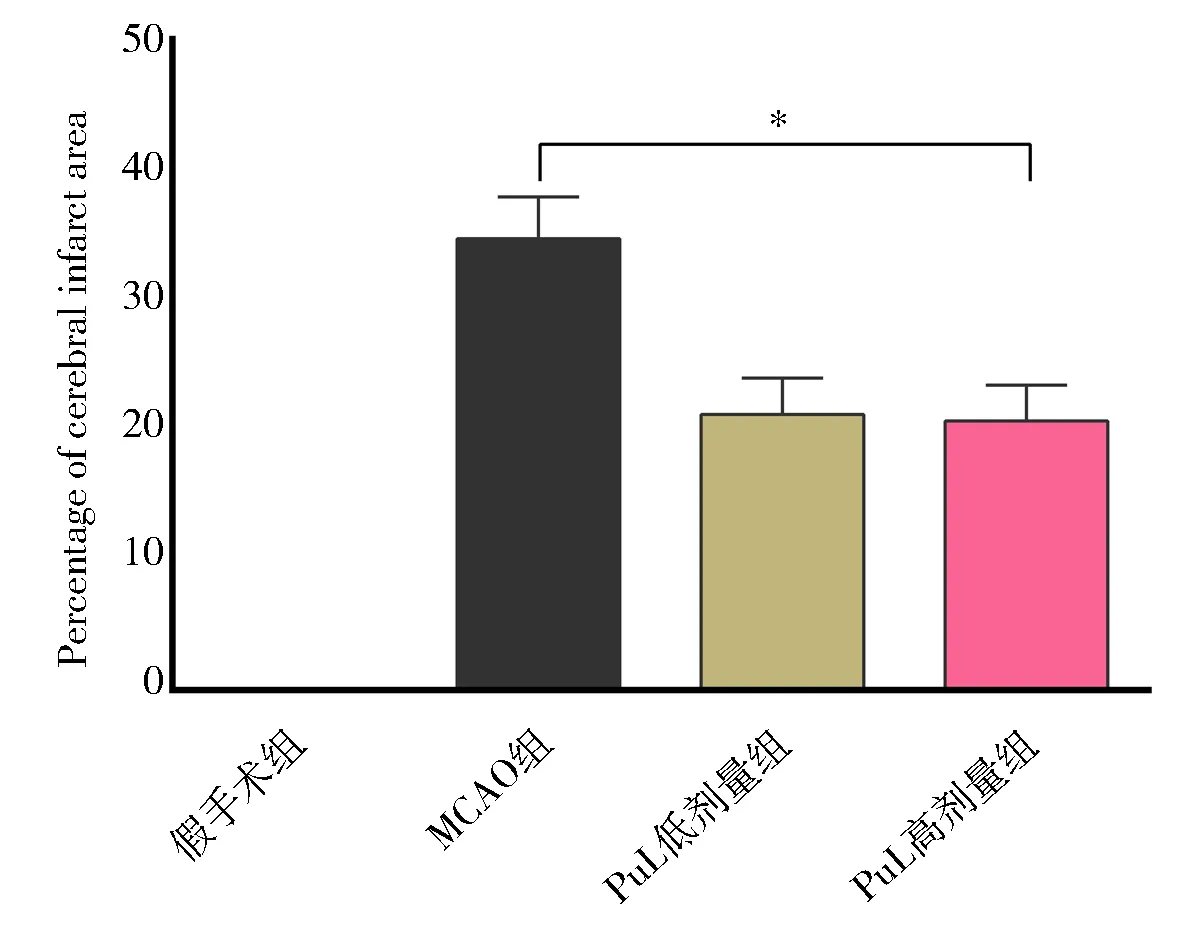
图2 叶下珠提取物对大鼠脑梗死面积的影响Fig 2 Effect of Phyllanthus urinaria extract on cerebral infarction area in rats
2.3 叶下珠提取物对大鼠脑组织SOD、NO、eNOS水平的影响
脑缺血72 h 后,假手术组大鼠脑组织SOD、NO、eNOS 水平分别为(219.10±9.766)、(40.41±3.44)、(18.21±3.16),模型组大鼠脑组织SOD、NO、eNOS 水平分别为(142.09±4.36)、(84.61±4.14)、(58.80±3.15),模型 组与假 手术组 相比,差异具有统计学意义(FSOD=3.45、FNO=0.628、Fe‑NOS=0.066;tSOD=24.83、tNO=-42.44、teNOS=-28.41,P均<0.05),提示脑缺血模型成功;与模型组比较,PuL 低、高剂量的SOD 水平明显升高[(173±3.99)、(180.31±5.36)vs.(142.09±4.36);F低=0.173,F高=0.309;t低=-13.368,t高=-30.605;P均<0.05];PuL 低、高 剂 量 的NO 水 平有一定的下降,但无统计学意义;PuL 低、高剂量的eNOS 水平明显降低[(29.91±3.48)、(26.93±4.77)vs.(58.80±3.15);F低=0.102,F高=1.453;t低=17.449,t高=18.121;P均<0.05],纵 观PuL 两个剂量组SOD、NO、eNOS 水平,高剂量组略好于低剂量组,但两组无显著性差异。叶下珠能抗氧化应激来保护脑细胞损伤,见图3。
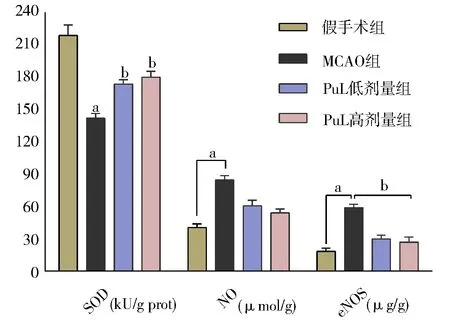
图3 各组大鼠脑组织SOD、NO、eNOS 水平Fig 3 Levels of SOD,NO and eNOS in brain tissue of rats in each group
2.4 叶下珠提取物对大鼠脑组织活化caspase-3 阳性细胞计数情况
各组大鼠脑缺血72 h 后,免疫荧光染色后,以异硫氰酸荧光素特异性标记发光,caspase-3 阳性细胞表达为绿色荧光,显微镜下可以看出,图4A 为假手术组大鼠脑组织可见零散的caspase-3阳性细胞(3.03±0.59),而图4B为MCAO组、图4C为PuL低剂量、图4D为高剂量组的大鼠脑组织caspase-3阳性细胞计数分别为(40.30±4.42)、(26.82±4.75)、(21.11±4.17),比假手术组显著性升高(FMCAO=42.435、F低=9.208、F高=33.373;tMCAO=-26.408、t低=-15.683、t高=-13.553,P均<0.01);与MCAO 组 相 比,PuL 低、高剂量组大鼠脑组织caspase-3 阳性细胞计数明显降低,且具有统计学意义[(26.82±4.75)、(21.11±4.17)vs.(40.30±4.42);F低=0.174、F高=0.247;t低=6.573、t高=9.982,P低<0.05、P高<0.01],提示:叶下珠干预后可抑制cas‑pase-3 执行凋亡蛋白,来阻止神经细胞的增殖,见图4。
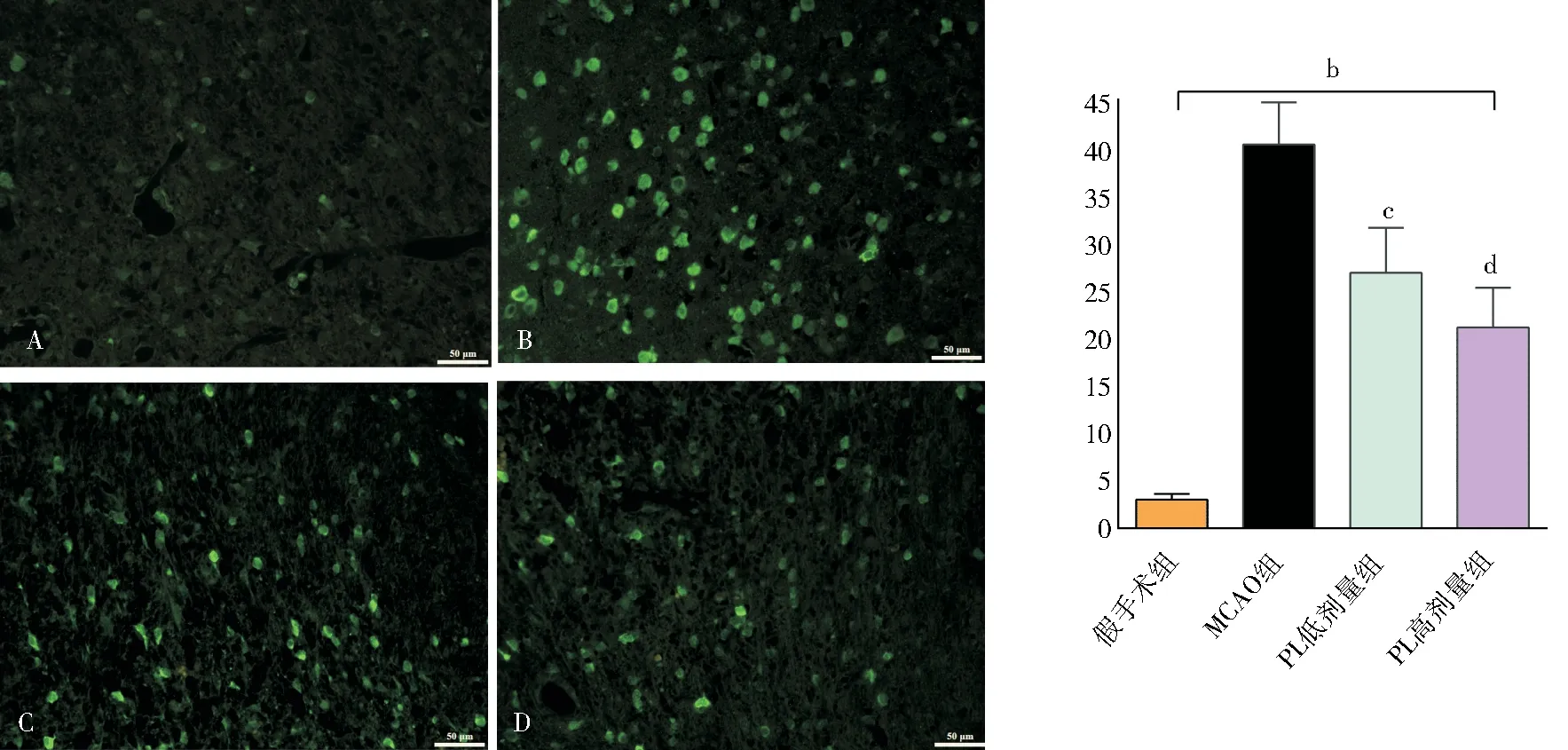
图4 各组大鼠脑组织活化caspase-3 阳性细胞计数(免疫荧光染色,×200)Fig 4 Count of activated caspase-3 positive cells in brain tissue of rats in each group(immunofluorescence staining,× 200)
2.5 叶下珠提取物对大鼠脑组织PI3K、AKT 蛋白表达的影响
各组大鼠脑缺血72 h 后,图5B 为MCAO 组大鼠脑组织的PI3K、AKT 蛋白表达分别是(0.64±0.17)、(0.58±0.13),与图5A 假手术组大鼠脑组织的PI3K、AKT 蛋白表达(1.19±0.15)、(1.61±0.24)相比明显降低,差异有统计学意义(FPI3K=0.016、FAKT=1.594;tPI3K=6.269、tAKT=11.351,P均<0.05);图5C 和图5D为PuL低、高剂量组大鼠脑组织的PI3K、AKT 蛋白表达分别是(0.81±0.18)、(0.95±0.19);(1.27±0.17)、(1.05±0.14)均 比MCAO 组 大 幅 度 升 高,其 中,PuL 高剂量组大鼠脑组织的PI3K 蛋白表达与MCAO 组相比差异有统计学意义(F=0.133,t=-3.192,P<0.05);而PuL 低 剂 量 组 大 鼠 脑 组 织的AKT 蛋白表达与MCAO 组相比有显著性差异(F=0.435,t=-8.835,P<0.05)。提示叶下珠能抑制大脑神经元的凋亡,通过抗凋亡使神经元细胞存活,见图5。
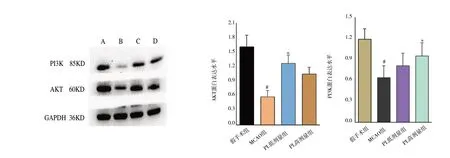
图5 各组大鼠脑组织PI3K、AKT 蛋白表达水平Fig 5 Expression levels of PI3K and Akt proteins in brain tissue of rats in each group
3 讨论
脑血管疾病正逐年升高,缺血性脑损伤为常见病之一,发病后往往供血动脉功能异常、导致脑组织供血不足[11]。当前,关于传统草药应用于减轻缺血性脑损伤报道颇多,这表明传统草药有一定的优势在该领域。通过改善脑循环,保护神经元,清除自由,减少脑缺血继发性反应[12]。本研究通过叶下珠提取物干预脑缺血大鼠发现,大鼠神经功能损害在脑缺血24、48、72 h 3 个时间段都比MCAO 组低,提示脑损伤后机体随着时间的推移可能会产生自我清除损伤使神经功能恢复,但从结果中显示叶下珠提取物干预后每个时间点清除的能力都比MCAO 组大鼠强,并且脑梗死面积百分比也明显降低,说明叶下珠可能助推机体自我清除损伤功能来保护大鼠缺血性脑卒中后的脑细胞、加速神经功能恢复以及降低脑梗死面积。
脑缺血损伤发生后,发生许多病理级联反应,比如炎症反应造成的损害,氧化应激造成的损害以及细胞凋亡的开始。这些因素会相互影响并相互作用,最终形成恶性循环诱导环,导致细胞坏死或凋亡。也是临床治疗过程的主要困难所在。eNOS 是血管中NO 的主要亚型和主要来源,其缺乏会导致血管疾病和各种病理生理疾病[13]。高水平的一氧化氮可诱导神经元凋亡,有研究发现,脑缺血后细胞凋亡的增加可能与活性氧的产生有关,表现为抗氧化酶SOD 活性的水平减少[14]。本研究结果发现,给予叶下珠提取物干预MCAO 模型大鼠后,大鼠脑组织中NO、eNOS、SOD 含量得到一定的改善,提示叶下珠提取物可能在氧化应激损伤中发挥了一定的作用,改善大鼠脑缺血损伤后的氧化应激损伤,从而抑制神经细胞的凋亡来保护脑缺血损伤。
脑缺血损伤形成中央缺血区,缺血区的脑组织可能会遭受程序性死亡,并增加脑部损伤的程度。caspase-3 也是一种重要的蛋白酶,如果在脑缺血损伤的急性期,它就成为促进细胞凋的作用,并可导致神经元死亡;而在脑缺血损伤恢复期时,它则有抑制神经细胞元的增长作用,并防止受伤后脑功能的再生恢复[15]。又有报道发现,无论人还是大鼠发生脑缺血损伤时,其脑组织中的caspase-3 表达会有上调趋势[16]。所以Caspase-3 已被确定为引发细胞死亡的重要介体。当cas‑pase-3 被激活时,脑组织细胞就会不由自主的发生凋亡。又发现阻断或抑制其caspase-3 高表达药物作用脑梗死大鼠模型中,已发挥出了明显的神经保护效应[17]。本研究实验通过免疫荧光手段,观察大鼠脑组织的caspase-3 表达是否有细胞凋亡情况,结果显示,脑缺血72 h 后,除假手术组外,其他3 组的caspase-3 阳性细胞计数都明显增高,但经过叶下珠提取物干预后,caspase-3 阳性细胞计数比MCAO 组大鼠大大降低,说明叶下珠可能抑制caspase-3 的表达来阻止神经细胞凋亡,进而保护脑缺血后损伤。
Akt 是磷脂酰肌醇-3 激酶(PI3K)下游作用的苏氨酸激酶,它依赖PI3K 途径来发挥脑损伤后脑细胞存活,PI3K-Akt 信号传导通路可防止神经细胞凋亡,并对出血和缺血性中风具有神经保护作用。因此PI3K 和Akt 是加速细胞增殖和抗凋亡的功能,有研究表明,此信号通路无论是在脑还是在心和肾的缺血性损伤都有关键作用[18]。此外,PI3K 和Akt 在脑缺血和缺氧性脑损伤方面,发挥保护脑组织和神经细胞死亡的主要作用[19]。本研究结果表明,脑缺血损伤后,除假手术外,其余组大鼠的AKT、PI3K 蛋白表达不同程度的降低,尤其MCAO 组最严重,而经过叶下珠提取物作用后的大鼠脑组织中AKT、PI3K 蛋白表达有很大的改善,相比MCAO 组大鼠显著升高。提示,叶下珠得以保护脑缺血是通过减少细胞凋亡的作用可能通过激PI3K-Akt 信号通路得以实现的。
综上,传统医药对神经系统的保护逐渐关键,本研究从抗氧化方面入手,结果显示,叶下珠虽然有脑缺血损伤的几个关键指标有了一定调节的作用,但范围太宽,涉及更深更细的如基因调控等机制尚未阐明,因此是本研究的不足,希望可以进一步深挖、不断的验证其起主导的关键方面,将扩大此领域的内容。也为叶下珠今后应用临床提供基础实验依据。
作者贡献度说明:
温小龙:调研整理文献,设计研究方案及论文框架,起草论文;李骏鹏、刘鑫鑫、李宗慧、熊芸雲:参与研究,实施研究过程,采集整理数据,统计分析;虞道锐:提出研究选题,获取研究经费,技术或材料支持,指导性支持。
